Method Article
קביעת חומצות שומן החמצון וLipogenesis בעכבר העיקרי hepatocytes
In This Article
Summary
lipogenesis נובו דה וחמצון חומצת β-השומן מהווים מסלולי מפתח חילוף חומרים בhepatocyte, מסלולים המוטרדים בכמה הפרעות מטבוליות, כוללים מחלת כבד שומני. כאן אנו מדגימים בידוד של hepatocytes העיקרי עכבר ולתאר כימות של חמצון חומצת β-השומן וlipogenesis.
Abstract
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
Introduction
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
Protocol
כל הניסויים בבעלי החיים צריכים להתבצע בהתאם לתקנות פדרליות ומקומיות ובאישור של ממשל IACUC ובטיחות קרינה מוסדי.
1. הכנה
- כמה ימים לפני assay, להפשיר את בקבוק 500 מיליליטר של כבד Digest בינוני (LDM) וrefreeze ~ 35 aliquots מיליליטר ב 50 מיליליטר צינורות חרוטי. חנות ב -20 ° C עד צורך.
- יום אחד לפני assay, מראש לעקר כלים לנתיחה נקיים על ידי החיטוי.
- ביום של assay, טיפול הסכום הדרוש של צלחות תרבות 24 גם עם קולגן.
- מערבבים חלק 1 של קולגן זנב חולדה / מיליליטר 3 מ"ג עם 50 חלקים של PBS. להוסיף כ 500 μl היטב בכל צלחת 24 גם דגירה של 3-5 דקות בטמפרטורת חדר (RT). הסר את הקולגן ולאפשר צלחת לייבוש באוויר במכסת מנוע. חזור על לפחות פעם אחת נוספת.
הערה: ציפוי קולגן יכול להתבצע עד שבוע במודעהאנס וצלחות מאוחסנים על 4 מעלות צלזיוס אטומות בניילון הנצמד.
- מערבבים חלק 1 של קולגן זנב חולדה / מיליליטר 3 מ"ג עם 50 חלקים של PBS. להוסיף כ 500 μl היטב בכל צלחת 24 גם דגירה של 3-5 דקות בטמפרטורת חדר (RT). הסר את הקולגן ולאפשר צלחת לייבוש באוויר במכסת מנוע. חזור על לפחות פעם אחת נוספת.
- הכן LDM עבור assay: LDM הפשירי וחמה עד 37 מעלות צלזיוס ולהתאים את ה- pH 7.4 באמצעות 1 N KOH. מסנן באמצעות מסנן מזרק 0.2 מיקרומטר ומקום באמבט מים 42 מעלות צלזיוס הסירקולציה המחודשת.
- 25 מיליליטר חם של כבד זלוף בינוני עד 42 מעלות צלזיוס באמבט מים הסירקולציה המחודשת.
- הכן 90% סיליקה colloidal מצופים פתרון polyvinylpyrrolidone: הוסף 1 מיליליטר של 10x DPBS עד 9 מיליליטר של סיליקה colloidal מצופה polyvinylpyrrolidone. התאם ל- pH 7.4 באמצעות 0.1 N HCl. סנן עם מסנן מזרק 0.2 מיקרומטר סטרילי. אחסן בRT.
- בינוני ציפוי חם עד 37 מעלות צלזיוס.
2. בידוד של יסודי העכבר hepatocytes
- הגדר את משאבת peristaltic, צינורות, ושולחן נתיחה: לעקר צינורות על ידי שטיפה עם אתנול 5 מיליליטר 70% במים מזוקקים, ואחריו 10 מיליליטר של מים סטריליים. מניחים צינורות בכבד זלוף בינוני ומשאבה לרוץ למלאלכל אורך צינור.
- להקריב עכבר בשיטה אושרה מוסדי.
- לנתח פתוח חלל הבטן: ספריי בטן העכבר בנדיבות עם אתנול 70%. בעזרת מספריים קהה-סוף, לעשות חתך קו האמצע דרך העור באורך של הבטן ומשקפים רוחבי. לעשות חתך דומה בהצפק לחשוף את הקרביים.
- שימוש במכשיר קהה, בעדינות לעקור את המעיים כדי לחשוף את כלי הדם בבטן אתר את הווריד הנבוב הנחות הבטן (IVC) ומקום תפר מתחת לכלי הדם, דיסטלי לוריד הכליה
- דיסטלי לתפר, למקם את מחט וצנתר לתוך IVC, קידומה מעבר לרמה של התפר. עם המחט עדיין במקום, לקשור את התפר סביב קטטר להחזיק אותו במקום. מוציא בזהירות את המחט. אם נעשה בצורה נכונה, דם עם זרימה דרך קטטר.
- באמצעות pipet, למלא את השטח שנותר בצנתר עם מדיום זלוף, הבטחהשאין אוויר הוא הווה. בזהירות רבה, לצרף את צינורות לקטטר.
- לנתח פתוח חלל הריאות: בעדינות משקף את האונה של הכבד מעולה לחשוף את הסרעפת. לנקב בזהירות הסרעפת במספריים קצה חד, אז לעשות חתך לרוחב כדי לחשוף את חלל פלאורלי, לטפל כדי למנוע כיס המרה וכלי דם פלאורלי. הנח מהדק בולדוג סביב הווריד הנבוב הנחות החזה רק הפרוקסימלי לווריד הכבד.
- חותך את וריד השער ולהפעיל את המשאבה ב3 - 4 מיליליטר / דקה. Perfuse את הכבד עם כבד זלוף בינוני במשך 5 דקות באמצעות כ 20 מיליליטר של מדיום זלוף.
הערה: הכבד צריך לשנות באופן מיידי מאדום לאפור / שיזוף. אם החלקים של הכבד יישארו אדומים, זה סביר מציין זלוף העני, ואת הסבירות של בידוד מוצלח היא פחת באופן משמעותי. במהלך זלוף, להיות זהיר כדי להבטיח בינוני לא נגמר ושאין בועות להיכנס לצינורות. - לאחר הדגירה 5 דקות, לעצורהמשאבה ולהעביר את צינורות לכבד Digest בינוני. הפעל מחדש את המשאבה ותנקב את הכבד לעוד 10 - 15 דקות (עד שהמדיום הוא מותש).
- בסופו של זלוף, לעצור את המשאבה. הכבד צריך להיות גוון ורדרד ומופיע מוגדל במקצת. בלו הכבד על ידי נתיחה זהירה. הסר את כיס המרה ולהעביר את הכבד לצלחת תרבית רקמת 10 סנטימטרים.
- בארון בטיחות ביולוגית, להוסיף 10 מיליליטר של ציפוי בינוני (טבלה 1) בכבד. בעדינות לגרד את הכבד או באמצעות מלקחיים או אזמל כדי להסיר את hepatocytes. סנן את ההשעיה באמצעות מסננת תא 100 מיקרומטר ולהעביר צינור חרוטי 50 מיליליטר. לשטוף את הצלחת עם תוספת של 10 מיליליטר של ציפוי בינוני ובריכה בצינור חרוטי 50 מיליליטר.
- גלולה התאים על ידי צנטריפוגה 5 דקות ב 350 XG, 4 מעלות צלזיוס.
- בינוני לשאוב וגלול גלולים ב 10 מיליליטר של ציפוי בינוני ולהוסיף 10 מיליליטר של 90% סיליקה colloidal מצופה פוlyvinylpyrrolidone. מערבבים בעדינות וצנטריפוגה כמו בשלב 2.11. לאחר צנטריפוגה, שכבה של תאים מתים תהיה צף על גבי התערובת, בעוד התאים חי גלולה לתחתית.
- לשאוב תאים מתים ובינוני. לשטוף 2 פעמים עם 20 מיליליטר של ציפוי בינוני, צנטריפוגות כמו ב2.11.
- תאי Resuspend ב 10 מיליליטר של ציפוי בינוני. ספירת תאים עם hemocytometer ומקום 9 x 10 4 תאים / גם בתרבות מנות 24 גם טופל קולגן. דגירה בתרבית רקמת חממת 37 ° C עבור שעה 2. כל צלחת יכולה לשמש גם עבור assay חומצות שומן החמצון או assay Lipogenesis.
- לחלופין, לשנות את הבארות לתחזוקה בינונית (טבלה 1) ותרבות על 37 מעלות צלזיוס. תאים יכולים להיות מתורבת עבור 2 - 3 ימים מבלי להשפיע על תוצאות assay.
3. חומצות שומן החמצון Assay
אזהרה: שימוש בקרינה רדיואקטיבית יכול להיות מסוכנת. כל הרכישה, האחסון, הטיפול, ודיsposal של חומר רדיואקטיבי צריכה להתבצע בהתאם למדינה, תקנות מוסדיות, ופדרליות והנחיות.
- 16 - 20 שעות לפני assay, לשטוף תאים 2 פעמים עם PBS החם. לשנות את התאים לסרום רעב בינוני סרום ללא (טבלת 1) עם 20 ננומטר גלוקגון ודגירת הלילה על 37 מעלות צלזיוס.
הערה: מאחר בסרום שור עוברי מכיל ריכוז לא ידוע של הורמונים מטבוליים (למשל אינסולין, גלוקגון), סרום להרעיב את התאים כדי להסיר כל תופעות בלבול זה יכול להיות על assay. תאי קיימא בסרום רעב בינוני ל> 24 שעות. טיפול גלוקגון משמש כדי לעורר חמצון של חומצות שומן בתאים הכבדים. - בבוקרו של assay, להכין טרום דגירה בינונית: Resuspend כמות מתאימה של נתרן Palmitate במי ultrapure לעשות פתרון 100 מ"מ וחום עד 70 מעלות צלזיוס במשך 10 דקות. בינתיים, מכין את הסכום הנדרש (0.5 מיליליטר לכל גם צלחת 24 גם)של DMEM עם 25 HEPES מ"מ, 1% V בר BSA, ו -20 ננומטר גלוקגון. חום עד 37 מעלות צלזיוס.
- ברגע שsolubilized, להוסיף Palmitate לריכוז סופי של 250 מיקרומטר עד הבינוני. לשנות hepatocytes מראש דגירה בינונית ולדגור על 37 מעלות צלזיוס במשך שעה 2. שומר כמה טרום דגירה בינונית על 37 מעלות צלזיוס לשימוש מאוחר יותר.
- במהלך הדגירה, לייבש כמות מתאימה של 14 C-Palmitate (0.5 μCi / טוב) על ידי אידוי תחת גז חנקן.
- לדוגמה, כדי למדוד 24 דגימות בצלחת 24 גם, להעביר 120 μl של 0.1 μCi / מיליליטר 14 C-Palmitate לצינור 1.5 מיליליטר. לאט להתאדות אתנול הממס על ידי פיצוץ גז חנקן על הפתרון ממרחק של 3-5 סנטימטר במנדף. הממס צריך להתאדות בכ 30 - 40 דקות, והשאיר 14 C-Palmitate היבש בחלק התחתון של הצינור.
- כ -15 דקות לפני תום הדגירה, resuspend 14C-Palmitate ב 0.1 N NaOH (12.5 μl / μCi). לדגור על 70 מעלות צלזיוס במשך 10 דקות. להוסיף שלושה כרכים של חמה טרום דגירה בינונית ומערבבים על ידי pipetting למעלה ולמטה.
- ספייק כל טוב עם 25 μl של דילול 14 C-Palmitate. מערבבים בעדינות על ידי הנדנדה הצלחת ולדגור על 37 מעלות צלזיוס במשך 90 דקות. זהו פלייט Assay.
- במהלך הדגירה, להכין צלחת נייר סינון (איור 1).
- הסר את המכסה מצלחת 24 גם סטרילי. הנח סנטימטר אחד 2 פיסת נייר סינון x 2 סנטימטר בחלק התחתון של כל אחד מהבארות. כיסוי הצלחת עם חתיכת 4 "x 7" parafilm.
- שימוש באובייקט מלבני גדול, כגון תיבת קצה micropipettor, לשפשף את parafilm על הבארות ללנקב parafilm בפתחים היטב וליצור חותם על פני יתרת הצלחת. הסר את העיגולים המחוררים של parafilm עכשיו מכסים את הבארות. הצלחת צריכה עכשיו להיות מכוסה היטב עם parafilm בכל התחומים למעט o גםpenings.
- 10 דקות לפני סוף הדגירה, להוסיף 200 μl של 3 N NaOH היטב בכל צלחת נייר הסינון, כדי לוודא שנייר הסינון סופג את כל הנוזלים.
- לחלופין לפני ההקפאה, להעביר את המדיום לצלחת 24 גם טרי. לאחר שטיפת פעם עם PBS, lyse התאים שנותרו ב0.1 N HCl ולחשב את תכולת חלבון על ידי assay BCA.
- בסוף הדגירה, snap-להקפיא פלייט Assay בחנקן נוזלי. להיות זהיר כדי להבטיח היטב כל קפוא לחלוטין לפני שתמשיך.
- להוסיף 70% חומצת perchloric 100 μl היטב בכל צלחת Assay. מייד לכסות עם צלחת נייר סינון. מקם את הצלחות בייקר מסלולית ורוק במהירות סיבובית של 80 סל"ד ב RT עבור שעה 2.
- לאחר הדגירה, לעבד את הדגימות:
- כדי למדוד את חלק CO 2, להעביר את ריבועי נייר סינון 4 מיליליטר נוזל נצנץ נוזלי בנצנץבקבוקון ואות C מידת 14.
- כדי למדוד את החומר מסיס החומצה, להעביר 400 μl של מדיום לצינור 1.5 מיליליטר microfuge. צנטריפוגה במהירות המרבית למשך 10 דקות. להוסיף את supernatant וכתוצאה מכך 100 μl 500 μl של 2: 1 כלורופורם-מתנול (V / V), ובקצרה מערבולת.
- הוסף 250 μl של מים לתערובת, ומערבולת שוב. צנטריפוגה דגימות במשך 10 דקות ב 3000 x גרם. העברה 200 μl של השלב העליון עד 4 מיליליטר נוזל נצנץ נוזלי בבקבוקון נצנץ ולמדוד אות C 14.
4. Lipogenesis Assay
- הערב לפני תחילת assay, לשטוף את התאים 2 פעמים עם PBS החם. לשנות את hepatocytes לסרום רעב בינוני עם 100 ננומטר אינסולין. דגירה הלילה בשעת 37 מעלות צלזיוס.
הערה: מאחר בסרום שור עוברי מכיל ריכוז לא ידוע של הורמונים מטבוליים (למשל אינסולין, גלוקגון), סרום להרעיב את התאים כדי להסיר כל תופעות בלבול זה יכול להיות על assay. תאי קיימא בסרום רעב בינוני ל> 24 שעות. אינסולין משמש בassay זה כדי לעורר lipogenesis. - הפוך Lipogenesis בינוני: סרום רעב בינוני עם 100 ננומטר אינסולין, אצטט קר 10 מיקרומטר ו-0.5 μCi 3 H-אצטט בכל טוב. לשנות תאים לLipogenesis בינוני ולדגור על 37 מעלות צלזיוס במשך שעה 2. כלול את כל תרכובות של עניין להיבדק.
- לאחר תקופת הדגירה, לשטוף תאים 2 פעמים עם PBS. תאי Lyse על ידי גירוד ב120 μl של 0.1 N HCl. שמורת 10 μl עבור assay חלבון (להעריך על ידי assay BCA), והעברה לצינור 1.5 מיליליטר microfuge 100 μl.
- שומני תמצית על ידי תוספת של 500 μl של 2: 1 כלורופורם-מתנול (V / V). בקצרה מערבולת לדגור על RT במשך 5 דקות. הוסף 250 μl מים, מערבולת ולדגור על RT עבור 5 דקות נוספות. דגימות צנטריפוגה 10 דקות ב 3000 XG, RT. זהירותלהעביר שלב נמוך עד 4 מיליליטר נוזל נצנץ נוזלי בבקבוקון נצנץ ולמדוד 3 פעילות H.
תוצאות
בידודי Hepatocyte בדרך כלל לגרום 1 - 3 x 10 7 תאים כולל. לאחר דגירה הלילה, התאים יופיעו משושה, שרבים מהם יהיה binucleated (איור 2). תאים בריאים צריכים להיות נטולי granulations או שלפוחיות, אשר מעידים על המוות של תאים.
באופן כללי, assay חומצות שומן החמצון מנוהל בשלושה עד ארבעה חזרות למתחם בדיקה. ספירה לCO 2 הדגימות כחמישית מאלה הנגזרים מהחומר מסיס החומצה. אנחנו בדרך כלל לחשב את היחס של CO 2 לחומר מסיס חומצה כמדד לחמצון מלא (כלומר, סכום חמצון באמצעות מעגל החומצה הציטרית). חומרים המקדמים נשימה תאית, כגון ציאניד 4-phenylhydrazone קרבוניל (trifluoromethoxy) (FCCP) יעברו יחס זה כלפי CO 2, המציין יותר חמצון באמצעות מחזור TCA. מעכבים של שרשרת הנשימה יקטנו חמצון בכל(איור 3). כאשר מטיס assay זה, עדיף כולל שליטה לא תאים כדי לאמת את הליך הפקת פעילות תא ספציפי.
Lipogenesis assay הוא בהשוואה לרוב לשליטת אפס נקודה זמן (תאים שטופלו עם מצע מייד לפני הקציר). Assay צריך להיות ליניארי לעומת זמן דרך לפחות ארבע שעות של דגירה. תרכובות אשר משפרות חמצון של חומצות שומן, כגון FCCP, או להפחית את סינתזת ATP, כגון oligomycin, תפחית פעילות lipogenic (איור 4).
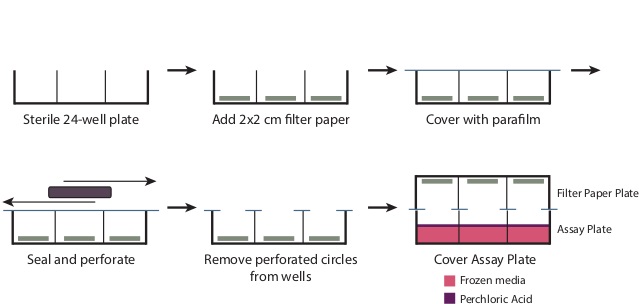
איור 1: הכנת צלחת הסינון כדי להכין את צלחת המסנן כמתואר בשלב 3.6, להסיר את הכיסוי מצלחת 24 גם סטרילי. הנח x 2 חתיכת סנטימטר 2 סנטימטר של נייר סינון בבסיס של כל טוב. כיסוי כל הצלחת עם 7 "x 4" חתיכה של סעיףסרט, ולשפשף את הצלחת לאטום את החלק העליון של הבארות בחוזקה. זה יפיק חוגים מחוררים של parafilm על הפתחים היטב, שיש להסיר. לאחר תוספת של חומצת perchloric בשלב 3.9, מניח את צלחת נייר סינון בחוזקה על צלחת Assay לייצר חותם.
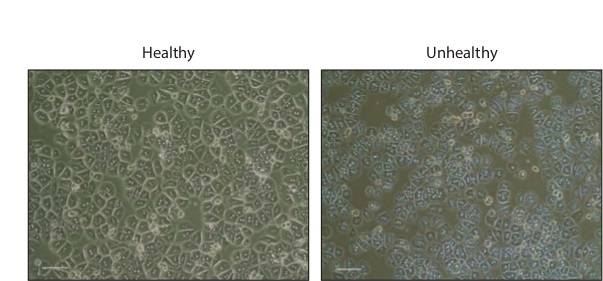
איור 2: היסודי hepatocytes בתרבות שלב ניגוד תמונות של hepatocytes עכבר העיקרי הבריא ולא בריא 16 שעות לאחר ציפוי בלוחות 24 גם קולגן מצופה. בר סולם, 200 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
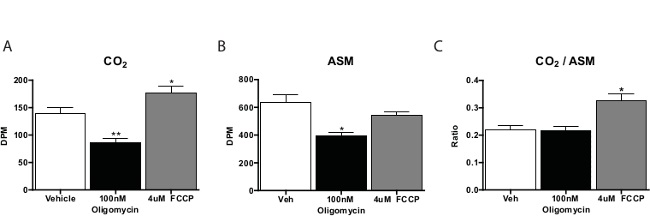
איור 3: חומצות שומן חמצון על ידי ראשי העכבר hepatocytes בתרבות 14 חמצון C-Palmitate לCO () 2, חומר חומצה (B) מסיס, ו- (ג) היחס של CO 2 לחומר מסיס חומצה מhepatocytes העיקרי מודגרות עם הרכב, FCCP, או oligomycin. הנתונים הם ממוצעים ± SEM. * P <0.05, ** p <0.01 לעומת רכב על ידי מבחן t-זנב אחד. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4: Lipogenesis בתרבית הראשוני עכבר hepatocytes פעילות Lipogenic לעומת הזמן בhepatocytes העיקרי שטופל עם 3 H-אצטט ופעילות lipogenic (ב ') בנוכחות של רכב, oligomycin, או FCCP (). הנתונים הם ממוצעים ± SEM. *** P <0.001 לעומת רכב על ידי מבחן t-זנב אחד.
| טבלת 1 | |
| תרבות מדיה | |
| ציפוי בינוני | |
| DMEM | 500 מיליליטר |
| FBS | 10% |
| פירובט נתרן | 2 מ"מ |
| פן / סטרפטוקוקוס | 2% |
| Dexamethasone | 1 מיקרומטר |
| אינסולין | 0.1 מיקרומטר |
| תחזוקה בינונית | |
| DMEM | 500 מיליליטר |
| V שבר BSA | 0.2% |
| פירובט נתרן | 2 מ"מ |
| פן / סטרפטוקוקוס | 2% |
| Dexamethasone | 0.1 מיקרומטר |
| אינסולין | 1 ננומטר |
| רעב בינוני | |
| DMEM | 500 מיליליטר |
| V שבר BSA | 0.2% |
| פירובט נתרן | 2 מ"מ |
| פן / סטרפטוקוקוס | 2% |
Discussion
הזמן מהקרבה לזלוף צריך להיות פחות מ 3 דקות לזלוף אידיאלי ועיכול collagenase של הכבד. ברגע שזלוף עם זלוף בינוני הוא יזם, הכבד צריך לשנות באופן מיידי את מראה למאדום לחיוורים. לאחר כ 10 דקות של דגירה עם LDM, הכבד יופיע נפוח ורודה. במקרה שזלוף אינו מספיק, בכבד לא יכול להציג שינויים אלה, וזה בדרך כלל יגרום לתשואה hepatocyte נמוכה יותר.
בעקבות צעדי השטיפה, ניתן לאחסן hepatocytes המבודד במשך כמה שעות בהשעיה על קרח לפני הציפוי. ברגע שמצופה, hepatocytes התרבותי דורש כמה שעות לדבוק ולהתפשט. בעקבות 2 שעות של דגירה בציפוי בינוני, hepatocytes יישאר קטן ועגול. לאחר דגירה לילה, hepatocytes ייקח על מראה משושה אופייני יותר, שרבים מהם יהיה binucleated. אם ההכנה היא לא בריאה, גאמות יפגינו רב granulations ומדי פעם blebbing, מעיד על המוות של תאים. על מנת לשמור על יכולת קיום התרבות הטובה ביותר, צריכה להיות שונה תקשורת בכל שעה 24 וטופלה כדי למזער את החשיפה לאוויר פתוחה.
palmitate נתרן הוא מסיס במים ב RT, עם זאת, לאחר דגירה על 70 מעלות צלזיוס זה צריך להתמוסס לחלוטין. חשיפה לRT תגרום השומנים לגבש במהירות, ובכך זה הכרחי לעבוד במהירות. ברגע שpalmitate כבר מומס בטרום דגירה בינונית, זה קריטי כדי לשמור על המדיום על 37 מעלות צלזיוס על מנת לשמור על המסיסות של השומנים.
כפי שצוין לעיל, על מנת להבטיח תוצאות מדויקות מassay חומצות שומן החמצון, הבינוני חייבים להיות לגמרי קפוא בחנקן נוזלי. זה מונע כל בריחה של CO 2 בתוספת של חומצת perchloric לבארות. מייד לאחר התוספת של חומצת perchloric לדגימות קפואות, צלחת assay חייבת להיות הדוקה גovered על ידי צלחת נייר הסינון, והקפד ליישר את הצלחות להעברת גז בין הבארות. מאז נייר הסינון ספוג עם עודף של NaOH, ההרכב של התגובה הוא מסוגל ללכוד CO 2 שוחררו כNaHCO 3. הניסויים הבאים פרוטוקול זה יצרו תוצאות לשחזור, עם קורות חיים% משכפל טיפוסי שיש ≤ 10. במידת צורך, חומר מסיס חומצה מחומצות שומן חמצון assay או lysate התא מassay Lipogenesis הם מסוגל להיות מאוחסן ב -80 ° C ומעובד מאוחר יותר ללא כל השפעה משמעותית על תוצאות. מבחני שתוארו לעיל מאפשרים למנגנון יעיל יחסית פשוט וזמן כדי להעריך את חילוף החומרים של שומנים בדם בhepatocytes העיקרי מבודד מהכבד עכבר. באמצעות שימוש בתרבות vivo לשעבר, שיטות אלה מאפשרות בדיקת ההשפעות של מספר תנאים על חמצון של חומצות שומן וlipogenesis. פרוטוקול זה יכול להיות מותאם על מנת להעריך את התפקיד של שינויים גנטיים בproce אלהsses, עם זאת, בידודה של hepatocytes הוא הגבלת זמן ובכך in vivo מנתח עשוי להיות מתאים יותר לחקירת מודלים של בעלי חיים מהונדסים מסוימים. אם הניתוח של הכנות hepatocyte מרובות הכרחי, נורמליזציה של ערכי assay לרמות חלבון יכולה להתבצע כפי שמתוארת בצעד האופציונלי 3.7.1 ומשמש לנורמליזציה. אנו ממליצים מבחני שבוצעו בהכנות מרובות להשוואה שינויים ביחס לעומת שליטה מתאימה.
לבסוף, יש לנו לא בחנו את האפשרות של תקופות ארוכות יותר תרבות, לעומת זאת, hepatocytes עשוי להפגין מאפייני חילוף חומרים שווי ערך לאחר מספר ימים בתרבות. עם שינוי קל, פרוטוקול זה יכול להיות מותאם כדי לאפשר לטיפולים כמה ימים לפני הערכת ההשפעות של תרכובות בחילוף חומרים של שומנים.
Disclosures
The authors indicate they have no conflicts of interest.
Acknowledgements
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
Materials
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24 G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24 mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 ml Syringe | Becton Dickinson | 309653 | |
| 50 ml conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1,000, 200, 20 μl pipet and tips |
References
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved