Method Article
マウス初代肝細胞における脂肪酸酸化および脂質生成の決意
要約
デノボ脂質生成およびβ脂肪酸酸化は、肝細胞に脂肪肝疾患を含むいくつかの代謝障害に摂動された経路を主要な代謝経路を構成しています。ここでは、マウス初代肝細胞の単離を実証し、β - 脂肪酸の酸化および脂質生成の定量化について説明します。
要約
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
概要
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
プロトコル
すべての動物実験は、ローカルおよび連邦規制に従って及び制度IACUCと放射線安全管理の承認を得て実施されるべきです。
1.準備
- 数日前、アッセイに、肝臓ダイジェストミディアム(LDM)の500ミリリットル瓶を解凍し、50mlのコニカルチューブに〜35ミリリットルのアリコートを再凍結。必要になるまで-20℃で保存してください。
- アッセイの1日前に、オートクレーブによりクリーンな解剖ツールを事前に滅菌します。
- アッセイの日に、コラーゲンとの24ウェル培養プレートの必要な量を扱います。
- PBSの50部で3 mg / mlのラット尾コラーゲン1部を混合します。 24ウェルプレートの各ウェルに約500μLを加え、室温(RT)で3~5分間インキュベートします。コラーゲンを外し、プレートをフード内空気乾燥することができます。少なくとも一つの追加の時間を繰り返します。
注意:コラーゲンコーティングが広告に1週間まで行うことができますヴァンス、プレートをプラスチックラップで密封し、4℃で保存しました。
- PBSの50部で3 mg / mlのラット尾コラーゲン1部を混合します。 24ウェルプレートの各ウェルに約500μLを加え、室温(RT)で3~5分間インキュベートします。コラーゲンを外し、プレートをフード内空気乾燥することができます。少なくとも一つの追加の時間を繰り返します。
- 37℃に解凍LDMと暖かいと1N KOHを使用してpHを7.4に調整します。アッセイのLDMを準備します。再循環を42℃の水浴中で、0.2μmのシリンジフィルターと場所を使用してフィルタ。
- 水浴を再循環で42°Cまでの肝灌流中のウォーム25ミリリットル。
- ポリビニルピロリドンの溶液を塗布し、90%のコロイダルシリカを準備します。ポリビニルピロリドンで被覆されたコロイド状シリカの9ミリリットルに10倍のDPBS 1ミリリットルを追加します。 0.1 N HClを用いてpHを7.4に調整します。滅菌0.2μmのシリンジフィルターでろ過します。室温で保管してください。
- 37°Cまでのめっき中暖かいです。
初代マウス肝細胞の単離2。
- 蠕動ポンプ、チューブ、および解剖テーブルを設定します。滅菌水10ml、続いて蒸留水で5ミリリットルの70%エタノールで洗浄することによりチューブを滅菌します。埋めるために肝灌流培地でチューブと実行ポンプを配置しますチューブの全長。
- 制度承認の方法により、マウスを生け贄に捧げます。
- 腹腔を開き、解剖70%エタノールで自由にマウスの腹部スプレー。平滑末端はさみを使用して、真皮を通って腹部の長さを正中切開を行い、横方向に反映しています。内臓を露出するために腹膜に同様の切開を行います。
- 鈍器を使用して、静かに腎静脈の遠位に、腹部下大静脈(IVC)を見つけて、血管の下に縫合糸を配置腹部血管系を露出するように腸を変位
- 遠位縫合糸に、縫合糸のレベルを超えて、それを進める、IVCに針やカテーテルを配置します。まだ場所に針で、所定の位置に保持するために、カテーテルの周りに縫合糸を結びます。慎重に針を取り除きます。カテーテルを通して流れに血液、正しく行われた場合。
- ピペットを使用することで、確実に、灌流媒体とカテーテル内の残りの領域を埋めます空気が存在しません。細心の注意を払って、カテーテルにチューブを取り付けます。
- 肺の空洞を開く解剖:優しくダイヤフラムを露出するために、優れた肝葉を反映しています。慎重に胆嚢と胸膜血管系を避けるように注意しながら、胸膜腔を露出するために、横方向の切開を行い、その後、鋭い先端のハサミで隔膜を穿刺。肝静脈のすぐ近位胸部下大静脈の周りブルドッグクランプを配置します。
- 門脈をカットし、3でポンプの電源をオンに - 4ミリリットル/分。灌流培地の約20ミリリットルを用いて5分間肝灌流培地で肝臓を灌流。
注:肝臓はすぐにグレー/黄褐色に赤から変更する必要があります。肝臓の部分が赤のままである場合、これはおそらく乏しい灌流を示し、成功した分離の可能性が大幅に減少します。灌流の間に、媒体が出て実行されず、気泡がチューブに入らないことを保証するように注意してください。 - 5分間のインキュベーションに続いて、停止しますポンプおよび肝臓ダイジェスト中にチューブを移します。 (媒体がなくなるまで)15分 - ポンプを再起動して、別の10のために肝臓を灌流。
- 灌流の終了時に、ポンプを停止します。肝臓はピンクがかった色合いを持っており、やや拡大表示されます。慎重な切開により、肝臓を切除。胆嚢を削除し、10cmの組織培養皿に肝臓を転送します。
- バイオセーフティキャビネットでは、肝臓にメッキミディアム( 表1)の10ミリリットルを追加します。静かに肝細胞を除去するために、いずれかのピンセットやメスを用いて肝臓をこすり。 50mlコニカルチューブに100μmのセルストレーナー、転送を使用してサスペンションをフィルタリングします。 50mlコニカルチューブにめっき中、プールの追加10mlでプレートを洗浄します。
- 350×gで、4℃で5分間の遠心分離により細胞をペレット化。
- めっき中の10ml中の培地を吸引し、再懸濁ペレットとPOでコーティングされた90%のコロイダルシリカの10ミリリットルを追加しますlyvinylpyrrolidone。穏やかに混合し、ステップ2.11のように遠心します。生細胞が底にペレット化する一方遠心分離した後、死細胞の層は、混合物の上に浮遊されます。
- 吸引し死んだ細胞および培地。メッキ中、2.11のように遠心20mlで2回洗浄します。
- めっき中の10ml中に再懸濁細胞。血球計数器で細胞をカウントし、コラーゲン処理した24ウェル培養皿に9×10 4細胞/ウェルで置き。 2時間、37℃の組織培養インキュベーター中でインキュベートします。各プレートは、脂肪酸酸化アッセイまたは脂質生成アッセイのいずれかのために使用することができます。
- 必要に応じて、37℃で維持培地( 表1)と文化に井戸を変更します。アッセイの結果に影響を与えずに3日 - 細胞を2ために培養することができます。
3.脂肪酸酸化アッセイ
警告:放射能の使用は危険です。すべての購買、保管、取り扱い、およびジ放射性物質のsposalは、制度的状態、および連邦の規制やガイドラインに従って行われるべきです。
- 16から20時間アッセイの前に、温かいPBSで細胞を2回洗浄します。 20 nMのグルカゴンで無血清血清飢餓培地( 表1)に細胞を変更し、37℃で一晩インキュベートします。
注意:ウシ胎児血清は、代謝ホルモンの未知の濃度( 例えば、インスリン 、グルカゴン)を含んでいるので、血清これはアッセイに持つかもしれない交絡の影響を除去するために、細胞を飢えさせます。細胞は> 24時間血清飢餓培地中で生存可能です。グルカゴン治療は、肝細胞内の脂肪酸酸化を刺激するために使用されます。 - アッセイの朝に、前培養培地を準備し、10分間70℃で100mMの溶液と熱を加えるために超純水にナトリウムパルミチン酸の適切な量を再懸濁します。一方で、必要量(24ウェルプレートのウェルあたり0.5 ml)を調製25mMのHEPES、1%のBSAフラクションV、および20 nMのグルカゴンを含むDMEMの。 37℃に加熱します。
- 可溶化した後、培地に250μmの最終濃度にパルミチン酸を追加します。プレインキュベーション中に肝細胞を変更し、37℃で2時間インキュベートします。後で使用するために、37℃で、いくつかのプレインキュベーション中を予約。
- インキュベーションの間、窒素ガス下で蒸発させて14 C-パルミチン酸(0.5μCiの/ウェル)の適切な量を乾燥させます。
- 例えば、24ウェルプレートで24のサンプルを測定して1.5 mlチューブに0.1μCiの/ mlの14 C-パルミチン酸120μlのを転送します。ゆっくりとヒュームフード3-5センチの距離からの溶液上に窒素ガスを吹き付けてエタノール溶媒を蒸発させます。チューブの底に乾燥14 C-パルミチン酸を残し、40分-溶媒が約30を蒸発させる必要があります。
- 約15分間のインキュベーションの終了前に、14を再懸濁0.1 N NaOH中のC-パルミチン酸(12.5μL/マイクロCi)。 70℃で10分間インキュベートします。暖かいプレインキュベーション中の三巻を追加し、ピペッティングにより混和します。
- 希釈された14 C-パルミチン酸の25μlの各ウェルをスパイク。静かにプレートをロッキングすることによって混合し、37℃で90分間インキュベートします。これは、アッセイプレートです。
- インキュベーションの間、フィルターペーパープレート( 図1)を作製 。
- 滅菌24ウェルプレートからカバーを取り外します。各ウェルの底にろ紙の2センチメートル×2センチピースを置きます。 4 "×7"パラフィルムの切れ端でプレートをオーバーレイ。
- このようなピペットチップボックスとして、大きな長方形のオブジェクトを使用して、ウェル開口部にパラフィルムを穿孔し、プレートの残りの部分の上にシールを作成するために、ウェル上にパラフィルムをこします。今井戸をカバーするパラフィルムの穴あき円を削除します。プレートは現在、しっかりウェルOを除くすべての地域でパラフィルムでカバーされるべきですpenings。
- インキュベーションの終了の10分前に、ろ紙は、液体の全てを吸収し確認して、フィルターペーパープレートの各ウェルに3 N NaOHを200μlを添加します。
- 必要に応じて前に新鮮な24ウェルプレートにメディアを転送し、凍結します。 PBSで1回洗浄した後、0.1 N HCl中の残りの細胞を溶解し、BCAアッセイによってタンパク質含量を算出します。
- インキュベーションの終了時に、スナップ凍結アッセイプレートを、液体窒素中で。各ウェルは、先に進む前に、完全に凍結されていることを確認するように注意してください。
- アッセイプレートの各ウェルに70%過塩素酸を100μlのを追加します。すぐにフィルターペーパープレートでカバーしています。室温で2時間80 rpmでの軌道速度でオービタルシェーカーと岩の上にプレートを置きます。
- インキュベーション後、サンプルを処理します。
- シンチレーション4 mlの液体シンチレーション液をろ紙の正方形を転送する、CO 2の画分を測定します14 C信号をバイアルおよび測定します。
- 酸可溶性物質を測定するために、1.5mlマイクロチューブに培地を400μlのを転送します。 10分間最大速度で遠心します。簡単に1クロロホルム - メタノール(v / v)であり、渦:2の500μlに得られた上清を100μlを追加します。
- 再び混合物に水を250μl加え、ボルテックス。 3000×gで10分間遠心サンプル。シンチレーションバイアルに液体シンチレーション流体4ミリリットルに上相の200μLを移し、14 C信号を測定します。
4.脂質生成アッセイ
- アッセイの前に開始する夜は、温かいPBSで細胞を2回洗浄します。 100nMのインスリンで血清飢餓中に肝細胞を変更します。 37℃で一晩インキュベートします。
ウシ胎児血清は代謝ホルモンの未知の濃度が含まれているので( 例えば、インスリン 、グルカゴン注:)、血清がこのアッセイに持つかもしれない交絡の影響を除去するために、細胞を飢えさせます。細胞は> 24時間血清飢餓培地中で生存可能です。インスリンは、脂質生成を刺激するために、このアッセイで使用されます。 - 100nMのインスリン、10μMの冷たい酢酸および0.5μCiの3 H-アセテートウェル当たりで血清飢餓培地:脂質生成中にします。脂質生成中に細胞を変更し、37℃で2時間インキュベートします。試験しようとする目的の任意の化合物が含まれます。
- インキュベーション期間の後、PBSで細胞を2回洗浄します。 0.1 N HClを120μlの掻き落とし行ない、細胞を溶解します。リザーブ10タンパク質アッセイ用μL(BCAアッセイにより評価)、および1.5mlマイクロチューブに100μlのを転送します。
- 1クロロホルム - メタノール(v / v)の:2の500μlに添加することにより、脂質を抽出します。渦は簡単にし、5分間室温でインキュベートします。水、渦の250μLを加え、さらに5分間室温でインキュベートします。遠心サンプル3000×gで、室温で10分。慎重にシンチレーションバイアルに4 mlの液体シンチレーション流体に下相を転送し、3 H活性を測定します。
結果
3×10 7の全細胞-肝細胞の単離は、一般的に1になります。一晩のインキュベーションの後、細胞は、六角形の表示され、その多くは( 図2)二核れます。健康な細胞は、細胞死の指標である顆粒またはブレブ、を欠いでなければなりません。
一般的には、脂肪酸酸化アッセイは、試験化合物ごとに3〜4回繰り返して実行されます。 CO 2のサンプルのカウントは、酸可溶性物質から誘導されるものの約五分の一です。我々は一般的に(つまり、クエン酸サイクルを経て酸化量である)完全な酸化の指標としての酸可溶性物質へのCO 2の比を計算します。このようなシアン化カルボニル-4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)などの細胞呼吸を促進する物質は、TCAサイクルを経由してより多くの酸化を示す、CO 2に向けてこの比率をシフトします。呼吸鎖の阻害剤は、全体的に酸化を減少します( 図3)。このアッセイを操縦する場合は、手順は、細胞特異的活性を生産していることを確認するために、無細胞対照を含めることをお勧めします。
脂質生成アッセイは、ほとんどの場合、ゼロ時点管理(直ちに収穫前の基板で処理された細胞)と比較します。アッセイは、インキュベーションの少なくとも4時間を通して時間に対して直線的でなければなりません。例えば、オリゴマイシンのようなFCCPとして、脂肪酸酸化を増強する、またはATP合成を減少させる化合物は、脂質生成活性( 図4)が減少します。
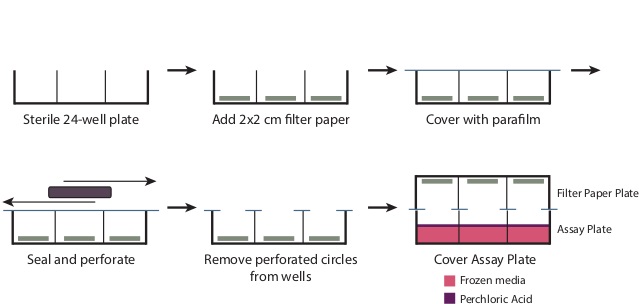
図1:ステップ3.6で説明したように、フィルタープレートを準備するためにフィルタープレートの調製は 、無菌の24ウェルプレートからカバーを取り外します。各ウェルの底にろ紙2cmの×2センチピースを置きます。パラの7 "×4"の部分でプレート全体をオーバーレイフィルム、しっかりと井戸の上部をシールするプレートをこします。これは、除去されなければならないだけでなく、開口部、パラフィルムの上の穴のあいた円を生成します。ステップ3.9での過塩素酸を添加した後、シールを生成するためにアッセイプレートの上にしっかりとフィルターペーパープレートを配置します。
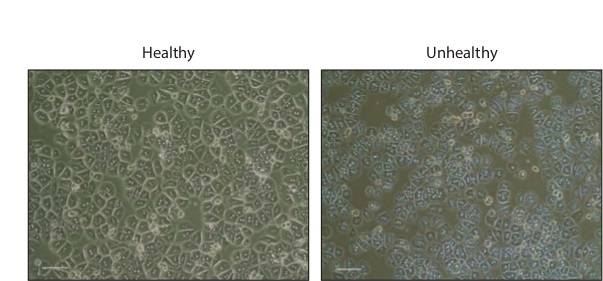
図2:文化相で初代肝細胞を16時間 、コラーゲンコートした24ウェルプレートにプレーティングした後、健康と不健康な初代マウス肝細胞の画像を対比。スケールバー、200μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
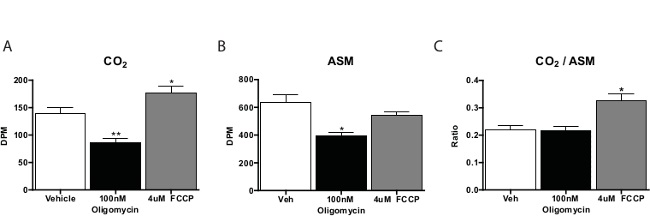
図3:プライマリによって脂肪酸酸化文化14(A)、CO 2、(B)酸可溶性物質、および(C)車両、FCCP、またはオリゴマイシンとインキュベートし、一次肝細胞からの酸可溶性物質へのCO 2の比率のCパルミチン酸酸化のマウス肝細胞。データは平均±SEMです。車両対* P <0.05、** P <0.01、片側スチューデントのt検定による。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4:3 H-酢酸および(B)脂質合成車両の存在下での活性、オリゴマイシン、またはFCCPで処理した初代肝細胞における対時間培養した初代マウス肝細胞 (A)脂質合成活性における脂質生成 。データは平均±SEMです。 *** P <0.001車両対片側スチューデントのt検定による。
| 表1 | |
| 培地 | |
| めっき中 | |
| DMEM | 500ミリリットル |
| FBS | 10% |
| ピルビン酸ナトリウム | 2 mMの |
| ペニシリン/ストレプトマイシン | 2% |
| デキサメタゾン | 1μM |
| インスリン | 0.1μM |
| メンテナンス中 | |
| DMEM | 500ミリリットル |
| BSAフラクションV | 0.2% |
| ピルビン酸ナトリウム | 2 mMの |
| ペニシリン/ストレプトマイシン | 2% |
| デキサメタゾン | 0.1μM |
| インスリン | 1 nMの |
| 飢餓ミディアム | |
| DMEM | 500ミリリットル |
| BSAフラクションV | 0.2% |
| ピルビン酸ナトリウム | 2 mMの |
| ペニシリン/ストレプトマイシン | 2% |
ディスカッション
犠牲から灌流までの時間は、肝臓の理想的な灌流およびコラゲナーゼ消化のために3分未満でなければなりません。灌流培地で灌流が開始されると、肝臓はすぐに淡赤からに外観を変更する必要があります。 LDMとのインキュベーションの約10分後、肝臓が腫れてピンク色に表示されます。潅流が不十分である場合には、肝臓はこれらの変化を示さないことがあり、これは典型的にはより低い肝細胞の収率をもたらします。
洗浄工程の後に、単離された肝細胞は、従来のめっきを氷上で懸濁液中で数時間保存することができます。メッキ後は、培養肝細胞が付着して広がるために数時間を必要とします。めっき中でのインキュベーションの2時間後に、肝細胞は小さくて丸いままになります。一晩インキュベートした後、肝細胞は、二核されますそれらの多くは、より特徴的な六角形の外観になります。準備が不健康である場合には、Cellsは、細胞死を示す多数の顆粒と時折小疱形成を示すであろう。最良培養生存度を維持するために、培地は24時間毎に変更する必要があり、外気への暴露を最小限に抑えるように注意。
パルミチン酸ナトリウムは、それが完全に溶解すべきである70℃でのインキュベーションの後、しかし、室温で水に不溶性です。 RTへの曝露は、このように、それは迅速に作業することが不可欠である、脂質は急速に固化するようになります。パルミチン酸は、プレインキュベーション媒体中に溶解された後、それは、脂質の溶解度を維持するために、37℃で培地を維持することが重要です。
脂肪酸酸化アッセイからの正確な結果を保証するために、前述したように、媒体が液体窒素で完全に凍結する必要があります。これは、ウェルに過塩素酸の添加中のCO 2のいずれかの脱出を防ぐことができます。直ちに凍結サンプルに過塩素酸の添加後、アッセイプレートをしっかりCでなければなりませんフィルターペーパープレートによってovered、ウェル間のガス移送のためにプレートを必ず合わせてください。濾紙をNaOHの過剰に浸漬されているので、反応の化学量論をNaHCO 3のように放出されたCO 2を捕捉することが可能です。このプロトコルを以下の実験は、標準的な複製を有する%のCVで、再現性のある結果を生成した≤必要であれば10は、脂肪酸酸化アッセイまたは脂質生成アッセイからの細胞溶解物からの酸可溶性物質を-80℃で保存され、処理されることが可能です後で結果に任意のかなりの影響なし。上記のアッセイは、マウスの肝臓から単離した初代肝細胞における脂質代謝を評価するための比較的簡単で、時間効率的なメカニズムを可能にします。 ex vivoでの培養を使用することにより、これらの方法は、脂肪酸酸化及び脂質生成におけるいくつかの条件の効果を試験を可能にします。このプロトコルは、これらのproceにおける遺伝子変異の役割を評価するように構成することができますSSESしかしながら、肝細胞の単離は、時間制限であり、したがって、インビボで特定のトランスジェニック動物モデルを調査するために、より適切であり得る分析します。多数の肝細胞調製物の分析が必要であれば任意のステップ3.7.1で説明した正規化のために使用されるように、タンパク質レベルのアッセイ値の正規化を行うことができます。私たちは、複数の製剤は、適切なコントロールに対する相対変化として比較することで実施したアッセイをお勧めします。
最後に、より長い培養期間のオプションを検討していないが、肝細胞は、培養数日後に同等の代謝特性を示すことができます。わずかな変更で、このプロトコルは、脂質代謝に対する化合物の効果を評価する前に、数日間の治療を可能にするように適合させることができます。
開示事項
The authors indicate they have no conflicts of interest.
謝辞
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
資料
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24 G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24 mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 ml Syringe | Becton Dickinson | 309653 | |
| 50 ml conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1,000, 200, 20 μl pipet and tips |
参考文献
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved