Method Article
Indução e Caracterização da Hipertensão Pulmonar em Camundongos usando o Modelo De Hypoxia/SU5416
Neste Artigo
Resumo
Este protocolo descreve a indução da hipertensão pulmonar (PH) em camundongos com base na exposição à hipóxia e na injeção de um antagonista receptor VEGF. Os animais desenvolvem hipertrofia ph e ventricular direita (RV) 3 semanas após o início do protocolo. A caracterização funcional e morfométrica do modelo também é apresentada.
Resumo
Hipertensão Pulmonar (AP) é uma condição fisioterológica, definida por uma pressão arterial pulmonar média superior a 25 mm Hg em repouso, conforme avaliado pelo cateterismo cardíaco direito. Um amplo espectro de doenças pode levar à ETI, diferindo em sua etiologia, histopatologia, apresentação clínica, prognóstico e resposta ao tratamento. Apesar dos progressos significativos nos últimos anos, a AP continua sendo uma doença não recorrente. Compreender os mecanismos subjacentes pode abrir caminho para o desenvolvimento de novas terapias. Modelos animais são importantes ferramentas de pesquisa para alcançar esse objetivo. Atualmente, existem vários modelos disponíveis para recapitulação de PH. Este protocolo descreve um modelo PH de dois hits do mouse. Os estímulos para o desenvolvimento de PH são a hipóxia e a injeção de SU5416, um antagonista do receptor fator de crescimento endotelial vascular (VEGF). Três semanas após o início da Hipóxia/SU5416, os animais desenvolvem remodelação vascular pulmonar imitando as alterações histopatológicas observadas na AP humana (predominantemente grupo 1). A remodelação vascular na circulação pulmonar resulta na remodelação do ventrículo direito (RV). Os procedimentos para medir as pressões de RV (utilizando o método do peito aberto), as análises morfômicas do RV (dissecando e pesando ambos os ventrículos cardíacos) e as avaliações histológicas da remodelagem (tanto pulmonares através da avaliação da remodelagem vascular quanto do cardíaco, avaliando a hipertrofia e a fibrose cardiomiocócica do RV) são descritas detalhadamente. As vantagens deste protocolo são a possibilidade da aplicação tanto em camundongos selvagens quanto em camundongos geneticamente modificados, a implementação relativamente fácil e de baixo custo, e o rápido desenvolvimento da doença de interesse (3 semanas). As limitações deste método são que os camundongos não desenvolvem um fenótipo grave e a FP é reversível no retorno à normoxia. A prevenção, assim como os estudos terapêuticos, podem ser facilmente implementados neste modelo, sem a necessidade de habilidades avançadas (em oposição aos modelos de roedores cirúrgicos).
Introdução
Hipertensão pulmonar (AP) é uma condição fisioterológica, definida por uma pressão arterial pulmonar média (PA) superior a 25 mm Hg em repouso, conforme avaliado pelo cateterismo cardíaco direito1,,2. Há uma variedade de doenças que podem levar à PH. Na tentativa de organizar as condições associadas ao PH, vários sistemas de classificação foram desenvolvidos. A classificação clínica atual categoriza as múltiplas doenças associadas à AP em 5 diferentes grupos1. Essa distinção é importante, pois vários grupos de pacientes possuem doenças que diferem em sua apresentação clínica, patologia, prognóstico e resposta ao tratamento2. A Tabela 1 resume a classificação atual, complementada com as características histopatológicas básicas de cada doença.
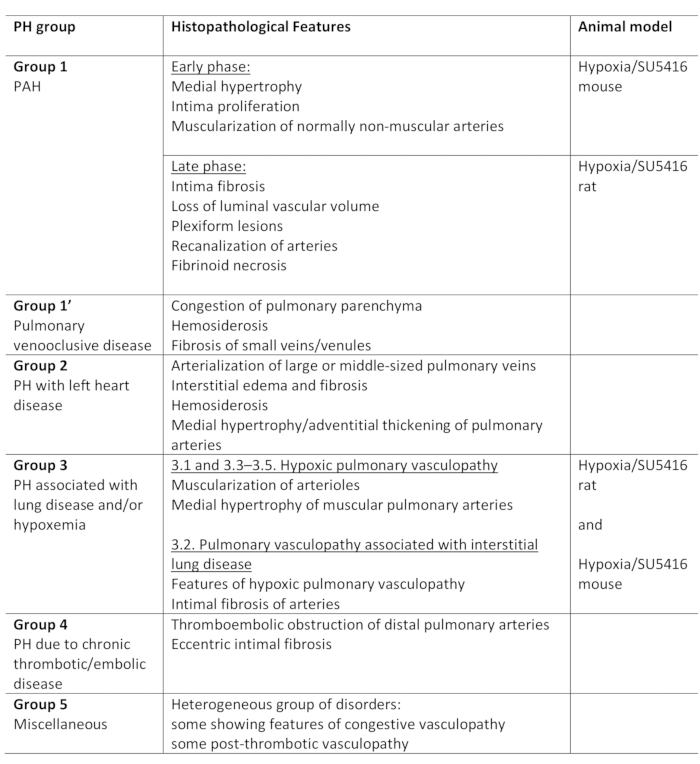
Tabela 1: Visão geral da classificação clínica de PH, juntamente com as principais características histopatológicas dentro dos grupos. Adequação do protocolo Hypoxia/SU5416 para modelagem de PH. Esta tabela foi modificada a partir de19. PH: Hipertensão pulmonar, PAH: Hipertensão Arterial Pulmonar
Apesar dos avanços significativos no tratamento de doenças associadas à AP, a AP ainda permanece sem cura, com uma taxa de mortalidade de 3 anos variando entre 20% e 80%3. Isso indica a necessidade imperativa de compreender os mecanismos subjacentes da AP e, posteriormente, o desenvolvimento de novas terapias para prevenir, retardar a progressão e curar a doença. Modelos animais são de importância crucial para este escopo. Atualmente, existem vários modelos para estudar PH. O leitor interessado é encaminhado para as excelentes avaliações sobre este tópico2,3,4. Tendo em vista a variedade de doenças que levam à PH, é óbvio que as diversas condições da AP humana não podem ser perfeitamente recapituladas em um modelo animal. Os modelos animais disponíveis podem ser categorizados em i) single-hit, ii) two-hit, iii) knockout, e iv) overexpression models3. Nos modelos de um único hit, a FP é induzida por um único estímulo patológico, enquanto os modelos de dois hits combinam dois estímulos patológicos com o objetivo de induzir a PH mais grave e, assim, imitar mais de perto a complexa doença humana. Além das diferenças etiológicas, os diversos estímulos resultam em diferenças de modelagem de PH que dependem também da espécie e do fundo genético dos animais4.
Um dos modelos clássicos de roedores PH mais usados é o modelo de hipóxia crônica2. A hipóxia é conhecida por induzir PH em humanos, bem como em várias espécies animais. A hipóxia tem a vantagem de ser um estímulo fisiológico para PH (Tabela 1). No entanto, enquanto o grau de hipóxia usado para induzir PH em roedores é muito mais grave do que em humanos, o único insulto (hipóxia) leva apenas a uma forma leve de remodelagem vascular. Isso não imita a gravidade da doença humana. A adição de um segundo hit, um estímulo extra para induzir a PH, mostrou resultados promissores: a injeção do composto SU5416 aos roedores combinado com o estímulo hipóxico induz um fenótipo PH mais grave2,,5,6. SU5416 é um inibidor do receptor fator de crescimento endotelial vascular (VEGF) receptor-2. Bloqueia os receptores VEGF e leva à apoptose celular endotelial. Em condições hipóxiis, isso estimula a proliferação de um subconjunto de células endoteliais resistentes à apoptose. Além disso, o SU5416 leva à proliferação de células musculares lisas. A combinação desses efeitos resulta em remodelação vascular patológica da circulação pulmonar e leva à elevada pressão da AF e remodelação ventricular direita2,,5,,7. O modelo foi descrito pela primeira vez em ratos6 e posteriormente aplicado em camundongos4,5,7. O modelo do mouse exibe remodelagem vascular menos severa em comparação com ratos. Além disso, quando retornado à normoxia, a AP continua a progredir em ratos, enquanto em camundongos é parcialmente reversível.
O protocolo a seguir descreve todas as etapas para modelagem de PH em camundongos usando o método Hypoxia/SU5416 (planejamento, cronograma, execução). Além disso, a caracterização do modelo está descrita neste protocolo: funcionalmente (medindo invasivamente a pressão ventricular direita (RV) utilizando a técnica do peito aberto), morfometricamente (dissecando e pesando tanto os ventrículos direito quanto esquerdo), bem como histologicamente (avaliando a remodelagem vascular pulmonar, hipertrofia cardiomiófica ventricular direita e fibrose).
Todas as etapas e métodos descritos neste protocolo podem ser facilmente implementados pelos investigadores em qualquer nível de experiência. Embora as medidas funcionais do RV usando a técnica de peito aberto (descrita aqui) não seja o método padrão-ouro no campo, ele tem a vantagem de que pode ser rapidamente aprendido e reproduzido com precisão até mesmo por um experimentador menos experiente.
Protocolo
Antes de qualquer experimentação animal obter a autorização do comitê de cuidados com animais institucionais locais. Os experimentos atuais foram realizados após aprovação do Comitê Institucional de Cuidados e Uso de Animais (IACUC) na Escola de Medicina Icahn do Monte Sinai.
1. Indução de PH
- Preparação
- Antes de iniciar o estudo, planeje cuidadosamente o projeto experimental. Certifique-se de que os camundongos são submetidos à hipóxia ao mesmo tempo que a primeira injeção SU5416. Um exemplo do projeto experimental para induzir PH usando o método Hypoxia/SU5416 é mostrado na Figura 1A. Os ratos de controle receberam apenas o veículo. Para este modelo, o SU5416 será injetado nos ratos uma vez por semana durante 3 semanas consecutivas.
- Use camundongos C57BL/6 de oito a doze semanas para este estudo. Abriga os animais a 18-20 °C em um ciclo claro-escuro de 12 h. Certifique-se de que alimentos e água são acessíveis ad libitum.
- Pesar os animais. Atribuê-los aleatoriamente a cada grupo: Normoxia e Hypoxia/SU5416.
- Prepare a câmara hipóxica como mostrado nos tanques de nitrogênio (N2)da Figura 1B. Nitrogênio seguro (N 2 ) perto da câmara. Coloque o controlador de oxigênio (O2)em um ponto de 10% O2. Deixe o sistema chegar a um estado estável.
- Prepare SU5416 para injeção (use uma dose de 20 mg/kg de peso corporal). O SU5416 não se dissolve em soluções aquosas; portanto, dissolva o valor calculado em 100 μL DMSO8. Por exemplo, para um mouse de 25 g, a quantidade de SU5416 a ser injetado é de 0,5 mgs dissolvido em solvente de 100 μL (DMSO). A concentração final de SU5416 para este mouse é, portanto, de 5 mg/mL.
ATENÇÃO: SU5416 é um material perigoso. Leia cuidadosamente a Ficha de Dados de Segurança acompanhada do produto e certifique-se de tomar as precauções recomendadas ao manusear esta substância. Use luvas de proteção e (quanto a qualquer injeção) use proteção ocular. A estrutura química de SU5416 é mostrada na Figura 1C.
NOTA: Calcule um excesso adequado da solução para compensar o volume que será perdido durante a injeção (por exemplo, na seringa, frasco etc.). Dependendo da seringa utilizada, o volume morto é de aproximadamente 200 μL. Para um grupo de 10 camundongos, calcule um excesso de 2 doses de camundongos. - Prepare as seringas para injeção. Use seringas de 1 mL com agulhas de 25 G x 5/8".
- Injeção subcutânea SU5416
- Contenha o animal. Coloque o mouse na tampa da gaiola para auxiliar a contenção. Segure a pele e forme uma tenda paralela à coluna. Certifique-se de agarrar firmemente a parte de trás da cabeça, para evitar a possível lesão de mordida pelo mouse.
NOTA: A presença de dois investigadores torna o procedimento mais rápido e preciso, pois um pode segurar o animal enquanto o outro realiza a injeção. - Insira a agulha subcutânea sobre o flanco na dobra solta da pele. Certifique-se de inserir a agulha paralela à pele. Evite penetrar na parede abdominal.
- Injete o teor da seringa (100 μL de SU5416 dissolvido ou veículo).
NOTA: Para evitar vazamentos após o parto completo, segure a seringa por aproximadamente 10 s e gire ligeiramente a agulha sob a pele. - Retire a agulha e devolva o animal para sua gaiola. Após a injeção de SU5416, coloque as gaiolas na câmara de hipóxia ventilada.
- Contenha o animal. Coloque o mouse na tampa da gaiola para auxiliar a contenção. Segure a pele e forme uma tenda paralela à coluna. Certifique-se de agarrar firmemente a parte de trás da cabeça, para evitar a possível lesão de mordida pelo mouse.
- Exposição à hipóxia
- Monitore a ventilação ao longo do tempo. Certifique-se de manter 10% do suprimento de oxigênio. Manter animais de normoxia em uma câmara semi-vedátil em 21% O2.
- Certifique-se de que as câmaras estão equipadas com um sensor de oxigênio para medir o nível de oxigênio. Evite a abertura extensiva das câmaras. Para limpeza e adição de alimentos e água abra as câmaras por não mais de 20 minutos a cada 3 dias.
- Inspecione animais diariamente. Considere sinais de estresse como piloerection ou perda significativa de peso.
NOTA: Espera-se que animais sob Hipoxia/SU5416 percam peso5. Isso é uma indicação do desenvolvimento da doença. - Repita a injeção SU5416 semanalmente por 3 semanas consecutivas (ver Figura 1A para a visão geral do design experimental).
NOTA: Variar o local da injeção pode ajudar a reduzir as irritações na pele.
2. Caracterização funcional por medidas invasivas de pressão de RV
- Preparação
NOTA: Selecione um regime anestésico. Podem ser utilizados anestésicos inalaáveis ou inaláveis. Uma vez que uma pequena overdose de anestésicos injetáveis (especialmente de cetamina/xilazina ou pentobarbital) pode afetar significativamente a função cardíaca, recomenda-se o uso de anestésicos voláteis. É de grande importância usar o mesmo anestésico para todos os camundongos dentro de um estudo.- Use um vaporizador para garantir uma dose precisa de anestésico por animal. A dose para isoflurane é a seguinte: indução 3-4%, manutenção 1% misturada com 100% de oxigênio.
NOTA: Use equipamentos de proteção individual e evite respirar o vapor. - Prepare uma almofada de aquecimento e/ou lâmpadas de aquecimento para manter a temperatura corporal. Prepare uma sonda de temperatura retal para monitorar a temperatura corporal.
- Certifique-se de ventilação adequada. Prepare o ventilador com antecedência. Prepare o conector do tubo Y e verifique a função do ventilador usando o modo manual. Certifique-se de que a pressão inspiratória é <1 cm H2O para evitar barotrauma. Coloque a taxa respiratória em 110 respirações/min.
- Prepare um tubo endotraqueal cortando um cateter intravascular de 20 G.
- Prepare os instrumentos necessários: fórceps pequenos, tesouras, retráteis de gancho elástico, cauterizador de vasos e cotonetes de algodão. Em um cotonete ajuste uma pequena agulha de 25 G x 5/8" que será usada para fazer uma pequena punção no ventrículo direito.
- Prepare o Cateter de Pressão, a Unidade de Controle de Volume de Pressão e inicie o software de aquisição de dados. Coloque o Cateter PV em um tubo de 15 mL cheio de PBS a 37 °C por 15 min e calibrar de acordo com o protocolo do fabricante.
- Para a perfusão e fixação dos órgãos, preparar PBS e uma solução de 50% PBS / 50% OUT. Prepare 2 x 10 mL de seringas (com agulha de 25 G): uma será usada para perfusar o coração e o pulmão com PBS in situ e a segunda para injetar a solução OCT/PBS (50/50) para a amostra pulmonar que será usada para exame histológico.
- Use um vaporizador para garantir uma dose precisa de anestésico por animal. A dose para isoflurane é a seguinte: indução 3-4%, manutenção 1% misturada com 100% de oxigênio.
- Intubação
- Pese o rato e regise o estado de saúde antes da anestesia.
- Induzir anestesia com 3-4% de isoflurane. Verifique a profundidade da anestesia testando o reflexo do dedo do pé-beliscar: belisque o dedo do pé de um dos membros firmemente. Se o animal retirar o membro, é um sinal de anestesia insuficiente.
- Após indução de anestesia, raspe o pescoço e as áreas do peito.
- Coloque o mouse na almofada de aquecimento. Coloque uma sonda de temperatura retal para monitorar a temperatura corporal.
NOTA: A manutenção da temperatura corporal é importante para as medidas funcionais. A temperatura corporal deve ser de aproximadamente 36,5-37 °C. - Usando fórceps curvos conecte um fio de sutura aos incisivos superiores do mouse, estique e fixe na almofada de aquecimento com fita cirúrgica. Fixar os membros do rato usando fitas cirúrgicas.
- Para entubar o animal faça uma pequena incisão de aproximadamente 1 cm na pele cervical medial usando uma tesoura pequena.
NOTA: A intubação oral é um método alternativo que requer mais experiência. - Com um aplicador de ponta de algodão separado sem rodeios as glândulas salivares parótidas e submandibulares no nível médio. Isso vai expor os músculos sobreovando a traqueia.
- Corte cuidadosamente esses músculos expondo a traqueia.
- Com uma tesoura pequena faça uma pequena incisão entre as cartilagens traqueais e insira o tubo endotraqueal preparado. Tire a guia metálica do cateter intravascular.
- Ligue o cateter ao ventilador. Verifique a posição do tubo traqueal inflando manualmente os pulmões. Proteja a posição com fita adesiva.
- Mantenha uma anestesia isoflurane de 1% durante todo o procedimento.
- Monitore regularmente a profundidade da anestesia testando o reflexo do dedo do dedo do dedo do dedo. Ajuste a anestesia de acordo.
NOTA: A frequência cardíaca recomendada durante os experimentos, abaixo de 1% de anestesia isoflurane, é de aproximadamente 400 batimentos /min. A manutenção da temperatura corporal e da anestesia são essenciais para controlar a frequência cardíaca. O excesso de isoflurane pode reduzir a frequência cardíaca. No entanto, a recuperação pode ser alcançada reduzindo a taxa de isoflurano.
- Medidas de pressão do RV (abordagem de peito aberto)
- Com uma tesoura pequena, realize uma incisão cutânea de aproximadamente 1 cm sobre o processo xifoide e a parte abdominal superior. Separe a pele que cobre o peito e a parede abdominal dos quadrantes abdominais superiores: comece na linha do meio, distal até o xifoide e mova-se cuidadosamente lateralmente em ambos os lados. Use termocauteria para controlar o sangramento.
NOTA: O objetivo é ter acesso à cavidade torácica através da parede abdominal. - Abra a cavidade abdominal e corte o diafragma cuidadosamente, tomando cuidado para não ferir o coração batendo ou os pulmões.
NOTA: O objetivo é expor o ápice e o ventrículo direito do coração. Uma boa exposição e visão do coração são de importância crucial para a correta colocação do cateter. É de grande importância evitar sangramento durante todo o procedimento. Mesmo pequenas alterações no volume intravasal podem alterar a carga do coração direito e afetar os parâmetros registrados. - Remova suavemente o pericárdio usando um aplicador de ponta de algodão.
- Pouco antes de colocar o cateter de pressão no coração, traga o cateter ao lado do mouse.
- O uso do aplicador preparado com ponta de algodão com a agulha faz uma facada na parte distal apical do ventrículo direito. Remova cuidadosamente a agulha e insira o cateter de pressão neste orifício.
NOTA: Isso deve funcionar sem aplicar força. Caso isso não seja possível, tente fazer um novo buraco perto do primeiro, a fim de evitar lesões prolongadas do coração. A agulha não deve ser inserida mais profundamente do que aproximadamente 3 mm. - Insira o cateter de pressão paralelo à direção do ventrículo direito, com a ponta voltada para a artéria pulmonar.
- Observe o rastreamento da onda de pressão para garantir o posicionamento correto do cateter. Os rastreamentos representativos são demonstrados na Figura 2.
- Deixe o sinal de pressão estabilizar. Pausar as respirações e obter pelo menos 3 medidas. Entre as medidas individuais permitem que o animal seja ventilado.
- Uma vez que todas as medidas são registradas, remova o cateter e coloque-o de volta no tubo cheio de PBS no banho de água.
NOTA: Após a conclusão do experimento, limpe o cateter de acordo com as instruções do fabricante.
- Com uma tesoura pequena, realize uma incisão cutânea de aproximadamente 1 cm sobre o processo xifoide e a parte abdominal superior. Separe a pele que cobre o peito e a parede abdominal dos quadrantes abdominais superiores: comece na linha do meio, distal até o xifoide e mova-se cuidadosamente lateralmente em ambos os lados. Use termocauteria para controlar o sangramento.
- Eutanásia e perfusão pulmonar
- Após a conclusão do experimento eutanize o rato por exsanguinação.
- Abra o peito amplamente. Usando uma tesoura, corte todo o esterno e preste atenção para não ferir o coração ou os pulmões.
- O uso de uma tesoura de íris faz uma pequena incisão no ventrículo esquerdo para permitir que o sangue saia da câmara.
- Coloque a agulha de 25 G de uma seringa contendo 10 mL de PBS no ventrículo direito e injete a solução PBS até que os pulmões sejam limpos de sangue.
- Uma vez concluída esta etapa, confirme a eutanásia por colheita de tecido vital (coração e pulmões): corte os acessórios cava e aórtico e remova o coração e os pulmões em bloco.
3. Caracterização morfométrica
- Imediatamente após a remoção do coração e dos pulmões (Passo 2.4.5), isole o coração e remova ambos atria. Com a tesoura de tenotomia curva disseca cuidadosamente o ventrículo direito (RV) do ventrículo esquerdo (LV), deixando o septo (S) com o ventrículo esquerdo. Pesar RV e LV+S e calcular o índice Fulton= RV/LV+ S (Figura 3)5,9.
- Pegue uma parte do ventrículo direito e coloque-a em um molde de incorporação pré-preenchido em OCT. Use a outra parte do ventrículo direito para análise de RNA e/ou proteína. Encaixe o congelamento no gelo seco e armazene a -80 °C.
- Use uma tesoura de íris para isolar os pulmões do coração e qualquer outro tecido restante.
NOTA: Para a preparação dos pulmões, a perfusão descrita acima (Passos 2.4.3-2.4.5) é de grande importância. - Encaixe parte dos pulmões e armazene-a para RNA, extração de proteínas ou outros ensaios.
- Use a outra parte dos pulmões para análise histológica. Para isso, insira a seringa contendo 50% de PBS e 50% de OUTUBRO em um brônquio do lobo usado10,11. O experimentador pode facilmente ver que o pulmão fica inflado quando o conteúdo da seringa é perfundido no tecido.
- Coloque esses pedaços de pulmão em moldes de incorporação pré-preenchidos com OCT e escorram congelá-los em gelo seco. Armazene as amostras a -80 °C depois de congeladas.
- Prepare seções de 8 μm de RV e pulmão usando uma máquina de criostat. O ar seca as seções à temperatura ambiente por 30 minutos.
- Fixar os slides à temperatura ambiente usando 10% de paraformaldeído (PFA) por 10 minutos.
NOTA: PFA é um conhecido cancerígeno humano. Reduza o risco de exposição usando uma coifa química, procedimentos adequados e equipamentos de proteção individual. Consulte a Folha de Dados de Segurança do Material (MSDS) para obter mais informações. - Avaliação de remodelagem vascular por manchas de Hematoxylin/Eosin
Nota: Realizar a coloração de Hematoxilina/Eosina para avaliar as alterações estruturais do coração e remodelagem vascular no pulmão(Figura 3).- Mancha com solução de hematoxilina por 8 min.
- Enxágüe com água da torneira corrente por 5 minutos seguida de uma lavagem rápida em água destilada.
- Enxágüe em 95% EtOH por 1 min e contra-mancha na solução Eosin por 1 min.
- Desidratar (80% Etanol 10-30 s, 100 Etanol para 1 min e 100% Toluol por 3 min).
- Monte e cubra com uma mancha de cobertura. Seque os slides durante a noite à temperatura ambiente.
NOTA: As soluções utilizadas para coloração podem ser perigosas. Reduza o risco de exposição usando uma coifa química, procedimentos adequados e equipamentos de proteção individual. Consulte o MSDS para obter mais informações.
- Avaliação da fibrose ventricular direita por Picrosirius Red Staining
NOTA: No Picrosirius Red Staining, picrosirius vermelho, que é ácido, liga-se ao colágeno12. Portanto, essa coloração pode ser utilizada para um exame histológico do conteúdo do colágeno.- Incubar os slides em uma Solução de Bouin pré-aquecido a 58 °C por 1 h.
- Lave os slides em água da torneira corrente para remover a cor amarela das seções por 10-15 min.
- Mancha em 0,1% Verde Rápido por 20 min em temperatura ambiente.
- Enxágüe em 1% ácido acético por 1 min.
- Enxágüe na água da torneira por 5 minutos.
- Mancha em 0,1% Vermelho Sirius por 30 min à temperatura ambiente seguido de desidratação em Toluol.
ATENÇÃO: As soluções utilizadas para coloração podem ser perigosas. Reduza o risco de exposição usando uma coifa química, procedimentos adequados e equipamentos de proteção individual. Consulte o MSDS para obter mais informações.
- Avaliação de hipertrofia de cardiomiócitos rv por WGA Staining
NOTA: A hipertrofia do ventrículo direito (RV) no nível celular pode ser avaliada com a realização de uma coloração de Agglutinina do Germe de Trigo (WGA)(Figura 4).- Fixar os slides na solução de Acetona fria por 15 minutos seguidos de 3 passos de lavagem em PBS (5 min cada).
- Bloqueie com 10% de soro de cabra em uma solução Dako por 30 minutos à temperatura ambiente.
- Incubar os slides com WGA: Adicionar WGA 1:200 e incubar por 1 1/2 h a 37 °C no escuro.
- Lave os slides três vezes com PBS.
- Incubar os slides com um corante de ácido nucleico.
- Lave os slides três vezes com PBS.
- Para montagem, remova o excesso de líquido e aplique mídia de montagem e uma mancha de cobertura. Seque os slides por 1 hora à temperatura ambiente no escuro e armazene a 4 °C.
NOTA: As soluções utilizadas para coloração podem ser perigosas. Reduza o risco de exposição usando uma coifa química, procedimentos adequados e equipamentos de proteção individual. Consulte o MSDS para obter mais informações.
- Realizar a imunoquímica do pulmão para avaliar mais e especificamente a remodelagem vascular. Por exemplo, a coloração de células musculares lisas pode ser usada para avaliar a musculação dos vasos, enquanto a coloração do Fator von Willebrand pode ser usada para visualizar alterações endoteliais. Esses métodos são descritos em outros lugares5.
Resultados
Neste protocolo, descrevemos detalhadamente a criação do modelo Desoxia/SU5416 para induzir a PH em camundongos. Além disso, detalhamos todas as etapas necessárias para a realização da avaliação vascular e cardíaca pulmonar no final do período de observação.
Uma visão geral do design experimental para este modelo é mostrada na Figura 1A13,14. Os camundongos são submetidos à hipóxia normobáica (10% O2) e subcutâneamente injetados uma vez por semana com SU5416 por três semanas consecutivas. Os estímulos utilizados para induzir a PH neste protocolo são mostrados nas Figuras 1B e 1C.
O antagonista do receptor VEGF SU5416 age causando apoptose celular endotelial e, portanto, permitindo a proliferação de células endoteliais resistentes à apoptose. Isso leva à remodelação vascular na vasculatura pulmonar e ao aumento da resistência vascular5. A pressão elevada na circulação pulmonar aumenta a carga posterior do RV e leva progressivamente à disfunção e falha doRV 9. Na primeira etapa, o sucesso do protocolo Hypoxia/SU5416 pode ser avaliado avaliando funcionalmente a função RV no final do período de observação. Neste protocolo, descrevemos detalhadamente a avaliação invasiva da pressão sistólica do RV utilizando o método de medição de pressão do RV do peito aberto. Curvas de pressão representativas e análise quantitativa da pressão ventricular direita são exibidas na Figura 2.
Como quantificar a remodelagem vascular, o que leva à resistência vascular elevada e, consequentemente, à PH? Histomorphometria é o padrão-ouro para caracterizar a vasculatura pulmonar. Neste protocolo, descrevemos em detalhes o protocolo De Coloração de Hematoxilina e Eosin (H&E). Após a coloração e captura das imagens, as artérias pulmonares podem ser distinguidas em pequenas (<50 μm) e maiores (> 50 μm). As artérias brônquicos foram excluídas do nosso estudo. Para avaliar a espessura medial, é medido o externo (ED), bem como o diâmetro interno (ID) das artérias. Imagens representativas de artérias pulmonares remodeladas após o tratamento de Hipóxia/SU5416 são mostradas na Figura 3A. A porcentagem de espessura medial das artérias em relação ao diâmetro transversal é mostrada na Figura 3B. A análise morfométrica das artérias pulmonares distal demonstra um aumento significativo da espessura medial em camundongos tratados com Hipóxia/SU5416 em comparação com animais de normoxia(Figura 3).
O aumento da carga posterior leva à hipertrofia do RV e à medida que a doença progride para a fibroserv 9,15. A hipertrofia rv pode ser avaliada morfometricamente medindo o Índice Fulton (RV/LV+Septum), bem como medindo a hipertrofia cardiomiófica (CM). A razão de peso do ventrículo direito (RV) para o ventrículo esquerdo (LV) mais septo [RV/(LV+S)] é calculada como um índice de hipertrofia ventricular direita. Os resultados representativos do Índice Fulton em Hipoxia/SU5416 e dos camundongos normoxia são mostrados na Figura 4B. O método descrito aqui para avaliar a hipertrofia CM é a coloração de seções ventriculares direitas com Agglutinina gerendo trigo (WGA). A WGA liga-se às glicoproteínas da membrana celular e pode ser usada para determinar a área transversal dos miócitos16,17. Imagens representativas de seções ventriculares direitas manchadas com WGA são mostradas na Figura 4A. Quantificações da área de CM em camundongos doentes e de controle são mostradas na Figura 4A. A exposição à hipóxia/SU5416 resulta em um aumento acentuado no tamanho do cardiomiócito e hipertrofia ventricular direita(Figura 4). Nós e outros já mostramos anteriormente que, quando comparado ao único hit (apenas hipóxia), a Hipóxia/SU5416 agrava o fenótiporv 5,18.

Figura 1: Visão geral do método Hypoxia/SU5416. (A) Design experimental para o modelo de mouse Hypoxia/SU5416. SU5416 é injetado subcutâneamente uma vez por semana por 3 semanas consecutivas. (B) Representação esquemática do sistema de hipóxia. O controlador detecta e regula oxigênio dentro da câmara infundindo nitrogênio através do tubo de infusão de gás. (C) Estrutura química de SU5416. Clique aqui para ver uma versão maior desta figura.
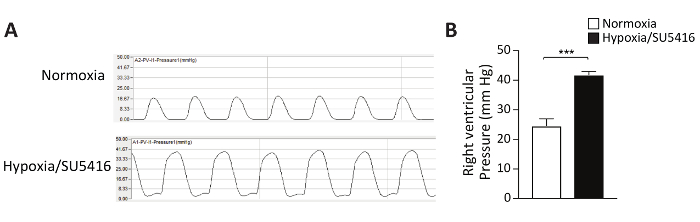
Figura 2: Pressão ventricular direita em camundongos expostos à hipóxia crônica combinada com injeção de SU5416. (A) Rastreamentos representativos de medidas de pressão invasivas do ventrículo direito (RV). (B) Pressão sistólica rv em camundongos hipóxia/SU5416 e controlar animais expostos à normoxia. n = 6-8 ratos por grupo. p < 0,001. Todos os dados quantitativos são relatados como meios ± SEM. Clique aqui para ver uma versão maior desta figura.
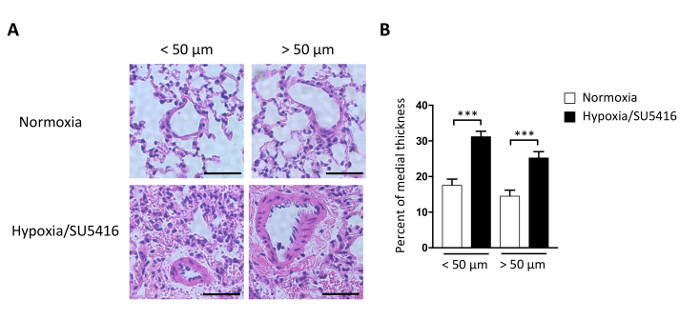
Figura 3: A hipóxia/SU5416 induz a remodelação vascular pulmonar. (A) Seções representativas de hematoxilina/eosina manchadas de pulmões dos grupos indicados demonstram aumento da espessura da parede da mídia nas artérias pulmonares de camundongos de Hipóxia/SU5416. Barra de escala: 50 μm. (B) Percentual de espessura medial das artérias em relação ao diâmetro transversal. n = 5 ratos por grupo. p < 0,001. Todos os dados quantitativos são relatados como meios ± SEM. Clique aqui para ver uma versão maior desta figura.
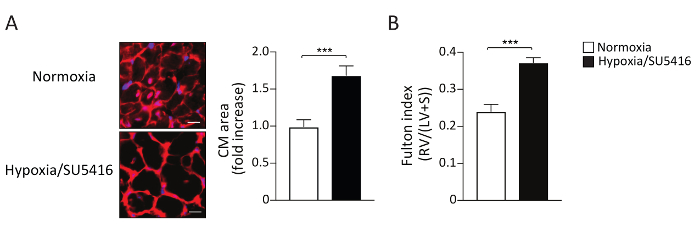
Figura 4: Hipertrofia ventricular direita em camundongos expostos à hipóxia crônica combinada com injeção de SU5416. (A) (Esquerda) Representante WGA (Gerente de Trigo Agglutinina) colorindo tecido ventricular direito após o tratamento indicado. Barra de escala: 50 μm. (À direita) Análise quantitativa dos dados. n = 5 ratos por grupo. (B) Hipertrofia rv refletida pelo peso rv sobre LV mais a razão de peso de septo interventricular (S) razão de peso (Índice Fulton= RV/LV+ S) em cada grupo. n = 8 ratos por grupo. p < 0,001. Todos os dados quantitativos são relatados como meios ± SEM. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve como modelar PH em camundongos combinando dois estímulos patológicos: hipoxia crônica e injeção de SU5416 (Hipóxia/SU5416)18. Na tentativa de correlacionar este modelo de mouse com a condição ph humana, inevitavelmente deve-se olhar para a classificação PH atual, mostrada na Tabela 1. A PH em quase todas as formas é caracterizada pela vasoconstrição pulmonar e proliferação aberrante de células musculares endoteliais e lisas. Isso leva a uma pressão elevada nas artérias pulmonares e, consequentemente, ao aumento da carga posterior do ventrículo direito.
Toda tentativa de caracterizar um modelo animal de PH deve incluir evidências da remodelação histopatológica da vasculatura pulmonar e do ventrículo direito. O modelo de rato de hipóxia de um único hit leva a uma forma leve de remodelação da vasculatura2,3. Esses achados patológicos incluem a musculação de vasos não musculosos anteriormente, acompanhados de células endoteliais, células musculares lisas e proliferação de fibroblastos. Esses achados são agravados pela adição do segundo hit (injeção de SU5416). Os efeitos são reversíveis no modelo single-hit (hipóxia) e apenas parcialmente reversíveis no modelo Hypoxia/SU5416.
A principal causa de morte para pacientes com PH é a falha ventricular direita (RVF)4,20. A remodelagem vascular pulmonar em modelos animais nem sempre é acompanhada por RVF. Para caracterizar um modelo animal em termos de dados morfológicos, funcionais e moleculares da RVF devem ser analisados. Este último está além do escopo deste protocolo. A remodelagem morfológica do RV inclui aspectos macro e microscópicos. No nível macroscópico, o principal índice para hipertrofia rv é o índice Fulton, definido como o peso do RV dividido pelo ventricular esquerdo (LV) e septum (S) peso (RV/LV+S). No nível microscopical, fibrose, inflamação e hipertrofia podem ser avaliadas pelas manchas de vermelho Sirius, Hematoxylin/Eosin e WGA, respectivamente.
O modelo de Hypoxia/SU5146 do camundongo (descrito aqui) mostra uma disfunção de RV, medida por pressões sistólicas elevadas e critérios morfológicos. Em relação à remodelagem vascular pulmonar, a hipertrofia medial é observada três semanas após o início do protocolo. Comparado ao modelo de Hipóxia/SU5416 em ratos, o modelo do camundongo não causa falha de RV (apenas disfunção moderada), não leva a angiopatia obliterativa grave, como observado em humanos gravemente doentes, e a patologia pulmonar ameniza após o retorno à normoxia. No geral, o modelo de Hypoxia/SU5416 do camundongo é adequado para imitar lesões vasculares encontradas em PH, predominantemente grupo I (parcialmente Grupo III, ver Tabela 1)1,19. A vantagem deste modelo é a aplicação em camundongos do tipo selvagem (geneticamente não modificados), a implementação relativamente fácil e de baixo custo, a mortalidade relativamente baixa dos animais doentes e o rápido desenvolvimento da doença de interesse (3 semanas). Estudos de prevenção e terapia de PH podem ser facilmente implementados neste modelo, sem a necessidade de habilidades avançadas em oposição aos modelos de roedores cirúrgicos.
Ao implementar o protocolo, existem algumas etapas críticas, que devem-se ter em mente. Ao planejar o estudo, deve-se ter em mente que no grupo Hipóxia/SU5416 a mortalidade dos animais varia entre 0-10% (observações inéditas). Portanto, para alcançar o poder estatístico e evitar estudos sem energia, são recomendados pelo menos 10 camundongos por grupo. A solubilidade de SU5416 é baixa. Portanto, dMSO ou outro solvente (por exemplo, celulose carboximetila, CMC) devem ser utilizados. DMSO em altas doses pode ser tóxico. O uso de LD50 para subcutâneo (s.c.) em camundongos foi relatado como sendo de 13,9 - 25,6 g/kg21,22. LD50 é definido como a dose necessária para matar 50% dos membros de uma população testada após uma duração de teste especificada21,22. Para um mouse que pesa 25 g, 4,4 g/Kg de DMSO é usado (cálculos baseados na densidade DMSO de 1,1 g/mL e 0,1 mL aplicado s.c./mouse). Portanto, a dose subcutânea dada é muito menor do que o valor LD50. Em nossas mãos, a aplicação de SU5416 dissolvido no DMSO, como descrito aqui, pode causar irritação na pele em alguns casos, mas nenhum outro efeito tóxico é observado. No entanto, vários relatórios recomendam o uso do CMC como veículo alternativo ao SU541614. Ao realizar as medições funcionais do RV, é preciso prestar muita atenção à temperatura corporal, sangramento e profundidade da anestesia, conforme avaliado pelo teste dos reflexos do camundongo. A técnica de peito aberto para avaliar a pressão do RV, como descrito aqui, tem a vantagem de ser facilmente implementada até mesmo por um usuário inexperiente. O método de peito fechado (descrito em outros lugares23,24,25) tem a vantagem de ser menos invasivo e pode, portanto, ser implementado também em experimentos não terminais. Requer um alto nível de experiência.
Após a primeira descrição do modelo Hypoxia/SU5416 em ratos, o modelo do mouse foi usado com sucesso em diversos estudos5,,9,13. No entanto, há evidências de que os resultados dependem do histórico genético e sexo dos camundongos, do fabricante de SU5416 e da frequência da injeção SU541626. Enquanto injetar SU5416 ao longo de três semanas consecutivas leva ao PH em camundongos, uma única dose não induziria PH4. Além disso, outras formas de AP, como as associadas à doença cardíaca esquerda ou devido à doença tromboembólica crônica, requerem modelos relacionados à etiologia. Novas terapias devem ser testadas em pelo menos 2 modelos animais diferentes, antes de serem capazes de pavimentar o caminho para estudos translacionais.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Este trabalho foi apoiado por subsídios da American Heart Association (AHA- 17SDG33370112 e 18IPA34170258) e dos Institutos Nacionais de Saúde NIH K01 HL135474 a Y.S. O.B foi apoiado pela Deutsche Herzstiftung.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
Referências
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados