Method Article
Induzione e caratterizzazione dell'ipertensione polmonare nei topi utilizzando il modello Ipossia/SU5416
In questo articolo
Riepilogo
Questo protocollo descrive l'induzione dell'ipertensione polmonare (PH) nei topi in base all'esposizione all'ipossia e all'iniezione di un antagonista del recettore VEGF. Gli animali sviluppano PH e ipertensione ventricolare destra (RV) 3 settimane dopo l'avvio del protocollo. Viene presentata anche la caratterizzazione funzionale e morfometrica del modello.
Abstract
L'ipertensione polmonare (PH) è una condizione patofisiologica, definita da una pressione arteriosa polmonare media superiore a 25 mm Hg a riposo, come valutato dalla cateterizzazione del cuore destro. Un ampio spettro di malattie può portare alla PH, differendo nella loro eziologia, istopatologia, presentazione clinica, prognosi e risposta al trattamento. Nonostante i progressi significativi degli ultimi anni, la PH rimane una malattia non curata. Comprendere i meccanismi sottostanti può spianare la strada allo sviluppo di nuove terapie. I modelli animali sono importanti strumenti di ricerca per raggiungere questo obiettivo. Attualmente, ci sono diversi modelli disponibili per la ricapitolazione PH. Questo protocollo descrive un modello PH del mouse a due colpi. Gli stimoli per lo sviluppo di PH sono l'ipossia e l'iniezione di SU5416, un antagonista del recettore del fattore di crescita endoteliale vascolare (VEGF). Tre settimane dopo l'inizio dell'ipossia/SU5416, gli animali sviluppano rimodellamento vascolare polmonare imitando i cambiamenti istopatologici osservati nella PH umana (prevalentemente gruppo 1). Il rimodellamento vascolare nella circolazione polmonare comporta il rimodellamento del ventricolo destro (RV). Le procedure per misurare le pressioni del camper (utilizzando il metodo toracico aperto), le analisi morfometriche del camper (sezionando e pesando entrambi i ventricoli cardiaci) e le valutazioni istologiche del rimodellamento (sia polmonare valutando il rimodellamento vascolare che il cardiaco valutando l'ipertrofia e la fibrosi cardiomiociti RV) sono descritte in dettaglio. I vantaggi di questo protocollo sono la possibilità dell'applicazione sia in tipo selvaggio che nei topi geneticamente modificati, l'attuazione relativamente facile e a basso costo e il rapido sviluppo della malattia di interesse (3 settimane). Limitazioni di questo metodo sono che i topi non sviluppano un fenotipo grave e PH è reversibile al ritorno alla normasoia. La prevenzione, così come gli studi terapeutici, possono essere facilmente implementati in questo modello, senza la necessità di competenze avanzate (al contrario dei modelli di roditori chirurgici).
Introduzione
L'ipertensione polmonare (PH) è una condizione patofisiologica, definita da una pressione media arteriosa polmonare (PA) superiore a 25 mm Hg a riposo, come valutato dalla cateterizzazione del cuore destro1,2. C'è una varietà di malattie che possono portare a PH. Nel tentativo di organizzare le condizioni associate al PH, sono stati sviluppati diversi sistemi di classificazione. L'attuale classificazione clinica classifica le molteplici malattie associate al PH in 5 gruppi diversi1. Questa distinzione è importante poiché vari gruppi di pazienti hanno malattie che differiscono nella loro presentazione clinica, patologia, prognosi e risposta al trattamento2. La tabella 1 riassume l'attuale classificazione, completata dalle caratteristiche istopatologiche di base di ogni malattia.
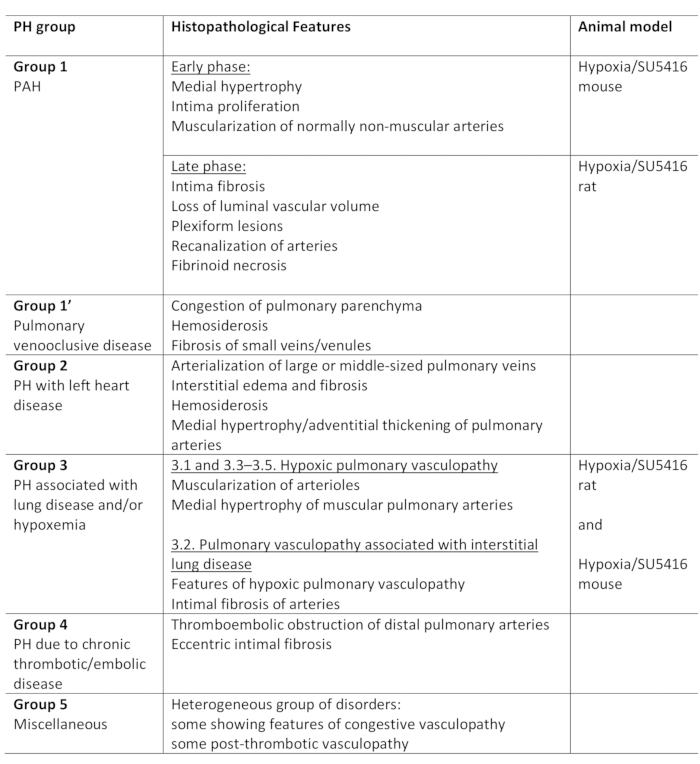
Tabella 1: Panoramica della classificazione clinica della PH, insieme alle principali caratteristiche istopatologiche all'interno dei gruppi. Idoneità del protocollo Hypoxia/SU5416 per la modellazione ph. Questa tabella è stata modificata da19. PH: Ipertensione polmonare, PAH: Ipertensione arteriosa polmonare
Nonostante i significativi progressi nel trattamento delle malattie associate al PH, la PH rimane ancora senza una cura, con un tasso di mortalità a 3 anni compreso tra il 20% e l'80%3. Ciò indica l'imperativo di comprendere i meccanismi sottostanti della PH e, successivamente, lo sviluppo di nuove terapie per prevenire, rallentare la progressione e curare la malattia. I modelli animali sono di fondamentale importanza per questo ambito. Attualmente, esistono vari modelli per studiare la PH. Il lettore interessato si riferisce alle ottime recensioni su questo argomento2,3,4. Tenendo presente la varietà di malattie che portano alla PH, è ovvio che le diverse condizioni della PH umana non possono essere perfettamente ricapitolate in un modello animale. I modelli animali disponibili possono essere classificati in i) modelli a colpo singolo, ii) a due colpi, iii) knockout e iv) sovraespressioni3. Nei modelli a singolo colpo, la PH è indotta da un singolo stimolo patologico, mentre i modelli a due colpi combinano due stimoli patologici con l'obiettivo di indurre LA PH più grave e quindi di imitare più da vicino la complessa malattia umana. Oltre alle differenze eziologiche, i diversi stimoli si trasfono differenze di modellazione PH che dipendono anche dalla specie e dal background genetico degli animali4.
Uno dei modelli di roditori PH classici più comunemente utilizzati è il modello di ipossia cronica2. L'ipossia è nota per indurre il PH nell'uomo e in diverse specie animali. L'ipossia ha il vantaggio di essere uno stimolo fisiologico per la PH(tabella 1). Tuttavia, mentre il grado di ipossia utilizzato per indurre PH nei roditori è molto più grave che negli esseri umani, il singolo insulto (ipossia) porta solo ad una lieve forma di rimodellamento vascolare. Questo non imita la gravità della malattia umana. L'aggiunta di un secondo colpo, uno stimolo in più per indurre PH, ha mostrato risultati promettenti: l'iniezione del composto SU5416 ai roditori combinato con lo stimolo ipossico induce un fenotipo PHpiù grave 2,5,6. SU5416 è un inibitore del fattore di crescita endoteliale vascolare (VEGF) recettore-2. Blocca i recettori VEGF e porta all'apoptosi cellulare endoteliale. In condizioni ipossiche, questo stimola la proliferazione di un sottoinsieme di cellule endoteliali resistenti all'apoptosi. Inoltre, SU5416 porta alla proliferazione delle cellule muscolari lisce. La combinazione di questi effetti si traduce in rimodellamento vascolare patologico della circolazione polmonare e porta ad elevata pressione PA e rimodellamento ventricolaredestro 2,5,7. Il modello è stato descritto per la prima volta neiratti 6 e successivamente applicato aitopi 4,5,7. Il modello murino presenta rimodellamenti vascolari meno gravi rispetto ai ratti. Inoltre, quando è tornato alla normasa, il PH continua a progredire nei ratti, mentre nei topi è parzialmente reversibile.
Il protocollo seguente descrive tutti i passaggi per la modellazione di PH nei topi utilizzando il metodo Hypoxia/SU5416 (pianificazione, sequenza temporale, esecuzione). Inoltre, la caratterizzazione del modello è descritta in questo protocollo: funzionalmente (misurando in modo invasivo la pressione ventricolare destra (RV) utilizzando la tecnica del torace aperto), morfometricamente (sezionando e pesando sia il ventricolo destro che quello sinistro), così come istologicamente (valutando il rimodellamento vascolare polmonare, l'ipertrofia e fibrosi cardiomiocite destra ventricolari).
Tutti i passaggi e i metodi descritti in questo protocollo possono essere facilmente implementati dagli investigatori a qualsiasi livello di esperienza. Mentre le misurazioni funzionali del camper utilizzando la tecnica del torace aperto (descritto qui) non sono il metodo gold standard sul campo, ha il vantaggio che può essere appreso rapidamente e riprodotto con precisione anche da uno sperimentatore meno esperto.
Protocollo
Prima di qualsiasi sperimentazione animale ottenere l'autorizzazione del comitato istituzionale locale per la cura degli animali. Gli esperimenti in corso sono stati eseguiti dopo l'approvazione da parte dell'Institutional Animal Care and Use Committee (IACUC) presso la Icahn School of Medicine a Mount Sinai.
1. Induzione di PH
- Preparazione
- Prima di iniziare lo studio, pianificare attentamente il progetto sperimentale. Assicurarsi che i topi siano sottoposti a ipossia nello stesso punto di tempo della prima iniezione su5416. Un esempio della progettazione sperimentale per indurre PH utilizzando il metodo Hypoxia/SU5416 è illustrato nella Figura 1A. I topi di controllo hanno ricevuto solo il veicolo. Per questo modello, SU5416 verrà iniettato ai topi una volta alla settimana per 3 settimane consecutive.
- Utilizzare topi C57BL/6 di età da otto a dodici settimane per questo studio. Ospita gli animali a 18-20 gradi centigradi in un ciclo di 12 ore di luce-scuro. Assicurarsi che cibo e acqua siano accessibili ad libitum.
- Pesare gli animali. Assegnarli casualmente a ciascun gruppo: Normoxia e Hypoxia/SU5416.
- Preparare la camera ipossica come illustrato nella figura 1B. Proteggere i serbatoi di azoto (N2) vicino alla camera. Impostare il controller di ossigeno (O2) in un punto di 10% O2. Lasciare che il sistema raggiunga uno stato stabile.
- Preparare SU5416 per l'iniezione (utilizzare una dose di 20 mg/kg di peso corporeo). SU5416 non si dissolve in soluzioni aqueose; di conseguenza, sciogliere l'importo calcolato in 100 L DMSO8. Ad esempio, per un topo da 25 g, la quantità di SU5416 da iniettare è di 0,5 mg disciolto in solvente 100 l (DMSO). La concentrazione finale di SU5416 per questo topo è, quindi, 5 mg/mL.
CAUTION: SU5416 è un materiale pericoloso. Leggere attentamente la scheda dati di sicurezza accompagnata dal prodotto e assicurarsi di prendere le precauzioni raccomandate durante la movimentazione di questa sostanza. Indossare guanti protettivi e (come per qualsiasi iniezione) utilizzare la protezione oculare. La struttura chimica di SU5416 è illustrata nella Figura 1C.
NOTA: Calcolare un adeguato eccesso della soluzione per compensare il volume che andrà perso durante l'iniezione (ad esempio nella siringa, nella fiala, ecc.). A seconda della siringa utilizzata, il volume morto è di circa 200 L. Per un gruppo di 10 topi, calcolare un eccesso di 2 dosi di topo. - Preparare le siringhe per l'iniezione. Utilizzare siringhe da 1 mL con aghi da 25 G x 5/8".
- Iniezione sottocutanea SU5416
- Restringi l'animale. Posizionare il mouse sul coperchio della gabbia per aiutare la moderazione. Afferra la pelle e forma una tenda parallela alla colonna vertebrale. Assicurarsi di afferrare saldamente la parte posteriore della testa, per evitare il potenziale morso lesioni dal mouse.
NOTA: La presenza di due investigatori rende la procedura più veloce e più accurata in quanto uno può contenere l'animale mentre l'altro esegue l'iniezione. - Inserire l'ago sottocutaneamente sul fianco alla piega sciolta della pelle. Assicurarsi di inserire l'ago parallelo alla pelle. Evitare di penetrare la parete addominale.
- Iniettare il contenuto della siringa (100 L di SU5416 disciolto o veicolo).
NOTA: Per evitare perdite dopo la consegna completa, tenere la siringa per circa 10 s e ruotare leggermente l'ago sotto la pelle. - Ritirare l'ago e riportare l'animale nella sua gabbia. Dopo l'iniezione su5416, posizionare le gabbie nella camera di ipossia ventilata.
- Restringi l'animale. Posizionare il mouse sul coperchio della gabbia per aiutare la moderazione. Afferra la pelle e forma una tenda parallela alla colonna vertebrale. Assicurarsi di afferrare saldamente la parte posteriore della testa, per evitare il potenziale morso lesioni dal mouse.
- Esposizione all'ipossia
- Monitorare la ventilazione nel tempo. Assicurarsi di mantenere il 10% dell'apporto di ossigeno. Mantenere gli animali normoxia in una camera semi-sigillabile al 21% O2.
- Assicurarsi che le camere siano dotate di un sensore di ossigeno per misurare il livello di ossigeno. Evitare l'apertura estesa delle camere. Per la pulizia e l'aggiunta di cibo e acqua aprire le camere per non più di 20 min ogni 3 giorni.
- Ispezionare gli animali ogni giorno. Considerare i segnali di stress come la piloerection o una significativa perdita di peso.
NOTA: Gli animali sotto Ipossia/SU5416 dovrebbero perdere peso5. Questa è un'indicazione dello sviluppo della malattia. - Ripetere l'iniezione su5416 settimanalmente per 3 settimane consecutive (vedere la figura 1A per una panoramica della progettazione sperimentale).
NOTA: Variare il sito di iniezione può aiutare a ridurre le irritazioni cutanee.
2. Caratterizzazione funzionale mediante misurazioni invasive della pressione del camper
- Preparazione
NOTA: Selezionare un regime anestetico. Possono essere utilizzati anestetici iniettabili o inalabili. Poiché un leggero sovradosaggio di anestetici iniettabili (soprattutto da ketamina/xylazina o pentobarbital) può influenzare significativamente la funzione cardiaca, si raccomanda l'uso di anestetici volatili. È di grande importanza usare lo stesso anestetico per tutti i topi all'interno di uno studio.- Utilizzare un vaporizzatore per assicurare una dose di anestetici accurata per animale. La dose per isoflurane è la seguente: induzione 3-4%, manutenzione 1% mescolato con 100% ossigeno.
NOTA: Indossare dispositivi di protezione personale ed evitare di respirare il vapore. - Preparare un tampone riscaldante e/o lampade riscaldanti per mantenere la temperatura corporea. Preparare una sonda di temperatura rettale per monitorare la temperatura corporea.
- Garantire una ventilazione adeguata. Preparare il ventilatore in anticipo. Preparare il connettore a tubo Y e controllare la funzione del ventilatore utilizzando la modalità manuale. Assicurarsi che la pressione inspiratoria sia <1 cm H2O per evitare il barotrauma. Impostare la frequenza respiratoria a 110 respiri/min.
- Preparare un tubo endotracheale tagliando un catetere intravascolare da 20 G.
- Preparare gli strumenti necessari: piccole forbici, forbici, retrattili ad anello elastici, cauterizer del recipiente e tamponi di cotone. Su un tampone di cotone regolare un piccolo ago da 25 G x 5/8" che verrà utilizzato per fare una piccola foratura nel ventricolo destro.
- Preparare il catetere di pressione, l'unità di controllo del volume di pressione e avviare il software di acquisizione dati. Posizionare il catetere fotovoltaico in un tubo da 15 mL riempito con PBS a 37 gradi centigradi per 15 minuti e calibrare secondo il protocollo del produttore.
- Per la perfusione e la fissazione degli organi, preparare PBS e una soluzione del 50% PBS / 50% OCT. Preparare 2 siringhe da 10 mL (con un ago da 25 G): uno sarà utilizzato per perffusione del cuore e del polmone con PBS in situ e il secondo per iniettare la soluzione OCT/ PBS (50/50) al campione polmonare che verrà utilizzato per il suo esame.
- Utilizzare un vaporizzatore per assicurare una dose di anestetici accurata per animale. La dose per isoflurane è la seguente: induzione 3-4%, manutenzione 1% mescolato con 100% ossigeno.
- Intubazione
- Pesare il mouse e registrare lo stato di salute prima dell'anestesia.
- Indurre l'anestesia con 3-4% isoflurane. Controllare la profondità dell'anestesia testando il riflesso del dito-pizzicare: pizzicare saldamente la dita dei piedi di uno degli arti. Se l'animale ritira l'arto, è un segno di anestesia insufficiente.
- Dopo l'induzione dell'anestesia, radete il collo e le aree toracica.
- Posizionare il mouse sul pad di riscaldamento. Posizionare una sonda di temperatura rettale per monitorare la temperatura corporea.
NOTA: La manutenzione della temperatura corporea è importante per le misurazioni funzionali. La temperatura corporea dovrebbe essere di circa 36,5-37 gradi centigradi. - Utilizzando le forcetti curve collegare un filo di sutura agli incisivi superiori del mouse, allungare e fissare al pad di riscaldamento con nastro chirurgico. Fissare gli arti del topo utilizzando nastri chirurgici.
- Per intubare l'animale fare una piccola incisione di circa 1 cm nella pelle cervicale mediale utilizzando piccole forbici.
NOTA: L'intubazione orale è un metodo alternativo che richiede più esperienza. - Con un applicatore con punta di cotone separano senza mezzi termini le ghiandole salivari parotidi e submandibolari a medio livello. Questo esporrà i muscoli sovrasto la trachea.
- Tagliare con attenzione questi muscoli esponendo la trachea.
- Con piccole forbici fare una piccola incisione tra le cartilagi tracheali e inserire il tubo endotracheale preparato. Togliere la guida metallica del catetere intravascolare.
- Collegare il catetere al ventilatore. Verificare la posizione del tubo tracheale gonfiando delicatamente i polmoni. Fissare la posizione con nastro adesivo.
- Mantenere un 1% di anestesia isoflurane per tutta la procedura.
- Monitorare regolarmente la profondità dell'anestesia testando il riflesso del pizzico di dita dei piedi. Regolare l'anestesia di conseguenza.
NOTA: La frequenza cardiaca raccomandata durante gli esperimenti, sotto l'1% di anestesia isoflurana, è di circa 400 battiti /min. Il mantenimento della temperatura corporea e dell'anestesia sono essenziali per controllare la frequenza cardiaca. L'eccesso di isoflurane può ridurre la frequenza cardiaca. Tuttavia, il recupero può essere ottenuto riducendo il tasso di isoflurane.
- Misurazioni della pressione del camper (approccio al torace aperto)
- Con piccole forbici eseguire un'incisione della pelle di circa 1 cm sul processo xifoide e la parte addominale superiore. Separare la pelle che copre il torace e la parete addominale dei quadranti addominali superiori: iniziare dalla linea mediana, distale allo xifoide e muoversi con attenzione lateralmente su entrambi i lati. Utilizzare termocautera per controllare il sanguinamento.
NOTA: L'obiettivo è avere accesso alla cavità toracica attraverso la parete addominale. - Aprire la cavità addominale e tagliare il diaframma con attenzione, facendo attenzione a non ferire il cuore pulsante o i polmoni.
NOTA: L'obiettivo è quello di esporre l'apice e il ventricolo destro del cuore. Una buona esposizione e vista del cuore sono di fondamentale importanza per il corretto posizionamento del catetere. È di grande importanza evitare sanguinamento durante la procedura. Anche piccoli cambiamenti nel volume intravasale possono cambiare il carico del cuore destro e influenzare i parametri registrati. - Rimuovere delicatamente il pericardio utilizzando un applicatore con punta di cotone.
- Appena prima di posizionare il catetere a pressione nel cuore, portare il catetere accanto al mouse.
- Utilizzando l'applicatore preparato con punta di cotone con l'ago fa una ferita da taglio nella parte distale apica del ventricolo destro. Rimuovere con attenzione l'ago e inserire il catetere a pressione in questo foro.
NOTA: Questo dovrebbe funzionare senza applicare la forza. Nel caso in cui questo non è possibile, provare a fare una nuova buca vicino al primo al fine di evitare lesioni estese del cuore. L'ago non deve essere inserito più profondamente di circa 3 mm. - Inserire il catetere di pressione parallelo alla direzione del ventricolo destro, con la punta rivolta verso l'arteria polmonare.
- Osservare il tracciamento dell'onda di pressione per garantire il corretto posizionamento del catetere. Le analisi rappresentative sono illustrate nella Figura 2.
- Lasciare che il segnale di pressione si stabilizzi. Sospendere le respirazioni e ottenere almeno 3 misurazioni. Tra le singole misurazioni si ventila l'animale.
- Una volta registrate tutte le misurazioni, rimuovere il catetere e rimettilo nel tubo pieno PBS nel bagno d'acqua.
NOTA: Dopo il completamento dell'esperimento, pulire il catetere secondo le istruzioni del produttore.
- Con piccole forbici eseguire un'incisione della pelle di circa 1 cm sul processo xifoide e la parte addominale superiore. Separare la pelle che copre il torace e la parete addominale dei quadranti addominali superiori: iniziare dalla linea mediana, distale allo xifoide e muoversi con attenzione lateralmente su entrambi i lati. Utilizzare termocautera per controllare il sanguinamento.
- Eutanasia e perfusione polmonare
- Al termine dell'esperimento eutanasia del topo per espsanguinazione.
- Apri il petto. Usando le forbici, tagliare l'intero sterno e prestare attenzione a non ferire il cuore o i polmoni.
- Utilizzando le forbici dell'iride fa una piccola incisione nel ventricolo sinistro per consentire al sangue di lasciare la camera.
- Mettere l'ago da 25 G di una siringa contenente 10 mL di PBS nel ventricolo destro e iniettare la soluzione PBS fino a quando i polmoni non vengono eliminati dal sangue.
- Una volta completata questa fase, confermare l'eutanasia mediante raccolta vitale dei tessuti (cuore e polmoni): tagliare la cava e gli attacchi aortici e rimuovere il cuore e i polmoni in blocco.
3. Caratterizzazione morfometrica
- Immediatamente dopo aver rimosso il cuore e i polmoni (passaggio 2.4.5), isolare il cuore e rimuovere entrambi gli atri. Con le forbici curvo tenotomia sezionare con attenzione il ventricolo destro (RV) dal ventricolo sinistro (LV), lasciando il setto (S) con il ventricolo sinistro. Pesare RV e LV-S e calcolare l'indice Fulton , RV/LV, S (Figura 3)5,9.
- Prendere una parte del ventricolo destro e posizionarlo in uno stampo di incorporamento precompilato OCT. Utilizzare l'altra parte del ventricolo destro per l'analisi dell'RNA e/o delle proteine. Agganciare in ghiaccio secco e conservare a -80 gradi centigradi.
- Utilizzare le forbici dell'iride per isolare i polmoni dal cuore e da qualsiasi altro tessuto rimanente.
NOTA: Per la preparazione dei polmoni, la perfusione descritta in precedenza (punti 2.4.3-2.4.5) è di grande importanza. - Snap congelare parte dei polmoni e conservarlo per RNA, estrazione di proteine o altri saggi.
- Utilizzare l'altra parte dei polmoni per l'analisi i provider. A tal fine, inserire la siringa contenente il 50% di PBS e il 50% di PTOM in un bronco del lobousato 10,11. Lo sperimentatore può facilmente vedere che il polmone si gonfia quando il contenuto della siringa è perfuso nel tessuto.
- Mettere questi pezzi di polmone in stampi di incorporamento precompilati con OCT e bloccarli in ghiaccio secco. Conservare i campioni a -80 gradi centigradi dopo che sono stati congelati.
- Preparare 8 sezioni di RV e polmone utilizzando una macchina criostati. Asciugare l'aria le sezioni a temperatura ambiente per 30 min.
- Fissare i vetrini a temperatura ambiente utilizzando 10% paraformaldeide (PFA) per 10 min.
NOTA: PFA è un noto cancerogeno umano. Ridurre il rischio di esposizione utilizzando un cappuccio di fumi chimici, procedure adeguate e dispositivi di protezione personale. Per ulteriori informazioni, fare riferimento alla scheda MSDS (Material Safety Data Sheet). - Valutazione del rimodellamento vascolare da parte della colorazione Hematoxylin/Eosin
Nota: Eseguire la colorazione Ematoxylin/Eosin per valutare i cambiamenti strutturali del cuore e il rimodellamento vascolare nel polmone (Figura 3).- Macchia con soluzione Hematoxylin per 8 min.
- Risciacquare con acqua di rubinetto corrente per 5 minuti seguito da un rapido risciacquo in acqua distillata.
- Risciacquare nel 95% EtOH per 1 min e contro-macchia nella soluzione Eosin per 1 min.
- Disidratare (80% etanolo 10-30 s, 100 etanolo per 1 min e 100% Toluol per 3 min).
- Montare e coprire con un copriso- Asciugare i vetrini durante la notte a temperatura ambiente.
NOTA: le soluzioni utilizzate per la colorazione possono essere pericolose. Ridurre il rischio di esposizione utilizzando un cappuccio di fumi chimici, procedure adeguate e dispositivi di protezione personale. Per ulteriori informazioni, consultare msDS.
- Valutazione della fibrosi ventricolare destra di Picrosirius Red Staining
NOTA: Nella Colorazione Rossa Picrosirius, Picrosirius Red, che è acido, si lega al collagene12. Pertanto, questa colorazione può essere utilizzata per un esame itologico del contenuto di collagene.- Incubare i vetrini in una soluzione preriscaldata di Bouin a 58 gradi centigradi per 1 h.
- Lavare i vetrini in acqua di rubinetto corrente per rimuovere il colore giallo dalle sezioni per 10-15 min.
- Macchia in 0.1% Fast Green per 20 min a temperatura ambiente.
- Sciacquare in acido acetico 1% per 1 min.
- Sciacquare in acqua di rubinetto per 5 minuti.
- Macchia in rosso Sirius 0,1% per 30 min a temperatura ambiente seguita da disidratazione in Toluol.
CAUTION: Le soluzioni utilizzate per la colorazione possono essere pericolose. Ridurre il rischio di esposizione utilizzando un cappuccio di fumi chimici, procedure adeguate e dispositivi di protezione personale. Per ulteriori informazioni, consultare msDS.
- Valutazione dell'ipertrofia del cardiomiocito RV da parte di WGA Staining
NOTA: L'ipertrofia del ventricolo destro (RV) a livello cellulare può essere valutata eseguendo una colorazione di Agglutinina del germe di grano (WGA)(Figura 4).- Fissare i vetrini in soluzione acetone fredda per 15 min seguita da 3 gradini di lavaggio in PBS (5 min ciascuno).
- Blocco con 10% siero di capra in una soluzione Dako per 30 min a temperatura ambiente.
- Incubare le diapositive con WGA: Aggiungere WGA 1:200 e incubare per 1 1/2 h a 37 gradi centigradi al buio.
- Lavare le diapositive tre volte con PBS.
- Incubare i vetrini con un colorante acido nucleico.
- Lavare le diapositive tre volte con PBS.
- Per il montaggio, rimuovere l'eccesso di liquido e applicare supporti di montaggio e un coverslip. Asciugare i vetrini per 1 ora a temperatura ambiente al buio e conservare a 4 gradi centigradi.
NOTA: le soluzioni utilizzate per la colorazione possono essere pericolose. Ridurre il rischio di esposizione utilizzando un cappuccio di fumi chimici, procedure adeguate e dispositivi di protezione personale. Per ulteriori informazioni, consultare msDS.
- Eseguire l'immunochimica del polmone per valutare ulteriormente e specificamente il rimodellamento vascolare. Ad esempio, la colorazione delle cellule muscolari lisce può essere utilizzata per valutare la muscolosità dei vasi, mentre la colorazione di von Willebrand Factor può essere utilizzata per visualizzare i cambiamenti endoteliali. Questi metodi sono descritti altrove5.
Risultati
In questo protocollo, descriviamo in dettaglio la creazione del modello Hypoxia/SU5416 per indurre PH nei topi. Inoltre, dettagliamo tutti i passaggi necessari per eseguire la valutazione vascolare e cardiaca polmonare alla fine del periodo di osservazione.
Una panoramica della progettazione sperimentale per questo modello è illustrata nella Figura 1A13,14. I topi sono sottoposti a ipossia normobarica (10% O2) e iniettati sottocutaneamente una volta alla settimana con SU5416 per tre settimane consecutive. Gli stimoli utilizzati per indurre PH in questo protocollo sono illustrati nelle figure 1B e 1C.
L'antagonista del recettore VEGF SU5416 agisce causando apoptosi cellulare endoteliale e, quindi, permettendo la proliferazione di cellule apoptosi resistenti-endoteliali. Questo porta a rimodellamento vascolare nella vascolatura polmonare e una maggiore resistenza vascolare5. La pressione elevata nella circolazione polmonare aumenta il carico di lavoro del camper e conduce progressivamente alla disfunzione del camper e al fallimento9. Nella prima fase, il successo del protocollo Hypoxia/SU5416 può essere valutato valutando funzionalmente la funzione RV alla fine del periodo di osservazione. In questo protocollo, descriviamo in dettaglio la valutazione invasiva della pressione sistolica RV utilizzando il metodo di misurazione della pressione RV toracica aperta. Le curve di pressione rappresentative e l'analisi quantitativa della giusta pressione ventricolare sono visualizzate nella Figura 2.
Come possiamo quantificare il rimodellamento vascolare, che porta ad un'elevata resistenza vascolare e di conseguenza AL PH? L'istomorfometria è lo standard d'oro per caratterizzare la vascolatura polmonare. In questo protocollo viene descritto in dettaglio il protocollo Hematoxylin & Eosin Staining (H&E). Dopo aver colorato e catturato le immagini, le arterie polmonari possono essere distinte in piccole (<50 m) e più grandi (> 50 m). Le arterie bronchiali sono state escluse dal nostro studio. Per valutare lo spessore mediale, viene misurato il diametro esterno (ED) e il diametro interno (ID) delle arterie. Le immagini rappresentative delle arterie polmonari rimodellate dopo il trattamento Dipossia/SU5416 sono mostrate nella Figura 3A. La percentuale di spessore mediale delle arterie rispetto al diametro della sezione trasversale è illustrata nella Figura 3B. L'analisi morfometrica delle arterie polmonari distaliali dimostra un aumento significativo dello spessore mediale nei topi trattati con ipossia/SU5416 rispetto agli animali della normassia (Figura 3).
L'aumento del carico laterale porta all'ipertrofia del camper e man mano che la malattia progredisce fino alla fibrosiRV 9,15. L'ipertrofia RV può essere valutata morfometricamente misurando l'indice Fulton (RV/LV-Septum) e misurando l'ipertrofia cardiomiocite (CM). Il rapporto di peso tra il ventricolo destro (RV) e il ventricolo sinistro (LV) più il setto [RV/(LV-S)] è calcolato come indice dell'ipertrofia ventricolare destra. I risultati rappresentativi dell'indice Fulton nei topi Ipoxia/SU5416 e normoxia sono mostrati nella Figura 4B. Il metodo qui descritto per valutare l'ipertrofia CM è la colorazione delle sezioni ventricolari destra con Wheat Germ Agglutinin (WGA). WGA si lega alle glicoproteine della membrana cellulare e può essere utilizzato per determinare l'area trasversale dei miociti16,17. Le immagini rappresentative delle sezioni ventricolari destra macchiate con WGA sono mostrate nella Figura 4A. Le quantificazioni dell'area CM sia nei topi mati che in controlli sono mostrate nella Figura 4A. L'esposizione all'ipossia/SU5416 comporta un marcato aumento delle dimensioni cardiomiocate e dell'ipertrofia ventricolare destra (Figura 4). Noi e altri abbiamo già dimostrato che, rispetto al singolo colpo (solo ipossia), l'ipossia/SU5416 aggrava il fenotipoRV 5,18.

Figura 1: Panoramica del metodo Ipoxia/SU5416. (A) Progettazione sperimentale per il modello murino Hypoxia/SU5416. SU5416 viene iniettato sottocutaneamente una volta alla settimana per 3 settimane consecutive. (B) Rappresentazione schematica del sistema di ipossia. Il controllore rileva e regola l'ossigeno all'interno della camera infondendo azoto attraverso il tubo di infusione di gas. (C) Struttura chimica di SU5416. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
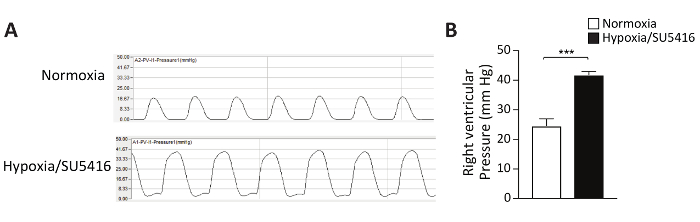
Figura 2: Pressione ventricolare destra nei topi esposti all'ipossia cronica combinata con iniezione di SU5416. (A) Tracciamenti rappresentativi delle misurazioni della pressione invasiva del ventricolo destro (RV). (B) Pressione sistolica RV nei topi ipossia/SU5416 e animali di controllo esposti alla normasa. n - 6-8 topi per gruppo. p < 0.001. Tutti i dati quantitativi sono segnalati come ± SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
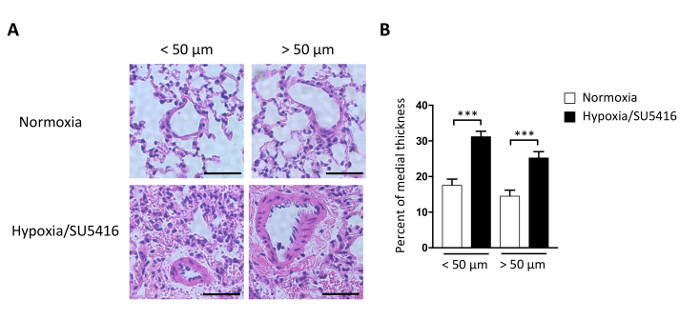
Figura 3: L'ipossia/SU5416 induce il rimodellamento vascolare polmonare. (A) Le sezioni rappresentative dei polmoni macchiate di Ematossilina/Eosin dei gruppi indicati dimostrano un aumento dello spessore della parete mediale nelle arterie polmonari dei topi Ipossia/SU5416. Barra della scala: 50 m. (B) Percentuale di arterie spessore mediale rispetto al diametro della sezione trasversale. n - 5 topi per gruppo. p < 0.001. Tutti i dati quantitativi sono segnalati come ± SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
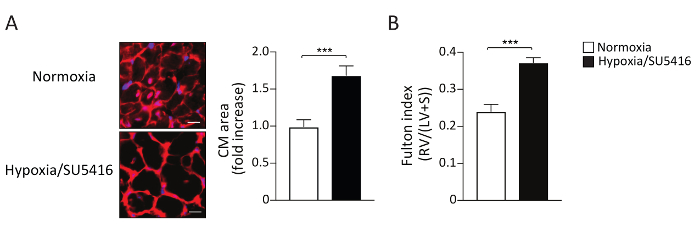
Figura 4: Ipertrofia ventricolare destra nei topi esposti all'ipossia cronica combinata con iniezione di SU5416. ( A )(Sinistra)Rappresentante WGA (Wheat Germ Agglutinin) colorazione del tessuto ventricolare destro dopo il trattamento indicato. Barra della scala: 50 m. (A destra) Analisi quantitativa dei dati. n - 5 topi per gruppo. (B) Ipertrofia RV riflessa dal peso del camper su LV più il rapporto di peso del setto interventricolare (S) (indice Fulton, RV/LV S) in ciascun gruppo. n - 8 topi per gruppo. p < 0.001. Tutti i dati quantitativi sono segnalati come ± SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo descrive come modellare la PH nei topi combinando due stimoli patologici: ipossia cronica e iniezione su5416 (Ipossia/SU5416)18. Nel tentativo di correlare questo modello di topo con la condizione di PH umana, si deve inevitabilmente guardare alla classificazione PH corrente, illustrata nella tabella 1. PH in quasi tutte le forme è caratterizzato da vasoconstriction polmonare e proliferazione aberrante di cellule muscolari endoteliali e lisce. Questo porta ad una pressione elevata nelle arterie polmonari e di conseguenza ad un aumento del dopo carico del ventricolo destro.
Ogni tentativo di caratterizzare un modello animale di PH dovrebbe includere la prova del rimodellamento istopatologico della vascolatura polmonare e del ventricolo destro. Il modello di topo ipossia singolo porta ad una lieve forma di ristrutturazione della vascolatura2,3. Questi risultati patologici includono la muscolosizzazione di vasi precedentemente non muscolosi, accompagnati da cellule endoteliali, cellule muscolari lisce e proliferazione fibroblasta. Questi risultati sono aggravati dall'aggiunta del secondo colpo (iniezione SU5416). Gli effetti sono reversibili nel modello single-hit (ipossia) e solo parzialmente reversibili nel modello Hypoxia/SU5416.
La principale causa di morte per i pazienti affetti da PH è il giusto guasto ventricolare (RVF)4,20. Il rimodellamento vascolare polmonare nei modelli animali non è sempre accompagnato da RVF. Al fine di caratterizzare un modello animale in termini di dati morfologici, funzionali e molecolari RVF dovrebbero essere analizzati. Quest'ultimo esula dall'ambito di questo protocollo. Il rimodellamento morfologico RV comprende sia gli aspetti macro- che microscopici. A livello macroscopico, l'indice principale per l'ipertrofia RV è l'indice Fulton, definito come il peso del camper diviso per il peso ventricolare sinistro (LV) e del peso del setto (S) (RV/LV-S). A livello microscopico, la fibrosi, l'infiammazione e l'ipertrofia possono essere valutate rispettivamente dalla colorazione sirius rosso, ematossilina/Eosin e WGA.
Il modello di ipossia/SU5146 del topo (descritto qui) mostra una disfunzione RV, misurata da pressioni sistoliche elevate e criteri morfologici. Per quanto riguarda il rimodellamento vascolare polmonare, l'ipertrofia mediale viene osservata tre settimane dopo l'avvio del protocollo. Rispetto al modello Hypoxia/SU5416 nei ratti, il modello murino non causa un guasto al RV (solo disfunzione moderata), non porta a una grave angiopatia obliterative, come osservato negli esseri umani gravemente maticchiati, e la patologia polmonare migliora dopo il ritorno alla normoxia. Nel complesso, il modello di topo Hypoxia/SU5416 è adatto per imitare le lesioni vascolari come rilevato nel PH, prevalentemente gruppo I (parzialmente Gruppo III, vedi Tabella 1)1,19. Il vantaggio di questo modello è l'applicazione di topi di tipo selvaggio (geneticamente non modificati), l'implementazione relativamente facile e a basso costo, la mortalità relativamente bassa degli animali malati e il rapido sviluppo della malattia di interesse (3 settimane). Gli studi di prevenzione e terapia della PH possono essere facilmente implementati in questo modello, senza la necessità di competenze avanzate al contrario dei modelli di roditori chirurgici.
Quando si implementa il protocollo ci sono alcuni passaggi critici, che si dovrebbe tenere a mente. Quando si pianifica lo studio, si dovrebbe tenere a mente che nel gruppo Hypoxia/SU5416 la mortalità degli animali varia tra 0-10% (osservazioni inedite). Pertanto, al fine di raggiungere la potenza statistica ed evitare studi sottopotenziati, si raccomandano almeno 10 topi per gruppo. La solubilità di SU5416 è bassa. Pertanto, è necessario utilizzare DMSO o un altro solvente (ad esempio Carboxymethyl cellulosa, CMC). DMSO in dosi elevate può essere tossico. L'LD50 per l'uso sottocutaneo (s.c.) nei topi è stato segnalato per essere 13.9 - 25.6 g/kg21,22. LD50 è definita come la dose necessaria per uccidere il 50% dei membri di una popolazione testata dopo una durata di provaspecificata 21,22. Per un topo che pesa 25 g, vengono utilizzati 4,4 g/Kg di DMSO (calcoli basati sulla densità DMSO di 1,1 g/mL e 0,1 mL applicati s.c./mouse). Pertanto, la dose somministrata sottocutaneamente è molto inferiore al valore LD50. Nelle nostre mani, l'applicazione di SU5416 disciolto in DMSO, come descritto qui, può causare irritazione della pelle in alcuni casi, ma non si osservano altri effetti tossici. Tuttavia, diversi rapporti raccomandano l'uso di CMC come veicolo alternativo a SU541614. Quando si eseguono le misurazioni funzionali del camper, è necessario prestare molta attenzione alla temperatura corporea, al sanguinamento e alla profondità dell'anestesia, come valutato testando i riflessi del topo. La tecnica del torace aperto per valutare la pressione del camper, come descritto di seguito, ha il vantaggio di essere facilmente implementata anche da un utente inesperto. Il metodo a torso chiuso (descrittoaltrove 23,24,25) ha il vantaggio di essere meno invasivo e può, quindi, essere implementato anche in esperimenti non terminali. Richiede però un alto livello di competenza.
Dopo la prima descrizione del modello Hypoxia/SU5416 nei ratti, il modello murino è stato utilizzato con successo in diversi studi5,9,13. Tuttavia, vi sono prove che i risultati dipendono dal background genetico e dal sesso dei topi, dal produttore di SU5416 e dalla frequenza dell'iniezione SU541626. Mentre l'iniezione di SU5416 per tre settimane consecutive porta alla PH nei topi, una singola dose non indurrebbe PH4. Inoltre, altre forme di PH, come quelle associate a malattie cardiache sinistra o a causa di malattie tromboemboliche croniche, richiedono modelli correlati all'eziologia. Le nuove terapie devono essere testate in almeno 2 diversi modelli animali, prima di poter spianare la strada a studi traslazione.
Divulgazioni
Gli autori non hanno nulla da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dell'American Heart Association (AHA- 17SDG33370112 e 18IPA34170258) e dal National Institutes of Health NIH K01 HL135474 a Y.S. O.B è stato sostenuto dalla Deutsche Herzstiftung.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
Riferimenti
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon