Method Article
Induktion und Charakterisierung der pulmonalen Hypertonie bei Mäusen mit dem Hypoxia/SU5416-Modell
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Induktion von pulmonaler Hypertonie (PH) bei Mäusen basierend auf der Exposition gegenüber Hypoxie und der Injektion eines VEGF-Rezeptor-Antagonisten. Die Tiere entwickeln 3 Wochen nach Beginn des Protokolls eine PH- und rechtsventrikuläre (RV) Hypertrophie. Die funktionale und morphometrische Charakterisierung des Modells wird ebenfalls dargestellt.
Zusammenfassung
Pulmonale Hypertonie (PH) ist ein pathophysiologischer Zustand, definiert durch einen mittleren pulmonalen arteriellen Druck von mehr als 25 mm Hg im Ruhezustand, wie durch rechte Herzkatheterisierung beurteilt. Ein breites Spektrum von Krankheiten kann zu PH führen, unterschiedlich in ihrer Ätiologie, Histopathologie, klinische Präsentation, Prognose, und Reaktion auf die Behandlung. Trotz erheblicher Fortschritte in den letzten Jahren bleibt PH eine unheilehafte Krankheit. Das Verständnis der zugrunde liegenden Mechanismen kann den Weg für die Entwicklung neuer Therapien ebnen. Tiermodelle sind wichtige Forschungsinstrumente, um dieses Ziel zu erreichen. Derzeit stehen mehrere Modelle zur Rekapitulation von PH zur Verfügung. Dieses Protokoll beschreibt ein PH-Modell mit zwei Treffern. Die Reize für die PH-Entwicklung sind Hypoxie und die Injektion von SU5416, einem vaskulären endotheliaalen Wachstumsfaktor (VEGF)-Rezeptor-Antagonisten. Drei Wochen nach Beginn von Hypoxie/SU5416 entwickeln Tiere eine pulmonale Gefäßumgestaltung, die die histopathologischen Veränderungen imitiert, die bei humanem PH beobachtet wurden (überwiegend Gruppe 1). Die vaskuläre Umgestaltung im Lungenkreislauf führt zur Umgestaltung der rechten Herzkammer (RV). Die Verfahren zur Messung von RV-Drücken (mit Hilfe der Methode der offenen Brust), die morphometrischen Analysen des RV (durch Sezieren und Wiegen beider Herzkammern) und die histologischen Beurteilungen des Umbaus (sowohl pulmonale durch Diekonversion als auch Herz durch Beurteilung der RV-Kardiomyozytenhypertrophie und Fibrose) werden ausführlich beschrieben. Die Vorteile dieses Protokolls sind die Möglichkeit der Anwendung sowohl bei Wildarten als auch bei gentechnisch veränderten Mäusen, die relativ einfache und kostengünstige Umsetzung und die schnelle Entwicklung der Krankheit von Interesse (3 Wochen). Einschränkungen dieser Methode sind, dass Mäuse keinen schweren Phänotyp entwickeln und PH bei Rückkehr zu Normoxia reversibel ist. Prävention, sowie Therapiestudien, können leicht in diesem Modell implementiert werden, ohne die Notwendigkeit von fortgeschrittenen Fähigkeiten (im Gegensatz zu chirurgischen Nagetiermodellen).
Einleitung
Pulmonale Hypertonie (PH) ist eine pathophysiologische Erkrankung, definiert durch einen mittleren pulmonalen arteriellen Druck (PA) von mehr als 25 mm Hg im Ruhezustand, wie durch rechte Herzkatheterisierung1,2beurteilt. Es gibt eine Vielzahl von Krankheiten, die zu PH führen können. Um die PH-assoziierten Bedingungen zu organisieren, wurden mehrere Klassifikationssysteme entwickelt. Die aktuelle klinische Klassifikation kategorisiert die multiplen PH-assoziierten Krankheiten in 5 verschiedene Gruppen1. Diese Unterscheidung ist von Bedeutung, da verschiedene Gruppen von Patienten Krankheiten haben, die sich in ihrer klinischen Darstellung, Pathologie, Prognose und Reaktion auf Behandlung unterscheiden2. Tabelle 1 fasst die aktuelle Klassifikation zusammen, ergänzt durch die grundlegenden histopathologischen Merkmale jeder Krankheit.
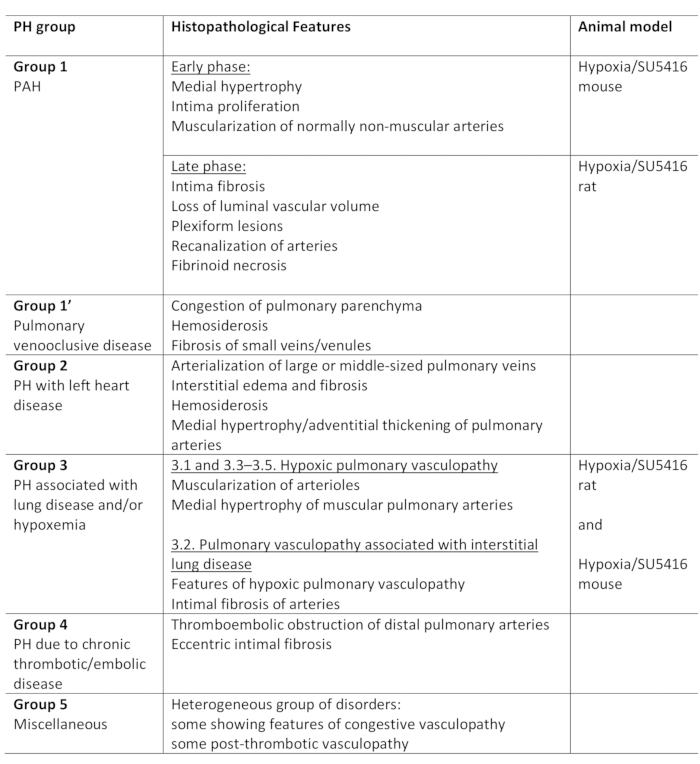
Tabelle 1: Überblick über die klinische Klassifikation von PH, zusammen mit den wichtigsten histopathologischen Merkmalen innerhalb der Gruppen. Eignung des Protokolls Hypoxia/SU5416 zur Modellierung von PH. Diese Tabelle wurde von19geändert. PH: Pulmonale Hypertonie, PAH: Pulmonale arterielle Hypertonie
Trotz erheblicher Fortschritte bei der Behandlung von PH-assoziierten Krankheiten bleibt PH ohne Heilung, mit einer 3-Jahres-Sterblichkeitsrate zwischen 20% und 80%3. Dies zeigt die zwingende Notwendigkeit, die zugrunde liegenden Mechanismen von PH und danach die Entwicklung neuer Therapien zu verstehen, um das Fortschreiten zu verhindern, zu verlangsamen und die Krankheit zu heilen. Tiermodelle sind für diesen Bereich von entscheidender Bedeutung. Derzeit gibt es verschiedene Modelle, um PH zu studieren. Der interessierte Leser wird auf die ausgezeichneten Rezensionen zu diesem Thema2,3,4verwiesen. Angesichts der Vielzahl von Krankheiten, die zu PH führen, ist es offensichtlich, dass die vielfältigen Bedingungen des menschlichen PH nicht in einem Tiermodell perfekt rekapituliert werden können. Die verfügbaren Tiermodelle können in i) Single-Hit, ii) Two-Hit, iii) Knockout und iv) Overexpression-Modelle3kategorisiert werden. In den Single-Hit-Modellen wird PH durch einen einzigen pathologischen Reiz induziert, während Zwei-Treffer-Modelle zwei pathologische Reize mit dem Ziel kombinieren, schwerere PH zu induzieren und damit die komplexe menschliche Krankheit genauer nachzuahmern. Neben den ätiologischen Unterschieden führen die verschiedenen Reize zu PH-Modellierungsunterschieden, die auch von der Art und dem genetischen Hintergrund der Tiere abhängen4.
Eines der am häufigsten verwendeten klassischen PH Nagetiermodelle ist die chronische Hypoxie Modell2. Hypoxie ist bekannt, PH beim Menschen sowie bei mehreren Tierarten induzieren. Hypoxie hat den Vorteil, ein physiologischer Stimulus für PH zu sein (Tabelle 1). Während jedoch der Grad der Hypoxie, der zur Induktion von PH bei Nagetieren verwendet wird, viel schwerer ist als beim Menschen, führt die einzelne Beleidigung (Hypoxie) nur zu einer milden Form der vaskulären Umgestaltung. Dies imitiert nicht die Schwere der menschlichen Krankheit. Die Zugabe eines Zweiten Treffers, ein zusätzlicher Stimulus zur Induktion von PH, zeigte vielversprechende Ergebnisse: Die Injektion der Verbindung SU5416 an Nagetiere in Kombination mit dem hypoxischen Stimulus induziert einen schwereren PH-Phänotyp2,5,6. SU5416 ist ein Inhibitor des vaskulären endotheliaalen Wachstumsfaktors (VEGF)-Rezeptor-2. Es blockiert die VEGF-Rezeptoren und führt zu Endothelzellapoptose. Unter hypoxischen Bedingungen stimuliert dies die Proliferation einer Teilmenge apoptoseresistenter Endothelzellen. Darüber hinaus führt SU5416 zu einer reibungslosen Zellproliferation der Muskelzellen. Die Kombination dieser Effekte führt zu einer pathologischen vaskulären Umgestaltung des Lungenkreislaufs und führt zu erhöhtem PA-Druck und rechtsventrikulärer Umgestaltung2,5,7. Das Modell wurde zuerst in Ratten6 beschrieben und später auf Mäuse4,5,7angewendet. Das Mausmodell weist im Vergleich zu Ratten eine weniger schwere Gefäßumgestaltung auf. Darüber hinaus, wenn zu Normoxia zurück, PH weiterhin Fortschritte bei Ratten, während bei Mäusen ist es teilweise reversibel.
Das folgende Protokoll beschreibt alle Schritte zur Modellierung von PH bei Mäusen mit der Hypoxia/SU5416-Methode (Planung, Zeitleiste, Ausführung). Zusätzlich wird die Charakterisierung des Modells in diesem Protokoll beschrieben: funktionell (durch invasive Messung des rechten ventrikulären (RV) Drucks mit der offenen Brusttechnik), morphometrisch (durch Sezieren und Wiegen sowohl der rechten und linken Ventrikel als auch histologisch (durch Bewertung des pulmonalen VaskulärenRekonsedes, rechtsventrikulärer Kardiomyozytenhypertrophie und Fibrose).
Alle in diesem Protokoll beschriebenen Schritte und Methoden können von den Ermittlern auf jeder Erfahrungsebene einfach implementiert werden. Während die funktionellen Messungen des Wohnmobils mit der offenen Brusttechnik (hier beschrieben) nicht die Goldstandardmethode auf dem Gebiet sind, hat es den Vorteil, dass es auch von einem weniger erfahrenen Experimentator schnell erlernt und genau reproduziert werden kann.
Protokoll
Vor allen Tierversuchen erhalten Sie die Genehmigung des örtlichen institutionellen Tierpflegeausschusses. Die aktuellen Experimente wurden nach Genehmigung durch das Institutional Animal Care and Use Committee (IACUC) an der Icahn School of Medicine am Berg Sinai durchgeführt.
1. PH-Induktion
- Vorbereitung
- Bevor Sie mit der Studie beginnen, planen Sie sorgfältig das experimentelle Design. Stellen Sie sicher, dass Mäuse gleichzeitig mit der ersten SU5416-Injektion hypoxie ausgesetzt sind. Ein Beispiel für das experimentelle Design zur Induktion von PH mit der Hypoxia/SU5416-Methode ist in Abbildung 1Adargestellt. Kontrollmäuse erhielten nur das Fahrzeug. Für dieses Modell wird SU5416 den Mäusen einmal pro Woche für 3 aufeinanderfolgende Wochen injiziert.
- Verwenden Sie acht bis zwölf Wochen alte C57BL/6-Mäuse für diese Studie. Die Tiere bei 18-20 °C in einem 12-h-Licht-Dunkel-Zyklus unterbringen. Stellen Sie sicher, dass Lebensmittel und Wasser ad libitumzugänglich sind.
- Wiegen Sie die Tiere. Weisen Sie sie jeder Gruppe nach dem Zufallsprinzip zu: Normoxia und Hypoxie/SU5416.
- Bereiten Sie die hypoxische Kammer wie in Abbildung 1B dargestellt vor. Sicherer Stickstoff (N2) Tanks in der Nähe der Kammer. Stellen Sie den Sauerstoffregler (O2) auf einen Punkt von 10% O2ein. Lassen Sie das System einen stabilen Zustand erreichen.
- Bereiten Sie SU5416 für die Injektion vor (verwenden Sie eine Dosis von 20 mg/kg Körpergewicht). SU5416 löst sich nicht in wässrigen Lösungen auf; lösen Sie daher den berechneten Betrag in 100 L DMSO8auf. Bei einer 25 g-Maus beträgt die zu injizierende SU5416-Menge beispielsweise 0,5 mg gelöst in 100 l Lösungsmittel (DMSO). Die Endkonzentration von SU5416 für diese Maus beträgt daher 5 mg/ml.
VORSICHT: SU5416 ist ein gefährliches Material. Lesen Sie sorgfältig das Sicherheitsdatenblatt zusammen mit dem Produkt und stellen Sie sicher, dass Sie die empfohlenen Vorsichtsmaßnahmen beim Umgang mit diesem Stoff treffen. Tragen Sie Schutzhandschuhe und (wie bei jeder Injektion) Augenschutz verwenden. Die chemische Struktur von SU5416 ist in Abbildung 1C dargestellt.
HINWEIS: Berechnen Sie einen angemessenen Überschuss der Lösung, um das Volumen zu kompensieren, das während der Injektion verloren geht (z. B. in der Spritze, durchstechflämigen Usw.). Je nach verwendeter Spritze beträgt das Totvolumen ca. 200 l. Für eine Gruppe von 10 Mäusen berechnen Sie einen Überschuss von 2 Mausdosen. - Bereiten Sie die Spritzen für die Injektion vor. Verwenden Sie 1 ml Spritzen mit 25 G x 5/8" Nadeln.
- SU5416 subkutane Injektion
- Halten Sie das Tier zurück. Legen Sie die Maus auf den Deckel des Käfigs, um die Zurückhaltung zu unterstützen. Greifen Sie die Haut und bilden Sie ein Zelt parallel zur Wirbelsäule. Achten Sie darauf, den Hinterkopf fest zu greifen, um die mögliche Bissverletzung durch die Maus zu vermeiden.
HINWEIS: Die Anwesenheit von zwei Forschern macht das Verfahren schneller und genauer, da einer das Tier halten kann, während der andere die Injektion durchführt. - Setzen Sie die Nadel subkutan über die Flanke an der lockeren Hautfalte ein. Stellen Sie sicher, dass Die Nadel parallel zur Haut eingesetzt wird. Vermeiden Sie es, in die Bauchwand einzudringen.
- Injizieren Sie den Inhalt der Spritze (100 l gelöstes SU5416 oder Fahrzeug).
HINWEIS: Um Leckagen nach vollständiger Lieferung zu vermeiden, halten Sie die Spritze ca. 10 s und drehen Sie die Nadel leicht unter die Haut. - Ziehen Sie die Nadel ab und bringen Sie das Tier in seinen Käfig zurück. Legen Sie die Käfige nach der SU5416-Injektion in die belüftete Hypoxiekammer.
- Halten Sie das Tier zurück. Legen Sie die Maus auf den Deckel des Käfigs, um die Zurückhaltung zu unterstützen. Greifen Sie die Haut und bilden Sie ein Zelt parallel zur Wirbelsäule. Achten Sie darauf, den Hinterkopf fest zu greifen, um die mögliche Bissverletzung durch die Maus zu vermeiden.
- Exposition gegenüber Hypoxie
- Überwachen Sie die Belüftung im Laufe der Zeit. Achten Sie darauf, 10% der Sauerstoffversorgung aufrechtzuerhalten. Halten Sie Normoxia-Tiere in einer halbversiegelbaren Kammer bei 21%O2.
- Stellen Sie sicher, dass die Kammern mit einem Sauerstoffsensor ausgestattet sind, um den Sauerstoffgehalt zu messen. Vermeiden Sie eine umfangreiche Öffnung der Kammern. Zum Reinigen und Hinzufügen von Nahrung und Wasser öffnen Sie die Kammern für nicht mehr als 20 min alle 3 Tage.
- Tiere täglich inspizieren. Betrachten Sie Stresssignale wie Piloerektion oder signifikanten Gewichtsverlust.
HINWEIS: Tiere unter Hypoxie/SU5416 werden voraussichtlich Gewicht verlieren5. Dies ist ein Hinweis auf die Entwicklung von Krankheiten. - Wiederholen Sie die SU5416-Injektion wöchentlich für 3 aufeinander folgende Wochen (siehe Abbildung 1A für die Übersicht des experimentellen Designs).
HINWEIS: Eine Änderung der Injektionsstelle kann helfen, Hautreizungen zu reduzieren.
2. Funktionelle Charakterisierung durch invasive RV-Druckmessungen
- Vorbereitung
HINWEIS: Wählen Sie ein Anästhetikum aus. Injizierbare oder inhalierbare Anästhetika können verwendet werden. Da eine leichte Überdosierung von injizierbaren Anästhetika (insbesondere aus Ketamin/Xylazin oder Pentobarbital) die Herzfunktion signifikant beeinflussen kann, wird die Verwendung von flüchtigen Anästhetika empfohlen. Es ist von großer Bedeutung, das gleiche Anästhetikum für alle Mäuse innerhalb einer Studie zu verwenden.- Verwenden Sie einen Verdampfer, um eine genaue Anästhesiedosis pro Tier zu gewährleisten. Die Dosis für Isofluran ist wie folgt: Induktion 3-4%, Wartung 1% gemischt mit 100% Sauerstoff.
HINWEIS: Tragen Sie persönliche Schutzausrüstung und vermeiden Sie das Atmen des Dampfes. - Bereiten Sie ein Heizkissen und/oder Wärmelampen zur Aufrechterhaltung der Körpertemperatur vor. Bereiten Sie einen rektalen Temperaturfühler zur Überwachung der Körpertemperatur vor.
- Sorgen Sie für eine ordnungsgemäße Belüftung. Bereiten Sie das Beatmungsgerät vorher vor. Bereiten Sie den Y-Rohrstecker vor und überprüfen Sie die Funktion des Beatmungsgeräts im manuellen Modus. Stellen Sie sicher, dass der Inspiratoriumsdruck <1 cmH2O ist, um Barotrauma zu vermeiden. Stellen Sie die Atemfrequenz auf 110 Atemzüge/min ein.
- Bereiten Sie ein Endotrachealrohr vor, indem Sie einen 20 G intravaskulären Katheter schneiden.
- Bereiten Sie die benötigten Instrumente vor: kleine Zangen, Scheren, elastische Hakenretraktoren, Gefäßkauterisierer und Wattestäbchen. Passen Sie auf einem Wattestäbchen eine kleine 25 G x 5/8" Nadel an, die verwendet wird, um eine kleine Punktion im rechten Ventrikel zu machen.
- Bereiten Sie den Druckkatheter, die Druck-Volumen-Steuereinheit, vor und initiieren Sie die Datenerfassungssoftware. Stellen Sie den PV-Katheter in ein 15 ml-Rohr, das mit PBS gefüllt ist, 15 min bei 37 °C und kalibrieren Sie ihn gemäß dem Herstellerprotokoll.
- Für die Perfusion und Fixierung der Organe, bereiten PBS und eine Lösung von 50% PBS / 50% OCT. Bereiten Sie 2 x 10 ml Spritzen (mit einer 25 G Nadel): eine wird für die Durchlässigung des Herzens und der Lunge mit PBS in situ und die zweite für die Injektion der OCT / PBS (50/50) Lösung in die Lungenprobe verwendet werden, die für die histologische Untersuchung verwendet wird.
- Verwenden Sie einen Verdampfer, um eine genaue Anästhesiedosis pro Tier zu gewährleisten. Die Dosis für Isofluran ist wie folgt: Induktion 3-4%, Wartung 1% gemischt mit 100% Sauerstoff.
- Intubation
- Wiegen Sie die Maus und erfassen Sie den Gesundheitszustand vor der Anästhesie.
- Induzieren Anästhesie mit 3-4% Isofluran. Überprüfen Sie die Anästhesietiefe, indem Sie den Zehen-Pinch-Reflex testen: Kneifen Sie die Zehen eines der Gliedmaßen fest. Wenn das Tier die Gliedmaße zurückzieht, ist dies ein Zeichen für eine unzureichende Anästhesie.
- Nach der Anästhesieinduktion den Hals und den Brustbereich rasieren.
- Legen Sie die Maus auf das Heizkissen. Stellen Sie einen rektalen Temperaturfühler zur Überwachung der Körpertemperatur auf.
HINWEIS: Die Aufrechterhaltung der Körpertemperatur ist für die funktionellen Messungen von Bedeutung. Die Körpertemperatur sollte ca. 36,5-37 °C betragen. - Mit gekrümmten Zangen befestigen Sie ein Nahtgewinde an den oberen Schneidezähnen der Maus, dehnen und fixieren Sie das Heizkissen mit chirurgischem Klebeband. Sichern Sie die Gliedmaßen der Maus mit chirurgischen Bändern.
- Zum Intubieren macht das Tier mit einer kleinen Schere einen kleinen Schnitt von ca. 1 cm in der medialen Halshaut.
HINWEIS: Die orale Intubation ist eine alternative Methode, die mehr Erfahrung erfordert. - Mit einem baumwollgekippten Applikator trennen sich die Ohrspeicheldrüsen und submandibulären Speicheldrüsen auf der mittleren Ebene unverblümt. Dadurch werden die Muskeln über der Luftröhre entblößt.
- Schneiden Sie diese Muskeln sorgfältig aus der Luftröhre.
- Mit einer kleinen Schere einen kleinen Schnitt zwischen den Trachealknorpeln machen und das vorbereitete Endotrachealrohr einsetzen. Nehmen Sie die Metallführung des intravaskulären Katheters heraus.
- Schließen Sie den Katheter an das Beatmungsgerät an. Überprüfen Sie die Position des Luftröhrens, indem Sie die Lunge manuell sanft aufblasen. Sichern Sie die Position mit Klebeband.
- Bewahren Sie während des gesamten Verfahrens eine Isoflurananästhesie von 1% an.
- Überwachen Sie regelmäßig die Tiefe der Anästhesie, indem Sie den Zehenkneifreflex testen. Passen Sie die Anästhesie entsprechend an.
HINWEIS: Die empfohlene Herzfrequenz während der Experimente, unter 1% Isoflurananästhesie, beträgt ca. 400 Schläge /min. Die Aufrechterhaltung der Körpertemperatur und anästhesie sind wichtig für die Kontrolle der Herzfrequenz. Überschüssiges Isofluran kann die Herzfrequenz senken. Eine Erholung kann jedoch durch eine Senkung der Isofluranrate erreicht werden.
- RV-Druckmessungen (offener Brustansatz)
- Mit einer kleinen Schere führen Sie einen Hautschnitt von ca. 1 cm über den xiphoiden Prozess und den oberen Bauchteil durch. Trennen Sie die Haut, die die Brust und die Bauchwand der oberen Bauchquadranten bedeckt: beginnen Sie an der Mittellinie, distal bis zum Xiphoid und bewegen Sie sich seitlich auf beiden Seiten. Verwenden Sie Thermokautery, um Blutungen zu kontrollieren.
HINWEIS: Das Ziel ist es, Zugang zur Brusthöhle durch die Bauchwand zu haben. - Öffnen Sie die Bauchhöhle und schneiden Sie das Zwerchfell sorgfältig, wobei Sie darauf achten, das schlagende Herz oder die Lunge nicht zu verletzen.
HINWEIS: Das Ziel ist es, die Spitze und die rechte Herzkammer zu entlarven. Eine gute Belichtung und Sicht auf das Herz sind von entscheidender Bedeutung für die korrekte Platzierung des Katheters. Es ist von großer Bedeutung, Blutungen während des gesamten Verfahrens zu vermeiden. Schon kleine Veränderungen des intravasalen Volumens können die Belastung des rechten Herzens verändern und die aufgezeichneten Parameter beeinflussen. - Entfernen Sie das Perikard vorsichtig mit einem mit Baumwolle umgaben Applikator.
- Kurz vor dem Platzieren des Druckkatheters in das Herz, bringen Sie den Katheter neben die Maus.
- Die Verwendung des präparierten Baumwoll-Applikators mit der Nadel macht eine Stichwunde im apikaldistalen Teil des rechten Ventrikels. Entfernen Sie die Nadel vorsichtig und legen Sie den Druckkatheter in dieses Loch ein.
HINWEIS: Dies sollte ohne Anwendung von Gewalt funktionieren. Falls dies nicht möglich ist, versuchen Sie, ein neues Loch in der Nähe des ersten zu machen, um eine längere Verletzung des Herzens zu vermeiden. Die Nadel sollte nicht tiefer als ca. 3 mm eingesetzt werden. - Setzen Sie den Druckkatheter parallel zur Richtung des rechten Ventrikels ein, wobei die Spitze auf die Lungenarterie gerichtet ist.
- Beobachten Sie die Druckwellenverfolgung, um die korrekte Positionierung des Katheters zu gewährleisten. Repräsentative Rückverfolgungen sind in Abbildung 2dargestellt.
- Lassen Sie das Drucksignal stabilisieren. Atempausen und mindestens 3 Messungen. Zwischen den Einzelmessungen kann das Tier belüftet werden.
- Sobald alle Messungen aufgezeichnet sind, entfernen Sie den Katheter und legen Sie ihn wieder in das PBS-gefüllte Rohr im Wasserbad.
HINWEIS: Reinigen Sie den Katheter nach Abschluss des Experiments gemäß den Anweisungen des Herstellers.
- Mit einer kleinen Schere führen Sie einen Hautschnitt von ca. 1 cm über den xiphoiden Prozess und den oberen Bauchteil durch. Trennen Sie die Haut, die die Brust und die Bauchwand der oberen Bauchquadranten bedeckt: beginnen Sie an der Mittellinie, distal bis zum Xiphoid und bewegen Sie sich seitlich auf beiden Seiten. Verwenden Sie Thermokautery, um Blutungen zu kontrollieren.
- Euthanasie und Lungenperfusion
- Nach Abschluss des Experiments einschläfern die Maus durch Exsanguination.
- Öffnen Sie die Brust weit. Schneiden Sie mit einer Schere das gesamte Brustbein und achten Sie darauf, das Herz oder die Lunge nicht zu verletzen.
- Mit Irisschere macht einen kleinen Schnitt in der linken Herzkammer, damit Blut die Kammer verlassen.
- Legen Sie die 25 G Nadel einer Spritze mit 10 ml PBS in den rechten Ventrikel und injizieren Sie die PBS-Lösung, bis die Lunge von Blut befreit ist.
- Sobald dieser Schritt abgeschlossen ist, bestätigen Sie die Euthanasie durch lebenswichtige Gewebeernte (Herz und Lunge): Schneiden Sie die Kava und Aortenansammlungen und entfernen Sie herz und lungen en block.
3. Morphometrische Charakterisierung
- Unmittelbar nach dem Entfernen des Herzens und der Lunge (Schritt 2.4.5), isolieren Sie das Herz und entfernen Sie beide Vorhöfe. Mit gekrümmter Tenotomieschere seziert vorsichtig der rechte Ventrikel (RV) vom linken Ventrikel (LV), so dass das Septum (S) mit dem linken Ventrikel bleibt. Wiegen Sie RV und LV+S und berechnen Sie den Fulton Index= RV/LV+ S (Abbildung 3)5,9.
- Nehmen Sie einen Teil des rechten Ventrikels und legen Sie ihn in eine OCT-Vorbettform. Verwenden Sie den anderen Teil des rechten Ventrikels für die RNA- und/oder Proteinanalyse. Einfrieren im Trockeneis einfrieren und bei -80 °C lagern.
- Verwenden Sie Irisschere, um die Lunge vom Herzen und jedem anderen verbleibenden Gewebe zu isolieren.
HINWEIS: Für die Vorbereitung der Lunge ist die oben beschriebene Perfusion (Schritte 2.4.3-2.4.5) von großer Bedeutung. - Fangen Sie einen Teil der Lunge ein und speichern Sie ihn für RNA, Proteinextraktion oder andere Assays.
- Verwenden Sie den anderen Teil der Lunge für die histologische Analyse. Zu diesem Zweck legen Sie die Spritze mit 50% PBS und 50% OCT in einen Bronchus des verwendeten Lappens10,11ein. Der Experimentator kann leicht erkennen, dass die Lunge aufgeblasen wird, wenn der Inhalt der Spritze im Gewebe durchdrungen ist.
- Legen Sie diese Lungenstücke in einbettende Formen, die mit OCT vorgefüllt sind, und fangen Sie sie in Trockeneis ein. Bewahren Sie die Proben nach dem Einfrieren bei -80 °C auf.
- Bereiten Sie 8 m Abschnitte von RV und Lunge mit einer Kryostatmaschine vor. Die Abschnitte bei Raumtemperatur 30 min trocknen.
- Fixieren Sie die Dias bei Raumtemperatur mit 10% Paraformaldehyd (PFA) für 10 min.
HINWEIS: PFA ist ein bekanntes menschliches Karzinogen. Reduzieren Sie das Expositionsrisiko durch den Einsatz einer chemischen Dunstabzugshaube, ordnungsgemäßer Verfahren und persönlicher Schutzausrüstung. Weitere Informationen finden Sie im Material Sicherheitsdatenblatt (MSDS). - Beurteilung der Vaskulären Umgestaltung durch Hämatoxylin/Eosinfärbung
Anmerkung: Führen Sie Hämatoxylin/Eosin-Färbung durch, um die strukturellen Veränderungen des Herzens und der vaskulären Umgestaltung in der Lunge zu bewerten (Abbildung 3).- Mit Hämatoxylinlösung für 8 min.
- Spülen Sie mit fließendem Leitungswasser für 5 min, gefolgt von einer schnellen Spülung in destilliertem Wasser.
- In 95% EtOH für 1 min und Gegenfärbung in der Eosin-Lösung für 1 min abspülen.
- Dehydrieren (80% Ethanol 10-30 s, 100 Ethanol für 1 min und 100% Toluol für 3 min).
- Montieren und Decken mit einem Deckelschlupf. Trocknen Sie die Rutschen über Nacht bei Raumtemperatur.
HINWEIS: Die für die Färbung verwendeten Lösungen können gefährlich sein. Reduzieren Sie das Expositionsrisiko durch den Einsatz einer chemischen Dunstabzugshaube, ordnungsgemäßer Verfahren und persönlicher Schutzausrüstung. Weitere Informationen finden Sie im MsDS.
- Rechtsventrikuläre Fibrose-Bewertung von Picrosirius Red Staining
HINWEIS: In der Picrosirius Red Staining bindet Picrosirius Red, das säureist, an Kollagen12. Daher kann diese Färbung für eine histologische Untersuchung des Kollagengehalts verwendet werden.- Inkubieren Sie die Dias in einer vorgeheizten Bouin-Lösung bei 58 °C für 1 h.
- Waschen Sie die Dias in fließendem Leitungswasser, um gelbe Farbe aus Abschnitten für 10-15 min zu entfernen.
- Stain in 0.1% Fast Green für 20 min bei Raumtemperatur.
- 1 min in 1% Essigsäure abspülen.
- Spülen Sie in Leitungswasser für 5 min.
- Stain in 0.1% Sirius rot für 30 min bei Raumtemperatur gefolgt von Dehydrierung in Toluol.
VORSICHT: Die für die Färbung verwendeten Lösungen können gefährlich sein. Reduzieren Sie das Expositionsrisiko durch den Einsatz einer chemischen Dunstabzugshaube, ordnungsgemäßer Verfahren und persönlicher Schutzausrüstung. Weitere Informationen finden Sie im MsDS.
- RV Cardiomyozyten Hypertrophie Bewertung von WGA Staining
HINWEIS: Hypertrophie des rechten Ventrikels (RV) auf zellulärer Ebene kann durch Durchführung einer Weizenkeim-Agglutinin (WGA) Färbung beurteilt werden (Abbildung 4).- Fixieren Sie die Dias in kalter Acetonlösung für 15 min gefolgt von 3 Schritten des Waschens in PBS (jeweils 5 min).
- Block mit 10% Ziegenserum in einer Dako-Lösung für 30 min bei Raumtemperatur.
- Inkubieren Sie die Dias mit WGA: Fügen Sie WGA 1:200 hinzu und inkubieren Sie für 1 1/2 h bei 37 °C im Dunkeln.
- Waschen Sie die Dias dreimal mit PBS.
- Inkubieren Sie die Dias mit einem Nukleinsäurefarbstoff.
- Waschen Sie die Dias dreimal mit PBS.
- Für die Montage, entfernen Sie den Überschuss an Flüssigkeit und tragen Montagemedien und einen Deckelschlupf auf. Trocknen Sie die Dias für 1 Stunde bei Raumtemperatur im Dunkeln und lagern Sie bei 4 °C.
HINWEIS: Die für die Färbung verwendeten Lösungen können gefährlich sein. Reduzieren Sie das Expositionsrisiko durch den Einsatz einer chemischen Dunstabzugshaube, ordnungsgemäßer Verfahren und persönlicher Schutzausrüstung. Weitere Informationen finden Sie im MsDS.
- Führen Sie die Immunchemie der Lunge durch, um den vaskulären Umbau weiter zu verbessern und gezielt zu bewerten. Zum Beispiel kann glatte Muskelzellfärbung verwendet werden, um die Muskulisierung der Gefäße zu beurteilen, während von Willebrand Factor Färbung verwendet werden kann, um endotheliale Veränderungen zu visualisieren. Diese Methoden werden an anderer Stelle beschrieben5.
Ergebnisse
In diesem Protokoll beschreiben wir detailliert die Erstellung des Hypoxia/SU5416 Modells zur Induktion von PH bei Mäusen. Darüber hinaus beschreiben wir alle notwendigen Schritte zur Durchführung der pulmonalen Gefäß- und Herzbewertung am Ende des Beobachtungszeitraums.
Eine Übersicht über das experimentelle Design für dieses Modell ist in Abbildung 1A13,14dargestellt. Mäuse werden normobarischen Hypoxie (10%O2) ausgesetzt und einmal pro Woche subkutan mit SU5416 für drei aufeinander folgende Wochen injiziert. Die Reize, die verwendet werden, um PH in diesem Protokoll zu induzieren, sind in Abbildung 1Bund 1Cdargestellt.
Der VEGF-Rezeptor-Antagonist SU5416 wirkt, indem er Endothelzellapoptose verursacht und somit die Proliferation von apoptoseresistenten endotheliaalen Zellen ermöglicht. Dies führt zu einer vaskulären Umgestaltung der Lungenvaskulatur und einem erhöhten Gefäßwiderstand5. Der erhöhte Druck in der Lungenzirkulation erhöht die RV-Nachlast und führt schrittweise zur RV-Dysfunktion und zum Ausfall9. Im ersten Schritt kann der Erfolg des Hypoxia/SU5416-Protokolls durch funktionale Beurteilung der RV-Funktion am Ende des Beobachtungszeitraums bewertet werden. In diesem Protokoll beschreiben wir detailliert die invasive Beurteilung des RV-Systolischen Drucks mit der offenen Brust-RV-Druckmessmethode. Repräsentative Druckkurven und quantitative Analyse des rechten ventrikulären Drucks sind in Abbildung 2dargestellt.
Wie können wir den vaskulären Umbau quantifizieren, was zu erhöhtem Gefäßwiderstand und damit zu PH führt? Die Histomorphometrie ist der Goldstandard für die Charakterisierung der Lungenvaskulatur. In diesem Protokoll beschreiben wir ausführlich das Hämatoxylin & Eosin Staining (H&E) Protokoll. Nach der Färbung und Aufnahme der Bilder können die Lungenarterien in kleinen (<50 m) und größeren (> 50 m) unterschieden werden. Bronchiale arterien wurden von unserer Studie ausgeschlossen. Zur Beurteilung der Medialdicke wird der außen (ED) sowie der Innendurchmesser (ID) der Arterien gemessen. Repräsentative Bilder von umgebauten Lungenarterien nach der Behandlung von Hypoxie/SU5416 sind in Abbildung 3A dargestellt. Der Prozentsatz der medialen Dicke der Arterien im Verhältnis zum Querschnittsdurchmesser ist in Abbildung 3Bdargestellt. Die morphometrische Analyse distaler Lungenarterien zeigt eine signifikante Zunahme der medialen Dicke bei Hypoxie/SU5416-behandelten Mäusen im Vergleich zu Normoxia-Tieren (Abbildung 3).
Die erhöhte Nachbelastung führt zu RV-Hypertrophie und mit fortschreitender Erkrankung zu RV-Fibrose9,15. RV-Hypertrophie kann morphometrisch beurteilt werden, indem der Fulton-Index (RV/LV+Septum) sowie die Kardiomyozyten-Hypertrophie (CM) gemessen werden. Das Gewichtsverhältnis des rechten Ventrikels (RV) zum linken Ventrikel (LV) plus Septum [RV/(LV+S)] wird als Index der rechten ventrikulären Hypertrophie berechnet. Repräsentative Ergebnisse des Fulton Index bei Hypoxie/SU5416 und Normoxia-Mäusen sind in Abbildung 4Bdargestellt. Das hier beschriebene Verfahren zur Beurteilung der CM-Hypertrophie ist die Färbung rechtsventrikulärer Abschnitte mit Weizenkeim Agglutinin (WGA). WGA bindet an Glykoproteine der Zellmembran und kann zur Bestimmung des Querschnittsbereichs der Myozyten16,17verwendet werden. Repräsentative Bilder von rechtsventrikulären Abschnitten, die mit WGA befleckt sind, sind in Abbildung 4Adargestellt. Quantifizierungen des CM-Bereichs bei erkrankten und Kontrollmäusen sind in Abbildung 4A dargestellt. Hypoxie/SU5416-Exposition führt zu einer deutlichen Zunahme der Kardiomyozytengröße und der rechtsventrikulären Hypertrophie (Abbildung 4). Wir und andere haben zuvor gezeigt, dass Hypoxie/SU5416 im Vergleich zum einzelnen Treffer (nur Hypoxie) den RV-Phänotyp5,18verschlimmert.

Abbildung 1:Überblick über die Hypoxie/SU5416-Methode. (A) Experimentelles Design für das Mausmodell Hypoxia/SU5416. SU5416 wird einmal pro Woche für 3 aufeinander folgende Wochen subkutan injiziert. (B) Schematische Darstellung des Hypoxiesystems. Der Regler erfasst und reguliert Sauerstoff in der Kammer, indem er Stickstoff durch das Gasinfusionsrohr einspritzt. (C) Chemische Struktur von SU5416. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
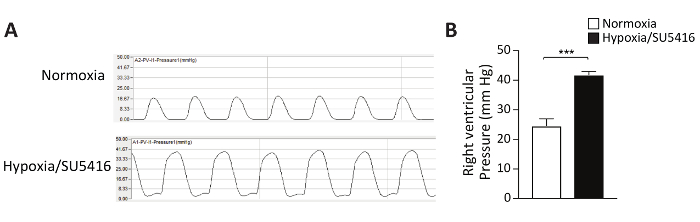
Abbildung 2: Rechter ventrikulärer Druck bei Mäusen, die einer chronischen Hypoxie in Verbindung mit der SU5416-Injektion ausgesetzt sind. (A) Repräsentative Rückverfolgungen von invasiven Druckmessungen des rechten Ventrikels (RV). (B) RV-Systolischer Druck bei Hypoxie/SU5416-Mäusen und Kontrolltieren, die Normoxien ausgesetzt sind. n = 6-8 Mäuse pro Gruppe. p < 0,001. Alle quantitativen Daten werden als Mittel ± SEM gemeldet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
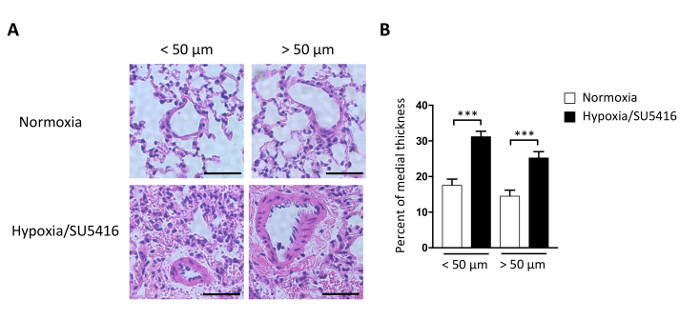
Abbildung 3: Hypoxie/SU5416 induziert eine pulmonale Gefäßumgestaltung. (A) Repräsentative Hämatoxylin/Eosin-gefärbte Abschnitte der Lunge aus den angegebenen Gruppen zeigen eine erhöhte Medienwanddicke in Denmonarterien von Hypoxie/SU5416-Mäusen. Maßstabsleiste: 50 m. (B) Prozentsatz der arterienmittleren Dicke in Bezug auf den Querschnittsdurchmesser. n = 5 Mäuse pro Gruppe. p < 0,001. Alle quantitativen Daten werden als Mittel ± SEM gemeldet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
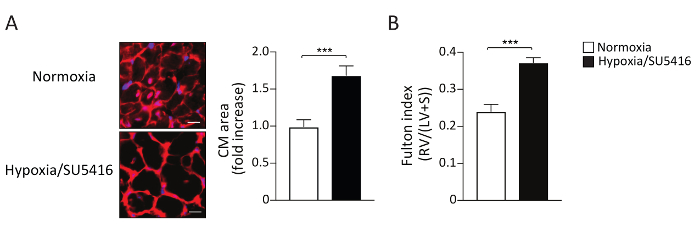
Abbildung 4: Rechtsventrikuläre Hypertrophie bei Mäusen, die einer chronischen Hypoxie in Verbindung mit der SU5416-Injektion ausgesetzt sind. (A) (links) Vertreter WGA (Wheat Germ Agglutinin) Färbung des rechtsventrikulären Gewebes nach der angegebenen Behandlung. Maßstabsleiste: 50 m. (Rechts) Quantitative Analyse der Daten. n = 5 Mäuse pro Gruppe. (B) RV-Hypertrophie, die durch das RV-Gewicht über LV plus interventrikuläres Septum (S) Gewichtsverhältnis (Fultonindex= RV/LV+ S) in jeder Gruppe reflektiert wird. n = 8 Mäuse pro Gruppe. p < 0,001. Alle quantitativen Daten werden als Mittel ± SEM gemeldet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt, wie man PH bei Mäusen modellieren kann, indem man zwei pathologische Reize kombiniert: chronische Hypoxie und SU5416-Injektion (Hypoxie/SU5416)18. Um dieses Mausmodell mit der menschlichen PH-Bedingung zu korrelieren, muss man sich unweigerlich die aktuelle PH-Klassifikation ansehen, die in Tabelle 1dargestellt ist. PH in fast allen Formen ist durch pulmonale Vasokonstriktion und abnorme Proliferation von endothelialen und glatten Muskelzellen gekennzeichnet. Dies führt zu erhöhtem Druck in den Lungenarterien und damit zu erhöhter Nachbelastung der rechten Herzkammer.
Jeder Versuch, ein Tiermodell von PH zu charakterisieren, sollte Beweise für die histopathologische Umgestaltung der Lungenvaskulatur und der rechten Herzkammer enthalten. Das Single-Hit-Hypoxie-Maus-Modell führt zu einer milden Form der Vaskulatur-Umgestaltung2,3. Diese pathologischen Befunde umfassen die Muskulatur von zuvor nicht-muskulären Gefäßen, begleitet von Endothelzellen, glatten Muskelzellen und Fibroblastenproliferation. Diese Befunde werden durch die Zugabe des zweiten Treffers (SU5416-Injektion) verschlimmert. Die Effekte sind im Single-Hit-Modell (Hypoxie) reversibel und im Hypoxia/SU5416-Modell nur teilweise reversibel.
Die Haupttodesursache für PH-Patienten ist das rechte ventrikuläre Versagen (RVF)4,20. Lungengefäßumbau in Tiermodellen wird nicht immer von RVF begleitet. Um ein Tiermodell in Bezug auf RVF zu charakterisieren, sollten morphologische, funktionelle und molekulare Daten analysiert werden. Letzteres geht über den Rahmen dieses Protokolls hinaus. Die morphologische Remodellierung von RV umfasst sowohl makro- als auch mikroskopische Aspekte. Auf makroskopischer Ebene ist der Hauptindex für RV-Hypertrophie der Fulton-Index, definiert als das Gewicht von RV geteilt durch das linke ventrikuläre (LV) und Septum (S) Gewicht (RV/LV+S). Auf mikroskopischer Ebene können Fibrose, Entzündungen und Hypertrophie durch Sirius-Rot-, Hämatoxylin-/Eosin- bzw. WGA-Färbung beurteilt werden.
Das Mausmodell Hypoxia/SU5146 (das hier beschrieben wird) zeigt eine RV-Dysfunktion, gemessen an erhöhten systolischen Drücken und morphologischen Kriterien. In Bezug auf die pulmonale Vaskuläre Remodellierung wird die mediale Hypertrophie drei Wochen nach Beginn des Protokolls beobachtet. Im Vergleich zum Hypoxie/SU5416-Modell bei Ratten verursacht das Mausmodell kein RV-Versagen (nur moderate Dysfunktion), führt nicht zu einer schweren obliterativen Angiopathie, wie sie bei schwer kranken Menschen beobachtet wird, und die Lungenpathologie verbessert sich nach der Rückkehr zur Normoxie. Insgesamt eignet sich das Mausmodell Hypoxie/SU5416 zur Nachahmung von Gefäßverletzungen wie in PH, überwiegend Gruppe I (teilweise Gruppe III, siehe Tabelle 1)1,19. Der Vorteil dieses Modells ist die Anwendung bei wildlebenden (genetisch unveränderten) Mäusen, die relativ einfache und kostengünstige Umsetzung, die relativ niedrige Sterblichkeit der erkrankten Tiere und die schnelle Entwicklung der Krankheit von Interesse (3 Wochen). PH-Präventions- und Therapiestudien lassen sich in diesem Modell problemlos umsetzen, ohne dass im Gegensatz zu chirurgischen Nagetiermodellen fortgeschrittene Fähigkeiten erforderlich sind.
Bei der Implementierung des Protokolls gibt es einige kritische Schritte, die man beachten sollte. Bei der Planung der Studie sollte man bedenken, dass in der Hypoxie/SU5416-Gruppe die Sterblichkeit der Tiere zwischen 0-10% schwankt (unveröffentlichte Beobachtungen). Um statistische Leistung zu erreichen und untermotorisierte Studien zu vermeiden, werden daher mindestens 10 Mäuse pro Gruppe empfohlen. Die Löslichkeit von SU5416 ist gering. Daher müssen DMSO oder ein anderes Lösungsmittel (z.B. Carboxymethylcellulose, CMC) verwendet werden. DMSO in hohen Dosen kann toxisch sein. Die LD50 für die subkutane (s.c.) Anwendung bei Mäusen wurde als 13,9 - 25,6 g/kg21,22berichtet. LD50 ist definiert als die Dosis, die erforderlich ist, um 50% der Mitglieder einer getesteten Population nach einer bestimmten Testdauer21,22abzutöten. Für eine Maus, die 25 g wiegt, werden 4,4 g/kg DMSO verwendet (Berechnungen basierend auf dmSO-Dichte von 1,1 g/ml und 0,1 ml angewendet s.c./maus). Daher ist die subkutan verabreichte Dosis viel niedriger als der LD50-Wert. In unseren Händen kann die Anwendung von SU5416, wie hier beschrieben, in DMSO gelöst, in einigen Fällen Hautreizungen verursachen, aber es werden keine anderen toxischen Wirkungen beobachtet. Mehrere Berichte empfehlen jedoch die Verwendung von CMC als alternatives Fahrzeug zu SU541614. Bei der Durchführung der RV-Funktionsmessungen ist bei der Körpertemperatur, Blutung und Der Tiefe der Anästhesie, wie durch das Testen der Mausreflexe beurteilt, besondere Aufmerksamkeit zu schenken. Die hier beschriebene offene Brusttechnik zur Beurteilung des RV-Drucks hat den Vorteil, dass sie auch von einem unerfahrenen Anwender problemlos umgesetzt wird. Die Methode der geschlossenen Brust (an anderer Stelle beschrieben23,24,25) hat den Vorteil, weniger invasiv zu sein und kann daher auch in nicht-terminalen Experimenten eingesetzt werden. Es erfordert jedoch ein hohes Maß an Fachwissen.
Nach der ersten Beschreibung des Modells Hypoxia/SU5416 bei Ratten wurde das Mausmodell in mehreren Studien erfolgreich eingesetzt5,9,13. Es gibt jedoch Hinweise darauf, dass die Ergebnisse vom genetischen Hintergrund und Geschlecht der Mäuse, dem Hersteller von SU5416 und der Häufigkeit der SU5416-Injektion26abhängen. Während die Injektion von SU5416 über drei aufeinanderfolgende Wochen zu PH bei Mäusen führt, würde eine Einzeldosis PH4nicht induzieren. Darüber hinaus erfordern andere Formen von PH, wie z. B. solche, die mit linken Herzerkrankungen oder aufgrund chronischer thromboembolischer Erkrankungen verbunden sind, ätiologische Modelle. Neue Therapien sollten in mindestens 2 verschiedenen Tiermodellen getestet werden, bevor sie den Weg zu translationalen Studien ebnen können.
Offenlegungen
Die Autoren haben nichts zu erklären.
Danksagungen
Diese Arbeit wurde durch Stipendien der American Heart Association (AHA- 17SDG33370112 und 18IPA34170258) und der National Institutes of Health NIH K01 HL135474 an Y.S. O.B. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
Referenzen
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten