Method Article
低酸素/SU5416モデルを用いたマウスにおける肺高血圧の誘導と特徴づけ
要約
このプロトコルは、低酸素症への暴露およびVEGF受容体拮抗薬の注射に基づくマウスにおける肺高血圧(PH)の誘導について説明する。動物は、プロトコルの開始から3週間後にPHおよび右心室(RV)肥大を発症する。モデルの機能的および形態的特徴付けも提示される。
要約
肺高血圧症(PH)は、右心カテーテル法によって評価されるように、安静時25mmHgを超える平均肺動脈圧によって定義される病態生理学的状態である。疾患の広いスペクトルは、病因、病理組織病理学、臨床提示、予後、および治療への応答で異なるPHにつながることができます。過去数年間で大きな進歩を遂げたにもかかわらず、PHは未硬化の病気のままです。根本的なメカニズムを理解することは、新しい治療法の開発への道を開くことができます。動物モデルは、この目標を達成するための重要な研究ツールです。現在、PHの再現に使用できるモデルがいくつかあります。このプロトコルは、2 ヒット マウス PH モデルについて説明します。PH開発の刺激は、血管内皮増殖因子(VEGF)受容体アンタゴニストであるSU5416の低酸素および注射である。低酸素/SU5416の開始から3週間後、動物はヒトPH(主に1群)で観察された組織病理学的変化を模倣した肺血管改修を発症する。肺循環における血管の再モデリングは、右心室(RV)のリモデリングをもたらす。RV圧(開胸法を用いた)、RVの形態測定(心室の両方を解剖し、計量すること)および改造の組織学的評価(血管再造形と心臓の両方を評価して、RV心筋細胞肥大および線維症を評価することによって肺)を詳細に説明する。このプロトコルの利点は、野生型と遺伝子組み換えマウスの両方での適用の可能性、比較的容易かつ低コストの実装、および対象疾患の迅速な開発(3週間)である。この方法の制限は、マウスが重度の表現型を発症しないことであり、PHはノルモキシアに戻ると可逆的である。予防は、治療研究と同様に、(外科げっ歯類モデルとは対照的に)高度なスキルの必要性なしに、このモデルで容易に実施することができる。
概要
肺高血圧症(PH)は、右心カテーテル法,1,2によって評価されるように、平均肺動脈(PA)圧が安静時25mmHgを超える状態で定義される病1態生理学的状態である。PHに至る病気はさまざまです。PH関連条件を整理する試みとして、いくつかの分類システムが開発されました。現在の臨床分類は、複数のPH関連疾患を5つの異なるグループ1に分類する。この区別は、患者の様々なグループが臨床提示、病理、予後、および治療2に対する応答において異なる疾患を有するので重要である。表1は、各疾患の基本的な病理的特徴を補完する現在の分類を要約する。
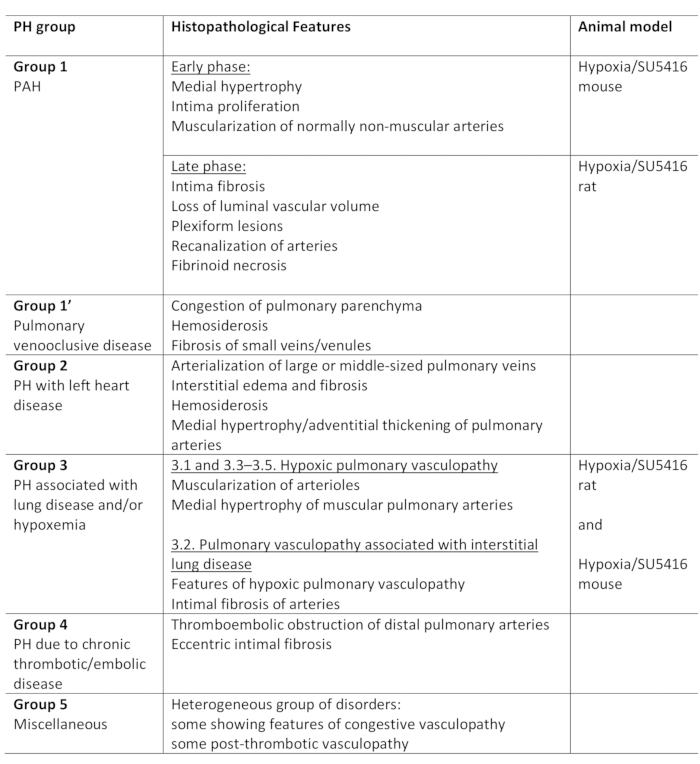
表1:グループ内の主な組織病理学的特徴とともに、PHの臨床分類の概要。低酸素/SU5416プロトコルのモデル化PHに適しています。このテーブルは19から変更されています。PH: 肺高血圧症,PAH:肺動脈性高血圧
PH関連疾患の治療の著しい進歩にもかかわらず、PHは治癒なしで残っており、3年の死亡率は20%から80%の間に30%の範囲である。これは、PHの根本的なメカニズムを理解し、その後、予防し、進行を遅らせ、病気を治す新しい治療法の開発に不可欠な必要性を示しています。動物モデルはこの範囲にとって極めて重要です。現在、PHを研究するために様々なモデルが存在する。興味のある読者は、このトピック2、3、43に2関する優れたレビューを4参照しています。PHに至る様々な疾患を念頭に置いて、ヒトPHの多様な状態を1つの動物モデルで完全に再現できないことは明らかです。利用可能な動物モデルは、i)シングルヒット、ii)2ヒット、iii)ノックアウト、およびiv)過剰発現モデル3に分類することができます。シングルヒットモデルでは、PHは単一の病理学的刺激によって誘発され、2つのヒットモデルはより重篤なPHを誘導し、複雑なヒト疾患をより密接に模倣することを目的とした2つの病理学的刺激を組み合わせる。病因学的な違いに加えて、いくつかの刺激は動物の種および遺伝的背景にも依存するPHモデリングの違いをもたらす4。
最も一般的に使用される古典的なPHげっ歯類モデルの1つは、慢性低酸素モデル2です。低酸素症は、ヒトだけでなく、いくつかの動物種においてPHを誘導することが知られている。低酸素症は、PHに対する生理学的刺激であるという利点を有する(表1)。しかし、げっ歯類のPHを誘導するために使用される低酸素症の程度は、ヒトよりもはるかに重篤であるが、単一の侮辱(低酸素)は、血管のリモデリングの軽度の形態にしか導かない。これは、人間の病気の重症度を模倣しません。第二ヒットの添加は、PHを誘導するための余分な刺激であり、有望な結果を示した:低酸素刺激と結合されたげっ歯類への化合物SU5416の注入は、より重度のPH表現型22、5、65,6を誘導する。SU5416は血管内皮増殖因子(VEGF)受容体-2の阻害剤である。それはVEGF受容体をブロックし、内皮細胞アポトーシスにつながる.低酸素条件下では、これはアポトーシス耐性内皮細胞のサブセットの増殖を刺激する。さらに、SU5416は平滑筋細胞増殖をもたらす。これらの効果の組み合わせは、肺循環の病理学的血管リモデリングをもたらし、PA圧力の上昇および右心室リモデリング22、5、75,7をもたらす。このモデルは、まずラット6で説明され、後でマウス4、5、75,に適用された。4マウスモデルは、ラットに比べて重症の血管リモデリングを呈する。さらに、ノルモキシアに戻すと、ラットではPHが進行し続け、一方マウスでは部分的に可逆性である。
以下のプロトコルは、低酸素/SU5416法(計画、タイムライン、実行)を用いてマウスでPHをモデリングするためのすべてのステップを説明する。さらに、モデルの特性評価は、このプロトコルに記載されています:機能的に(開胸技術を使用して右心室(RV)圧力を侵襲的に測定することによって、形態論的(左右の心室の両方を解剖して計量することによって)、組織学的(肺血管リモデリング、右心室心筋肥大および線維症を評価することによって)
このプロトコルで説明されているすべての手順と方法は、どの経験レベルでも調査担当者が簡単に実装できます。オープンチェスト技術(ここで説明)を用いたRVの機能測定は、現場でのゴールドスタンダード法ではないが、経験の浅い実験者でも迅速に学習し、正確に再現できるという利点を有する。
プロトコル
動物実験の前に、地元の機関動物ケア委員会の認可を得る。現在の実験は、シナイ山のイカーン医学部の施設動物ケア・使用委員会(IACUC)の承認を得て行われました。
1. PH誘導
- 準備
- 研究を始める前に、慎重に実験計画を立ててください。最初のSU5416注射と同時に、マウスが低酸素症に供されることを確認してください。低酸素/SU5416法を用いてPHを誘導するための実験計画の一例を 図1Aに示す。制御マウスは車両のみを受け取った。このモデルでは、SU5416を3週連続で週に1回マウスに注射する。
- この研究には8〜12週齢のC57BL/6マウスを使用する。12-hの明暗サイクルで18-20 °Cで動物を収容する。食べ物と水がアクセス可能な アドリビタムであることを確認します。
- 動物の重量を量る。ノルモキシアと低酸素/SU5416:各グループにランダムにそれらを割り当てます。
- 図1B.安全な窒素(N2)タンクに示すように、2低酸素室をチャンバー近くに準備します。酸素(O2)コントローラを10%O2の点にセット2する。システムを安定状態にします。
- 注射用のSU5416を準備します(体重20mg/kgの用量を使用してください)。SU5416は水溶液に溶解しません。したがって、計算量を100 μL DMSO8に溶解します。例えば、25gマウスの場合、注入されるSU5416の量は、100μL溶媒(DMSO)に溶解した0.5mgである。このマウスのSU5416の最終濃度は、したがって、5 mg/mLです。
注意: SU5416 は危険物です。製品に付属の安全データシートをよく読み、この物質を取り扱う際には必ず推奨の注意事項を取ってください。保護手袋を着用し、(注射用)目の保護を使用してください。SU5416の化学構造を図1Cに示す。
注:溶液の適切な過剰を計算して、注入中に失われるボリューム(注射器、バイアルなど)を補正します。使用するシリンジに応じて、デッドボリュームは約200μLです。10匹のマウスのグループについて、2回のマウス投与量を超えて計算する。 - 注射用注射器を準備します。25 G x 5/8 インチ針で 1 mL の注射器を使用してください。
- SU5416皮下注射
- 動物を拘束します。ケージの蓋にマウスを置き、拘束を助けます。皮膚をつかみ、背骨に平行にテントを形成する。マウスによる咬傷の可能性を避けるために、頭の後ろをつかむことを確認してください。
注:2人の研究者の存在は、一方が動物を保持し、もう一方が注射を行うことができるので、手順をより速く、より正確にします。 - 皮膚の緩い折り目で脇腹の上に皮下に針を挿入します。針を皮膚に平行に挿入してください。腹壁に浸透しないようにしてください。
- シリンジの内容(溶解したSU5416または車両の100 μL)を注入します。
注:完全な配達後に漏れを避けるために、注射器を約10 s保持し、針を皮膚の下でわずかに回転させます。 - 針を引き出し、ケージに動物を戻します。SU5416注入後、換気された低酸素室にケージを入れます。
- 動物を拘束します。ケージの蓋にマウスを置き、拘束を助けます。皮膚をつかみ、背骨に平行にテントを形成する。マウスによる咬傷の可能性を避けるために、頭の後ろをつかむことを確認してください。
- 低酸素症への暴露
- 時間をかけて換気を監視します。酸素供給の10%を維持することを確認してください。21%O2で半密閉可能なチャンバーでノルモキシア動物を維持する。
- チャンバーに酸素レベルを測定する酸素センサーが装備されていることを確認します。チャンバーの広範な開口部を避けてください。清掃と食品や水を追加するために、3日ごとに20分以上のチャンバーを開きます。
- 毎日動物を検査します。ピロ勃起や体重の大幅な減少などのストレス信号を考えてみましょう。
注意:低酸素/SU5416の下の動物は体重5を失うことが期待されています。これは病気の発症を示す指標です。 - 連続して 3 週間連続して毎週 SU5416 注入を繰り返します (実験計画の概要については 、図 1A を参照)。
注:注射部位を変化させることは、皮膚刺激を軽減するのに役立ちます。
2. 侵襲的RV圧力測定による機能特性評価
- 準備
注: 麻酔体制を選択します。注射可能または吸入可能な麻酔薬を使用することができる。注射用麻酔薬のわずかな過剰摂取(特にケタミン/キシラジンまたはペントバルビタールから)が心臓機能に大きな影響を与える可能性があるため、揮発性麻酔薬の使用が推奨されます。研究内のすべてのマウスに同じ麻酔薬を使用することは非常に重要です。- 動物ごとの正確な麻酔薬の線量を保証するために気化器を使用してください。イオブルランの用量は以下の通りである:誘導3〜4%、維持1%が100%酸素と混合した。
注:個人用保護具を着用し、蒸気を吸い込むのを避けてください。 - 体温を維持するために、加熱パッドや温ランプを用意してください。体温を監視するための直腸温度プローブを準備します。
- 適切な換気を確認してください。事前に人工呼吸器を用意してください。Yチューブコネクタを用意し、手動モードで人工呼吸器の機能を確認します。圧的な外傷を避けるために、吸気圧が<1cmH2Oであることを確認してください。呼吸数を110呼吸/分に設定します。
- 20Gの血管内カテーテルを切断して気管内チューブを準備します。
- 必要な器具を準備する:小さな鉗子、はさみ、弾性フックレトラクター、容器の焼灼器、綿棒。綿棒で右心室に小さな穿刺を作るために使用される小さい25 G x 5/8"針を調節する。
- 圧力カテーテル、圧力容積制御ユニットを準備し、データ取得ソフトウェアを開始します。37°CでPBSを充填した15 mLチューブにPVカテーテルを15分間置き、メーカーのプロトコルに従ってキャリブレーションします。
- 臓器の灌流と固定のために、PBSと50%PBS / 50%OCTの溶液を調製し、2 x 10 mL注射器(25G針付き):1つは心臓と肺を PBSで 浸透させるために使用され、2番目のものは彼の検査に使用される肺標本にOCT / PBS(50/50)溶液を注入するために使用されます。
- 動物ごとの正確な麻酔薬の線量を保証するために気化器を使用してください。イオブルランの用量は以下の通りである:誘導3〜4%、維持1%が100%酸素と混合した。
- 挿管
- マウスの重量を量り、麻酔前に健康状態を記録します。
- 3-4%のイオブルランで麻酔を誘発する。つま先ピンチ反射をテストすることによって麻酔の深さをチェックしてください:手足のつま先をしっかりとつまみます。動物が手足を引き出した場合、それは不十分な麻酔の徴候である。
- 麻酔の誘導後、首と胸部を剃ります。
- マウスを加熱パッドに置きます。体温を監視するための直腸温度プローブを設置します。
メモ:体温の維持は機能測定のために重要である。体温は約36.5~37 °Cです。 - 湾曲した鉗子を使用して、マウスの上部の切り口に縫合糸を取り付け、外科テープで加熱パッドに伸ばして固定する。手術用テープを使用して、マウスの手足を固定します。
- 動物を挿管するために小さいはさみを使用して内側頸部の皮膚に約1cmの小さな切開を行います。
注: 口腔挿管は、より多くの経験を必要とする代替方法です。 - 綿先端のアプリケーターは、中間レベルの耳下腺と下顎下唾液腺をぶっきらぼうに分離する。これは気管の上に筋肉を露出します。.
- 気管を露出するこれらの筋肉を慎重にカットします。
- 小さいはさみで気管軟骨の間に小さな切開を行い、準備された気管チューブを挿入します。血管内カテーテルの金属ガイドを取り出します。
- カテーテルを人工呼吸器に接続します。手動で肺を静かに膨らませて気管管の位置を確認します。テープでポジションを固定します。
- 処置を通して1%のイオブルラン麻酔を維持する。
- つま先ピンチ反射をテストすることにより、定期的に麻酔の深さを監視します。それに応じて麻酔を調整します。
注:実験中の推奨心拍数は、1%イオブルラン麻酔下で、約400拍/分です。心拍数を制御するためには体温や麻酔の維持が不可欠です。イオブルランの過剰は心拍数を減少させることができます.しかし、回収はイオブルラン速度を低下させることによって達成できる。
- RV圧力測定(オープン胸部アプローチ)
- 小さいはさみでは、xiphoidプロセスと上腹部部分の上に約1cmの皮膚切開を行います。胸部を覆う皮膚と腹部の腹部の腹部の壁を分離する:中央線から始まり、xiphoidに遠位し、両側を慎重に横方向に動かす。出血を制御するために熱コータリーを使用してください。
注: 目標は、腹壁を通って胸腔にアクセスすることです。 - 腹腔を開き、鼓動する心臓や肺を傷めないように注意して、慎重に横隔膜を切断します。
注:目標は、心臓の頂点と右心室を露出することです。良好な露出および心臓の眺めはカテーテルの正しい配置のために重要である。手順全体の出血を避けることは非常に重要です.小さな空の体積変化でも右心の負荷が変化し、記録されたパラメータに影響を与える可能性があります。 - 綿状のアプリケーターを使用して心膜をそっと取り除きます。
- 心臓に圧力カテーテルを置く直前に、カテーテルをマウスの隣に持って来てください。
- 針で準備された綿先端アプリケーターを使用すると、右心室の先端遠位部分に刺し傷が生じさせる。慎重に針を取り外し、この穴に圧力カテーテルを挿入します。
注: これは力を加えずに動作するはずです。これが不可能な場合は、心臓の延長傷害を避けるために、最初の穴の近くに新しい穴を作ってみてください。針は約3mmより深く挿入してはならない。 - 右心室の方向に平行に圧力カテーテルを挿入し、先端を肺動脈に向けます。
- 圧力波トレースを監視し、カテーテルの正しい位置を確認します。代表的なトレースは、 図 2に示されています。
- 圧力信号が安定するようにします。呼吸を一時停止し、少なくとも3つの測定値を得る。個々の測定の間に動物が換気されることを可能にする。
- すべての測定が記録されたら、カテーテルを取り除き、水浴中のPBS充填チューブに戻します。
メモ:実験が完了したら、メーカーの指示に従ってカテーテルを清掃してください。
- 小さいはさみでは、xiphoidプロセスと上腹部部分の上に約1cmの皮膚切開を行います。胸部を覆う皮膚と腹部の腹部の腹部の壁を分離する:中央線から始まり、xiphoidに遠位し、両側を慎重に横方向に動かす。出血を制御するために熱コータリーを使用してください。
- 安楽死と肺灌流
- 実験が完了すると、マウスを排泄して安楽死させる。
- 胸を広く開きます。はさみを使用して、胸骨全体を切断し、心臓や肺を傷めないように注意してください。
- 虹彩はさみを使用すると、血液がチャンバーを離れることができるように左心室に小さな切開を行います。
- 右心室に10mLのPBSを含む注射器の25G針を入れ、肺が血液を取り除くまでPBS溶液を注入する。
- このステップが完了したら、重要な組織収穫(心臓と肺)によって安楽死を確認する:カバと大動脈の付着物を切断し、心臓と肺 をブロックで取り除く。
3. 形態評価
- 心臓と肺を取り除いた直後(ステップ2.4.5)、心臓を分離し、両方の心房を取り除く。曲がった手切除ハサミで、左心室(LV)から右心室(RV)を慎重に解剖し、中隔(S)を左心室に残す。RVとLV +Sの重量を量り、フルトン指数= RV / LV + S (図3)5,95を9計算する。
- 右心室の一部を取り、OCTプレフィル充填埋め込み型に配置します。右心室の他の部分をRNAやタンパク質分析に使用します。ドライアイスで凍結し、-80°Cで保管してください。
- 虹彩はさみを使用して、心臓および他の残りの組織から肺を隔離する。
注:肺の準備のために、上記のような灌流(ステップ2.4.3-2.4.5)は非常に重要です。 - 肺の一部を凍結し、RNA、タンパク質抽出または他のアッセイのためにそれを保存します。
- 組織学的分析のために肺の他の部分を使用してください。この目的のために、使用されたローブ10、11,11の気管支に50%PBSおよび50%OCTを含むシリンジを挿入する。実験者は、注射器の含有量が組織に浸透すると肺が膨張することを容易に見ることができる。
- これらの肺片をOCTで事前に充填した埋め込み型に入れ込み、ドライアイスで凍結します。冷凍後、-80°Cで保存してください。
- クライオスタットマシンを使用してRVと肺の8μmセクションを準備します。空気は30分間室温でセクションを乾燥させます。
- 10分間パラホルムアルデヒド(PFA)を使用して室温でスライドを固定します。
注:PFAは既知のヒト発がん性物質です。化学発煙フード、適切な手順、および個人用保護具を使用して、暴露リスクを低減します。詳細については、材料安全データシート(MSDS)を参照してください。 - ヘマトキシリン/エオシン染色による血管リモデリング評価
注:肺の心臓および血管のリモデリングの構造変化を評価するために、ヘマトキシリン/エオシン染色を行う(図3)。- ヘマトキシリン溶液で8分間染色する。
- 水道水を5分間流し、蒸留水で素早くすすい水を流します。
- 95%のEtOHで1分間、エオシン溶液で1分間の反染色でリンスします。
- 脱水(80%エタノール10-30 s、100エタノール1分間、100%トルオール3分間)
- カバースリップで取り付け、カバーします。スライドを室温で一晩乾燥させます。
注: 染色に使用するソリューションは危険な場合があります。化学発煙フード、適切な手順、および個人用保護具を使用して、暴露リスクを低減します。詳細については、MSDS を参照してください。
- ピクロシリウス赤染色による右心室線維症評価
注:ピクロシリウスレッド染色では、酸であるピクロシリウスレッドは、コラーゲン12に結合します。従って、この染色はコラーゲン含有量の組織学的検査に用いることができる。- 58°Cで予熱されたブイン溶液でスライドを1時間インキュベートします。
- スライドを水道水で洗い、10〜15分間セクションから黄色の色を取り除きます。
- 0.1%の速い緑で室温で20分間汚す。
- 1%酢酸で1分間リンスします。
- 水道水で5分間すすいでください。
- 0.1%シリウスレッドで室温で30分間染色し、続いてトルオールで脱水症状を起こす。
注意: 染色に使用するソリューションは危険な場合があります。化学発煙フード、適切な手順、および個人用保護具を使用して、暴露リスクを低減します。詳細については、MSDS を参照してください。
- WGA染色によるRV心筋細胞肥大症評価
注:細胞レベルでの右心室(RV)の肥大は、小麦胚芽凝集剤(WGA)染色を行うことによって評価することができる(図4)。- 冷たいアセトン溶液でスライドを15分間固定し、その後3ステップのPBSで洗浄します(各5分)。
- ダコ溶液中の10%のヤギの血清を室温で30分間ブロックします。
- WGAでスライドをインキュベートする:WGA 1:200を追加し、暗闇の中で37 °Cで1 1/2時間インキュベートします。
- PBSで3回スライドを洗います。
- 核酸染料でスライドをインキュベートします。
- PBSで3回スライドを洗います。
- 取り付けのために、液体の過剰を取り除き、取り付け媒体およびカバースリップを適用する。暗い場所で室温で1時間スライドを乾かして、4°Cで保管してください。
注: 染色に使用するソリューションは危険な場合があります。化学発煙フード、適切な手順、および個人用保護具を使用して、暴露リスクを低減します。詳細については、MSDS を参照してください。
- さらに、具体的に血管のリモデリングを評価するために肺の免疫化学を行います.例えば、平滑筋細胞染色は血管の筋肉質化を評価するのに使用でき、フォン・ヴィルブランド因子染色は内皮変化を視覚化するために使用することができる。これらのメソッドは、他の 5 で説明されています。
結果
本プロトコルでは、マウスにPHを誘導する低酸素/SU5416モデルの作成について詳細に説明する。さらに、観察期間の終わりに肺血管および心臓評価を行うための必要なステップをすべて詳述する。
このモデルの実験計画の概要を、図1A13,,14に示します。マウスは、ノルモバリック低酸素症(10%O2)2を受け、週に1回、SU5416を3週連続で皮下注射する。このプロトコルでPHを誘導するために使用される刺激は、図1Bおよび1Cに示されている。
VEGF受容体拮抗薬SU5416は、内皮細胞アポトーシスを引き起こすことによって作用し、したがって、アポトーシス耐性内皮細胞の増殖を可能にする。これは、肺血管系における血管の再モデリングと血管抵抗の増加を引き起こし5.肺循環の上昇圧力はRV後負荷を増加させ、RV機能障害および障害9に徐々に導く。最初のステップでは、視察期間の終わりにRV機能を機能的に評価することによって、低酸素/SU5416プロトコルの成功を評価することができます。本プロトコルでは、オープンチェストRV圧測定法を用いたRV収縮圧の侵襲的評価について詳細に説明する。右心室圧の代表的な圧力曲線と定量分析を 図2に示す。
血管抵抗の上昇と結果的にPHにつながる血管リモデリングを定量化するにはどうすればよいでしょうか。糸離散病は肺血管系を特徴付けるためのゴールドスタンダードである。このプロトコルでは、ヘマトキシリン&エオシン染色(H&E)プロトコルについて詳しく説明します。画像を染色して捕獲した後、肺動脈は小さい(<50 μm)およびより大きい(>50 μm)で区別することができる。気管支動脈は我々の研究から除外された。内側の厚さを評価するために、外的(ED)、ならびに動脈の内径(ID)が測定される。低酸素/SU5416治療後の改造された肺動脈の代表的な画像を図3Aに示すFigure 3B。遠位肺動脈の形態学的分析は、ノルモクシア動物と比較して低酸素/SU5416処置マウスにおける内側の厚さの有意な増加を示す(図3)。
増加した後負荷はRV肥大につながり、疾患が進行するにつれてRV線維症99、15に至る。RV肥大はフルトン指数(RV/LV+隔壁)を測定し、心筋細胞(CM)肥大を測定することによって形態測定することができる。左心室(LV)と中隔[RV/(LV+S)]に対する右心室(RV)の重量比は、右心室肥大の指標として計算されます。低酸素/SU5416およびノルモキシアマウスにおけるフルトン指数の代表的な結果を図4Bに示す。CM肥大を評価するためにここで説明する方法は、小麦胚芽凝集剤(WGA)を有する右心室切片の染色である。WGAは細胞膜の糖タンパク質に結合し、筋細胞16,17,17の断面積を決定するために使用することができる。WGAで染色された右心室セクションの代表的な画像を図4Aに示します。疾患マウスおよび対照マウスの両方におけるCM領域の定量化は、図4A.低酸素/SU5416暴露結果が心筋細胞サイズおよび右心室肥大の顕著な増加をもたらす(図4)。我々および他の人々は、以前に、単一のヒット(唯一の低酸素)と比較すると、低酸素/SU5416はRV表現型55、1818を悪化させることを示している。

図1: 低酸素/SU5416法の概要(A) 低酸素/SU5416マウスモデルの実験計画SU5416は、3週連続で週に1回皮下注射される。 (B) 低酸素系の模式的表現。コントローラーはガス注入管を通して窒素を注入することによってチャンバーの中の酸素を感知し、調節する。(C) SU5416の化学構造 この図の大きなバージョンを表示するには、ここをクリックしてください。
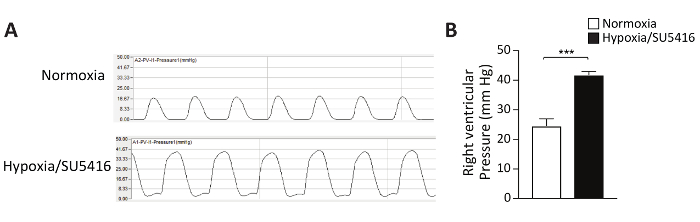
図2:慢性低酸素症に曝露したマウスにおける右心室圧をSU5416注射と組み合わせた(A)右心室(RV)の侵襲的圧力測定の代表的なトレース。(B)低酸素/SU5416マウスにおけるRV収縮期圧およびノルモキシアにさらされた制御動物n = 1群あたり6〜8匹のマウス。p < 0.001.すべての定量的データは、SEM±手段として報告されます。
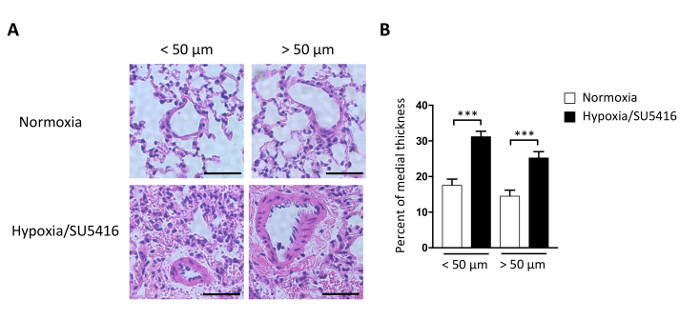
図3:低酸素/SU5416は肺血管のリモデリングを誘発する。(A) 示されたグループからの肺のヘマトキシリン/エオシン染色切片は、低酸素/SU5416マウスの肺動脈における培地壁厚の増加を示す。スケールバー:50 μm。 (B) 断面直径に関する動脈の内側の厚さの割合。n = 1群あたり5匹のマウス。p < 0.001.すべての定量的データは、SEM±手段として報告 されます。
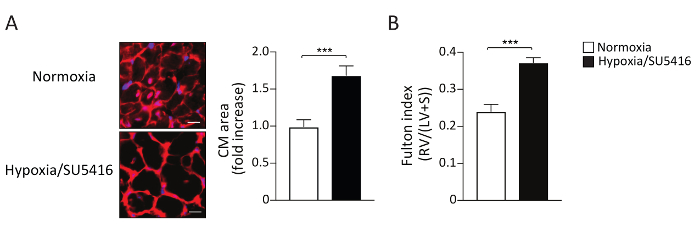
図4:慢性低酸素症にさらされたマウスにおける右心室肥大は、SU5416注射と組み合わされた。(A)(左)代表WGA(小麦胚芽凝集剤)示された治療後の右心室組織の染色。Aスケールバー:50 μm。(右)データの定量分析。n = 1群あたり5匹のマウス。(B)RV重みによって反射されたRV重みはLV+心室中隔(S)重量比(フルトン指数=RV/LV+S)を各群に加えた。n = 1群あたり8匹のマウス。p < 0.001.すべての定量的データは、SEM±手段として報告されます。
ディスカッション
このプロトコルは、慢性低酸素症とSU5416注射(低酸素/SU5416)18の2つの病理学的刺激を組み合わせることによってマウスの18PHをモデル化する方法を記述する。このマウスモデルをヒトPH状態と相関させようとする試みにおいて、必然的に現在のPH分類を見なければならない、表1に示す。ほぼすべての形態のPHは、肺血管収縮および内皮および平滑筋細胞の異常増殖によって特徴付けられる。これは肺動脈の圧力の上昇につながり、その結果、右心室の後負荷が増加する。
PHの動物モデルを特徴付けるすべての試みは、肺血管系および右心室の組織病理学的リモデリングの証拠を含むべきである。シングルヒット低酸素マウスモデルは、血管系リモデリング22、3の軽度の形態に導きます。これらの病理学的知見には、内皮細胞、平滑筋細胞および線維芽細胞増殖を伴う、以前に非筋肉化血管の筋質化が含まれる。これらの知見は、第2のヒット(SU5416注射)の添加によって悪化する。効果は、シングルヒット(低酸素)モデルでは可逆的であり、低酸素/SU5416モデルでは部分的に可逆的です。
PH患者の主な死因は右心室障害(RVF)4,204,20である。動物モデルにおける肺血管再モデリングは、RVFを伴うわけではありません。動物モデルをRVF形態学的に特徴づけるためには、機能データと分子データを分析する必要があります。後者は、このプロトコルの範囲を超えています。RV形態学的リモデリングは、マクロと顕微鏡の両方の側面を含む。巨視レベルでは、RV肥大の主な指標はフルトン指数であり、RVの重量を左心室(LV)と隔隔(S)重量(RV/LV+S)で割った値として定義される。顕微鏡レベルでは、線維症、炎症、および肥大は、シリウスレッド、ヘマトキシリン/エオシンおよびWGA染色によってそれぞれ評価することができる。
マウスの低酸素/SU5146モデル(ここで説明する)は、上昇した収縮期圧力および形態学的基準によって測定されるRV機能を示す。肺血管リモデリングに関しては、プロトコルの開始から3週間後に内側肥大が観察される。ラットの低酸素/SU5416モデルと比較して、マウスモデルはRV障害(中等度の機能不全のみ)を引き起こさない、重度の閉塞性血管症を引き起こさない、重度の病気のヒトで観察されるように、肺病理はノルモキシアに戻った後に改善する。全体として、マウス低酸素/SU5416モデルは、主にグループI(部分的グループIII、表1を参照)1、1919において遭遇した血管損傷を模倣1するのに適している。このモデルの利点は、野生型(遺伝的に未修飾)マウスでの適用、比較的容易かつ低コストの実施、疾患動物の死亡率の比較的低い、および目的の疾患の迅速な開発(3週間)である。PHの予防および療法の研究は外科げっ歯類モデルとは対照的に高度な技術の必要性なしで、このモデルで容易に、実現することができる。
プロトコルを実装する際には、重要な手順をいくつか用意します。研究を計画する際には、低酸素/SU5416群では動物の死亡率が0〜10%(未発表の観察)の間で変化することを覚えておいてください。したがって、統計的な力に達し、力不足の研究を避けるために、グループごとに少なくとも10匹のマウスが推奨される。SU5416の溶解度が低い。従って、DMSOまたは他の溶媒(例えばカルボキシメチルセルロース、CMC)を使用しなければならない。高用量のDMSOは有毒である可能性があります。マウスにおける皮下(s.c.)用のLD50は、13.9-25.6 g/kg21,22,22であると報告されている。LD50は、指定された試験期間21,22,22の後に、試験された集団のメンバーの50%を殺すために必要な用量として定義される。25 g の重さのマウスの場合、DMSO の 4.4 g/Kg が使用されます(DMSO 密度 1.1 g/mL および 0.1 mL の適用された s.c./マウスに基づく計算)。したがって、皮下投与量はLD50値よりはるかに低い。私たちの手では、ここで説明するようにDMSOに溶解したSU5416の適用は、場合によっては皮膚刺激を引き起こす可能性がありますが、他の毒性効果は観察されません。しかし、いくつかの報告では、SU541614の代替車両としてCMCを使用することをお勧めします。RV機能測定を行う場合、マウス反射をテストすることによって評価されるように、体温、出血、および麻酔の深さにおいて細心の注意を払う必要があります。RV圧を評価するためのオープンチェスト技術は、ここで説明したように、経験の浅いユーザーによっても容易に実装されるという利点を有する。閉胸法(他の23、24、25)24,25は侵襲性が低いという利点を有し、したがって、非末端実験においても実施することができる。23それは高いレベルの専門知識を必要とします。
ラットにおける低酸素/SU5416モデルの最初の記述の後、マウスモデルは、いくつかの研究55、9、139,13で正常に使用されています。しかしながら、結果はマウスの遺伝的背景および性別に依存するという証拠があり、SU5416の製造業者およびSU5416注射の頻度26。連続して3週間にわたってSU5416を注入するとマウスのPHに至るが、単回投与ではPH4を誘導しない。さらに、他の形態のPHは、左心疾患または慢性血栓塞栓症に関連するものなど、病因関連モデルを必要とする。新しい治療法は、翻訳研究への道を開くことができる前に、少なくとも2つの異なる動物モデルでテストする必要があります。
開示事項
著者は宣言するものは何もありません。
謝辞
この研究は、米国心臓協会(AHA-17SDG3370112および18IPA34170258)からの助成金によって支えられ、国立衛生研究所NIH K01 HL135474からY.S.O.Bへのドイツハーツティフトゥンによってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
参考文献
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved