Method Article
使用缺氧/SU5416模型对小鼠的肺高血压进行诱导和特征
摘要
该协议描述了小鼠肺高血压(PH)的诱导,基于暴露于缺氧和VEGF受体拮抗剂的注射。动物在协议启动3周后出现PH和右心室(RV)肥大。介绍了模型的功能和形态特征。
摘要
肺高血压 (PH) 是一种病理生理状况,由超过 25 mm Hg 的呼吸道动脉压力定义,由右心导管评估。广泛的疾病可导致PH,其病因、基础病理学、临床表现、预后和治疗反应各不相同。尽管近年来取得了重大进展,但PH仍然是一种未治愈的疾病。了解基本机制可以为开发新疗法铺平道路。动物模型是实现这一目标的重要研究工具。目前,有几个模型可用于重述PH。该协议描述了两击鼠标 PH 模型。PH发育的刺激是缺氧和SU5416的注射,一种血管内皮生长因子(VEGF)受体拮抗剂。低氧/SU5416开始三周后,动物发展肺血管重塑模仿在人类PH中观察到的组织病理学变化(主要是第1组)。肺循环中的血管重塑导致右心室 (RV) 的重塑。详细描述了测量RV压力(使用开放胸法)、RV的形态分析(通过解剖和称重两个心室)和重塑术(通过评估血管重塑和心脏评估肺功能评估)的过程。该协议的优点是,在野生型和转基因小鼠中应用的可能性,相对容易和低成本的实施,以及感兴趣的疾病的快速发展(3周)。这种方法的局限性是小鼠不发展严重的表型和PH是可逆的返回诺莫夏。预防以及治疗研究可以很容易地在这个模型中实施,而没有必要的高级技能(而不是手术啮齿动物模型)。
引言
肺高血压 (PH) 是一种病理生理状况,由平均肺动脉 (PA) 压力在休息时超过 25 mm Hg 定义,由右心导管1,2评估。有各种各样的疾病,可导致PH。为了组织与PH相关的条件,开发了几种分类系统。目前的临床分类分类的多个PH相关疾病在5个不同的组1。这种区别很重要,因为不同组的患者的临床表现、病理学、预后和治疗反应都不同。表1总结了目前的分类,并辅之以每种疾病的基本组织病理学特征。
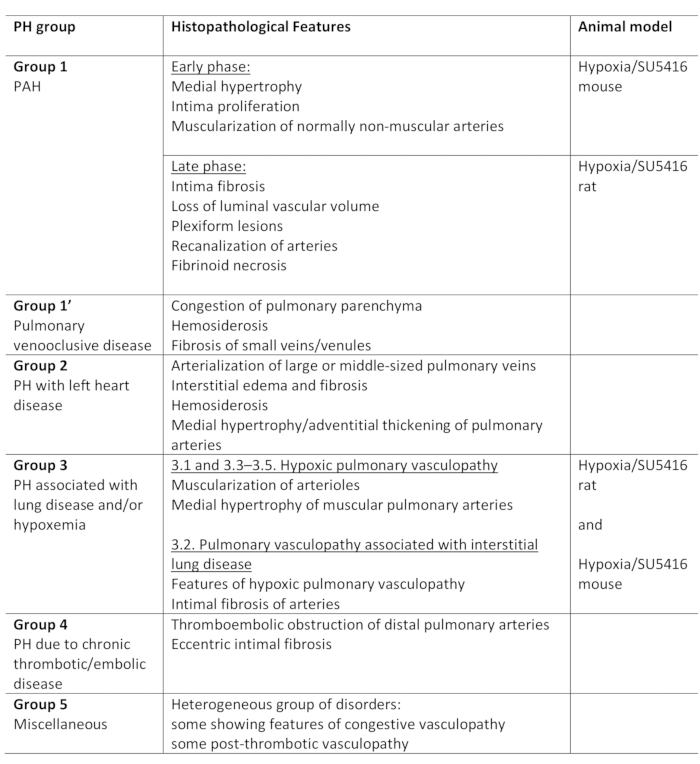
表1:PH临床分类概述,以及各组内的主要组织病理学特征。低氧/SU5416 协议的适用性,用于建模 PH。此表已从19 起修改。PH: 肺高血压, PAH: 肺动脉高血压
尽管在治疗PH相关疾病方面取得了重大进展,但PH仍然无法治愈,3年死亡率在20%至80%之间。这表明迫切需要了解PH的基本机制,然后,开发新的疗法,以防止,减缓进展,并治愈疾病。动物模型对于这个范围至关重要。目前,研究PH的各种模型都存在。有兴趣的读者会参考有关这个题目2,3,4,的优秀,评论。考虑到导致PH的各种疾病,很明显,人类PH的各种条件不能完全概括为一种动物模型。可用的动物模型可以分为 i) 单击, ii) 两击, iii) 淘汰, 和 iv) 过度表达模型3。在单击模型中,PH 是由单个病理刺激诱导的,而双命中模型将两种病理刺激与诱导更严重 PH 的目标相结合,从而更密切地模仿复杂的人类疾病。除了病因差异外,几种刺激导致PH建模差异,也取决于动物的种类和遗传背景4。
最常用的经典PH啮齿动物模型之一是慢性缺氧模型2。众所周知,低氧在人类和几种动物物种中诱发PH。缺氧的好处是PH的生理刺激(表1)。然而,虽然用于诱导啮齿动物PH的缺氧程度比人类严重得多,单一的侮辱(缺氧)只导致轻微的血管重塑。这不能模仿人类疾病的严重程度。增加第二次命中,一个额外的刺激诱导PH,显示了有希望的结果:注射化合物SU5416啮齿动物结合低氧刺激诱导更严重的PH表型2,5,6。,5,6SU5416是血管内皮生长因子(VEGF)受体-2的抑制剂。它阻断VEGF受体并导致内皮细胞凋亡。在缺氧条件下,这刺激了抗凋亡内皮细胞子集的增殖。此外,SU5416导致平滑的肌肉细胞增殖。这些效果的组合导致肺循环的病理血管重塑,并导致PA压力升高和右心室重塑2,5,7。,5,7该模型首先在大鼠6中描述,后来应用于小鼠,4、5、7。547与大鼠相比,小鼠模型表现出的血管重塑不太严重。此外,当回到诺莫夏时,PH在大鼠中继续进步,而在大鼠中则部分可逆。
以下协议描述了使用缺氧/SU5416 方法(规划、时间线、执行)在小鼠中建模 PH 的所有步骤。此外,本方案还描述了该模型的特征:功能性(通过侵入性测量右心室(RV)压力使用开放胸部技术)、形态测量(通过解剖和称重右心室和左心室),以及组织学(通过评估肺血管重塑、右心室心肌细胞肥大和纤维化)。
本协议中描述的所有步骤和方法都可以在任何经验级别上由调查人员轻松实施。虽然使用开放胸腔技术(此处描述)的 RV 的功能测量不是该领域的黄金标准方法,但它的优点是,即使经验较少的实验者也可以快速了解和准确再现。
研究方案
在任何动物实验之前,获得当地机构动物护理委员会的授权。目前的实验是在西奈山伊坎医学院的机构动物护理和使用委员会(IACUC)批准后进行的。
1. PH 感应
- 制备
- 在开始研究之前,请仔细规划实验设计。确保小鼠在第一次SU5416注射的同一时间点受到缺氧。图1 A 中显示了使用缺氧/SU5416 方法诱导 PH 的实验 设计示例。对照鼠标只收到车辆。对于此模型,SU5416 将连续 3 周每周向小鼠注射一次。
- 使用8至12周大的C57BL/6小鼠进行本研究。在12-h的浅暗循环下,在18-20°C下将动物饲养。确保食物和水是可 获得的。
- 称量动物。将它们随机分配给每组:诺莫夏和缺氧/SU5416。
- 准备缺氧室,如图 1B. 将氮气 (N2) 罐固定到腔室附近。将氧气 (O2)控制器设置为 10% O2点。让系统达到稳定状态。
- 准备SU5416注射(使用20毫克/千克体重的剂量)。SU5416不溶于水溶液;因此,将计算金额溶解在 100 μL DMSO8 中。例如,对于 25 g 小鼠,要注射的 SU5416 量为 0.5 mg 溶解在 100 μL 溶剂 (DMSO) 中。因此,此小鼠的 SU5416 最终浓度为 5 mg/mL。
注意:SU5416 是一种危险材料。请仔细阅读产品附带的安全数据表,并确保在处理这种物质时采取建议的预防措施。戴上防护手套(如任何注射)使用眼部保护。SU5416的化学结构如图 1C所示。
注:计算溶液的适当过量,以补偿注射过程中将损失的体积(例如注射器、小瓶等)。根据使用的注射器,死体积约为200μL。对于一组 10 只小鼠,计算超过 2 个小鼠剂量。 - 准备注射器进行注射。使用 1 mL 注射器与 25 G x 5/8" 针头。
- SU5416 皮下注射
- 约束动物。将鼠标放在笼子盖上,以协助约束。抓住皮肤,形成与脊柱平行的帐篷。一定要紧紧抓住后背,避免被老鼠咬伤。
注:两名调查员的存在使手术更快、更准确,因为一个调查员可以容纳动物,而另一个可以进行注射。 - 将针头皮下插入皮肤松散褶皱的侧翼上。确保插入与皮肤平行的针。避免穿透腹壁。
- 注射注射器的含量(100μL 溶解的SU5416或车辆)。
注:为了避免在完全分娩后泄漏,请将注射器按住约 10 s,并在皮肤下稍微旋转针头。 - 把针头取出来,把动物还到笼子里。在SU5416注射后,将笼子放在通风缺氧室中。
- 约束动物。将鼠标放在笼子盖上,以协助约束。抓住皮肤,形成与脊柱平行的帐篷。一定要紧紧抓住后背,避免被老鼠咬伤。
- 低氧暴露
- 一段时间监控通风。确保保持 10% 的氧气供应。在21%O 2的半密封室中保持无节动物。
- 确保腔室配备氧气传感器以测量氧气水平。避免大面积打开房间。用于清洁和添加食物和水,每3天打开不超过20分钟。
- 每天检查动物。考虑压力信号,如皮桩或体重显著减轻。
注:低氧/SU5416以下的动物预计将减肥5。这是疾病发展的迹象。 - 连续 3 周每周重复 SU5416 注射( 有关实验设计的概述 ,请参见图 1 A)。
注:改变注射部位有助于减少皮肤刺激。
2. 侵入性房车压力测量功能特性
- 制备
注:选择麻醉方案。可注射或可吸入麻醉剂。由于轻微过量注射麻醉剂(特别是氯胺酮/西拉辛或五巴比妥)可显著影响心脏功能,建议使用挥发性麻醉剂。在研究中,对所有小鼠使用相同的麻醉剂非常重要。- 使用蒸发器确保每个动物的麻醉剂量准确。异氟的剂量如下:诱导3-4%,维持1%与100%氧气混合。
注:穿戴个人防护装备,避免呼吸蒸汽。 - 准备加热垫和/或加热灯,以保持体温。准备直肠温度探头以监测体温。
- 确保通风正常。事先准备呼吸机。准备 Y 管接头并使用手动模式检查呼吸机的功能。确保吸入压力为 <1 厘米 H2O,以避免巴罗创伤。将呼吸速率设置为 110 呼吸/分钟。
- 通过切割 20 G 血管内导管准备气管。
- 准备所需的仪器:小钳子、剪刀、弹性钩缩回器、容器烧灼器和棉签。在棉签上调整一个小的 25 G x 5/8" 针,用于在右心室进行小穿刺。
- 准备压力导管、压力体积控制单元并启动数据采集软件。将PV导管放在充满PBS的15 mL管中,温度为37°C15分钟,并按照制造商的协议进行校准。
- 对于器官的灌注和固定,准备PBS和溶液50%PBS / 50%OCT.准备2×10毫升注射器(用25G针):一个将用于用 PBS原 位呼吸心脏和肺,第二个用于注射C OCT/PBS(50/50)溶液的肺标本,将用于组织学检查。
- 使用蒸发器确保每个动物的麻醉剂量准确。异氟的剂量如下:诱导3-4%,维持1%与100%氧气混合。
- 插管
- 称量鼠标并记录麻醉前的健康状况。
- 用3-4%等氟化诱导麻醉。通过测试手趾捏反射检查麻醉深度:用力捏紧四肢之一的手指趾。如果动物退出肢体,这是麻醉不足的迹象。
- 麻醉诱导后,剃光颈部和胸部区域。
- 将鼠标放在加热垫上。放置直肠温度探头以监测体温。
注:体温的维持对于功能测量非常重要。体温应约为36.5-37 °C。 - 使用弯曲钳将缝合线连接到鼠标的上切口,用手术胶带拉伸并固定到加热垫上。使用手术胶带固定小鼠的四肢。
- 对于插管动物,用小剪刀在宫颈皮肤中切大约1厘米的小切口。
注:口服插管是一种需要更多经验的替代方法。 - 用棉尖施用器钝直分离中层唾液腺。这将暴露肌肉覆盖气管。
- 小心地切割这些肌肉暴露气管。
- 用小剪刀在气管的推车之间做一个小切口,并插入准备好的气管管。拿出血管内导管的金属导管。
- 将导管连接到呼吸机。通过手动轻轻充气肺来验证气管位置。用胶带固定位置。
- 在整个过程中保持1%的异氟麻醉。
- 通过测试手趾捏反射,定期监测麻醉深度。相应地调整麻醉。
注:实验期间推荐的心率在1%异氟麻醉下,约为400次/分钟。维持体温和麻醉对控制心率至关重要。过量的异氟可降低心率。但是,可以通过降低异氟率实现恢复。
- RV 压力测量(开箱法)
- 用小剪刀在西腓工艺和上腹部部进行约1厘米的皮肤切口。分离覆盖胸部和上腹部象限的腹壁的皮肤:从中线开始,到西腓,小心地在两侧横向移动。使用热气库控制出血。
注:目标是通过腹壁进入胸腔。 - 打开腹腔,小心切开隔膜,注意不要伤害跳动的心脏或肺部。
注:目标是暴露心脏的顶点和右心室。良好的心脏暴露和视图对于正确放置导管至关重要。在整个过程中避免出血非常重要。即使是血管内体积的很小的变化也会改变右心的负荷,并影响记录的参数。 - 使用棉尖施用器轻轻取出百分。
- 在将压力导管放入心脏之前,将导管放在鼠标旁边。
- 使用准备好的棉尖施用器与针头使刺伤在右心室的尖孔半部。小心地取出针头,并将压力导管插入此孔中。
注意:这应该在不施加力的情况下有效。如果不可能,请尝试在第一个孔附近打一个新洞,以避免心脏受到长时间的伤害。针的插入深度不应超过约 3 mm。 - 插入与右心室方向平行的压力导管,尖端朝向肺动脉。
- 观察压力波跟踪,确保导管的正确定位。代表性跟踪如图 2 所示。
- 让压力信号稳定下来。暂停呼吸并获取至少 3 个测量值。在单个测量之间,允许动物通风。
- 记录所有测量值后,取出导管并将其放回水浴中 PBS 填充管中。
注:实验完成后,按照制造商的说明清洁导管。
- 用小剪刀在西腓工艺和上腹部部进行约1厘米的皮肤切口。分离覆盖胸部和上腹部象限的腹壁的皮肤:从中线开始,到西腓,小心地在两侧横向移动。使用热气库控制出血。
- 安乐死和肺灌注
- 实验完成后,通过排泄使鼠标安乐死。
- 广泛打开胸部。用剪刀切开整个胸骨,注意不要伤害心脏或肺部。
- 使用虹膜剪刀在左心室做一个小切口,让血液离开腔室。
- 将含有 10 mL PBS 的注射器的 25 G 针头放在右心室中,并注射 PBS 溶液,直到肺部清除血液。
- 一旦完成这一步,确认安乐死的重要组织收获(心脏和肺):切断卡瓦和大音附件,并删除心脏和 肺块。
3. 变形表征
- 立即切除心脏和肺(步骤2.4.5),分离心脏并切除两个阿不利亚。用弯曲的十耳分析器仔细解剖左心室 (LV) 的右心室 (RV),留下隔膜 (S) 与左心室。称重RV和LV+S并计算富尔顿指数=RV/LV+S(图3)5,9。5,9
- 采取右心室的一部分,并将其放在一个 OCT 预填充嵌入模具。使用右心室的另一部分进行RNA和/或蛋白质分析。在干冰中捕捉冻结,储存在-80°C。
- 使用虹膜剪刀将肺与心脏和任何其他剩余组织分离。
注:对于肺的准备,如上所述的灌注(步骤2.4.3-2.4.5)非常重要。 - 捕捉冷冻部分肺部,并将其储存在RNA、蛋白质提取或其他测定中。
- 使用肺的另一部分进行组织学分析。为此,将含有50%PBS和50%OCT的注射器插入已用叶10、11的支气管中。实验者可以很容易地看到,当注射器的含量被注入组织时,肺会膨胀。
- 将这些肺片放在预加的用于 OCT 的模具中,并把它们卡在干冰中。样品冷冻后,将样品储存在-80°C。
- 使用低温机准备 8 μm 的 RV 和肺部分。空气干燥部分在室温下30分钟。
- 使用 10% 的甲醛 (PFA) 在室温下固定幻灯片 10 分钟。
注:PFA是已知的人类致癌物质。通过使用化学烟机罩、适当的程序和个人防护设备降低暴露风险。有关更多信息,请参阅材料安全数据表 (MSDS)。 - 血氧林/Eosin染色的血管重塑评估
注:进行血氧蛋白/Eosin染色,以评估心脏和肺血管重塑的结构变化(图3)。- 用赤氧林溶液染色8分钟。
- 用自来水冲洗5分钟,然后用蒸馏水快速冲洗。
- 在 95% EtOH 中冲洗 1 分钟,在 Eosin 溶液中冲洗 1 分钟。
- 脱水(80%乙醇10-30秒,100乙醇1分钟和100%托洛尔3分钟)。
- 用盖玻片安装和盖上。在室温下将滑梯干燥过夜。
注:用于染色的溶液可能很危险。通过使用化学烟机罩、适当的程序和个人防护设备降低暴露风险。有关更多信息,请参阅 MSDS。
- 右心室纤维化评估由皮罗西里乌斯红染色
注:在皮罗西里乌斯红染色,皮罗西里乌斯红,这是酸,结合胶原蛋白12。因此,这种染色可用于组织学检查胶原蛋白含量。- 在 58 °C 的预热 Bouin 溶液中孵育幻灯片 1 小时。
- 在自来水中清洗滑梯,从部分去除黄色 10-15 分钟。
- 在室温下,在 0.1% 快速绿色中染色 20 分钟。
- 用1%醋酸冲洗1分钟。
- 用自来水冲洗5分钟。
- 在室温下在 0.1% 天狼星中染色 30 分钟, 随后在托卢奥尔脱水。
注意:用于染色的溶液可能很危险。通过使用化学烟机罩、适当的程序和个人防护设备降低暴露风险。有关更多信息,请参阅 MSDS。
- RV心肌细胞肥大评估由WGA染色
注:通过执行小麦胚芽 Agglutinin (WGA) 染色(图4),可以评估细胞水平上右心室 (RV) 的肥大。- 在冷丙酮溶液中固定幻灯片 15 分钟,然后用 PBS 进行 3 步清洗(每步 5 分钟)。
- 在室温下用10%的山羊血清在Dako溶液中阻断30分钟。
- 用 WGA 孵育幻灯片:添加 WGA 1:200,在黑暗中 37 °C 下孵育 1 1/2 小时。
- 用 PBS 清洗幻灯片三次。
- 用核酸染料孵育幻灯片。
- 用 PBS 清洗幻灯片三次。
- 对于安装,去除多余的液体,并应用安装介质和盖玻片。在黑暗中室温下干燥滑梯1小时,并在4°C下储存。
注:用于染色的溶液可能很危险。通过使用化学烟机罩、适当的程序和个人防护设备降低暴露风险。有关更多信息,请参阅 MSDS。
- 对肺进行免疫化学,以进一步和具体评估血管重塑。例如,平滑的肌肉细胞染色可用于评估血管的肌肉化,而冯·威利布兰德因子染色可用于可视化内皮变化。这些方法在其它部分描述。
结果
在该协议中,我们详细描述了低氧/SU5416模型的创建,该模型用于在小鼠中诱导PH。此外,我们详细介绍了在观察期结束时进行肺血管和心脏评估的所有必要步骤。
此模型的实验设计概述如图 1AA13,14,所示。 Figure 1小鼠患有正常缺氧(10%O2),并连续三周每周注射一次SU5416。图1B和1C中显示了本协议中用于诱导PH的刺激。
VEGF受体拮抗剂SU5416通过引起内皮细胞凋亡而作用,因此,允许凋亡耐内皮细胞的增殖。这导致血管重塑在肺血管和增加血管阻力5。肺循环中压力升高会增加RV后负荷,并逐渐导致RV功能障碍和故障9。在第一步,低氧/SU5416协议的成功可以通过在观察期结束时对RV函数进行功能评估来评估。在该协议中,我们使用开放胸RV压力测量方法详细描述了RV收缩压的侵入性评估。图2显示了代表性压力曲线和右心室压力 的定量分析。
我们如何量化血管重塑,这导致血管阻力升高,进而导致PH?组形学是肺血管特征的黄金标准。在此协议中,我们详细描述了赤氧树脂和 Eosin 染色 (H&E) 协议。染色和捕捉图像后,肺动脉可以区分为小(<50 μm)和较大的(> 50 μm)。支气管动脉被排除在我们的研究之外。为了评估中层厚度,测量动脉的外部 (ED) 以及内部直径 (ID)。缺氧/SU5416治疗后重塑肺动脉的代表性图像如图3A所示,动脉中层厚度相对于横截面直径的百分比如图3B所示。对近肺动脉的形态分析表明,与诺莫米动物相比,低氧/SU5416治疗小鼠的内膜厚度显著增加(图3)。
后载量增加导致RV肥大,随着疾病进展到RV纤维化9,9,15。RV肥大可以通过测量富尔顿指数(RV/LV+Septum)以及测量心肌细胞(CM)肥大来评估形态。右心室 (RV) 与左心室 (LV) 和隔膜 (RV/(LV+S)的权重比计算为右心室肥大指数。图4 B显示了缺氧/SU5416和诺莫米小鼠富尔顿指数的代表性结果。这里描述的用于评估CM肥大的方法是用小麦胚芽胶粘素(WGA)对右心室部分进行染色。WGA与细胞膜的糖蛋白结合,可用于确定菌细胞16、17的横截面面积。图 4 A 显示了沾有 WGA 的右心室部分的代表性图像。图4A.缺氧/SU5416暴露导致心肌细胞大小和右心室肥大显著增加(图4)。我们和其他人先前已经表明,与单击(只有缺氧)相比,缺氧/SU5416加重RV表型5,5,18。

图1:缺氧/SU5416方法概述。(A) 低氧/SU5416小鼠模型的实验设计。SU5416连续3周每周注射一次。 (B) 缺氧系统的示意图。控制器通过气体输液管注入氮气,感应并调节腔室内的氧气。(C) SU5416的化学结构。 请单击此处查看此图的较大版本。
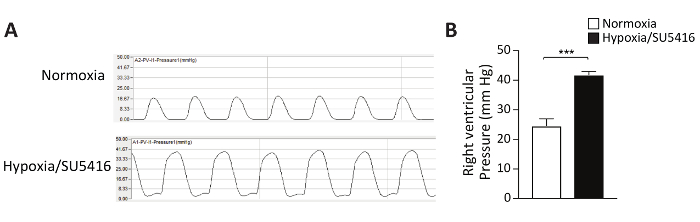
图2:接触慢性缺氧的小鼠右心室压力与SU5416注射相结合。 (A) 右心室(RV)的侵入性压力测量的代表性追踪。(B) 低氧/SU5416小鼠和接触诺莫夏的对照动物的RV收缩压。n = 每组6-8只小鼠。p < 0.001.所有定量数据都报告为 ±SEM。请点击这里查看这个数字的较大版本。
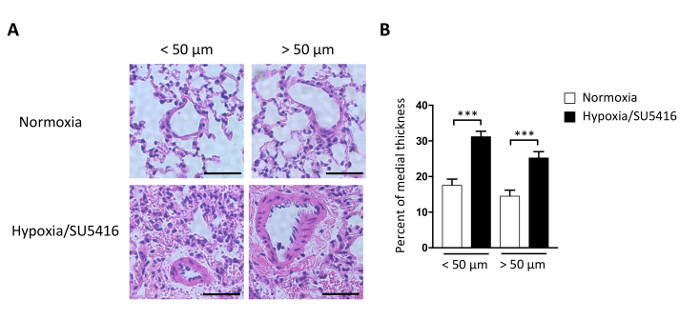
图3:缺氧/SU5416诱发肺血管重塑。(A) 来自所述组的代表血氧林/Eosin染色的肺部分表明,低氧/SU5416小鼠的肺动脉的介质壁厚增加。比例线:50 μm。 (B) 动脉中层厚度相对于横截面直径的百分比。n = 每组 5 只小鼠。p < 0.001.所有定量数据都报告为 ±SEM。请点击这里查看这个数字的较大版本。
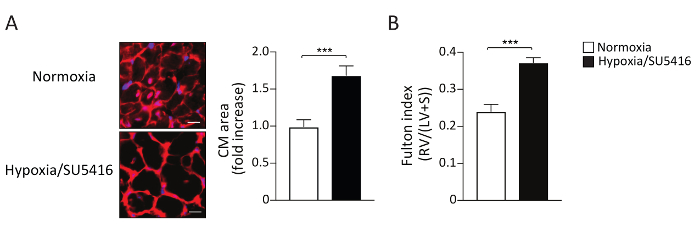
图4:接触慢性缺氧的小鼠右心室肥大,结合SU5416 注射。(A)(左)代表WGA(小麦细菌Agglutinin)在指示治疗后右心室组织染色。比例线:50 μm。(右)数据的定量分析。n = 每组 5 只小鼠。(B) RV 肥大反映在 LV 和中间隔膜 (S) 重量比 (富尔顿指数 = RV/LV+ S) 中, 每个组。n = 每组 8 只小鼠。p < 0.001.所有定量数据都报告为 ±SEM。请点击这里查看这个数字的较大版本。
讨论
该协议描述了如何通过结合两种病理刺激在小鼠的PH模型:慢性缺氧和SU5416注射(缺氧/SU5416)1818。为了试图将此鼠标模型与人类PH条件关联,不可避免地必须查看表1所示的当前PH分类。几乎所有形式的PH的特点是肺血管收缩和内皮细胞和平滑肌肉细胞的异常增殖。这导致肺动脉压力升高,从而增加右心室的后负荷。
每一次尝试描述PH动物模型应该包括肺血管和右心室的组织病理学重塑的证据。单击缺氧小鼠模型导致一种温和的血管重塑形式22,3。3这些病理发现包括以前非肌肉化血管的肌肉化,伴有内皮细胞、平滑肌细胞和成纤维细胞增殖。这些发现由于增加了第二次打击(SU5416注射)而更加严重。效果在单击(缺氧)模型中是可逆的,在缺氧/SU5416模型中只有部分可逆。
PH患者的主要死因是右心室衰竭(RVF)4,20。4,20动物模型中的肺血管重塑并不总是伴随着裂谷热。为了从裂谷热形态、功能和分子数据的角度对动物模型进行表征。后者超出了本协议的范围。RV形态重塑包括宏观和微观两个方面。在宏观层面上,RV 肥大的主要指数是富尔顿指数,定义为 RV 的重量除以左心室 (LV) 和 Septum (S) 重量 (RV/LV+S)。在微观水平上,纤维化、炎症和肥大分别由天狼星红、血氧林/Eosin和WGA染色进行评估。
小鼠低氧/SU5146模型(此处描述)显示了RV功能障碍,通过收缩压升高和形态标准测量。关于肺血管重塑,在协议启动三周后观察到中位肥大。与大鼠的缺氧/SU5416模型相比,小鼠模型不会导致RV失败(仅中度功能障碍),不会导致严重疾病人类观察到的严重性性性血管病,而肺病理学在返回诺莫夏后会促进。总体而言,小鼠缺氧/SU5416模型适合模仿PH中遇到的血管损伤,主要是第一组(部分第三组,见表1)1,191,。该模型的优点是应用在野生类型(基因未修改)小鼠,相对容易和低成本的实施,相对较低的死亡率的患病动物,和快速发展的疾病的兴趣(3周)。PH预防和治疗研究可以很容易地在这个模型中实施,而无需先进的技能,而不是手术啮齿动物模型。
在实现协议时,有一些关键步骤,应该记住这些步骤。在规划研究时,应记住,在缺氧/SU5416组,动物的死亡率在0-10%之间变化(未发表的观察)。因此,为了达到统计能力并避免研究能力不足,建议每组至少10只小鼠。SU5416 的溶解度低。因此,必须使用DMSO或其他溶剂(如碳甲基纤维素、CMC)。高剂量的DMSO可能是有毒的。据报道,小鼠皮下(s.c.)使用的LD50为13.9-25.6克/千克21,22。21,22LD50被定义为在指定的测试持续时间21,22之后杀死50%的被测试群体成员所需的剂量。对于重量为 25 g 的鼠标,使用 4.4 g/Kg 的 DMSO(基于 1.1 g/mL 和 0.1 mL 应用 s.c./mouse 的 DMSO 密度进行计算)。因此,皮下给定剂量远远低于LD50值。在我们的手中,SU5416的适用溶解在DMSO中,如这里所述,在某些情况下,可能会导致皮肤刺激,但没有其他毒性作用被观察到。然而,一些报告建议使用CMC作为SU541614的替代车辆。执行 RV 功能测量时,必须密切注意体温、出血和麻醉深度,通过测试小鼠反射进行评估。如此处所述,用于评估 RV 压力的开放式胸部技术具有即使由缺乏经验的用户轻松实现的优点。闭胸法(在其它方法23、24、25)的优点是侵入性较小,因此,也可以在非终端实验中实施。,24,25它需要高水平的专业知识。
在首次描述大鼠的缺氧/SU5416模型后,小鼠模型已成功地用于多项研究5、9、13。,9,13然而,有证据表明,结果取决于小鼠的遗传背景和性别,SU5416的制造商和SU5416注射频率26。虽然连续三周注射SU5416会导致小鼠的PH,单一剂量不会诱导PH4。此外,其他形式的PH,如那些与左心脏病或由于慢性血栓栓塞疾病,需要病因相关的模型。新的疗法应该在至少2种不同的动物模型中进行测试,然后才能为转化研究铺平道路。
披露声明
作者没有什么可申报的。
致谢
这项工作得到了美国心脏协会(AHA-17SDG333370112和18IPA34170258)的资助,以及来自国家卫生研究院NIH K01 HL135474到Y.S.O.B的资助,并得到德国赫兹斯蒂夫通的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
参考文献
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。