Method Article
단일 셀 정량 mRNA와 유인원 면역 결핍 바이러스에 감염 된 CD4에 표면 단백질 표정+ T 세포 격리에서 붉은 털 원숭이
요약
설명한 quantitate 96 유전자의 표현 하는 방법론 이며 단일 셀 전 비보, 차동의 식별을 위해 허용 하 여 18 표면 단백질 유전자와 감염 되지 않은 세포에 상대적으로 바이러스에 감염 된 세포에 있는 단백질을 표현. 우리는 접근 연구 SIV에 감염 된 CD4+ T 적용 붉은 털 원숭이에서 분리 하는 세포.
초록
단일 세포 분석은 세포의 이종 인구를 해 부하는 중요 한 도구 이다. 식별 및 희귀 세포의 격리 어려울 수 있습니다. 이 문제를 해결 하려면 방법론 결합 인덱스 cytometry 고 높은 처리량 다중화 정량적 중 합 효소 연쇄 반응 (정량) 개발 되었다. 목표를 식별 하 여 유인원 면역 결핍 바이러스 (SIV)의 특성은-붉은 털 원숭이 내의 세포를 감염. 형광 활성화 된 세포 분류 (FACS)에 의해 표면 단백질의 정량에 의해 mRNA 정량를 통해 바이러스에 감염 된 세포는 다차원 프로필을 만들 호스트 유전자와 단백질 측정 함께 바이러스 성 유전자 발현에 의해 식별 됩니다. . 우리 용어 접근, 타겟된 단일 셀 Proteo transcriptional 평가, 또는 tSCEPTRE. 메서드를 수행 하기 위해 실행 가능한 세포 표면 마커 FACS 절연 셀 집합 또는 다운스트림 phenotypic 분석의 사용에 대 한 특정 형광 항 체와 스테인드는. 단일 셀 뒤에 즉시 세포, 다중 반전 녹음 방송 (실시간), PCR 사전 확대, 및 최대 96 성적 높은 처리량 정량 정렬 됩니다. FACS 측정 정렬의 시간에서 기록 하 고 이후 transcriptional 프로필 및 결합된 단백질을 만드는 좋은 위치에 의해 유전자 표현 데이터에 연결 됩니다. SIV에 감염 연구를 직접 ex vivo세포, 세포는 여러 바이러스 RNA의 정량 검출에 의해 확인 되었다. 바이러스 성 성적표의 조합과 각 양의 바이러스 성 수명 주기 (예를 들어, 비 생산적 대 생산)의 단계로으로 세포를 분류 하기 위한 프레임 워크를 제공 합니다. 또한, SIV+ 세포의 tSCEPTRE 감염에 비해 셀 차동 표현된 호스트 유전자와 단백질을 평가 하기 위해 동일한 견본에서 고립 되었다. 분석 감염 된 세포 뿐만 아니라 vivo에서 단일 셀 해상도 post-transcriptional 유전자 SIV 중재 규정 중 이전 진가 바이러스 성 RNA 식이 밝혔다. TSCEPTRE 메서드는 의무가 표면 단백질 marker(s), 호스트 또는 병원 체 gene(s), 또는 그것으로 조합 식으로 식별 된 셀 인구의 분석입니다.
서문
종종 호스트 세포 생물학 변경 또는 전파의 그들의 기회를 극대화 하기 위해 호스트 세포의 매우 구체적인 부분 모집단을 대상으로 많은 세포내 병원 체 복제 호스트 셀 기계에 의존 합니다. 그 결과, 세포 생물학 프로세스는 일반적으로 중단, 호스트의 전반적인 건강에 해로운 결과. 바이러스 및 그들은 복제 하는 있는 호스트 세포 사이 상호 작용 이해 감염을 방지 하기 위해 향상 된 치료 및 전략의 개발에 도움이 있습니다 질병 메커니즘 명료 하 게 됩니다. 호스트 병원 체 상호 작용의 연구를 직접 분석 도구는이 필수적입니다. 단일 세포 분석은 명확 하 게 특정 유전자 형 또는 감염 상태1세포 표현 형을 특성에 유일한 수단을 제공 합니다. 예를 들어 병원 성 감염 자주 호스트 세포에서 둘 다 직접 및 간접 변화 유도. 따라서, 구별 그들의 감염에서 감염 된 세포는 직접 감염 또는 보조 효과 특성 호스트 셀 변경 하는 데 필요한 같은 일반화 된 염증. 또한, 많은 병원 체, SIV와 인간 면역 결핍 바이러스 (HIV), 같은 일찍, 늦게, 호스트 세포 감염 같은 여러 단계를 통해 진행 또는 숨겨진, 각각의 특징 수 있습니다 고유한 유전자와 단백질 표정 단면도2 , 3 , 4 , 5. 세포 혼합물의 대량 분석이이6을 잡으려고 실패 합니다. 대조적으로, 매우 둘 다 바이러스의 식 계량 수 단일 세포 분석 다중화 하 고 감염 관련 세포 섭, 감염 단계에 걸쳐 변화를 포함 하 여 해결 하는 수단을 제공 하는 호스트 유전자. 또한, 순수에 호스트 병원 체 상호 작용 분석 관련 설정을 감염 된 유기 체에서 발생 하는 이벤트의 식별을 위해 중요 합니다. 따라서, vivo ex vivo에서 최고의 가능성이 캡처는 직접 적용할 수 있는 방법을 처리 합니다.
SIV와 HIV CD4 대상+ T는 그들이 중화 호스트 항 바이러스 "제한" 요소와 downregulate 항 원 제시 하는 생산적인 감염 고 방지 면역 감시7,8, 분자 세포 9,,1011. 치료를 하지 않으면 감염 c d 4의 대규모 손실에 결과+ T 세포, 궁극적으로에 culminating 획득 면역 결핍 증후군 (에이즈)12. 투여 요법의 설정에서 latently 감염된 세포 저수지 치료 전략에 강한 장벽 포즈, 수십 년 동안 지속. Vivo에서 HIV/SIV에 감염 된 세포의 속성을 이해 pathogenesis 및 지 속성에 호스트 세포 기능을 가능성이 있다. 그러나, 이것은 매우 도전, 감염 된 세포의 low frequency 그리고 그들을 쉽게 식별할 수 시 약의 부족 때문에 주로. 바이러스 성 RNA 녹음 셀 0.01-1에 있기 위하여 견적 된다 CD4의 %+ T 세포가 혈액과 림프 조직13,,1415에. 진압 치료에서 latently 감염 된 세포는 10-3– 10-7- 16,,1718도 덜 자주. 체 외에 감염, 같은 세포내 개 그 공부 잘 작동 배경 0.01-0.1의 얼룩 때문에 차선은 분석 실험 바이러스 성 단백질 얼룩 %, 감염 된 세포13의 주파수 보다 작거나 비슷합니다 14. 잘 특징이 SIV/에이즈 환경을 특정 단일 클론 항 체를 사용 하 여 환경 단백질에 대 한 표면 얼룩 또한 입증 되었다 어려울, 아마 유사한 이유를 위해. 최근, 새로운 도구 중 개 그를 표현 하는 세포의 탐지를 향상을 목표로 통합 개 그 RNA 또는 대체 이미징 기술14,,1519를 사용 하 여 특정 분석 실험. 그러나, 이러한 접근 제한 남아 양적 측정 수에서 각 셀에서 수행.
여기, 우리 (1) 직접 비보 전 과민 하 고 특정 바이러스 성 유전자 정량 정량 및 (2) 각 감염에 대 한 최대 18 표면 단백질 및 96 유전자의 식을 단정 단일 바이러스에 감염 된 세포를 식별 하는 방법 설명 (그리고 감염 되지 않은) 셀입니다. 이 방법론은 FACS 즉시 세포 세포의 용 해에 의해 다음에 의해 단일 세포 표면 단백질 측정 그리고 Biomark 시스템에 대상으로 정량 멀티플렉스 유전자 표정 분석 사용 하 여. 통합된 유체 회로 (IFC) 기술 수 있습니다 96 샘플에서 96 유전자의 멀티플렉스 정량을 동시에 개별 정량 Pcr 반응을 수행 됩니다 9,216 챔버의 매트릭스에 의해 수행. 즉시 수행 분석에 대 한 전체 transcriptome 보존 하는 동안이 콘텐츠 단백질 풍부한 측정 기록 라이브 셀 FACS 정렬 다운스트림. 바이러스에 감염 된 세포를 식별, 양자 택일로 접합 하 고 unspliced 바이러스 성 RNAs (vRNA)에 대 한 분석 실험 관련 최대 96 유전자, 현재에 수용 하는 분석 실험의 최대 수를 총 사용자 정의 분석 실험의 패널 함께 정량 분석에 포함 IFC입니다. 유전자 발현 및 단백질 정보 각 셀에 대 한 좋은 위치에 의해 연결 됩니다. 우리는 이전20이 분석을 다른 곳에서 결과 보고 했다. 여기, 우리는 자세한 SIV에 감염 된 CD4의 추가 설명 형질으로 서 방법론 지침 제공+ T 세포.
우리 tSCEPTRE 기간,이 접근의 어떤 가능한 셀 붙일 레이블된 항 체를 표현 transcriptome 호환 가능한 정량 분석 실험 반응 정지에 적용할 수 있습니다. 예를 들어 그것은 차동 유전자와 단백질 표정 희귀 세포 또는 세포 표면 단백질 마커에 의해 쉽게 구별 특성화에 대 한 사용할 수 있습니다. 샘플 준비는 상업적으로 사용할 수 있는 항 체를 사용 하는 프로토콜을 얼룩이 지는 표준에 의존 합니다. 단일 셀 정렬 기능 Cytometers 또한 상업적으로 사용할 수 있습니다, 하지만 추가 biosafety 예방 감염 라이브 셀을 처리 하는 데 필요한. 여기 라고 잘 위치 하 여 각 셀에 대 한 단일-셀 단백질 식 프로필 기록 분류, 색인으로 정렬 소프트웨어 상용 FACS의 일반적인 기능입니다. 관심의 셀 인구 가운데 차동 표현된 호스트 유전자의 전산 분석, 설명 되지 않은 하지만 참조는 이전에 게시 방법에 제공 됩니다.
프로토콜
참고: 프로토콜 워크플로의 회로도 그림 1에 표시 됩니다. 그것은 세 가지 주요 단계로 구성 됩니다: FACS, RT 및 cDNA 사전 증폭, 및 최대 96 유전자에 대 한 정량 동시에. 프로토콜, 희석을 제한 하 고 단일 셀 정렬 셀 정렬의 두 가지 버전 5 단계 및 6 단계에서 자세히 각각 설명 되어 있습니다. 이러한 전략 다른 연구 질문 하지만 유사한 절차.
1. 필수 또는 이전 분석
- 앞에서 설명한6으로 사용할 모든 유전자 표현 분석을 확인 합니다.
참고:이 단계는 실험 날짜 임박 이루어집니다. 모든 분석을 확인, 상업 및 사용자 정의 단일 셀 수준까지 관련 RNA의 효율적이 고 선형 증폭을 보장 하는 데 필요한입니다. 많은 상업적으로 사용 가능 하 고 사용자 정의 분석 이러한 사양을 충족 하지. 추가 코딩 파일 1-5, 처리 및 최대 96 유전자의 분석 실험 식의 동시 자격에 대 한 자동화 곡선 맞춤 제공 됩니다 하지만 개별 분석 실험은 R2 와 선형 적합의 기울기를 사용 하 여 한정할 수 있습니다. 대표적인 성공 및 실패 분석 결과 자격 플롯은 그림 2에 표시 됩니다. -
항 체의 세포 표면 마커 얼룩의 흐름 cytometric 패널을 개발 합니다.
- 각 항 체와 항 체 관련 샘플, 예를 들어 붉은 털 주변 혈액 단 세포 (PBMCs), 얼룩에 의해 적정. 100 µ L에서 테스트 당 항 체의 20 µ L로 시작 반응 얼룩이 지 고 8 개의 두 배 직렬 희석을 만들. 부정적이 고 긍정적인 인구 사이 명확한 분리를 유지 하면서 강도 얼룩 최대 전시 최적 농도 식별 합니다.
- 평가 단계 1.2.1에서 최적의 농도에서 모든 항 체의 혼합물을 사용 하 여 추가 셀 sample(s)에 결합 된 얼룩. 얼룩이 지는 개별 항 체 얼룩에 대 한 관찰과 비슷한 인지 확인 합니다. 얼룩 때 어떤 항 체 분리에 사용 된 관찰은 무엇 보다 작은 경우, 대체 형광 색소 변화 같은 항 체를 대체 하는 것이 좋습니다.
2. 진 식 시험 준비
- 1-15 mL 튜브에는 RNase/DNase-무료 분석 실험 결합 96 유전자 발현 (크기는 정렬 번호판의 번호와 다를 수 있습니다). 이 연구에 사용 된 분석 실험의 패널은 표 1 과 표 2에 지정 됩니다. 결과 자료를 "분석 결과 믹스" 라고 합니다. 각 분석 결과 180의 최종 농도에 추가 정방향 및 역방향 뇌관의 nM. DNA 분석 결과 혼합의 적절 한 희석을 달성 하기 위해 서 스 펜 션 버퍼를 추가 합니다.
참고: 실용적인 목적을 위해 사용자 정의 (사용자 생성) 분석 결과 주식 수 있습니다 준비 18 µ M 상용 "20 x" 진 식 정량 분석 (자료 테이블)의 농도와 일치 하도록. 각 유전자에 대 한 사용자 정의 앞으로 역 뇌관의 18 µ M 믹스 DNA 정지 버퍼 재고 솔루션에서 만들어집니다. 상업적으로 이용 가능한 분석 (자료 테이블) 프로브 포함 하지만 프로브 RT 또는 cDNA 사전 증폭 및 수 필요 하지 않습니다. 따라서 사용자 정의 분석 실험에 대 한 생략. 하나를 포함 하는 것이 좋습니다 또는 정렬, 셀 복구 및 cDNA 합성의 효율성을 평가 하기 위한 품질 관리에 대 한 더 많은 내부 관리 유전자 사용. CDNA를 생성 하기 위해 임의의 뇌관의 사용 결정 되지 않았습니다, 하지만 유전자 특정 뇌관 보다 덜 효율적일 것으로 예상 된다. - 분석 결과 판 x 2 단계 7.1 (다중 정량)에 사용 하기 위해 준비. 예상 각 96 x 96 칩 배열, 96-잘 PCR 접시의 지정 각 각 분석 결과의 6 µ L 플라스틱. 예를 들어 5 칩, 각 분석 결과의 30 µ L 96 잘 접시에 단일 잘을 차지할 것입니다. 96 분석 실험을 사용 하 여, 96 잘 접시의 각 잘 분석 결과 포함 됩니다. 접착제 인감과 접시를 봉인.
참고: 이상적으로, 단계 2.1과 2.2 수행 됩니다, 동시에 유전자 표현 분석에 대 한 여러 freeze-thaw 주기를 피하기 위해. 분석 결과 배지 내의 모든 유전자도 되어 있어야 분석 결과 믹스 (2.1 단계)에. 분석 결과 믹스와 분석 결과 플레이트 모두 저장할 수 있습니다 장기 또는 단기적인 사용, 4 ° C 또는-20 ° C에 각각.
3. 표면 얼룩 가능한 셀
참고: 세포내 얼룩, permeabilization, 및 고정 호환 되지 않습니다이 방법으로 그들은 RNA 타협.
- 셀 얼룩을 위해 사용 하는 것 2.5-fold 높은 농도에서 보상 구슬의 40 µ L에 재료의 테이블에 에서 나열 된 각 항 체를 추가 하 여 보상 샘플을 준비 합니다. 빛에서 보호 하는 25 ° C에서 20 분 동안 품 어. 구슬 및 25 ° c.에 3 분 동안 500 x g 에서 원심 분리기에 PBS의 3 mL를 추가 PBS를 발음 하 고 ~ 300 µ L의 PBS에 구슬 resuspend.
- 흐름 cytometric 셀 정렬 샘플 처리에 대 한 준비: 보상 튜브 확보, 보상 행렬, 만들고 실험 표본에 대 한 수집 파일에 행렬을 적용.
- 테이블의 재료, 스테인드 될 모든 샘플에 대 한 호박 1.5 mL 튜브에 지정 된 대로 각 항 체의 적절 한 볼륨을 결합 하 여 형광 항 체 칵테일의 마스터 믹스를 준비 합니다. 소용돌이 원심 분리기 21000 x g 작은 항 체를 25 ° C에서 2 분 동안에 칵테일 집계 합니다.
참고: 여기에 사용 되는 항 체 재료의 테이블에에서 나열 됩니다. - 12 mL PBS의 15 mL 튜브, 25 ° c, 3 분 동안 500 x g 에서 원심 분리기에 세포 현 탁 액의 2 분 추가 0.5-2 mL에 대 한 37 ° C 물 욕조에 cryopreserved 세포를 해 동 하 고 PBS 발음. 3 ml PBS와 5 mL 폴리스 티 렌 튜브에 resuspend. 위와 같이 원심 고 ~ 20 µ L 잔여 PBS를 떠나 PBS 발음.
참고: 착 온도 따뜻한 또는 추운 온도에 따라 조건 얼룩 (단계 1.2 참조) 항 체 적정을 수정 하 여 특정 응용 프로그램에 대 한 필요에 따라 적응 수 있습니다. - Resuspend 2 x 10까지7 칵테일 항 체의 80 µ L에서 세포를 씻어 하 고 빛 으로부터 보호 하는 25 ° C에서 20 분 동안 품 어. 샘플 2 x 107 셀을 초과 증가 착 반응 볼륨 따라 유지 위해 < 2 x 107 셀/100 µ L.
- PBS의 3 mL를 추가 하 여 셀을 씻어 3 분, 500 x g 에서 centrifuging와 발음은 상쾌한.
- 철저 하 게 35 µ m 나일론 셀 스 트레이너 모자를 통해 pipetting으로 300-500 µ L의 PBS와 필터 셀 resuspend. 얼음에 세포를 유지 하 고 정렬까지 빛 으로부터 보호.
4. 준비 셀 컬렉션 접시, FACS 정렬 수행 및 생성 cDNA
- RT-앰프 반응 혼합 부품 (표 3)를 결합 하 여 단일 RNAse/DNAse 없는 무 균 튜브에 pipetting으로.
참고: 이전에 또는 3 단계에서 착 색 하는 동안이 단계를 수행할 수 있습니다. RT 효소 정량 신호에 DNA 템플렛의 기여를 확인 하려면 여기 생략할 수 있습니다. - 멀티 채널 피 펫을 사용 하 여 실시간 앰프 반응 혼합의 10 µ L 96 잘 PCR 정렬 컬렉션 번호판의 원하는 수로 분배. 접착제 필름, 접시를 봉인 하 고 미리 냉장된 96 잘 알루미늄 블록에 접시를 놓습니다.
- 얼룩진된 샘플의 약 20000 셀에서 데이터를 획득 하 여 교류 cytometer에 제어 체계를 정렬 셀을 설정 합니다. 보상 매트릭스 수집 된 데이터에 적용 됩니다 확인 하십시오. 그리기 문 고 격리 유전자 표정 분석에 대 한 관심의 셀 population(s)을 나타내는 제어 트리를 정의 합니다.
참고: 잠재적인 SIV vRNA+ 셀의 컬렉션에 대 한 사용 제어 트리는 그림 3에 표시 됩니다. - 각 잘으로 분류 될 수와 셀의 하위 집합을 지정 하려면 적절 한 악기 설정을 입력 하십시오. 정렬 중 하나에 대 한 자세한 지침을 추가 제한 셀 희석 시리즈 또는 단일 셀에에서 제공 됩니다 단계 5와 6, 각각.
- FACS 준비 96 잘 PCR 컬렉션 접시로 셀을 정렬 합니다. 정렬 전에 접착 씰을 제거 하 고 신선한 물개 종류를 다음으로 바꿉니다.
참고: 항상, 정렬 하는 동안 포함 하 여 미리 냉장된 알루미늄 블록 플레이트를 유지. - 정렬, 소용돌이 및 원심 분리기 직후 컬렉션 접시 2000 x g 4 ° c.에 1 분에서
- Thermocycle 따뜻한 뚜껑 다음 조건을 사용 하 여 PCR 기계에 접시: 15 분 (RT), 2 분 동안 95 ° C 50 ° C 95 ° C의 18 주기 다음 15 s 및 4 분 (사전 증폭) 60 ° C.
- 새로운 96-잘 PCR 접시에 DNA 정지 버퍼의 20 µ L에 cDNA의 5 μ를 전송 하 여 cDNA 1: 5을 희석. 희석된 cDNA 저장할 수 있습니다 4 ° C 또는-20 ° C에 무기한이 시점에서. cDNA를 정량 (단계 5.2, 7.4)에 대 한 서식 파일로 사용할 수 지금 이다.
참고:이 희석 하면 RT preamp 반응에 뇌관 다운스트림 정량에 기여 하지 않습니다.
5. 변형 a: FACS 정렬 셀 시리즈로 제한 희석 vRNA+ 의 주파수를 결정 하기 위해 셀 또는 실험 품질 관리 수행
참고: 단일 셀 정렬을 수행 하기 전에 그것은 복제에 직렬 희석으로 셀을 정렬 하 여 관심의 세포의 주파수를 결정 하는 사용의 있을 수 있습니다. 이 단계 또한 제공 한다 귀중 한 품질 관리 정렬 효율, 세포 세포의 용 해, RNA 복구 및 cDNA 합성 단계 5.3에서에서 설명한 대로. VRNA+ 셀 주파수의 이전 결정은 적절 하 게 구동된 vRNA+ 세포 유전자 표정 분석에 대 한 충분 한 샘플 크기를 달성 하기 위해 정렬 되어야 하는 단일 셀의 수의 더 정확한 견적에 대 한 수 있습니다.
- FACS 단계 4.1-4.2, 같이 준비 96 잘 접시에 셀을 정렬 하 고 여러 복제에 잘 당 1-1000 셀을 수집 합니다.
참고: 각 셀 희석에 복제 우물의 수는 일반적으로 잘 당 세포 농도와 반비례 연결. 감염 된 세포 주파수 1% 아래 이면 셀 희석 잘 당 100-1000 셀에 집중 해야 한다. 예를 들어 정렬 판 지도 그림 1, 왼쪽 상단에에서 제공 됩니다. 잘 당 1000 셀 초과 결과 증가 때문에 피해 야 한다 반응 볼륨 및 다운스트림 cDNA 합성 및 정량화와 간섭. - 표 4에서 마스터 믹스 솔루션에 정량 시 약을 결합 한다. 25 µ L 반응 볼륨, 마스터 믹스의 22.5 µ L 단계 3.9에서에서 희석된 cDNA 템플릿의 2.5 µ L와 결합 된다. 표준 자전거 상태를 사용 하 여 정량 Pcr을 수행 (예를 들어, 5 분, 94 ° C 94 ° C의 40 주기 다음 15 s를 1 분 동안 60 ° C).
참고: Singleplex 정량 반응 기존의 실시간 정량 악기를 사용 하 여 하나 또는 몇 가지 분석 실험의 경제적인 예비 분석으로 효율적인 셀 정렬, RNA 복구 및 cDNA 합성 권장 됩니다. 그것은 또한 vRNA+ 세포의 주파수를 계산에 사용할 수 있습니다. Biomark를 사용 하 여 다중 정량 반응은 일반적으로 더 대규모 단일 세포 분석에 적합 합니다. - 품질 관리에 대 한 플롯 외 값 (동부 표준시 = Ct최대 − Ct) 셀의 숫자 대 로그10 규모로 잘 당 정렬 하 고 선형 회귀 분석을 적용.
참고: 일관성이 복제, 3.3 (± 0.3), 선형 회귀 기울기와 R2 > 0.9는 효율적인 실험의 지표. 최적의 차선 일종의 예, RT-앰프 실험 그림 4에 나와 있습니다. - VRNA+ 세포의 주파수를 결정, 셀 숫자 x 축 (로그10 규모)의 분수에 잘 당 정렬 플롯 vRNA는 y 축에 각 셀 희석에 대 한 긍정적인 우물. 예를 들어, 그림 1 (더 낮은 왼쪽된, 포아송 분포)를 참조 하십시오. 항구의 한 긍정적인 셀 평균, 웰 스 포지티브 (y 축에 0.632)21의 63.2%에 해당 하는 셀의 수를 결정 하려면 데이터를 선형 회귀 모델을 적용 합니다. 이 셀 희석 수 (x 축 절편) 주파수 백분율 표현으로 변환 합니다. 예를 들어, 48 셀 당 하나의 vRNA+ 셀은 2.1%의 주파수.
6. 변형 b: FACS 정렬 세포를 단일 세포 분석
- 4.1-4.8, 단계 고 좋은 위치에 잘 교류 cytometer 인덱스 정렬 기능을 사용 하 여 정렬 하 고, 각 셀에 대 한 개별 FCS 파일을 만드는 당 정렬 한 셀을 지정 합니다.
참고: 정렬 컬렉션 접시의 수는 사용 가능한 thermocyclers의 수를 초과 하면, 사이클링 역전사 비활성화 단계 (2 분 동안 95 ° C) 후 중지할 수 있습니다 및 thermocyclers 사용할 수 있습니다 때까지 4 ° C에서 cDNA를 저장할 수 있습니다. 이 경우에, 15 95 ° C의 첫 번째 사이클에서 사전 증폭 시작 s. - 선택 사항: 만들 cDNA 잔여 undiluted cDNA를 사용 하 여 관심사의 희귀 셀에 대 한 화면에 단일 셀의 사용자 정의 된 일괄 처리에서 cDNA의 구성 된 "풀". 새로운 96 잘 접시에 멀티 채널 피 펫 2 µ L undiluted 단일 셀 미리 증폭 된 cDNA의 전송. 여 반복 지정 된 풀의 모든 추가 단일 셀에서 cDNA의 pipetting 2 µ L 동일한으로 잘 합니다. 관심 (예를 들어, vRNA) 기존의 정량 Pcr를 사용 하 여 긍정적인 셀을 포함 하는 그 결정의 gene(s)에 대 한 cDNA 풀 화면. 풀링 각 셀에서 cDNA의 작은 약 수만 필요, cDNA의 나머지 ~ 8 µ L 이므로 여전히 단일 세포 분석에 사용할 수 있습니다.
참고: 풀링 전략은 리소스가 다중 정량에 의해 심문을 하는 단일 셀의 수를 줄이기 위해 노력에서 단일 셀 유전자 표정 분석을 수행 하기 전에 것이 좋습니다. 그것은 예비 단일-플렉스 정량 분석 결과 의해 관심사 (예를 들어, SIV mRNA +)의 세포 수 있습니다 식별 하는 경우에 적합 합니다. CDNA 풀 만들 간단 높은 처리량 전략 새로운 접시에 단일 잘으로 2 µ L 컬렉션 정렬 접시의 행 (즉, 모든 12 행 A에서 세포) 또는 열 (즉, 열 1에 있는 모든 8 셀), undiluted cDNA의 결합을 포함 됩니다. 전략을 풀링 하는 최고를 확인 하려면 단계 5.4에서 셀의 예상된 주파수를 고려 하십시오. 예를 들어 셀의 10%는 긍정적인 것으로 예상 된다, 6 단일 셀 cDNA 샘플 구성 풀 자주 음수가 될 것입니다 그리고 그 수영장에서 세포 따라서 다운스트림 단일 세포 분석에서 제외할 수 있습니다.
7. 다중 정량 Biomark 플랫폼에
참고:이 섹션은 버전 A 또는 B 위에서 설명한을 추적할 수도 있습니다. 여기서 설명 하는 연구에서 그것은 단일 세포 분석에 독점적으로 적용 했다.
- 분석 결과 각 잘에서 시 로드 4 µ L를 포함 하 새로운 96-잘 PCR 격판덮개로 분석 결과 플레이트 (준비 단계 2.2에서에서) x 2에서 각 분석 결과의 pipetting 4 µ L에 의해 정량 분석 결과 접시를 준비 합니다. 분석 결과 플레이트 4 ° c.에 유지
참고: 분석 결과 접시와 한 달 동안-20 ° C에서 최대 1 주일까지 4 ° C에서 안정적입니다. 따라서, 그것은 여러 개의 칩에 대 한 충분 한 자료를 준비 하 고 적절 하 게 저장 하려면 유용할 수 있습니다. - 칩의 2 개의 흡 기 밸브에 못쓰게 주사기에서 제어 라인 체액을 분배. 접시 아래 보호 플라스틱을 제거 합니다. A 1 위치에서 노치 면 IFC 컨트롤러에 칩을 놓습니다. 주 메뉴에서 "총리" 스크립트를 선택 합니다. 스크립트를 실행 합니다.
- 실시간 반응 혼합 시 약 각 미세 칩에 대 한 PCR 마스터 믹스 (자료 테이블)의 500 µ L 로드 하는 샘플의 50 µ L를 혼합 하 여 준비 합니다. 새로운 96-잘 PCR 접시 이제부터 "샘플 접시"로 지정의 각 음에 4.4 µ L 플라스틱.
- 4.8 실시간 반응 혼합을 포함 하는 샘플 접시에 단계에서 1:5 희석된 cDNA의 3.6 µ L 플라스틱
참고: 경우 PCR 다운 선택 단계 6.2에서에서 설명한 것 처럼 희귀 (예를 들어, vRNA+)에 대 한 다운스트림 분석에 대 한 셀 화면, 긍정적인 풀에서 셀만 포함을 위해 수행 되었습니다. - 칩 못쓰게 완료, 다음 로드는 칩의 노치 (시험) 측에 잘 해당 시험 접시에서 분배 5 µ L 및 5 µ L 칩 후미 샘플 접시에서 잘 (샘플) 반대편에는 칩의 해당. IFC 컨트롤러에 칩을 삽입 하 고 "로드 믹스" 스크립트를 실행 합니다.
- 멀티플렉스 정량 Pcr을 수행 하기 위해 Biomark 플랫폼에 칩을 전송. 악기 설정 및 다음 단계별 실시간 PCR 분석 소프트웨어에서 제공 하 고 PCR의 40 주기 함께 진 식 (GE) 96.96 표준 V.1 프로토콜을 사용 하 여 정량 프로그래밍을 진행. 지정 된 폴더에서 ChipRun 파일을 저장 합니다.
참고: 여러 개의 칩 하루와 여러 일 동안 실행할 수 있습니다. - 정량 데이터를 분석 합니다.
- 실시간 PCR 분석 소프트웨어를 엽니다. "ChipRun.bml" 파일은 "파일 | 열기"메뉴입니다.
- "칩 탐색기"와 "칩 실행 요약" 소프트웨어 윈도우의 상단 왼쪽된 모서리에 찾습니다. 칩 실행 요약의 세 가지 구성 요소를 식별: 분석 보기, 샘플 설치 및 감지기 설치.
- "감지기 설치"를 클릭 하십시오. "작업"에서 "새로 만들기"를 클릭 하 고 컨테이너 유형 "SBS 판", 및 컨테이너 형식 "SBS96"를 선택 합니다. "매핑"을 옆에 클릭은... "M96-분석 결과-SBS96.dsp"를 버튼을, 선택한.
- 선택 사항: 할당 각 검출기 (시험) 숫자 또는 각의 "이름" 섹션에서 이름 잘 1세인트 에 두 번 클릭 합니다. 잘 "F2"를 눌러 다음으로 이동 합니다.
- "샘플 설치"를 클릭 하십시오. "작업" 옆 "매핑"을 클릭 합니다는... "M96-샘플-SBS96.dsp"를 버튼을, 선택한.
- "분석 보기"를 클릭 하십시오. "정량" 탭에서 "작업", 선택 "선형 (파생)에 대 한 기준선 보정", 그리고 "사용자 (감지기)에 대 한 Ct 임계값 방법". "Ct 임계값" 탭에서 "자동 상자 초기화"를 확인 하십시오. 위의 "분석" 버튼을 클릭 합니다.
- "분석 보기"의 상단 오른쪽 사분면에서 두 번째 탭 "결과 표"를 클릭 합니다. 드롭 다운 메뉴에서 "열 지도 보기"를 선택 합니다. 열 지도 데이터와 함께 표시 됩니다.
- 선택 사항: 칩에 걸쳐 균일 한를 이용한 형광을 되도록 선택 "열 맵 보기" 대신 "이미지 보기" 같은 메뉴에서 합니다. 열 지도 위에 오른쪽 창에서 두 번째에 "를 이용한"을 선택 합니다. 오른쪽 창에서 첫 번째, 1-40 주기 중 하나를 선택 합니다. 이용한 형광의 흑백 디스플레이를 전환 오른쪽 창에서 4를 클릭 하십시오. 이미지를 알리는 뿌려 놓은 것 요, 입자, 또는 칩에 결함이 표시 됩니다. 이용한 균일 가려진 조잡 한 경우 다시 칩을 실행 합니다.
- 열 지도 아래 "임계값" 및 "로그 그래프"를 클릭 합니다. 지 수 단계에 증폭 곡선을 교차 하는 데 필요한 임계값 분석 (열의 열 지도)에 클릭 하 여 수동으로 각 검출기에 대 한 Ct 임계값을 조정 합니다. 완료 되 면, "분석"을 클릭 합니다.
- 정량 데이터를.csv 파일로 내보냅니다. 스프레드시트 또는 통계 분석 소프트웨어 (예를 들어, JMP)로 데이터를 가져올 하 고 칩 샘플 및 분석 결과 위치로 결과. 새 열을 만들고 조건부 수식을 사용 하 여 바이러스 성 유전자의 표현에 따라 그룹으로 셀을 구성 합니다. "분석"에서 "맞는 Y에서 X", 선택 하 고 그룹 대 유전자 발현을 플롯 합니다. 통계 분석을 적용 합니다.
참고: 4 개의 SIV RNA 종의 대표 단일 셀 양적 표현 그림 5A에서 이항 플롯에 그려져 있습니다. SIV RNA+ 세포에 양적 호스트 유전자 발현은 그림 5B에 표시 됩니다. - 단일 셀 FACS 데이터에서 정량적 단백질 식 값을 추출 합니다.
- .fcs를 열고는 FACS에서 파일 정렬 (단계 6.1) 96 잘 접시 FlowJo 버전 9 사용 하 여 해당. 선택 강조 표시 파일 이름으로 "플랫폼 | 이벤트 번호 게이트 | 만들 인덱스 정렬 게이츠 ". 개별 셀 행에 의해 표시 된 표시 됩니다.
- 모든 96 셀 (안 행)를 선택 하 고 선택 "작업 영역 | 수출 | 선택 모든 보상된 fluors ". "데이터 형식"에서 "FCS 파일"을 선택 하 고 "내보내기"를 클릭 하 고 지정 된 폴더를 선택.
- 새로운 FlowJo 작업 영역으로 개별 셀에 대 한 새로운.fcs 파일을 끕니다. 모든 셀을 강조, "통계 추가" (왼쪽된 상단에 있는 "Σ" 버튼)을 클릭 합니다 "| 의미 | 모든 fluor 매개 변수 "입니다.
- 왼쪽된 상단에 있는 왼쪽에서 4 번째 버튼을 클릭 하 여 "테이블 편집기"를 엽니다. 첫 번째 셀의 모든 fluores를 선택 하 고 테이블 편집기 창으로 끕니다. 테이블 편집기 창에서 "만들기 및 보기 테이블" 맨 같은 단추를 클릭 합니다. 이것은 96 셀의 각 형 석에 대 한 숫자 매개 변수 테이블을 만듭니다.
- 출력 데이터베이스 소프트웨어 (예를 들어, MS Excel, JMP)에 두 복사/붙여넣기 또는 "저장 하 고 시작 응용 프로그램"을 클릭 하 여 (4에서 복사 테이블 위의 왼쪽된 버튼).
참고:이 절차는 FlowJo 버전 9에 대 한 특정. FlowJo 버전 10 인덱싱된 데이터를 가져올 다른 절차를 사용 합니다. 인덱싱된 흐름 데이터 복사/붙여 JMP 셀 정렬에서 만든.csv 파일에서 직접 하실 수 있습니다.
- 단일 셀 FACS 데이터 및 번호에 의해 정량 데이터를 병합 하 고 잘 위치. 결합 된 단일 셀 유전자 (정량)에 그래픽 및 통계 분석을 수행 하 고 단백질 식 (FACS) 데이터.
참고: 단일 셀의 예 결합 정량 및 FACS 데이터는 그림 6 에 나와 있습니다 (호스트 SIV에 감염, 접합 vRNA+ 붉은 털 원숭이 세포 표면 단백질 식 프로필), 그림 7 (c d 4 유전자 발현 표면 대 CD4 단백질 식 접합된 vRNA+ 붉은 털 원숭이 세포에서), 그리고 이전20출판. 차동 식별 하 셀 population(s) 관심 있는 유전자 표현, 단일 세포 분석 방법에서 설명한 권장된20,22,,2324, 차지 하는 연속 유전자 식 값으로 유전자에 대 한 긍정적인 셀의 비율.
결과
전체 프로토콜에 대 한 워크플로 그림 1에 묘사 된다. 그것은 이루어져 있다 2 개의 유사 콘텐츠를 정렬 하는 셀의 수에 의해 정의: 어느 제한 희석 또는 텍스트에 설명 된 대로 셀, 싱글로. 2-fold 직렬 RNA 희석에 뇌관 프로브 자격 분석의 예는 그림 2에 표시 됩니다. 잠재적인 SIV+ 셀을 식별 하는 제어 전략은 그림 3에 표시 됩니다. 하우스키핑 유전자 GAPDH FACS 정렬 셀 제한 희석에 대 한 성공, 차선 및 실패 한 품질 관리 정량은 그림 4에 나와 있습니다. 단일 셀 양적 유전자의 표현은 4 SIV RNA 종과 붉은 털 원숭이 차동 감염 된 세포에 표현 된 그림 5에 나와 있습니다. 대표 이항, 히스토그램, 및 scatterplots+ T SIV RNA+ CD4의 표면 단백질 식 프로필 묘사 셀 cytometry 그림 6에 의해 측정. Trivariate 거품 플롯 (그림 7) 표면 CD3 또는 CD4 단백질, CD3 또는 CD4 mRNA 및 양적 바이러스 유전자 사이의 관계를 표시 (문신/레 브) 단일 셀에 식.

그림 1 : 실험 워크플로의 회로도에서는 세 가지 주요 구성 요소: cytometric 정렬, 반전 녹음 방송 플러스 cDNA의 사전 증폭 PCR 기반 흐름 (RT, 프리 앰프), 고 정량. 정렬 제한 한 희석 (A, 녹색 배경) 또는 단일 셀 (B, 주황색 배경)으로 수행할 수 있습니다. FACS 정렬에는 즉시 다음 셀 lysed 고 RNA cDNA와 미리 증폭된 (RT, 프리 앰프 PCR) 정량 템플릿을 준비 하로 베낀 반전은. 제한 희석 종류 실험 효율성과 푸아송 분포 통계를 사용 하 여 바이러스 성 RNA에 대 한 긍정적인 세포의 주파수를 결정 고 복구. 녹색 화살표 머리 셀의 예상된 수, (긍정적인 유전자를 되 고 같은 우물의 63.2% 확률에 해당) 바이러스 성 유전자에 대 한 긍정적인 잘 포함 한 셀 당 정렬 셀 주파수로 개조 되는 나타냅니다. 주파수 견적 후속 정렬 (B)에서 수집 된 단일 셀의 수를 사용할 수 있습니다. 인덱싱된 단일 셀 FACS 정렬 예금 하나 잘 당 세포 고 96 잘 접시 내 좋은 위치에 의해 주석이 각 셀에 대 한 데이터 파일을 생성 합니다. 단일 셀 정량 96 유전자에 대 한 멀티플렉스에서 동시에 수행 됩니다. 표면 단백질 (FACS)와 mRNA 식 개별 셀 (오른쪽 열)의 프로 파일링 할 수 있습니다. 바이러스 유전자에 대 한 선택적 정량 Pcr을 수행할 수 있습니다 사전 증폭 PCR 및 다중화 정량 (B, 중간) 화면 단일 셀 또는 풀 다운 선택 바이러스 성 RNA+ 셀을 단일 셀 cDNA의 또는 다중 정량 분석에 대 한 풀 사이. 열 지도 96 분석 (열)에 대 한 유전자 발현 (Ct 값) 및 96 단일 셀 (행)를 보여 줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 뇌관 자격 실험에서 대표 정량 데이터에 대 한 표시 됩니다 성공 (왼쪽 및 가운데) (오른쪽) 상용 분석 실험 실패 (CD6, SIV 문신/회전, 및 TLR3, 각각). CD6 및 TLR3, RNA 106 FACS 정렬 붉은 털 원숭이 PBMC CD4에서 추출 된에 대 한+ 상업 키트를 사용 하 여 T-셀. 8 12 포인트 RNA 2 배 희석 시리즈의 복제 (0.023-48 ng RNA, 가정 20 세 RNA CD4 당 1.2-2400 셀을 해당+ T-세포) RT-앰프 및 정량을. SIV 문신/레 브에 대 한 RNA 감염 PBMCs에서 생체 외에서 SIVmac239와 붉은 털 원숭이에서 추출 했다. RNA 희석에는 6-12, 000 셀의 스패닝 RNA 등가물 준비가 되어 있었다. 동부 표준시 (40-Ct) 값, 유전자 발현, 증가 예상된 핸드폰 번호 대 그려집니다. 희석 시리즈 R2 전시 > 0.97 3.32 ± 0.3의 슬로프 성공적인 뇌관 자격을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
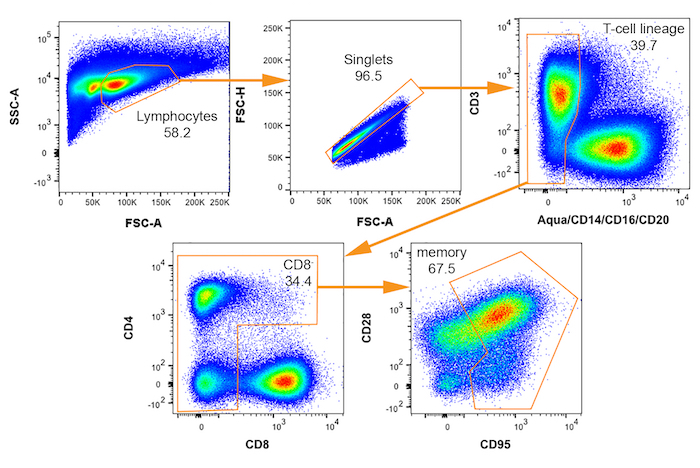
그림 3: 이항 FACS 게이팅 붉은 털 원숭이 세포 SIV에 의해 잠재적으로 감염의 격리에 대 한 체계와 플롯. 메모리 (CD95 +)을 선택 하기 위한 순차적 게이츠 CD4+ T 세포는 각 인구 이름이 표시 된 오른쪽을 낮은 왼쪽 상단에서 표시 됩니다. 각 게이트 내 부모 플롯의 % 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : FACS 정렬 셀 희석 사용 하 여 제한에 정량의 대표적인 실험 검증 수행 GAPDH 3 개의 독립적인 실험에 대 한 내부 관리 유전자: 성공 (왼쪽), 차선 (가운데), 실패 (오른쪽). 더 이상 2 Ets와 300-1000 셀 웰 스 1에서 잘 당 10-100 셀의 복제 걸쳐 동부 표준시. 선형 회귀 기울기 3.32 ± 0.3, R2 이어야 한다 > 0.95. 이러한 사양을 달성 하는 실패는 단계 1, 2, 3, 또는 조합에서에서 기술적인 어려움을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5 : 단일 셀 양적 바이러스와 호스트 유전자 발현 FACS 정렬 붉은 털 원숭이 CD4에+ Mesenteric 림프 노드 10 일 게시물 SIVmac251 감염에서 T 셀. (A) 바이러스 성 유전자 발현 이항 곱하기 접합의 플롯 (문신/레 브) 그리고 단일 접합 (env) 단일에 의해 SIV mRNA 세포 (왼쪽). 문신/계+환경을- 셀 (빛 녹색 x 축 따라) 익스프레스 문신의 적은 복사본 /레 브 RNA는 초기와 일치 환경을+ 셀 (짙은 녹색), 보다 감염의 고 계 단백질 중재 및 환경을 등 부분적으로 접합된 vRNAs의 핵 수출 이전 단계. 접합된 바이러스 성 RNA를 표현 하지 않는 셀은 회색 (바이러스 성 RNA), 브라운 (+ 개 그및 LTR+), 또는 (+ 개 그또는 LTR+) 탄에 묘사 된다. (개 그+) unspliced와 총 (LTR+) SIV mRNA 식 (오른쪽) 같은 셀에 표시 됩니다. Unspliced 개 그 RNA 문신에 높은 풍부 /계++ 환경을 셀은 늦은 단계 생산적인 감염 기간 동안 풍부한 게놈 RNA 신진으로 포장에 대 한 표현으로 일관 virions입니다. (B) 바이올린 플롯의 붉은 털 원숭이 유전자 차동 감염 되지 않은 세포 (회색)에 비해 SIV에 감염 된 세포의 하나 이상의 하위 집합에 표시 합니다. 앞에서 설명한20,22,,2324통계 분석 수행 되었다. 별표는 감염 되지 않은 세포에 상대적인 결합된 가능성 비율 시험 비교에서 false 검색 속도 < 10%를 나타냅니다. 선 각 유전자에 대 한 셀 그룹에서 평균 값을 연결합니다. 이 그림에서 볼튼 외 수정 되었습니다. 20 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6: 대표 호스트 붉은 털 원숭이 mesenteric 림프 노드 10 일 게시물 SIVmac251 감염에서 FACS 정렬 세포의 표면 단백질 식 프로필. (A) Scatterplot CD3, CD4, 그리고 ICOS 표면 단백질 표정에 감염 되지 않은 (회색)+ 개 그문신/계- (갈색), 그리고문신/계+ + 개 그셀 (녹색)의 표시. 형광 강도 각 셀 (점)에 대 한 플롯 됩니다. 국외 자 상자 플롯 묘사 interquartile 범위 (IQR) 및 중간 (상자), 1.5에서 먼 포인트 상자 (수염), 및 잠재적인 outliers (분리 점)에서 x IQR. 상단에 가로 막대 표시 중요 한 차이 (p < 0.05, 비패라메트릭 Wilcoxon 순위 테스트). (B) Bivariate 및 히스토그램 표시 (A)에 표시 된 셀에 대 한 표면 CD3, CD4 단백질 표정. 도트 그림 (왼쪽)는 사분면 내에서 각 셀의 비율을 나타냅니다. CD3, CD4 히스토그램 (가운데, 오른쪽)는 감염 되지 않은 상대문신/계+ 셀+ 개 그와+ 개 그문신/계- 세포 표면 단백질 downregulation를 묘사. (C) 12 대표적인 문신/계+ (A-B)에서 단일 셀 (왼쪽) CD3/CD4, CD69/CD38 (가운데)과 ICOS/HLA-DR (오른쪽)의 표면 표현에 대 한 3 개의 이항 플롯에 걸쳐 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
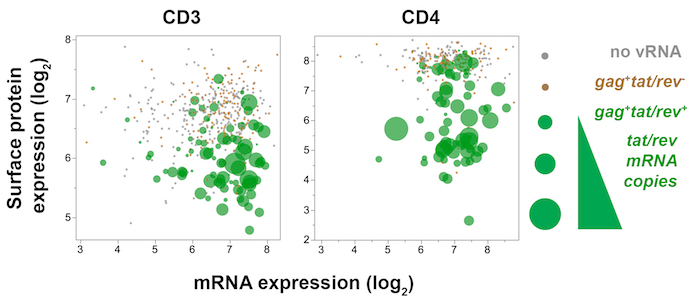
그림 7 : Trivariate 플롯 표시 단일 셀 바이러스 성 유전자 (문신/레 브), 호스트 유전자 (CD3 , CD4)와 SIV에 감염 된 메모리 CD4 호스트 표면 단백질 CD3 (CD4) 식+ T 세포 mesenteric 림프절에서 10 일 포스트 SIVmac251 감염. 문신/회전 각 셀으로 표현의 금액은 점 크기에 의해 반영 하는 동안 CD4 단백질 식 (형광) CD4 mRNA (정량)에 대 한 플롯 됩니다. 문신에 / 셀레 브+ (녹색), 지속적인된 CD4 , CD3 녹취 록과 함께 표면 CD4, CD3 단백질 표정 각각 감소, 표면 단백질 표정 하류 변조 표시 진 식입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
표 1: 뇌관 및 프로브 SIV 핵 산의 검출에 사용. 두 시퀀스는 뇌관 또는 프로브에 대 한 때, 두 시퀀스의 아데닌 금액 사용 되었다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
표 2: amplicons Biomark 악기에의 정량에 사용 되는 96-유전자 패널. 4 SIV 분석 파란색 배경으로 표시 됩니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
표 3: 반전 녹음 방송 및 사전 증폭에 사용 되는 반응 혼합. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
표 4: 정량 Pcr 반응 혼합 실시간 PCR에 사용 되는 양의 스튜디오 6 악기에 수행. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
추가 코딩 파일 1. 진 식 분석 자격에 대 한 지침. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
추가 코딩 파일 2: JMP 서식 파일 샘플 지도. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
추가 코딩 파일 3: JMP 서식 파일 조사 지도. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
추가 코딩 파일 4: JMP 뇌관 분석 스크립트. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
추가 코딩 파일 5. JMP 불연속 분석 스크립트. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
프로토콜 여기에 설명 된, tSCEPTRE 되 나, 높은 다중화 실시간 정량 Pcr에 의해 양적 단일 셀 mRNA 식 multiparameter cytometry에 의해 통합 하는 단일 세포 표면 단백질 정량. 이 두 기술의 조합 transcriptional는 결합의 높은 콘텐츠 스냅샷 및 높은 처리량 형식에서 단일 세포의 단백질 프로필 수 있습니다. 우리는 메서드를 사용 하 여 지금까지 애매 셀 SIV에서 vivo에서, 감염을 식별 하 고 차동 표현된 호스트 유전자와 단백질을 설명. 프로토콜 표면 protein(s), mRNA, 또는 조합을의 식에서 구별할 수의 어떤 셀의 연구에 대 한 적용할 수 있습니다. 설명된 방법 정확한 단일 셀 정렬에 의존 및 cytometry에 의해 기록 데이터와 상용 정량 시 약 실시간 PCR 계측 다중화. 출력은 단일 셀 결합된 단백질 및 유전자 표현 데이터의 구분, 양적 평가 이다.
다른 접근을 연결 하는 단일 세포에서 단백질 및 유전자 표현 되었습니다1,25,,2627설명. 인덱싱된 FACS 정렬 뒤에 RNAseq, 조 혈 줄기 세포의 특성에 성공적으로 적용 된 특히 유망한 접근28을 나타냅니다. 그러나, RNAseq는 몇몇 이점이 타겟된 유전자 표정 분석, 즉 편견된 전체 transcriptome 분석, 그것는 높은 여러 비교 통계 비용 및 낮은 복사의 정량화에 대 한 덜 민감한 있을 수 있습니다. 성적 증명서입니다. 또한, 그것은 현재 주파수에서 현재 희귀 감염 된 세포를 찾아 셀의 수천에 RNAseq를 수행 하기 위해 경제적으로 가능한 < 1% (예를 들면, HIV, SIV). 다른 신흥 단일 셀 기술 즉, FACS 또는 PCR, 단백질 및 핵 산 같은 셀의 검출을 위한 단일 판독을 생성 하고자 합니다. 형광 항 체에 의해 단백질의 mRNA FACS 분석 (mRNA-흐름-물고기)14,15,,2930다음 형광 oligonucleotide 조사에 의해 검출 포함 됩니다. 또한, 단백질 정량 반대로 베낀된 mRNA31,32,,3334 병행에서 하 여 검색 된 oligonucleotide 항 체 어원이 같은 말의 쌍에 의해 검출 될 수 있다 . 이러한 "" 하이브리드 접근 제공 동시 핵 산 및 단백질 측정 단일 셀 해상도 유사한 tSCEPTRE, 하지만 그들은 제한 된 어디 하거나 하지 양적 (mRNA-흐름-물고기) 또는 해야 할 수도 있습니다 사용자 지정 된 항 체 또는 mRNA 조사 합니다. 우리의 tSCEPTRE 접근 mRNA와 단백질 측정을 위한 양적 이며 모든 시 약은 상업적으로 사용할 수, 병원 체 관련 분석 실험의 가능한 예외와 함께.
특별 한 주의 실험 샘플의 분석에 앞서 프로토콜의 여러 단계에 적용 되어야 한다. 첫째, 높은 매개 변수 cytometry 민감한 감지 및 해결35되도록 형광 항 체의 패널의 주의 최적화 필요 합니다. 각 항 체를 달성할 최적의 분리 및 최소한의 배경 얼룩, 얼룩 모든 항 체 어원이 같은 말에에서 사용 하는 경우의 평가 다음 농도 식별 하기 위해 개별적으로 적정 한다. 관심사의 각 유전자를 측정 하는 적절 한 정량 유전자 식 분석 결과의 두 번째, 실험 결정은 필수적 이다. 여러 상용 분석 각 유전자에 대 한 일반적으로 사용할 수 있지만 우리의 경험에서는, 많은 단일 셀 레벨6에서 양적. 따라서, 모든 제안 된 분석 정량 유전자 발현에 대 한 사용 하 여 순차적으로 희석된 RNA 사전에 자격을 중요 하다. 이 시 약의 최적화는 시간이 걸리는, 하지만 시간을 투자를 정당화 하는 관심의 모든 분자의 과민 한 탐지를 허용 하는 항 체 어원이 같은 말 및 유전자 표정 분석 실험의 신뢰할 수 있는 패널의 값. 또한, 우선 순위는 엑손 exon 접합 (지정 접미사 "m1") mRNA에 대 한 특이성을 개선 하기 위해 대체 분석 실험 (접미사 "s1" 또는 "g1" 게놈 DNA를 감지 할 수 있지만 프로브를 포함 분석 하는 상용 실험에 주어져야 한다 ) 진 식 결과 각 셀에서 해당 염색체 복사본에 영향을 미칠 가능성이 있는 것으로 간주 됩니다. RT의 상류 RNA의 보존 중요 한 이며 프로토콜에 걸쳐 설명한 것 처럼 샘플, 냉장을 유지 하 여 이루어집니다. 마찬가지로, FACS 정렬 및 정렬 사이 간격의 기간 및 RT-프리 앰프는 최소한으로 유지 되어야 한다. 모두 제한 희석 및 단일 셀 정렬, cDNA 분석할 수 있습니다 먼저 기존의 정량 평가의 RNA 복구 하 여 높은 내부 관리 유전자 표현. 관찰 된 식의 핸드폰 번호, 같은 복제 또는 제한 희석 실패 유효성 검사에 대 한 선형 적합의 슬로프 중 균일 하지 않으면 문제 해결 셀 정렬 및 다운스트림 절차에서 수행 되어야 합니다.
여기서 설명 하는 접근의 잠재적인 한계 (1) 특히 mRNA 결합 접속점, 그리고 표면 단백질 및 유전자 측정 (2) 제한 수에 대 한 특정 분석 실험에 대 한 뿐만 아니라 RNA, DNA의 탐지를 포함 합니다. 그러나, DNA 검출 위에서 언급 한 이유로 차동 호스트 유전자 표정 분석에 실질적으로 기여할 가능성이 크다. 또한, 직접 우리는 DNA는 두 가지 방법으로이 프로토콜에서 정량 신호에 기여 하는 정도 측정: a) 역전사를 제외 하 고 b) 수정 세포 세포의 용 해 프로토콜 핵 막 세포를 강화 하. 하지만 역전사의 부재, 둘 다 접합 및 unspliced 바이러스 성 유전자 검색 여전히 훨씬 저렴 역전사 존재 보다 주파수 (~ 6-fold와 2-fold 감소, 각각)20. 따라서, 바이러스 성 유전자 표정 분석 실험과 대 평가 하는 셀 셀 관련 바이러스 성 DNA의 존재 때문에 바이러스 성 RNA의 양을 수 있습니다. 우리는 들어오는 virions36에서 발생 하는 접합 및 unspliced SIV/HIV RNA 발생 알려진 호스트 세포 감염 시 생성 되는 세포질 RT 제품을이 찾는 특성. 따라서, 그것은 일부 응용 프로그램에 대 한 서식 파일 DNA 파생을 quantitate를 역전사 부족 조건에 실험의 한 부분 사용 하는 것이 좋습니다 있을 수 있습니다. 그것은 들어오는 바이러스에서 파생 된 unspliced SIV/HIV RNA 합성 드 노 보 바이러스 성 RNA에서 구분할 수 없습니다 주목 해야한다. 둘째, 우리 RT preamp 프로토콜에 핵 세포 단계를 통합 하 고 통합된 SIV DNA (Alu LTR) 복사본에 있는 지 수 증가 관찰 (볼튼의그림 S3 그 외 여러분) 20. 게놈 DNA는 따라서 여기에 사용 된 세포 세포의 용 해 방법에서 추출한 핵 산 서식 파일에 실질적으로 기여할 가능성이. 메모의, 핵 세포 단계 추가 SIV latently 감염 된 세포를 포함 하 여 다른 바이러스 DNA 양성 세포를 조사 하고자 하는 유용한 미래에 단일 셀 연구 수 있습니다.
표면 단백질 분석 수 흐름 cytometric 셀 정렬의 기능에 의해 결정 됩니다. 현재 상업적으로 이용 가능한 악기 30 매개 변수를 초과 하지 마십시오. 고급 cytometry 채용 미래 연구 단백질 프로 파일링이 접근의 기능을 확대 추가 됩니다. 장비 및 계측 성적 증명서의 수 또한 96, 제공 된 지원 시 약(예를 들어, 높은 농도의 프라이 머)를 넘어 확장할 수 있습니다. 궁극적으로, 신기술 단일 셀 프로테옴 (질량 분석)의 분석을 결합 하는, transcriptome (RNAseq), 및 게놈 (DNAseq) 보다 우선 합니다 발견 연구31,37, 에 대 한 타겟된 접근 38 , 그러나 39., 타겟된 정량 가능성이 남아 있을 것 이다 같은 "omics" 접근으로 금 표준 양적 표현 분석에 대 한 유효성을 검사 하기 위한 유용한 도구.
TSCEPTRE에 의해 결합 된 단백질 및 전사 분석 또는 그 병원 체를 품고, oncogenes, 포함 된 또는 그렇지 않으면 탈 형을 전시 등 셀을 식별 하기 어려운 희귀 조사를 위한 강력한 도구입니다. 이러한 방법으로, 이러한 바이러스 성 감염의 병 인에 관련 된 새로운 메커니즘의 발견에서 transcriptionally 활성 SIV/에이즈에 감염 된 세포에 대 한 새로운 표시를 식별 수 있습니다. Latently 감염 된 세포의 식별은 엉덩이 바이러스 성 DNA 주인 게놈에 통합 하는 프로토콜의 추가 개발이 필요 합니다. 메모의 HIV/SIV에 감염 된 세포의 주파수는 상당히 낮은 만성 viremic 또는 치료 감염,이 설정에서 파생 된 공부 감염 된 세포에서 실용적인 과제를 발표할 예정 이다. 우리의 접근 이전 다루기 힘든 메커니즘을 평가 하기 위한 기초 낳는다: 단일 세포 수준에서 post-transcriptional 규칙의 호스트 병원 체 상호 작용 뿐만 아니라 좀 더 일반적인 세포질 과정의 광범위 한 적용을 있다.
공개
이 작품은 헨리 M. 잭슨 기초 군사 의학 발전, inc., 그리고 국방 미국 부서 (국방부) 사이 협력 계약 (W81XWH-07-2-0067)에 의해 지원 되었다. 표현 그 저자 고 미 육군 또는 국방부의 위치를 나타내는 해석 되어서는 안 됩니다. 연구 동물 복지 행위 및 다른 연방 법령 및 동물에 관련 된 규정 준수 AAALACi 공인 시설에서 승인 된 동물 사용 의정서 실시와 관련 된 동물 실험 원칙을 준수 관리 및 실험 동물의 사용, NRC 게시, 2011 년 판에 대 한 가이드에 명시 된.
감사의 말
저자는 NIAID VRC Flow Cytometry 코어와 MHRP Flow Cytometry 핵심 시설 유지 보수 및 FACS 악기와 정렬 장비 운영에 대 한 감사 하 고 싶습니다. 마리아 몬테, Vishakha Sharma, Kaimei 노래 전문가 기술 지원; 마이클 Piatak, 주니어 (고 인)를 통해 SIV 정량 분석 결과 디자인; 브랜든 킬와 SIV에 대 한 매튜 Scarlotta 시퀀스를 분리 하 고. 표현 그 저자 고 미 육군 또는 국방부의 위치를 나타내는 해석 되어서는 안 됩니다. 연구 동물 복지 행위 및 다른 연방 법령 및 동물에 관련 된 규정 준수는 AAALAC 공인 시설에서 승인 된 동물 사용 의정서 실시와 관련 된 동물 실험 원칙을 준수 관리 및 실험 동물의 사용, NRC 게시, 2011 년 판에 대 한 가이드에 명시 된.
자료
| Name | Company | Catalog Number | Comments |
| RNA extraction and PCR reagents and consumables | |||
| Genemate 96-Well Semi-Skirted PCR Plate | BioExpress/VWR | T-3060-1 | |
| Adhesive PCR Plate Seals | ThermoFisher | AB0558 | |
| Armadillo 384-well PCR Plate | ThermoFisher | AB2384 | |
| MicroAmp Optical Adhesive Film | Applied Biosystems/ThermoFisher | 4311971 | |
| DEPC Water | Quality Biological | 351-068-101 | |
| Glass Distilled Water | Teknova | W3345 | |
| Superscript III Platinum One-Step qRT-PCR Kit | Invitrogen/ThermoFisher | 11732088 | |
| SUPERase-In Rnase Inhibitor | Invitrogen/ThermoFisher | AM2696 | |
| Platinum Taq | Invitrogen/ThermoFisher | 10966034 | |
| dNTP Mix | Invitrogen/ThermoFisher | 18427088 | |
| ROX Reference Dye (if separate from kit) | Invitrogen/ThermoFisher | 12223012 | |
| DNA Suspension Buffer | Teknova | T0223 | |
| RNAqueous kit | Invitrogen/ThermoFisher | AM1931 | |
| TaqMan gene expression assays not listed in Table 2 | |||
| CD6 | Applied Biosystems/ThermoFisher | Hs00198752_m1 | |
| TLR3 | Applied Biosystems/ThermoFisher | Hs1551078_m1 | |
| Biomark reagents | |||
| Control Line Fluid Kit | Fluidigm | 89000021 | |
| TaqMan Universal PCR Mix | Applied Biosystems/ThermoFisher | 4304437 | |
| Assay Loading Reagent | Fluidigm | 85000736 | |
| Sample Loading Reagent | Fluidigm | 85000735 | |
| Dynamic Array 96.96 (chip) | Fluidigm | BMK-M-96.96 | |
| FACS reagents | |||
| SPHERO COMPtrol Goat anti-mouse (lambda) | Spherotech Inc. | CMIgP-30-5H | |
| CompBeads Anti-Mouse Ig,k | BD Biosciences | 51-90-9001229 | |
| 5 ml Polystyrene tube with strainer cap | FALCON | 352235 | |
| Aqua Live/Dead stain | Invitrogen/ThermoFisher | L34976 | dilute 1:800 |
| Mouse Anti-Human CD3 BV650 clone SP34-2 | BD Biosciences | 563916 | dilute 1:40 |
| Mouse Anti-Human CD4 BV786 clone L200 | BD Biosciences | 563914 | dilute 1:20 |
| Mouse Anti-Human CD8 BUV496 clone RPA-T8 | BD Biosciences | 564804 | dilute 1:10 |
| Mouse Anti-Human CD28 BV711 clone CD28.2 | Biolegend | 302948 | dilute 1:20 |
| Mouse Anti-Human CD95 BUV737 clone DX2 | BD Biosciences | 564710 | dilute 1:10 |
| Mouse Anti-Human CD14 BV510 clone M5E2 | Biolegend | 301842 | dilute 1:83 |
| Mouse Anti-Human CD16 BV510 clone 3G8 | Biolegend | 302048 | dilute 1:167 |
| Mouse Anti-Human CD20 BV510 clone 2H7 | Biolegend | 302340 | dilute 1:37 |
| Anti-CD38-R PE clone OKT10 | NHP reagent recource | N/A | dilute 1:100 |
| Mouse Anti-Human CD69 BUV395 clone FN50 | BD Biosciences | 564364 | dilute 1:10 |
| Mouse Anti-Human HLA-DR APC-H7 clone G46-6 | BD Biosciences | 561358 | dilute 1:20 |
| Mouse Anti-Human ICOS Alexa Fluor 700 clone C398.4A | Biolegend | 313528 | dilute 1:80 |
| Instruments | |||
| BioPrptect Containment Enclosure | Baker | ||
| BD FACS Aria | BD Biosciences | ||
| ProtoFlex Dual 96-well PCR system | Applied Biosystems/ThermoFisher | 4484076 | |
| Quant Studio 6 qPCR instrument | Applied Biosystems/ThermoFisher | 4485694 | |
| IFC controller HX | Fluidigm | IFC-HX | |
| Biomark HD | Fluidigm | BMKHD-BMKHD |
참고문헌
- Macaulay, I. C., Ponting, C. P., Voet, T. Single-Cell Multiomics: Multiple Measurements from Single Cells. Trends Genet. 33 (2), 155-168 (2017).
- Pasternak, A. O., Lukashov, V. V., Berkhout, B. Cell-associated HIV RNA: a dynamic biomarker of viral persistence. Retrovirology. 10, 41 (2013).
- Mailler, E., et al. The Life-Cycle of the HIV-1 Gag-RNA Complex. Viruses. 8 (9), (2016).
- Varmus, H. Retroviruses. Science. 240 (4858), 1427-1435 (1988).
- Frankel, A. D., Young, J. A. HIV-1: fifteen proteins and an RNA. Annu Rev Biochem. 67, 1-25 (1998).
- Dominguez, M. H., et al. Highly multiplexed quantitation of gene expression on single cells. J Immunol Methods. 391 (1-2), 133-145 (2013).
- Tokarev, A., Guatelli, J. Misdirection of membrane trafficking by HIV-1 Vpu and Nef: Keys to viral virulence and persistence. Cell Logist. 1 (3), 90-102 (2011).
- Malim, M. H., Bieniasz, P. D. HIV Restriction Factors and Mechanisms of Evasion. Cold Spring Harb Perspect Med. 2 (5), a006940 (2012).
- Sugden, S. M., Bego, M. G., Pham, T. N., Cohen, E. A. Remodeling of the Host Cell Plasma Membrane by HIV-1 Nef and Vpu: A Strategy to Ensure Viral Fitness and Persistence. Viruses. 8 (3), 67 (2016).
- Simon, V., Bloch, N., Landau, N. R. Intrinsic host restrictions to HIV-1 and mechanisms of viral escape. Nat Immunol. 16 (6), 546-553 (2015).
- Kirchhoff, F. Immune evasion and counteraction of restriction factors by HIV-1 and other primate lentiviruses. Cell Host Microbe. 8 (1), 55-67 (2010).
- Wigzell, H. Immunopathogenesis of HIV infection. J Acquir Immune Defic Syndr. 1 (6), 559-565 (1988).
- Reynolds, M. R., et al. Ex vivo analysis of SIV-infected cells by flow cytometry. Cytometry A. 77 (11), 1059-1066 (2010).
- Baxter, A. E., et al. Single-Cell Characterization of Viral Translation-Competent Reservoirs in HIV-Infected Individuals. Cell Host Microbe. 20 (3), 368-380 (2016).
- Grau-Exposito, J., et al. A Novel Single-Cell FISH-Flow Assay Identifies Effector Memory CD4+ T cells as a Major Niche for HIV-1 Transcription in HIV-Infected Patients. MBio. 8 (4), (2017).
- Eriksson, S., et al. Comparative analysis of measures of viral reservoirs in HIV-1 eradication studies. PLoS Pathog. 9 (2), e1003174 (2013).
- Finzi, D., et al. Identification of a reservoir for HIV-1 in patients on highly active antiretroviral therapy. Science. 278 (5341), 1295-1300 (1997).
- Chomont, N., et al. HIV reservoir size and persistence are driven by T cell survival and homeostatic proliferation. Nat Med. 15 (8), 893-900 (2009).
- DeMaster, L. K., et al. A Subset of CD4/CD8 Double-Negative T Cells Expresses HIV Proteins in Patients on Antiretroviral Therapy. J Virol. 90 (5), 2165-2179 (2015).
- Bolton, D. L., et al. Combined single-cell quantitation of host and SIV genes and proteins ex vivo reveals host-pathogen interactions in individual cells. PLoS Pathog. 13 (6), e1006445 (2017).
- Quintans, J., Lefkovits, I. Precursor cells specific to sheep red cells in nude mice. Estimation of frequency in the microculture system. Eur J Immunol. 3 (7), 392-397 (1973).
- Finak, G., et al. MAST: a flexible statistical framework for assessing transcriptional changes and characterizing heterogeneity in single-cell RNA sequencing data. Genome Biol. 16, 278 (2015).
- McDavid, A., et al. Modeling bi-modality improves characterization of cell cycle on gene expression in single cells. PLoS Comput Biol. 10 (7), e1003696 (2014).
- McDavid, A., Finak, G., Gottardo, R. The contribution of cell cycle to heterogeneity in single-cell RNA-seq data. Nat Biotechnol. 34 (6), 591-593 (2016).
- Kok, Y. L., Ciuffi, A., Metzner, K. J. Unravelling HIV-1 Latency, One Cell at a Time. Trends Microbiol. , (2017).
- Rato, S., Golumbeanu, M., Telenti, A., Ciuffi, A. Exploring viral infection using single-cell sequencing. Virus Res. 239, 55-68 (2017).
- Wagner, A., Regev, A., Yosef, N. Revealing the vectors of cellular identity with single-cell genomics. Nat Biotechnol. 34 (11), 1145-1160 (2016).
- Nestorowa, S., et al. A single-cell resolution map of mouse hematopoietic stem and progenitor cell differentiation. Blood. 128 (8), e20-e31 (2016).
- Soh, K. T., et al. Simultaneous, Single-Cell Measurement of Messenger RNA, Cell Surface Proteins, and Intracellular Proteins. Curr Protoc Cytom. 75, 41-47 (2016).
- Kochan, J., Wawro, M., Kasza, A. Simultaneous detection of mRNA and protein in single cells using immunofluorescence-combined single-molecule RNA FISH. Biotechniques. 59 (4), 209-212 (2015).
- Stahlberg, A., Thomsen, C., Ruff, D., Aman, P. Quantitative PCR analysis of DNA, RNAs, and proteins in the same single cell. Clin Chem. 58 (12), 1682-1691 (2012).
- Assarsson, E., et al. Homogenous 96-plex PEA immunoassay exhibiting high sensitivity, specificity, and excellent scalability. PLoS One. 9 (4), e95192 (2014).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nat Biotechnol. 20 (5), 473-477 (2002).
- Genshaft, A. S., et al. targeted profiling of single-cell proteomes and transcriptomes in a single reaction. Genome Biol. 17 (1), 188 (2016).
- Mahnke, Y. D., Roederer, M. Optimizing a multicolor immunophenotyping assay. Clin Lab Med. 27 (3), 469-485 (2007).
- Liang, C., Hu, J., Russell, R. S., Kameoka, M., Wainberg, M. A. Spliced human immunodeficiency virus type 1 RNA is reverse transcribed into cDNA within infected cells. AIDS Res Hum Retroviruses. 20 (2), 203-211 (2004).
- Stegle, O., Teichmann, S. A., Marioni, J. C. Computational and analytical challenges in single-cell transcriptomics. Nat Rev Genet. 16 (3), 133-145 (2015).
- Wu, M., Singh, A. K. Single-cell protein analysis. Curr Opin Biotechnol. 23 (1), 83-88 (2012).
- Haque, A., Engel, J., Teichmann, S. A., Lonnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Med. 9 (1), 75 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유