Method Article
תא בודד כימות של mRNA וביטוי חלבונים השטח ב- CD4 הנגועים בנגיף+ T תאים מבודדים מן קופי מקוק רזוס
In This Article
Summary
תיאר מתודולוגיה quantitate את הביטוי של גנים 96, 18 פני שטח חלבונים על ידי תאים בודדים לשעבר vivo, המאפשרות הזיהוי באופן שונה באה לידי ביטוי גנים, חלבונים בתאים הנגועים בנגיף ביחס תאים נגוע. אנו מיישמים את הגישה ללימוד CD4 הנגועים סיב+ T תאים מבודד קופי מקוק רזוס.
Abstract
ניתוח מתא בודד הוא כלי חשוב ניקוד אוכלוסיות הטרוגניות של תאים. זיהוי ובידוד של תאים נדיר יכול להיות קשה. כדי להתגבר על האתגר הזה, שילוב מתודולוגיה באינדקס cytometry זרימה, פיתחה תגובת שרשרת של פולימראז כמותיים מרובבת תפוקה גבוהה (qPCR). המטרה היתה כדי לזהות ולאפיין הקופי הכשל החיסוני (SIV)-נגוע תאים מתנה בתוך קופי מקוק רזוס. באמצעות כימות של חלבונים פני השטח על-ידי תא לפעיל על-ידי קרינה פלואורסצנטית מיון (FACS), ה-mRNA מאת qPCR, תאים הנגועים בנגיף מזוהים על ידי ביטוי גנים ויראלי, אשר בשילוב עם המידות גנים וחלבונים המארח כדי ליצור פרופיל רב-ממדי . אנו המונח את הגישה, הערכה תא בודד Proteo-תעתיק יישוב או tSCEPTRE. כדי לבצע את השיטה, התאים קיימא מוכתמים פלורסנט נוגדנים ספציפיים עבור סמני פני השטח המשמש לבידוד FACS תא משנה ו/או ניתוח פנוטיפי במורד הזרם. תאים בודדים מסודרים שהופעלו על ידי פירוק מיידי, שעתוק במהופך מולטיפלקס (RT), הגברה קדם PCR qPCR תפוקה גבוהה של עד 96 הפרוטוקולים. מדידות FACS הקליט בזמנו של מיון, ולאחר מכן לקשר את הנתונים ביטוי גנים לפי מיקום טוב כדי ליצור חלבון בשילוב פרופיל תעתיק. ללמוד הנגועים SIV תאים ישירות vivo לשעבר, תאים זוהו על ידי זיהוי qPCR של מספר מינים RNA נגיפי. השילוב של תעתיקים ויראלי את הכמות של כל אחת לספק מסגרת לסיווג תאים לשלבים ברורים של מחזור חיי ויראלי (למשל, היצרני לעומת לא פרודוקטיביים). יתר על כן, tSCEPTRE של תאים סיב+ היו תאים בהשוואה נגוע מבודד מן הדגימה זהה כדי להעריך המארח באופן שונה ביטוי גנים, חלבונים. ניתוח הנתונים גילה הטרוגניות ביטוי RNA נגיפי קודם לכן לא מוערך בין תאים נגועים וכן ויוו בתיווך סיב post-transcriptional הכונה ברזולוציה של תא בודד. שיטת tSCEPTRE רלוונטי לניתוח של כל התושבים תא לבצע זיהוי על ידי ביטוי של חלבונים פני השטח marker(s), מארח או פתוגן gene (s) או צירופם.
Introduction
פתוגנים תאיים רבים מסתמכים על מכונות התא המארח כדי לשכפל, לעתים קרובות שינוי ביולוגיה של התא המארח או פילוח subpopulations מאוד ספציפי של התאים המארחים כדי להגדיל את סיכוייהם של התפשטות. כתוצאה מכך, תהליכים ביולוגיים תא הם בדרך כלל משובשות, עם השלכות מזיקות על הבריאות הכללית של המחשב המארח. הבנת את האינטראקציות בין וירוסים התאים מארח שבו הם לשכפל לאיפיון מנגנוני המחלה עשוי לסייע בפיתוח של טיפולים משופרים ואסטרטגיות כדי למנוע זיהום. כלים אנליטיים ישירה המאפשרים חקר אינטראקציות פתוגן-פונדקאי חיוניים לצורך כך. ניתוח מתא בודד מספק את האמצעי היחיד לייחס הסלולר פנוטיפ חד משמעית גנוטיפ מסוים או זיהום בסטאטוס1. לדוגמה, זיהומים פתוגניים לגרום לעתים קרובות הן ישירים והן עקיפים שינויים בתוך התאים המארחים. לכן, הבחנה תאים נגועים מהקבצים המקבילים נגוע הכרחי לשינויים התא המארח התכונה זיהום ישירה או השפעות משניות, כגון מוכללת דלקת. יתר על כן, עבור גורמי מחלה רבים, כמו SIV ווירוסים הכשל החיסוני האנושי (HIV), זיהום התא המארח ממשיך דרך שלבים מרובים, כגון מוקדם, מאוחר, או סמויה, שכל אחד מהם עשוי להיות מאופיין על ידי גנים נפרדים פרופילי ביטוי חלבון2 , 3 , 4 , 5. ניתוח בצובר של תערובות תא ייכשל ללכוד זה הטרוגניות6. לעומת זאת, מאוד מרובב תא בודד ניתוחים היכולת לכמת את הביטוי של שניהם ויראלי, מארח את הגנים מציעים אמצעים כדי לפתור לפליטת הסלולר זיהום ספציפיים, כולל וריאציות על פני שלבים זיהום. עוד, ניתוח האינטראקציות פתוגן-פונדקאי פיזיולוגית הגדרות רלבנטיות הינה קריטית לצורך זיהוי אירועים המתרחשים אורגניזמים נגועים. לכן, שיטות שניתן להחיל ישירות שמחוץ הם סביר להניח הטובה ביותר ללכוד ויוו תהליכים.
SIV ו- HIV היעד CD4+ T תאים, שבו הם לנטרל גורמים אנטי-ויראלי "הגבלה" המארח ו downregulate אנטיגן הצגת מולקולות ליצור זיהום פרודוקטיבי ולהימנע מעקב המערכת החיסונית7,8, 9,10,11. ללא טיפול, הזיהום גורמת לאובדן מסיבי CD4+ T תאים, בסופו של דבר לשיאה רכשה כשל חיסוני תסמונת (איידס)12. בהגדרה של טיפול תרופתי, התא הנגוע לחשוף מאגרים להימשך עשרות שנים, מתחזה מחסום אימתני אסטרטגיות המרפא. הבנה של מאפייני ויוו תאים HIV/סיב-הנגועים יש פוטנציאל לחשיפת תכונות התא המארח אינסטרומנטלי פתוגנזה והתמדה. עם זאת, זה מאוד מאתגרת, בעיקר בשל את low frequency של תאים נגועים וחוסר ריאגנטים בקלות להזדהות איתם. תאים לתמלל RNA נגיפי, מוערך להיות נוכח-0.01 – 1% של CD4+ T תאי דם, רקמת הלימפה13,14,15. תחת טיפול מדכא, תאים נגועים לחשוף שכיחים פחות בגיל 10-3–10-7 16,17,18. חלבון נגיפי מכתים assays כי פועלות היטב עבור הלומדים חוץ גופית בתוך זיהומים, כגון איסור פרסום תאיים, הם שיוצרת בשל הרקע מכתים של 0.01 – 0.1%, דומה או גבוה יותר התדירות של תאים נגועים13, 14. צביעת משטח החלבונים Env באמצעות נוגדנים חד-שבטיים סיב/HIV Env ספציפיים מאופיין היטב גם הוכח להיות קשה, ככל הנראה מסיבות דומות. לאחרונה, כלים חדשניים שואפים לשפר את הגילוי של תאים המבטאים את הבדיחה על-ידי שילוב מבחני ספציפי עבור החלטורה RNA או על-ידי שימוש חלופי הדמיה טכנולוגיות14,15,19. עם זאת, גישות כאלה נשארים מוגבל במספר מדידות כמותיים מתבצע על כל תא.
כאן, אנו מתארים מתודולוגיה (1) המזהה תאים הנגועים בנגיף בודדים ישירות שמחוץ מאת ג'ין ויראלי רגיש וספציפי כמותית qPCR ו- (2) מכמת את הביטוי של חלבונים פני שטח עד 18, גנים 96 לכל נגוע ( תא נגוע). מתודולוגיה זו משלב חלבון משטח תא בודד מדידה על ידי FACS ואחריו פירוק התא מיידית, ביטוי גנים באמצעות ניתוח מרובב יישוב qPCR במערכת Biomark. הטכנולוגיה מעגל משולב fluidic (IFC) מאפשר כימות מרובבת של גנים 96 מדגימות 96 בו זמנית, על ידי מטריצה של צ'יימברס 9,216 שבו מתבצעות תגובות qPCR בודדים. המיון תא חי FACS רשומות מדידות שפע חלבון גבוהה-תוכן תוך שמירה על transcriptome כולה לניתוח מתבצעת באופן מיידי במורד הזרם. כדי לזהות תאים הנגועים בנגיף, מבחני ספציפי עבור RNAs ויראלי, לחלופין משולבים, unspliced (vRNA) הינם כלולים בניתוח qPCR, יחד עם פאנל של מבחני על-ידי המשתמש, בהיקף של עד 96 גנים, המספר המרבי של מבחני השוהים כיום על IFC. ביטוי גנים ומידע חלבון שנאספו עבור כל תא מקושרות על-ידי מיקום טוב. אנחנו קודם לכן דיווח תוצאות של ניתוח זה במקום20. כאן, אנו מספקים יותר מפורטות הנחיות מתודולוגי, כמו גם עוד יותר תיאורי phenotyping של CD4 הנגועים סיב+ T תאים.
גישה זו, אשר אנו המונח tSCEPTRE, ניתן ליישם את המתלים של כל האוכלוסייה קיימא תא תגובתי נוגדנים fluorescently שכותרתו, ביטוי של transcriptome תואם עם מבחני qPCR זמין. לדוגמה, זה יכול לשמש עבור אפיון גנים דיפרנציאלית וביטוי חלבונים תאים נדיר או תאים לא ברצון מכובד על ידי הדם שלה. הכנת הדוגמא מסתמכת על תקן מכתים פרוטוקול באמצעות נוגדנים זמינים מסחרית. Cytometers עם יכולת מיון תא בודד הינם גם זמינים מסחרית, אך אמצעי אבטחה נוספים נדרשים לעיבוד זיהומיות תאים חיים. מקליט את פרופיל ביטוי יחיד – התא חלבון עבור כל תא על-ידי מיקום טוב, התייחס בזאת כפי באינדקס מיון, היא תכונה נפוצה FACS זמינים מסחרית מיון תוכנה. ניתוח חישובית של המארח באופן שונה ביטוי גנים בין אוכלוסיות תאים עניין לא מתואר כאן, אבל הפניות מסופקים לשיטות שפורסמו בעבר.
Protocol
הערה: תיאור סכמטי של פרוטוקול זרימת העבודה מוצג באיור1. הוא מורכב משלושה שלבים עיקריים: FACS, RT cDNA קדם הגברה, ו qPCR עבור גנים עד 96 בו זמנית. שתי גרסאות של הפרוטוקול, מיון תאי דילולים ולהרחיב תאים בודדים, מתוארים בפירוט רב יותר בין שלב 5 שלב 6, בהתאמה. אסטרטגיות אלו שאלות מחקריות שונות אך לבצע נהלים דומים.
1. תנאים מוקדמים או מוקדמת
- אמת כל מבחני ביטוי הגן כדי לשמש שתואר לעיל6.
הערה: שלב זה נעשה הרבה לפני התאריך הניסוי. אימות של כל מבחני, מסחר, מותאם אישית, נדרש כדי להבטיח הגברה יעיל וארוך של RNA רלוונטי עד לרמת התא היחיד. מבחני זמינים מסחרית ומותאמות אישית רבים להיכשל לפגוש מפרטים אלה. עיבוד פריסטלטיות אוטומטיות עבור הכשרה סימולטני של מבחני ביטוי של גנים עד 96 הינם מסופקים בחדרי משלימה קידוד קבצים 1 – 5, אך מבחני בודדים יכול להיות מוסמך באמצעות R2 והשיפוע של התאים ליניארי. נציג assay שהצליחו ושנכשלו הכשרה חלקות מוצגים באיור2. -
לפתח פאנל cytometric זרימה של נוגדנים כתם סמני פני שטח התא עניין.
- Titrate נוגדנים על ידי צביעת מדגם רלוונטי, לדוגמה, רזוס היקפיים תאי תאי דם (PBMCs), עם כל נוגדן. להתחיל עם µL 20 של נוגדנים לכל מבחן ב- 100 µL מכתים התגובה וליצור שמונה דילולים טורי כפולה. לזהות את ריכוז אופטימלי זה המוצגים המרבי מכתים בעוצמה תוך שמירה על הפרדה ברורה בין האוכלוסיות שליליים או חיוביים.
- הערכת ההכתמה משולב על sample(s) תא נוספים באמצעות התערובת של נוגדנים כל-ריכוז אופטימלי שנקבע בשלב 1.2.1. ודא כי ההכתמה דומה לזה שנצפה על כתמי נוגדן בודדים. אם ההכתמה היא פחות מ תצפית כאשר כל נוגדן שימש בבידוד, שקול fluorochrome חלופי conjugates להחליף נוגדנים כאלה.
2. גנים ביטוי Assay הכנה
- ביטוי גנים 96 לשלב assays לתוך RNase/DNase ללא צינור 1 – 15 מ"ל (בגודל עשויה להשתנות עם מספר לוחות מיון). הפאנל של מבחני השתמשו במחקר זה צוין טבלה 1 ו לטבלה 2. החומר המתקבל מכונה "המיקס Assay". להוסיף כל assay ריכוז סופי של 180 ננומטר של תחל ואחורה. להוסיף מאגר ההשעיה דנ א כדי להשיג דילול המתאים של המיקס וזמינותו.
הערה: למטרות פרקטיות, מניות assay (גולשים) מותאמים אישית שתהיה מוכנה-מיקרומטר 18 עולה בקנה אחד עם הריכוז של מבחני qPCR ביטוי גנים זמינים מסחרית "x 20" (טבלה של חומרים). 18 מיקרומטר תערובות של פריימר ואחורה מותאמים אישית עבור כל הגן עשויים פתרונות מניות במאגר המתלים של ה-DNA. מבחני זמינים מסחרית (טבלה של חומרים) כוללים גם הגששים, אבל הגששים אינם הכרחיים לצורך RT או הגברה קדם cDNA והוא יכול ובכך להיות מושמט עבור מבחני מותאם אישית. מומלץ לכלול אחד או יותר גנים משק בית בשביל להשתמש בבקרת איכות להערכת היעילות של מיון, תא שחזור של cDNA סינתזה. השימוש אקראי תחל לייצר cDNA טרם נקבע, אך צפוי להיות פחות יעילה מאשר תחל גנים ספציפיים. - להכין את 2 x assay צלחת לשימוש בשלב 7.1 (מולטיפלקס qPCR). על כל מערך השבבים, 96x96 הצפוי, פיפטה 6 µL של כל assay לתוך כל איזור טוב של צלחת PCR 96-ובכן. לדוגמה, עבור שבבי 5, 30 µL של כל assay יתפוס לבאר בודדת בצלחת 96-ובכן. אם באמצעות מבחני 96, כל טוב של צלחת 96-ובכן יכיל וזמינותו. חותם את הצלחת בחותם דבק.
הערה: באופן אידיאלי, שלבים 2.1 ו- 2.2 מבוצעים בו-זמנית, כדי להימנע מחזורים ההקפאה-הפשרה מרובים עבור מבחני ביטוי גנים. כל הגנים בתוך הצלחת assay בטח גם היה נוכח המיקס Assay (שלב 2.1). המיקס assay והן את הצלחת assay שניתן לאחסן ב-20 ° C או 4 ° C לשימוש לטווח ארוך או קצר, בהתאמה.
3. שטח הכתם התאים קיימא
הערה: תאיים מכתים permeabilization, קיבוע אינן תואמות בשיטה זו כפי שהם להתפשר RNA.
- הכינו את הדגימות פיצוי על-ידי הוספת כל נוגדן המפורטים בטבלה של חומרים כדי µL 40 של פיצוי חרוזים-2.5-fold ריכוז גבוה יותר מאשר בשימוש עבור תא מכתים. תקופת דגירה של 20 דקות ב- 25 ° C מוגן מפני אור. להוסיף 3 מ"ל של PBS חרוזים, צנטריפוגה ב 500 x g למשך 3 דקות ב 25 º C. האחות של PBS, resuspend את החרוזים ב ~ 300 µL ל- PBS.
- להכין את סדרן התא cytometric זרימה לעיבוד מדגם: לרכוש צינורות פיצוי, ליצור במטריצת פיצוי ולהחיל מטריקס לקבצים רכישה עבור דגימות ניסיוני.
- הכינו את התמהיל מאסטר של קוקטייל פלורסנט נוגדנים על ידי שילוב של נפח מתאים של כל נוגדן כמפורט בטבלה של חומרים, צינור 1.5 מ ל ענבר עבור כל הדגימות להיות מוכתם. מערבולת, צנטריפוגה אגרגטים הקוקטייל ב 21,000 x g למשך 2 דקות ב- 25 ° C עד הצניפה הנוגדן.
הערה: נוגדנים המשמש כאן מפורטים בטבלה של חומרים. - להפשיר את התאים cryopreserved באמבט מים 37 ° C עבור 2 דק הוסף 2-0.5 מ"ל של התליה תא 12 מ של PBS בשפופרת 15 מ"ל, צנטריפוגה ב 500 x g למשך 3 דקות 25 ° c, מחוק לגמרי מגניב. Resuspend ב 3 מ"ל של PBS, העברת צינור פוליסטירן מ. צנטריפוגה כאמור לעיל, תשאף PBS, עוזב ~ 20 µL PBS שיורית.
הערה: הטמפרטורה מכתימים שעשוי להיות מותאם לטמפרטורות חם או קר לפי הצורך עבור יישומים ספציפיים על-ידי שינוי טיטרציה נוגדן מכתים תנאים בהתאם (ראה שלב 1.2). - Resuspend עד 2 x 107 שטף בתאים µL 80 של נוגדן קוקטייל, תקופת דגירה של 20 דקות ב- 25 ° C מוגן מפני אור. עבור דוגמאות העולה על 2 x 107 תאים, להגביר את עוצמת התגובה מכתימים בהתאם כדי לשמור על < 2 x 107 תאים/100 µL.
- לשטוף את התאים על ידי הוספת 3 מ"ל של PBS, צריך שתוציאו ב x 500 g למשך 3 דקות, וכ רפה בעברית את תגובת שיקוע.
- ביסודיות resuspend תאי µL 300 – 500 של PBS ואת מסנן על-ידי pipetting דרך 35 מיקרומטר ניילון תא מסננת כובע. להשאיר את התאים על קרח, מוגן מפני אור עד המיון.
4. מכינים תא אוסף צלחות לבצע מיון FACS, צור cDNA
- לשלב את המרכיבים תערובת התגובה RT-preamp (טבלה 3) על-ידי pipetting לתוך יחידה RNAse/DNAse ללא סטרילי צינור.
הערה: שלב זה ניתן לבצע לפני או במהלך צביעת בשלב 3. האנזים RT עשוי להיות מושמט כאן כדי לקבוע את התרומה של תבנית ה-DNA לאות qPCR. - השתמש פיפטה רב-ערוצי כדי לוותר על 10 µL של תערובת התגובה RT-preamp לתוך מספר 96-ובכן PCR סוג אוסף צלחות הרצוי. לאטום את הצלחות עם סרט דביק, ולמקם את הצלחות על קוביות אלומיניום 96-ובכן מראש צוננת.
- להקים את התא מיון ערכת המגביל הזרימה cytometer על ידי רכישת נתונים מתאי כ 20,000 המדגם מוכתם. ודא כי מטריקס פיצוי מוחל על הנתונים שנאספו. לצייר השערים ולהגדיר העץ המגביל שמזהה את population(s) תא עניין להיות מבודד לניתוח ביטוי גנים.
הערה: העץ המגביל המשמש עבור האוסף של תאים vRNA+ סיב פוטנציאליים מוצג באיור3. - הזן את הגדרות המכשיר המתאים כדי לציין את המספר ואת בתאים כדי למיין כל טוב. הדרכה מפורטת נוספים לצורך מיון גם סדרת המגביל של דילול תאים או תאים בודדים ניתנים שלבים 5 ו- 6, בהתאמה.
- FACS למיין את התאים מוכן 96-ובכן PCR אוסף לוחות. להסיר את החותם דבק לפני מיון והחלף כלב ים טריים לאחר המיון.
הערה: לשמור הצלחות על קוביות אלומיניום מראש צוננת בכל עת, לרבות במהלך המיון. - מיד אחרי מיון, מערבולת צנטריפוגה האוסף צלחת ב 2,000 x g עבור 1 דקות ב- 4 מעלות צלזיוס.
- Thermocycle הצלחת במכונת ה-PCR עם מכסה preheated תוך שימוש בתנאים הבאים: 50 מעלות למשך 15 דקות (RT), 95 מעלות צלזיוס למשך 2 דקות, ואחריו 18 מחזורים של 95 ° C עבור 15 s ו- 60 מעלות צלזיוס במשך 4 דקות (קדם הגברה).
- לדלל cDNA 1:5 על ידי העברת μL 5 של cDNA לתוך µL 20 של DNA מאגר השעיה של צלחת חדשה של ה-PCR 96-ובכן. CDNA מדולל ניתן לאחסן 4 ° C או-20 ° C ללא הגבלת זמן בשלב זה. CDNA מוכן כעת שישמש כתבנית עבור qPCR (שלבים 5.2, 7.4).
הערה: דילול זה מבטיח כי תחל נוכח התגובה RT-preamp אינו תורם qPCR במורד הזרם.
5. וריאציה ת FACS מיין תאים לתוך סדרה דילול הגבלת כדי לקבוע את התדירות של vRNA+ תאים או לבצע את בקרת האיכות ניסיוני
הערה: לפני ביצוע סוג תא בודד, זה עשוי להיות שימוש כדי לקבוע את התדירות של תאים עניין, על-ידי מיון התאים לתוך דילולים סדרתי בשכפול. שלב זה מספק גם בקרת איכות יקר עבור מיון יעילות, פירוק התא, שחזור RNA ו- cDNA סינתזה, כפי שמתואר בשלב 5.3. קביעה מראש של תדירות תא vRNA+ מאפשר הערכה מדויקת יותר של מספר תאים בודדים אותה יש למיין כדי להשיג גודל המדגם מספיק עבור ניתוח ביטוי גנטי של התא מופעל כראוי vRNA+ .
- FACS למיין את התאים לתוך הצלחות 96-ובכן מוכן כמו צעדים 4.1-4.2, ולאסוף 1 – 1,000 תאים לכל באר משכפל מרובים.
הערה: מספר בארות שכפל-כל דילול תא משויכת בדרך כלל הפוך הריכוז תא לכל טוב. כאשר תדירות התא הנגוע מתחת 1%, תא דילולים להתמקד על תאים 100 – 1000 לכל טוב. מפת צלחת של מיון דוגמה מסופק איור 1, למעלה משמאל. העולה על 1000 תאים לכל טוב יש להימנע בשל עליות וכתוצאה מכך נפח התגובה, הפרעה עם cDNA במורד הזרם סינתזה, כימות. - לשלב את ריאגנטים qPCR בפתרון מיקס מאסטר בטבלה4. עבור אמצעי אחסון התגובה µL 25, µL 22.5 של מיקס מאסטר בשילוב עם µL 2.5 של תבנית cDNA מדולל מהשלב 3.9. לבצע את qPCR באמצעות תנאי הרכיבה רגיל (למשל, 94 ° C למשך 5 דקות, ואחריו 40 מחזורי 94 ° C עבור 15 s ו- 60 מעלות צלזיוס במשך 1 דקה).
הערה: תגובות qPCR Singleplex שימוש בכלי qPCR בזמן אמת המקובלת מומלצים כמו ניתוח ראשוני חסכוני אחד או כמה מבחני להפגין מיון היעילה תא, שחזור RNA ו- cDNA סינתזה. זה עשוי לשמש גם כדי לחשב את התדירות של תאים vRNA+ . תגובות qPCR מולטיפלקס באמצעות Biomark הן בדרך כלל מתאים יותר עבור ניתוחים בתא יחיד בקנה מידה גדול. - בקרת איכות, מגרש Et ערכים (Et = −מקסימום Ct Ct) לעומת מספר של תאים ממוינים לפי טוב בקנה מידה10 יומן ולהחיל ניתוח רגרסיה ליניארית.
הערה: משכפל עקבית, רגרסיה ליניארית השיפוע של 3.3 (± 0.3) ו R2 > 0.9 מעידים על ניסוי יעיל. דוגמאות של האופטימלית, שיוצרת מיון, ניסויים RT-preamp מוצגים באיור4. - כדי לקבוע את התדירות של תאים vRNA+ , חלקה מספרי הטלפון הנייד ממוינות לפי טוב על ה-x (יומן10 סולם) וחלק השבר של בארות חיובי עבור vRNA-כל דילול תא בציר ה-y. לקבלת דוגמה, ראה איור 1 (התפלגות פואסון שמאלה, נמוך יותר). להחיל מודל רגרסיה ליניארית על הנתונים כדי לקבוע את מספר התאים הנמל תא חיובי אחד בממוצע, המקביל ל- 63.2% של בארות חיובי (0.632 בציר ה-y)21. להמיר מספר דילול זה התא (חיתוך ציר x) שכיחות באחוזים. לדוגמה, תא vRNA+ אחד לכל התאים 48 שווה לתדר של 2.1%.
6. וריאציה ב': מיון FACS תאים לניתוח תא בודד
- בצע שלבים 4.1 – 4.8, וציין תא אחד ממוינות לפי טוב שימוש בתכונה מיון אינדקס של cytometer זרימה כדי ליצור קבצים בודדים FCS עבור כל תא ממוין, מיפוי לפי מיקום טוב.
הערה: אם מספר מיון אוסף צלחות חורג מהמספר של thermocyclers זמין, רכיבה על אופניים יכולה להיעצר אחרי השלב איון רוורס טרנסקריפטאז (95 מעלות צלזיוס למשך 2 דקות), ניתן לאחסן cDNA ב 4 ° C עד thermocyclers הינם זמינים. במקרה זה, להתחיל הגברה טרום-מחזור ראשון של 95 ° C 15 s. - אופציונלי: ליצור cDNA "בריכות" המורכב cDNA של קבוצות על-ידי המשתמש של תאים בודדים עבור תאים נדיר עניין באמצעות cDNA מדולל שיורית מסך. העברת µL 2 של מדולל cDNA מראש מוגבר בתא יחיד באמצעות פיפטה רב-ערוצי לתוך צלחת 96-ובכן חדשה. חזור על ידי pipetting 2 µL של cDNA של תאים בודדים כל נוספים של בריכת המיועד לתוך אותו טוב. מסך בריכות cDNA gene (s) עניין (לדוגמה, vRNA) כדי לקבוע את אלה המכילים תאים חיוביים באמצעות qPCR קונבנציונלי. מאז באגירת דורש רק של aliquot קטן של cDNA של כל תא, µL ~ 8 שנותרו של cDNA הוא עדיין זמין עבור ניתוחים תא בודד.
הערה: אסטרטגיות באגירת מומלץ לפני ביצוע ניתוח ביטוי גנים מתא בודד, במאמץ להפחית את מספר תאים בודדים שנחקרו על-ידי qPCR מולטיפלקס משאבים רבים. היא מתאימה למצבים שבו התאים של הריבית (למשל, סיב mRNA +) עשוי להיות מזוהה על ידי assay qPCR ראשוני יחיד-פלקס. אסטרטגיות פעולה פשוטה תפוקה גבוהה ליצירת בריכות cDNA כוללים שילוב של 2 µL של cDNA מדולל שורות (כלומר, כל 12 תאים בשורה א') של צלחת סוג אוסף או עמודות (קרי, כל 8 תאים בעמודה 1), לבאר בודדת בתוך צלחת חדשה. כדי לקבוע הטוב ביותר באגירת אסטרטגיה, שקול את שכיחות צפויה של תאים עניין מהשלב 5.4. לדוגמה, אם 10% של תאים צפויים להיות חיובי, בריכות מורכבת ששת המדגמים cDNA תא בודד לעתים קרובות תהיה שלילית, התאים ייצג שבמאגר יכול ובכך ייכללו מניתוחי תא בודד במורד הזרם.
7. מולטיפלקס qPCR על פלטפורמה Biomark
הערה: סעיף זה שעשוי בצע גירסה A או B שתוארו לעיל. במחקר המתואר במסמך זה, הוחל באופן בלעדי אל תא בודד ניתוח.
- הכן את הצלחת assay qPCR על ידי pipetting 4 µL של כל assay 2 x צלחת assay (להכין בשלב 2.2) לתוך צלחת חדשה של ה-PCR 96-ובכן המכיל 4 µL של assay טעינת מגיב היטב בכל. לשמור על הצלחת assay ב 4 º C.
הערה: הצלחת assay יציב ב 4 ° C עד לשבוע אחד וב-20 ° C למשך חודש אחד. לכן, זה עשוי להיות שימושי כדי להכין חומר מספיק עבור שבבי מרובים, לאחסן כראוי. - לוותר על הנוזלים קו הבקרה של מזרקים לקרקע לתוך צריכת שני המסתמים של השבב. להסיר את הפלסטיק המגן בינות הצלחת. מניחים את השבב על לקונטרולר IFC עם הצד מחורץ במיקום A1. מתוך התפריט הראשי, בחר את התסריט "פריים". להריץ את הסקריפט.
- מכינים את תערובת התגובה בזמן אמת על ידי ערבוב 50 µL מדגם טעינת מגיב עם 500 µL של מיקס מאסטר PCR (טבלה של חומרים) עבור כל שבב microfluidic. פיפטה 4.4 µL לתוך כל טוב של צלחת PCR 96-ובכן חדשה, יועד מעתה ואילך "הצלחת מדגם".
- פיפטה 3.6 µL של cDNA מדוללת 1:5 מ שלב 4.8 המשקולת מדגם המכיל את תערובת התגובה בזמן אמת.
הערה: אם PCR למטה-בחירה בוצעה על המסך עבור נדיר (למשל, vRNA+) תאים לניתוח במורד הזרם, כמתואר בשלב 6.2, לכלול רק את התאים ייצג בבריכות חיובי. - בעקבות השלמת לראשוניות שבב, לטעון את אינלטס שבב על ידי שחולק µL 5 מהצלחת assay לתוך המתאימה גם על הצד ומחורצים (assay) של השבב, 5 µL מהצלחת מדגם לתוך המתאימה גם בצד השני (דוגמה) של השבב. הכנס את השבב לתוך הבקר IFC, להריץ את הסקריפט "לטעון מיקס".
- להעביר את השבב פלטפורמת Biomark כדי לבצע את qPCR מרובבת. להמשיך עם כלי ההתקנה, תיכנות qPCR בעקבות ההוראות צעד אחר צעד מסופקים על ידי תוכנת ניתוח PCR בזמן אמת, באמצעות פרוטוקול V.1 הרגיל הגן ביטוי (GE) 96.96 עם 40 מחזורי PCR. שמור את הקובץ ChipRun בתיקיה המיועדת.
הערה: מספר האסימונים ניתן להפעיל ליום, במשך מספר ימים. - לנתח את הנתונים qPCR.
- פתח את תוכנת ניתוח PCR בזמן אמת. פתח את הקובץ "ChipRun.bml" "קובץ | תפריט פתוח".
- אתר "צ'יפ Explorer" ו- 'סיכום לרוץ שבב' בפינה השמאלית העליונה של חלון התוכנה. לזהות שלושה מרכיבים של התקציר לרוץ שבב: ניתוח נופים, הקמה לדוגמה גלאי ההתקנה.
- לחץ על "גלאי להגדרת". תחת "פעילות", לחץ על "חדש" ובחר סוג מיכל "SBS צלחת", פורמט מכל "SBS96". ליד "מיפוי", לחץ על. כפתור ובחר "M96-Assay-SBS96.dsp".
- אופציונלי: להקצות לכל גלאי (assay) מספר או שם בסעיף "שם" של כל טוב על ידי לחיצה כפולה על 1סנט . טוב. מעבר לשני על ידי לחיצה על "F2".
- לחץ על "הגדרת מדגם". תחת "פעילות" ליד "מיפוי", לחץ. כפתור ובחר "M96-לדוגמה-SBS96.dsp".
- לחץ על "נוף ניתוח". תחת "פעילות" בכרטיסיה "qPCR", בחר "תיקון בסיסית עבור לינארית (נגזרת)", "סף Ct השיטה עבור המשתמש (גלאי)". בכרטיסיה "ספי Ct", בדוק "לאתחול עם התיבה האוטומטית". לחץ על לחצן 'נתח' ' לעיל.
- ברבע נכון העליון של "ניתוח נוף", לחץ על הכרטיסיה השני "טבלת התוצאות". בתפריט הנפתח, בחר "חום מפה נוף". המפה חום עם נתונים יופיעו.
- אופציונלי: כדי להבטיח קרינה פלואורסצנטית רוקס אחיד על פני השבב, בחר "תמונת נוף" במקום "חום מפה נוף" מתוך התפריט. בשלב השני מן החלון בדיוק מעל המפה חום, בחר "רוקס". בחודש הראשון מן החלון הנכון, בחר באחת מחזורים 1-40. לחץ על הרביעי מן החלון הנכון כדי לעבור אל התצוגה בשחור-לבן של זריחה רוקס. תמונה יופיעו מודיע שהכתמים, חלקיקים, או פגמים על השבב. אם אחידות רוקס בגסות מעורפל, הפעל מחדש את השבב.
- תחת המפה חום, לחץ על "סף" ו "יומן גרף". התאם את סף Ct באופן ידני עבור כל גלאי על-ידי לחיצה על מבחני (עמודות של המפה חום) וגרירת הסף כנדרש לחצות. את עקומות הגברה בשלב מעריכית. כאשר תסיים, לחץ על 'נתח'.
- יצא את הנתונים qPCR כקובץ csv. לייבא את הנתונים לתוך גיליון אלקטרוני או ניתוח סטטיסטי תוכנה (למשל, JMP) ולמפות את התוצאות על-ידי עמדות assay ולדגום את השבב. לארגן את התאים בקבוצות מבוסס על הביטוי של גנים ויראליים, על ידי יצירת עמודה חדשה באמצעות נוסחה מותנית. תחת 'נתח', בחר התאם Y לפי X", מגרש ביטוי גנים נגד קבוצה. החלת ניתוח סטטיסטי.
הערה: נציג תא בודד ביטוי כמותי של ארבעת המינים SIV RNA מתואר במגרשים bivariate איור 5A. המארח כמותיים ביטוי גנים בתאים SIV RNA+ מוצג באיור 5B. - תמצית חלבון כמותי ביטוי לערכים מנתונים FACS תא בודד.
- פתח את .fcs קבצים FACS למיין (שלב 6.1) המתאים צלחת 96-ובכן באמצעות FlowJo גירסה 9. עם שם הקובץ מסומן, בחר "פלטפורמה | שער מספר אירועים | צור אינדקס מיון שערים". תאים בודדים יופיעו המוצג על-ידי שורה.
- סמן את כל התאים 96 (לא שורות) ובחר "סביבת עבודה | ייצוא | בחר מדובבים כל fluors". תחת 'סוג נתונים', בחר 'FCS קובץ', לחץ על "לייצא" ובחר תיקייה.
- גרור קבצים חדשים .fcs לתאים בודדים לתוך סביבת עבודה חדשה של FlowJo. לסמן את כל התאים, לחץ על "הוסף סטטיסטיקות" (הלחצן "סיגמא" בפינה השמאלית העליונה) "| זאת אומרת | כל עבור חיל הים פרמטרים".
- פתח "שולחן עורך" על-ידי לחיצה על לחצן הרביעית משמאל בפינה השמאלית העליונה. להאיר את כל פלואורסצנט של התא הראשון, גרור אותם אל תוך חלון עורך טבלה. בחלון עורך טבלה, לחץ על לחצן אותו בראש ""צור, תצוגת שולחן. פעולה זו תיצור טבלה של תאים 96 ופרמטר מספריים עבור כל עבור חיל הים.
- העתק את הפלט לתוך תוכנת מסד נתונים (למשל, MS Excel, JMP), או העתקה/הדבקה או על ידי לחיצה על "שמור, הפעלה של יישום" (הרביעי הלחצן השמאלי מעל השולחן).
הערה: הליך זה הוא ספציפי FlowJo גרסה 9. FlowJo גירסה 10 משתמש הליך שונה כדי לייבא נתונים הכלולים באינדקס. אינדקס זרימת הנתונים ניתן גם להעתיק/להדביק לתוך JMP ישירות מתוך קבצי. csv, שיצר את סדרן התא.
- מיזוג נתונים FACS מתא בודד, qPCR נתונים על-ידי מספר לוחית והצב היטב. לבצע ניתוח גרפיים וסטטיסטיים על הגן בתא יחיד משולב (qPCR) ונתונים ביטוי (FACS) חלבון.
הערה: דוגמאות של תא בודד בשילוב qPCR, FACS נתונים מוצגים באיור 6 (לארח הדם פרופילי ביטוי עבור תאים מקוק רזוס SIV-נגועים, משולבים vRNA+ ), איור 7 (CD4 ביטוי גנים לעומת השטח CD4 חלבון ביטוי בתאים מקוק רזוס משולבים vRNA+ ), ופורסמו בעבר20. כדי לזהות באופן שונה הביע גנים תא population(s) של עניין, תא בודד ניתוח שיטות שתוארה קודם לכן הם מומלצים20,22,23,24, באיזה חשבון עבור היחס של תאים חיוביים עבור הגן, כמו גם את ערך הביטוי ג'ין רציפה.
תוצאות
זרימת העבודה עבור פרוטוקול כולו מתואר באיור1. הוא מורכב שתי וריאציות שהוגדרו על-ידי מספר התאים מיון: גם דילול המגביל או כמו יחיד תאים, כפי שתוארה בטקסט. דוגמאות פריימר-בדיקה ניתוחים מוקדמות על 2-fold דילולים RNA טורי מוצגות באיור2. האסטרטגיה חסימה כדי לזהות תאים סיב+ פוטנציאליים מוצג באיור3. QPCR בקרת איכות שהצליחו, שיוצרת ושנכשלו עבור הגן משק GAPDH על תאים ממוין FACS הגבלת דילול מוצגים באיור4. תא בודד ביטוי כמותי של ארבעה SIV RNA מינים ו רזוס מקוק גנים שבאו לידי ביטוי באופן שונה תאים נגועים מוצגים באיור5. נציג bivariate, היסטוגרמה ודו scatterplots מתארים את הדם ביטוי לפרופיל של RNA סיב+ CD4+ T תאים נמדדת cytometry זרימה איור6. העלילה בועה trivariate (איור 7) מציג את היחס בין חלבון CD3 או CD4 משטח, CD3 או CD4 mRNA ו ג'ין ויראלי כמותית (תאת/rev) ביטוי תאים בודדים.

איור 1 : תיאור סכמטי של זרימת עבודה ניסויית מתארת שלושה מרכיבים עיקריים: זרימה cytometric מיון, שעתוק במהופך פלוס מבוסס ה-PCR-הגברה מראש של cDNA (RT, קדם מגבר), ו- qPCR. ניתן לבצע את המיון או המגביל לדילול (A, רקע ירוק) או תאים בודדים (B, רקע כתום). מייד לאחר המיון FACS, התאים הם lysed, ה-RNA הוא להפוך משועתקים לתוך cDNA מראש מוגבר (RT, קדם מגבר PCR) להכין תבנית qPCR. מיני דילול המגביל לקבוע את התדירות של תאים חיוביים עבור נגיפי RNA באמצעות התפלגות פואסון נתונים סטטיסטיים, כמו גם יעילות ניסיוני, לטעום השחזור. בראש החץ הירוק מציין המספר המשוער של תאים ממוינים לכל תא אחד טוב המכיל חיובי עבור הגן הנגיפי (תואם ל- 63.2% ההסתברות של בארות כזה להיות ג'ין חיובי), אשר מומר בתדר של התא. הערכות תדירות עשוי לשמש כדי ליידע את מספר תאים בודדים שנאספו במין עוקבות (B). אינדקס תא בודד FACS המיון פיקדונות אחד תא לכל טוב ומייצר קבצי הנתונים עבור כל תא מבואר על-ידי מיקום טוב בתוך הצלחת 96-ובכן. QPCR תא בודד מתבצע בתוך אולם קולנוע עבור גנים 96 בו זמנית. שילוב של חלבונים פני השטח (FACS) ו- mRNA ביטוי מאפשרת יצירת פרופילים של תאים בודדים (בעמודה הימנית). QPCR אופציונלי עבור גן ויראלי יכול להתבצע בין קדם הגברה PCR qPCR מרובבת (B, התיכון) תאים בודדים מסך או בריכות של תא בודד cDNA למטה-בחר נגיפי RNA+ תאים או בריכות לניתוח מולטיפלקס qPCR. חום ממחיש ביטוי גנים (Ct ערך) עבור מבחני 96 (עמודות), תאים בודדים 96 (שורות). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: QPCR נציג נתונים מ תחל הכשרה ניסויים מוצגים עבור מוצלחת (הימנית והאמצעית) נכשל מבחני זמינים מסחרית (מימין) ( CD6, SIV tat/rev, ואת TLR3, בהתאמה). עבור CD6 ו- TLR3, RNA היה שחולצו מן מקוק רזוס ממוין FACS6 10 PBMC CD4+ תאי-T באמצעות ערכת מסחרי. שמונה משכפל בסדרה 12-נקודת ה-RNA כפולה דילול (ng 0.023-48 RNA, המתאים 1.2 – 2,400 תא מקבילות בהנחה 20 עמ' רנ א לכל CD4+ T-cell) היו נתונים RT-preamp ו- qPCR. עבור SIV tat/rev, RNA היה מופק מקוק רזוס PBMCs נגוע במבחנה עם SIVmac239. RNA דילולים הוכנו מקבילות RNA הפורש של תאים 6 – 12,000. Et מותווים ערכי (40-Ct), אשר מגבירים עם ביטוי גנים, לעומת מספרי הטלפון הנייד המשוער. דילול סדרות המציגות R2 > 0.97 והשיפוע של 3.32 ±0.3 מצביעים על פריימר מוצלחת מוקדמות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
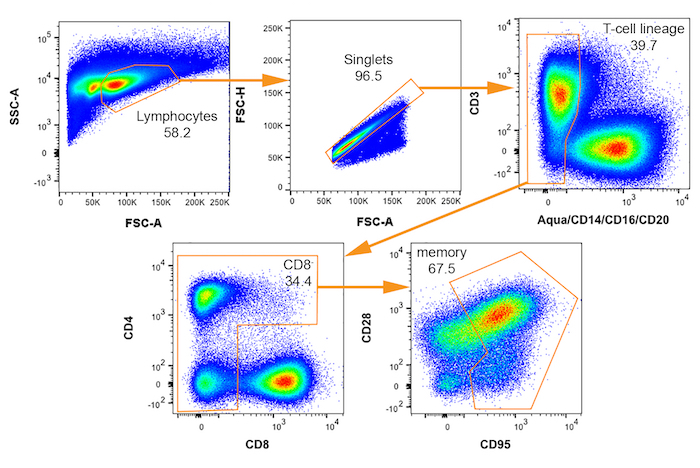
איור 3: Bivariate FACS מגרשים עם gating ערכה עבור בידוד של תאים מקוק רזוס שעשויות להיות נגוע על ידי SIV. שערים רציפים עבור בחירת זיכרון (CD95 +) CD4+ T תאים מוקרנים השמאלית העליונה להוריד נכון עם כל שם אוכלוסייה המצוין. אחוז של מגרש האב שנופל בתוך כל שער מסומן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : נציג ניסיוני אימות של qPCR מתבצע על תאים ממוין FACS הגבלת באמצעות דילול GAPDH משק הגן של 3 ניסויים עצמאית: מוצלח (משמאל), שיוצרת (באמצע), נכשל (מימין)- בית 10-100 תאים לכל טוב ישתרע Ets לא יותר מ- 2, 300 – 1,000 בארות תא בתוך 1 ואח. המדרון רגרסיה ליניארית צריך להיות 3.32 ± 0.3, R2 > 0.95. כשל כדי להשיג מפרטים אלה מעיד על קשיים טכניים בשלבים 1, 2, 3, או שילוב שלהם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5 : תא בודד כמותיים ויראלי ומנחה ביטוי גנים ב מקוק רזוס ממוין FACS CD4+ תאי T מזיהום פוסט-SIVmac251 של הצומת לימפה מצע המעי העליון 10 ימים- ביטוי גנים ויראליים (א) bivariate מתווה של הכפל-משולבים (תאת/rev) משולבים ביחידים (מעטפה) SIV mRNA על ידי יחיד תאי (משמאל). בלשכת המידע לתייריםrev+env– תאים (תאים ירוק בהיר לאורך ציר x) אקספרס פחות עותקים של תאת/rev RNA מאשר env+ התאים (ירוק כהה), בקנה אחד עם צעיר שלב של זיהום ולפני הגרעין הייצוא של vRNAs חלקית משולבים כגון envוייצוב בתיווך Rev חלבון. תאים המבטאים לא משולבים RNA נגיפי מתוארים גריי (אין RNA נגיפי), חום (מחסום פה+ ו LTR+) או טאן ( מחסום פה+ או LTR+). Unspliced (מחסום פה+), הכולל ביטוי mRNA סיב (LTR+) מוצג עבור אותם תאים (מימין). שפע גבוהה unspliced סותמים RNA ב תאת/rev+env+ תאים הוא עקבי עם המנוח בשלב פרודוקטיבי זיהום שבמהלכו RNA הגנומי שופע מתבטא אריזה לתוך ניצני virions. (B) כינור חלקות של גנים מקוק רזוס המתבטא באופן שונה משנה אחת לפחות של תאים הנגועים SIV בהשוואה לתאים נגוע (אפור). ניתוח סטטיסטי בוצע כפי שתואר לעיל20,22,23,24. הכוכבית מציינת גילוי שקר קצב < 10% בהסבירות בשילוב יחס מבחן השוואות ביחס תאים נגוע. קו מקשר ערכים רשע על פני קבוצות תאים עבור כל הגן. איור זה שונה מבולטון. et al. 20 אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6: מארח נציג הדם ביטוי פרופילים של תאים ממוין FACS מפני הידבקות פוסט-SIVmac251 של 10 ימים מצע המעי העליון הלימפה בבית השחי הצומת מקוק רזוס. Scatterplot (א) להציג של CD3, CD4 ו ICOS ביטוי הדם נגוע (אפור), מחסום פה+תאת/rev– (חום) ותאים מחסום פה+תאת/rev+ (ירוק). עוצמת קרינה פלואורסצנטית מותווים עבור כל תא (נקודה). חריג חשוד טעות תיבת חלקות מתארים את טווח בין רבעוני (IQR) ואת חציון (תיבה), הנקודות הרחוקה ביותר בתוך 1.5 x IQR מן התיבה (שפם), ואת הפוטנציאל ליניאריים (נקודות מנותקות). סרגלים אופקיים בחלק העליון מצביעים על הבדלים משמעותיים (p < 0.05, nonparametric Wilcoxon מבחן דרגה). (B) תצוגה Bivariate והיסטוגרמה משטח CD3 ו CD4 חלבון הביטוי עבור תאים המוצגים באותיות (A). נקודה מגרש (משמאל) מציין אחוזים מאוכלוסיית בכל תא בטווח רביע. היסטוגרמות CD3 ו CD4 (באמצע, נכון) מתארים את הדם downregulation בין מחסום פה+תאיםtat/rev+ ביחס נגוע ותאיםtat/rev– מחסום פה+. (ג) 12 נציג tat/rev+ תאים בודדים בלבד (A-B) מוצגים על-פני שלושה מגרשים bivariate לביטוי משטח של CD3/CD4 (משמאל), CD69/CD38 (באמצע) ו ICOS/הלע-ד ר (מימין). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
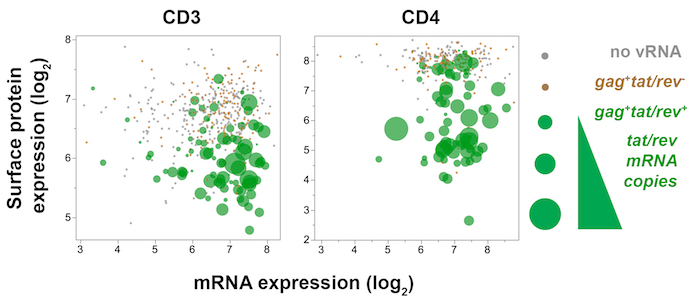
איור 7 : מגרש Trivariate הצגת תא בודד הגן ויראלי (tat/rev) גנים המארח (CD3 או CD4), המארח ביטוי חלבון משטח (CD3 או CD4) בזיכרון הנגועים SIV CD4+ T תאים מן הצומת לימפה מצע המעי העליון 10 ימים זיהום פוסט-SIVmac251. CD4 ביטוי חלבון (זריחה) מותווים נגד CD4 mRNA (qPCR), ואילו כמות tat/rev לידי ביטוי בכל תא משתקף לפי גודל נקודה. ב תאת/rev+ תאים (ירוק), ירד השטח CD4 CD3 חלבון הבעה עם תעתיקים מתמשכת של CD4 ו- CD3 , בהתאמה, מציינים כי הביטוי הדם הוא מווסת במורד הנהר ביטוי גנים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
טבלה 1: תחל וזונדים המשמש את הגילוי של חומצות גרעין SIV. כאשר שני סיקוונסים מסומנים עבור פריימר או בדיקה, שימשו equimolar כמויות של שני רצפים. אנא לחץ כאן כדי להוריד את הקובץ.
בטבלה 2: 96-גן פאנל המשמש עבור כימות של amplicons על מכשיר Biomark. ארבעה מבחני SIV מסומנים על רקע כחול. אנא לחץ כאן כדי להוריד את הקובץ.
טבלה 3: תערובת התגובה המשמש שעתוק במהופך של הגברה טרום- אנא לחץ כאן כדי להוריד את הקובץ.
בטבלה 4: qPCR תערובת התגובה המשמש PCR בזמן אמת מתבצע על מכשיר חשבים סטודיו 6- אנא לחץ כאן כדי להוריד את הקובץ.
משלימה קידוד קובץ 1. הנחיות במוקדמות מבחני ביטוי גנים. אנא לחץ כאן כדי להוריד את הקובץ.
משלימה קידוד קובץ 2: מפה לדוגמה תבנית ב- JMP. אנא לחץ כאן כדי להוריד את הקובץ.
3 קובץ קידוד משלימה: התבנית מפת בדיקה ב JMP. אנא לחץ כאן כדי להוריד את הקובץ.
משלימה 4 קובץ קידוד: ניתוח פריימר script עבור JMP. אנא לחץ כאן כדי להוריד את הקובץ.
משלימה קידוד קובץ 5. ניתוח piecewise script עבור JMP. אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
הפרוטוקול המתוארים כאן, הנקרא tSCEPTRE, משתלב כימות חלבון משטח תא בודד על-ידי cytometry זרימה multiparameter עם ביטוי mRNA תא בודד כמותיים מאוד מרובבת RT-qPCR. האיחוד של שתי טכנולוגיות אלה מאפשר תמונות בעלת תוכן גבוהה של משולב תעתיק חלבון פרופיל של תאים בודדים בתבנית תפוקה גבוהה. נוכל להשתמש בשיטה כדי לזהות עד כה חמקמק תאים נגועים SIV אין ויוו, ומתארים המארח באופן שונה ביטוי גנים, חלבונים. הפרוטוקול ניתן להתאים לצורך המחקר מאוכלוסיית תאים בכל עניין ניתן להבחנה על-ידי הביטוי של פני השטח protein(s), mRNA או שילוב שלהם. השיטות שתואר להסתמך על מיון מדויק מתא בודד, נתונים הקלטת cytometry זרימה לזווג עם ריאגנטים qPCR זמינים מסחרית מרובב מכשור PCR בזמן אמת. הפלט הוא רגיש, כמותית ההערכה של תא בודד חלבון וג'ין ביטוי נתונים משולב.
גישות אחרות שמקשר חלבונים ו ג'ין ביטוי תאים בודדים היו תיאר1,25,26,27. אינדקס FACS מיון ואחריו RNAseq, הוחלו בהצלחה האפיון של תאי גזע hematopoietic, מייצג גישה מבטיח במיוחד28. עם זאת, בעוד RNAseq יש כמה יתרונות על פני יישוב ג'ין ביטוי ניתוחים, כלומר ניתוח לא משוחד transcriptome מלאה, זה נתון גבוה יותר השוואות מרובות העלות הסטטיסטית, וייתכן שהוא פחות רגישים על כימות של עותק נמוך תעתיקים. יתר על כן, אין כיום כלכלית לבצע RNAseq על אלפי תאים בחיפוש אחר תאים נגועים נדיר נוכח בתדרים < % 1 (למשל, HIV, SIV). טכנולוגיות אחרות של תא בודד המתעוררים שואפים ליצור העתק יחיד, דהיינו, על ידי FACS או PCR, איתור של חלבונים ושל חומצות גרעין באותו התא. אלה כוללים את הגילוי של חלבונים על ידי נוגדנים פלורסנט ו mRNA מאת oligonucleotide פלורסנט הגששים ואחריו FACS ניתוח (mRNA-זרימה-דג)14,15,29,30. לחלופין, ניתן להבחין חלבונים על ידי זוגות של נוגדן-oligonucleotide conjugates שזוהו על-ידי qPCR במקביל reversely משועתקים mRNA31,32,33,34 . גישות אלה "היברידי" מספקים חומצות גרעין בו זמנית, מדידות חלבון עם תא בודד רזולוציה דומה tSCEPTRE, אך הם מוגבלים איפה הם גם לא כמותית (mRNA זרימה-דג) או עשויים לדרוש אישית נוגדן או mRNA הגששים. הגישה שלנו tSCEPTRE כמותיים למדידות גם חלבון וגם mRNA, ריאגנטים כל זמינים מסחרית, עם לגבעת מבחני הפתוגן הספציפי.
תשומת לב מיוחדת להחיל מספר שלבים בפרוטוקול לפני הניתוח של דגימות ניסיוני. הראשון, cytometry זרימה גבוהה-פרמטר דורש אופטימיזציה זהירה של פאנל של נוגדנים פלורסנט כדי להבטיח זיהוי ופתרון רגיש35. כל נוגדן צריך להיות טיטרציה בנפרד כדי לזהות את הריכוז משיג הפרדה מיטבית ועל רקע מינימלי מכתים, ואחריו את ההערכה של צביעת כאשר כל נוגדן conjugates משמשים בשילוב. קביעת השני, ניסיוני וזמינותו ביטוי גנים qPCR המתאים כדי למדוד את כל הגן עניין חיוני. מבחני מרובים זמינים מסחרית זמינים בדרך כלל עבור כל הגן, אך מניסיוננו, רבים אינם כמותיים ברמה תא בודד6. לכן, חשוב להיות זכאי מבחני כולן על באופן סדרתי מדולל RNA לפני השימוש, עבור ביטוי כמותי גנים. אופטימיזציה של ריאגנטים האלה זמן רב, אבל הערך של לוחות אמין של נוגדן conjugates, מבחני ביטוי גנטי המאפשר זיהוי רגיש של מולקולות כל עניין מצדיקה את ההשקעה של הזמן. בנוסף, יש לתת עדיפות מבחני זמינים מסחרית המכיל הגששים המתפרסים על צמתי אקסון-אקסון (איזור עם סיומת "m1") כדי לשפר את ירידה לפרטים של mRNA, למרות חלופי מבחני יכולת גילוי הדנ א הגנומי (סיומת "s1" או "g1" ) נחשבים סביר להשפיע על תוצאות ביטוי גנים עקב שווי ערך כרומוזומלית עותקים בכל תא. שימור RNA במעלה הזרם של RT הוא קריטי, מושגת על ידי שמירה על דגימות מקורר, כאמור לאורך כל הפרוטוקול. באופן דומה, משך הזמן של מרווח הזמן בין מיון ומיון FACS, RT-preamp צריך להישמר עד למינימום. עבור הגבלת דילול והן מיון מתא בודד, cDNA יכול להיות קודם נותחו על ידי qPCR המקובלת להערכת RNA שחזור של מאוד הביע שירות חדרנית גנים. אם הביטוי שנצפה אינה אחידה בין בית כמו מספרי הטלפון הנייד או את השיפוע של התאים ליניארי עבור הגבלת האימות נכשל דילולים, פתרון בעיות צריכה להתבצע על הליכי המיון ועל הזרם התא.
מגבלות אפשריות של הגישה המתוארת כאן כוללים (1) זיהוי ה-DNA בנוסף RNA, במיוחד עבור מבחני לא ספציפיות עבור צמתי splice mRNA, ומספר מוגבל (2) של פני שטח חלבונים וגם הגנים נמדד. אולם, זיהוי ה-DNA הוא צפוי לתרום באופן משמעותי כדי מארח דיפרנציאלית מפענוח ביטוי מהסיבה האמור לעיל. יתר על כן, מדדנו ישירות במידה שבה דנ א תורמת האות qPCR ב פרוטוקול זה על ידי שתי גישות: א) למעט רוורס טרנסקריפטאז ושינוי ב) פרוטוקול פירוק התא כדי לשפר את פירוק גרעיני ממברנה. בהיעדר רוורס טרנסקריפטאז, שניהם משולבים, עדיין זוהו גנים ויראליים unspliced, אך ב נמוכות בהרבה תדירות יותר בנוכחות רוורס טרנסקריפטאז (~ הפחתות 6-fold ו- 2-fold, בהתאמה)20. לפיכך, מבחני ביטוי גנים ויראליים ייתכן מפריז בערך הכמות של נגיפי RNA נוכח תא בשל נוכחותם של התא-הקשורים ה-DNA הנגיפי. אנו מייחסים ממצא זה למוצרים RT cytoplasmic שנוצרו במהלך זיהום התא המארח, עלולה להתרחש עבור RNA סיב/HIV משולבים וגם unspliced שמקורן virions נכנסות36. לפיכך, יתכן ורצוי להקדיש חלק מהניסויים בתנאי חסר רוורס טרנסקריפטאז כדי quantitate DNA-derived תבנית עבור יישומים מסוימים. יש גם לציין כי unspliced RNA סיב/HIV נגזר וירוס נכנסות לא יכול להיות נבדל RNA נגיפי דה נובו מסונתז. שנית, אנחנו צעד פירוק גרעיני שולבו פרוטוקול RT-preamp והנצפית גידול מעריכי עותקים סיב ה-DNA (Alu-LTR) משולב (איור S3 של בולטון et al.) 20. הדנ א הגנומי ולכן צפוי לתרום באופן משמעותי על תבנית חומצת גרעין מופק בשיטת פירוק התא המשמש כאן. ראוי לציין, התוספת של צעד פירוק גרעיני עשוי להיות שימושי בעתיד החד-תאיים מחקרים המבקשים לחקור סיב או שאר התאים דנ א חיובי וירוס, כולל תאים נגועים לחשוף.
המספר של חלבונים פני שטח ניתח מוכתב על ידי היכולת של סדרן התא cytometric הזרימה. כלים זמינים מסחרית הנוכחי לא יעלה על 30 פרמטרים. מחקרים עתידיים העסקת מיכשור מתקדם יותר ירחיב בהמשך החלבון פרופיל יכולת של גישה זו. גם ניתן להרחיב את מספר תעתיקים מעבר 96, ריאגנטים התומך שסופק (למשל, תחל של ריכוז גבוה יותר), ציוד ומכשור. בסופו של דבר, מתעוררים טכנולוגיות בתא יחיד המשלבים ניתוח של פרוטאום (ספקטרומטר מסה), transcriptome (RNAseq), ואת הגנום (DNAseq) תחליף את הגישות ממוקד עבור גילוי מחקר31,37, 38 , 39. qPCR יישוב ככל הנראה יישאר כלי רב ערך עבור אימות כזה גישות "טכנולוגיות" כתקן זהב עבור ניתוחים ביטוי כמותי.
חלבון בשילוב וניתוח שעתוק מאת tSCEPTRE הוא כלי רב עוצמה עבור חוקרים נדיר או קשה לזהות תאים כגון האלה מחסה פתוגנים, המכיל oncogenes או אחרת בתערוכה של פנוטיפ חריגה. ניתן לזהות סמנים חדש עבור תאים נגועים-SIV/HIV פעיל transcriptionally בדרך זו, כמו גם על גילוי מנגנוני חדשים מעורבים בפתוגנזה של זיהומים נגיפיים אלה. זיהוי של תאים נגועים לחשוף יחייב פיתוח נוסף של פרוטוקול ה-DNA הנגיפי משולב הגנום מארח את התחת. ראוי לציין, התדירות של תאים נגועים ב- HIV/סיב הוא נמוך משמעותית ב- viremic או דלקת כרונית, אשר יציג בפניך אתגר המעשי לומד תאים נגועים נגזר הגדרות אלה. הגישה שלנו מטילה את הקרקע להערכת מנגנון סורר בעבר: זה של תקנה post-transcriptional ברמה תא יחיד, ויש ישימות רחבה אינטראקציות פתוגן-פונדקאי, כמו גם תהליכים תאיים כללי יותר.
Disclosures
עבודה זו נתמכה על ידי הסכם שיתופיות (W81XWH-07-2-0067) בין מ הנרי ג'קסון הקרן קידום של הצבאי לרפואה, inc., ארה ב המחלקה של ההגנה (משרד ההגנה). הדיעות של המחברים, לא יפורש לייצג את העמדות של צבא ארה ב או ההגנה. המחקר נערך תחת פרוטוקול שאושר לשימוש בבעלי חיים במתקן AAALACi מוכר בדרישות חוק רווחת בעלי חיים, אחרים הפדרלי חוקים ותקנות הנוגעים לבעלי חיים, ניסויים בבעלי חיים מעורבים ונדבקת עקרונות נכתב במדריך עבור טיפול, שימוש של חיות מעבדה, הפרסום NRC, 2011 מהדורה.
Acknowledgements
המחברים רוצה להודות NIAID VRC Flow Cytometry הליבה ואת המתקנים MHRP Flow Cytometry הליבה עבור תחזוקה ותפעול של FACS מכשירים וציוד מיון; מריה מונטרו, Vishakha שארמה, שיר Kaimei לסיוע טכני מומחה; מייקל Piatak ג'וניור (נפטר) לקבלת סיוע עם סיב qPCR assay עיצוב; ברנדון בדק, מתיו Scarlotta עבור SIV לבודד רצפים. הדיעות של המחברים, לא יפורש לייצג את העמדות של צבא ארה ב או ההגנה. המחקר נערך תחת פרוטוקול שאושר לשימוש בבעלי חיים במתקן AAALAC מוכר בדרישות חוק רווחת בעלי חיים, אחרים הפדרלי חוקים ותקנות הנוגעים לבעלי חיים, ניסויים בבעלי חיים מעורבים ונדבקת עקרונות נכתב במדריך עבור טיפול, שימוש של חיות מעבדה, הפרסום NRC, 2011 מהדורה.
Materials
| Name | Company | Catalog Number | Comments |
| RNA extraction and PCR reagents and consumables | |||
| Genemate 96-Well Semi-Skirted PCR Plate | BioExpress/VWR | T-3060-1 | |
| Adhesive PCR Plate Seals | ThermoFisher | AB0558 | |
| Armadillo 384-well PCR Plate | ThermoFisher | AB2384 | |
| MicroAmp Optical Adhesive Film | Applied Biosystems/ThermoFisher | 4311971 | |
| DEPC Water | Quality Biological | 351-068-101 | |
| Glass Distilled Water | Teknova | W3345 | |
| Superscript III Platinum One-Step qRT-PCR Kit | Invitrogen/ThermoFisher | 11732088 | |
| SUPERase-In Rnase Inhibitor | Invitrogen/ThermoFisher | AM2696 | |
| Platinum Taq | Invitrogen/ThermoFisher | 10966034 | |
| dNTP Mix | Invitrogen/ThermoFisher | 18427088 | |
| ROX Reference Dye (if separate from kit) | Invitrogen/ThermoFisher | 12223012 | |
| DNA Suspension Buffer | Teknova | T0223 | |
| RNAqueous kit | Invitrogen/ThermoFisher | AM1931 | |
| TaqMan gene expression assays not listed in Table 2 | |||
| CD6 | Applied Biosystems/ThermoFisher | Hs00198752_m1 | |
| TLR3 | Applied Biosystems/ThermoFisher | Hs1551078_m1 | |
| Biomark reagents | |||
| Control Line Fluid Kit | Fluidigm | 89000021 | |
| TaqMan Universal PCR Mix | Applied Biosystems/ThermoFisher | 4304437 | |
| Assay Loading Reagent | Fluidigm | 85000736 | |
| Sample Loading Reagent | Fluidigm | 85000735 | |
| Dynamic Array 96.96 (chip) | Fluidigm | BMK-M-96.96 | |
| FACS reagents | |||
| SPHERO COMPtrol Goat anti-mouse (lambda) | Spherotech Inc. | CMIgP-30-5H | |
| CompBeads Anti-Mouse Ig,k | BD Biosciences | 51-90-9001229 | |
| 5 ml Polystyrene tube with strainer cap | FALCON | 352235 | |
| Aqua Live/Dead stain | Invitrogen/ThermoFisher | L34976 | dilute 1:800 |
| Mouse Anti-Human CD3 BV650 clone SP34-2 | BD Biosciences | 563916 | dilute 1:40 |
| Mouse Anti-Human CD4 BV786 clone L200 | BD Biosciences | 563914 | dilute 1:20 |
| Mouse Anti-Human CD8 BUV496 clone RPA-T8 | BD Biosciences | 564804 | dilute 1:10 |
| Mouse Anti-Human CD28 BV711 clone CD28.2 | Biolegend | 302948 | dilute 1:20 |
| Mouse Anti-Human CD95 BUV737 clone DX2 | BD Biosciences | 564710 | dilute 1:10 |
| Mouse Anti-Human CD14 BV510 clone M5E2 | Biolegend | 301842 | dilute 1:83 |
| Mouse Anti-Human CD16 BV510 clone 3G8 | Biolegend | 302048 | dilute 1:167 |
| Mouse Anti-Human CD20 BV510 clone 2H7 | Biolegend | 302340 | dilute 1:37 |
| Anti-CD38-R PE clone OKT10 | NHP reagent recource | N/A | dilute 1:100 |
| Mouse Anti-Human CD69 BUV395 clone FN50 | BD Biosciences | 564364 | dilute 1:10 |
| Mouse Anti-Human HLA-DR APC-H7 clone G46-6 | BD Biosciences | 561358 | dilute 1:20 |
| Mouse Anti-Human ICOS Alexa Fluor 700 clone C398.4A | Biolegend | 313528 | dilute 1:80 |
| Instruments | |||
| BioPrptect Containment Enclosure | Baker | ||
| BD FACS Aria | BD Biosciences | ||
| ProtoFlex Dual 96-well PCR system | Applied Biosystems/ThermoFisher | 4484076 | |
| Quant Studio 6 qPCR instrument | Applied Biosystems/ThermoFisher | 4485694 | |
| IFC controller HX | Fluidigm | IFC-HX | |
| Biomark HD | Fluidigm | BMKHD-BMKHD |
References
- Macaulay, I. C., Ponting, C. P., Voet, T. Single-Cell Multiomics: Multiple Measurements from Single Cells. Trends Genet. 33 (2), 155-168 (2017).
- Pasternak, A. O., Lukashov, V. V., Berkhout, B. Cell-associated HIV RNA: a dynamic biomarker of viral persistence. Retrovirology. 10, 41(2013).
- Mailler, E., et al. The Life-Cycle of the HIV-1 Gag-RNA Complex. Viruses. 8 (9), (2016).
- Varmus, H. Retroviruses. Science. 240 (4858), 1427-1435 (1988).
- Frankel, A. D., Young, J. A. HIV-1: fifteen proteins and an RNA. Annu Rev Biochem. 67, 1-25 (1998).
- Dominguez, M. H., et al. Highly multiplexed quantitation of gene expression on single cells. J Immunol Methods. 391 (1-2), 133-145 (2013).
- Tokarev, A., Guatelli, J. Misdirection of membrane trafficking by HIV-1 Vpu and Nef: Keys to viral virulence and persistence. Cell Logist. 1 (3), 90-102 (2011).
- Malim, M. H., Bieniasz, P. D. HIV Restriction Factors and Mechanisms of Evasion. Cold Spring Harb Perspect Med. 2 (5), a006940(2012).
- Sugden, S. M., Bego, M. G., Pham, T. N., Cohen, E. A. Remodeling of the Host Cell Plasma Membrane by HIV-1 Nef and Vpu: A Strategy to Ensure Viral Fitness and Persistence. Viruses. 8 (3), 67(2016).
- Simon, V., Bloch, N., Landau, N. R. Intrinsic host restrictions to HIV-1 and mechanisms of viral escape. Nat Immunol. 16 (6), 546-553 (2015).
- Kirchhoff, F. Immune evasion and counteraction of restriction factors by HIV-1 and other primate lentiviruses. Cell Host Microbe. 8 (1), 55-67 (2010).
- Wigzell, H. Immunopathogenesis of HIV infection. J Acquir Immune Defic Syndr. 1 (6), 559-565 (1988).
- Reynolds, M. R., et al. Ex vivo analysis of SIV-infected cells by flow cytometry. Cytometry A. 77 (11), 1059-1066 (2010).
- Baxter, A. E., et al. Single-Cell Characterization of Viral Translation-Competent Reservoirs in HIV-Infected Individuals. Cell Host Microbe. 20 (3), 368-380 (2016).
- Grau-Exposito, J., et al. A Novel Single-Cell FISH-Flow Assay Identifies Effector Memory CD4+ T cells as a Major Niche for HIV-1 Transcription in HIV-Infected Patients. MBio. 8 (4), (2017).
- Eriksson, S., et al. Comparative analysis of measures of viral reservoirs in HIV-1 eradication studies. PLoS Pathog. 9 (2), e1003174(2013).
- Finzi, D., et al. Identification of a reservoir for HIV-1 in patients on highly active antiretroviral therapy. Science. 278 (5341), 1295-1300 (1997).
- Chomont, N., et al. HIV reservoir size and persistence are driven by T cell survival and homeostatic proliferation. Nat Med. 15 (8), 893-900 (2009).
- DeMaster, L. K., et al. A Subset of CD4/CD8 Double-Negative T Cells Expresses HIV Proteins in Patients on Antiretroviral Therapy. J Virol. 90 (5), 2165-2179 (2015).
- Bolton, D. L., et al. Combined single-cell quantitation of host and SIV genes and proteins ex vivo reveals host-pathogen interactions in individual cells. PLoS Pathog. 13 (6), e1006445(2017).
- Quintans, J., Lefkovits, I. Precursor cells specific to sheep red cells in nude mice. Estimation of frequency in the microculture system. Eur J Immunol. 3 (7), 392-397 (1973).
- Finak, G., et al. MAST: a flexible statistical framework for assessing transcriptional changes and characterizing heterogeneity in single-cell RNA sequencing data. Genome Biol. 16, 278(2015).
- McDavid, A., et al. Modeling bi-modality improves characterization of cell cycle on gene expression in single cells. PLoS Comput Biol. 10 (7), e1003696(2014).
- McDavid, A., Finak, G., Gottardo, R. The contribution of cell cycle to heterogeneity in single-cell RNA-seq data. Nat Biotechnol. 34 (6), 591-593 (2016).
- Kok, Y. L., Ciuffi, A., Metzner, K. J. Unravelling HIV-1 Latency, One Cell at a Time. Trends Microbiol. , (2017).
- Rato, S., Golumbeanu, M., Telenti, A., Ciuffi, A. Exploring viral infection using single-cell sequencing. Virus Res. 239, 55-68 (2017).
- Wagner, A., Regev, A., Yosef, N. Revealing the vectors of cellular identity with single-cell genomics. Nat Biotechnol. 34 (11), 1145-1160 (2016).
- Nestorowa, S., et al. A single-cell resolution map of mouse hematopoietic stem and progenitor cell differentiation. Blood. 128 (8), e20-e31 (2016).
- Soh, K. T., et al. Simultaneous, Single-Cell Measurement of Messenger RNA, Cell Surface Proteins, and Intracellular Proteins. Curr Protoc Cytom. 75, 41-47 (2016).
- Kochan, J., Wawro, M., Kasza, A. Simultaneous detection of mRNA and protein in single cells using immunofluorescence-combined single-molecule RNA FISH. Biotechniques. 59 (4), 209-212 (2015).
- Stahlberg, A., Thomsen, C., Ruff, D., Aman, P. Quantitative PCR analysis of DNA, RNAs, and proteins in the same single cell. Clin Chem. 58 (12), 1682-1691 (2012).
- Assarsson, E., et al. Homogenous 96-plex PEA immunoassay exhibiting high sensitivity, specificity, and excellent scalability. PLoS One. 9 (4), e95192(2014).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nat Biotechnol. 20 (5), 473-477 (2002).
- Genshaft, A. S., et al. targeted profiling of single-cell proteomes and transcriptomes in a single reaction. Genome Biol. 17 (1), 188(2016).
- Mahnke, Y. D., Roederer, M. Optimizing a multicolor immunophenotyping assay. Clin Lab Med. 27 (3), 469-485 (2007).
- Liang, C., Hu, J., Russell, R. S., Kameoka, M., Wainberg, M. A. Spliced human immunodeficiency virus type 1 RNA is reverse transcribed into cDNA within infected cells. AIDS Res Hum Retroviruses. 20 (2), 203-211 (2004).
- Stegle, O., Teichmann, S. A., Marioni, J. C. Computational and analytical challenges in single-cell transcriptomics. Nat Rev Genet. 16 (3), 133-145 (2015).
- Wu, M., Singh, A. K. Single-cell protein analysis. Curr Opin Biotechnol. 23 (1), 83-88 (2012).
- Haque, A., Engel, J., Teichmann, S. A., Lonnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Med. 9 (1), 75(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved