Method Article
연 접 기능 그대로 신경 회로 내에 유전자 최저 효과 특성 인공 microRNAs Optogenetics 결합
요약
이 프로토콜은 인공 예측에 관한 중재 RNA 간섭 그대로 신경 회로 내에서 선택적 gene(s)의 감소 식이 구체적으로 연 접 boutons를 자극 하는 optogenetics와 결합 하는 방법에 대 한 워크플로우를 제공 합니다.
초록
이 프로토콜의 목적은 그대로 신경 회로 내에서 연 접 기능에 유전자 최저의 효과 특성 이다. 우리 인공 예측에 관한 (미르)를 결합 하는 방법에 대 한 워크플로 설명-급성 뇌 조각에 조작된 연 접 boutons의 선택적 자극을 달성 하기 위해 optogenetics RNA 간섭 중재. 실험 방법은 단일 바이러스 성 구조 및 드라이브는 optogenetic 프로브 및 연 접 gene(s)에 대 한 인공 miR(s)의 식 단일 신경 특정 발기인의 사용을 포함. Stereotactically 관심 뇌 영역에 주입 때 표현된 구문 수 있습니다 빛 조사 gene(s)의 감소 식이 독점적으로 뉴런을 자극 하. 이 전략 개발 및 유전자 변형된 마우스 라인의 유지 관리를 필요로 하지 않습니다 하 고 적용할 수 있는 원리에 다른 유기 체 및 선택의 모든 신경 진. 우리는 최근 연 접 P/Q 유형 전압 개폐 칼슘 채널 (VGCCs)의 대체 스플라이스 isoforms의 최저 급성 hippocampal 조각에서 CA1 흥분 성의 시 냅 스에 CA3에서 단기 시 냅 스가 소성을 조절 하는 방법을 조사를 적용 했습니다. 비슷한 접근 방식은 조작 하 고 신경 회로 비보프로브 사용 될 수 있습니다.
서문
이 프로토콜에는 연 접 기능 그대로 신경 회로 내에 유전자 최저의 효과 특성화 하는 새로운 접근 방식을 설명 합니다. 그대로 신경 회로에 연 접 기능을 조사 하는 것은 많은 연 접 boutons 너무 작기 때문에 및 멀리 결합된 분자와 electrophysiological 개입 있도록 소마에서 도전적 이다. RNA 간섭 최저의 시 냅 스 단백질1을 강력 하 고 유연한 방법을 제공 합니다, 하지만이 방법은 사용 되었습니다 아껴 서 최저 전통적인 사용의 효과 검출 하기 어렵기 때문에 연 접 기능을 조사 하 구분 하지 않는 전기 stimulations 조작 및 순진한 연 접 boutons2. 여기, 우리가 인공 예측에 관한 (미르)를 결합 하는 방법에 설명-급성 뇌 조각에 조작된 연 접 boutons의 선택적 자극을 달성 하기 위해 최근에 개발 된 optogenetic 기술로 RNA 간섭 중재.
전기 생리학 함께에서 조건부 녹아웃 쥐 연 접 단백질3,4의 기능을 조사 하기 위해 사용 될 수도, 하는 동안 우리의 전략 필요 하지 않은 개발 및 유지 보수의 유전자 마우스 라인을 수정 하 고 유전자의 특정 isoforms를 허물고 또한 쉽게 채택 될 수 있다. 더 일반적으로 상대적 사용된 짧은 헤어핀 RNAs (shRNAs), 우리 여기 사용 하 고, 인공 미르 뉴런에 최저에 대 한 주요 이점을 제공 합니다. ShRNAs, 달리는 중 합 효소 II 발기인1의 제어에서 표현할 수 있습니다. 따라서, 단일 발기인 미르의 형광 기자와 함께 optogenetic 프로브 식 드라이브를 사용할 수 있습니다. 이 방법에서는, 포장의 한계 내에서 재조합 형 adeno 관련 바이러스 (rAAV, 그림 1A)는 구조물의 크기를 보관할 수 있습니다. 또한, 단일 구조와 단일 발기인의 사용은 미르, optogenetic 프로브 및 고정된 비율에 형광 리포터의 표현에 대 한 허용 하기 때문에 실험적인 변화를 감소.
우리는 최근 마5연 접 칼슘 채널의 양자 택일로 접합된 isoforms의 역할을 검토 하는이 기술을 적용 했습니다. 이러한 전략의 어떤 두뇌 회로에 다른 presynaptically 표현한 단백질의 생리 적인 관련성을 공부에 일반적으로 적용 됩니다.
프로토콜
모든 실험 지침 (지침 2010/63/유럽 2014 년 3 월 4 일의), 유럽 공동체 위원회에 의해 설립에 따라 실시 했다 그리고 건강의 이탈리아 정부에 의해 승인 했다.
1. RNA 간섭 및 분리 식 시스템에 그들의 효율성의 평가 위한 microRNAs의 디자인
참고:이 프로토콜 다음 잘 설립 방법의 지식이 필요: 분자 클로닝, DNA 연속, 셀 라인, 칼슘 인산 염 transfection, 양적 실시간 유지 보수 시간 PCR (qRT-PCR), 세포에서 세포 lysates의 준비 그리고 서 부 럽입니다.
- 관심사의 유전자 대체 접합 적용 되는지 확인 합니다. 유전자의 일반적인 최저 선택 독점적으로 제정 exons; 특정 또는 접합된 isoform의 최저 관련 또는 접합된 exon를 선택 합니다.
- 전용된 소프트웨어 (예: https://rnaidesigner.thermofisher.com/rnaiexpress/)를 사용 하 여 관심사의 순서에 대 한 RNA 간섭에 대 한 인공 미르 디자인.
참고: 그것은 기본적인 현지 줄 맞춤 검색 도구 (폭발)을 사용 하 여 대상에 대 한 가능한 오프-같은 종 내에서 확인 하는 것이 중요. - 대상 유전자에 대 한 상위 3 위 미르를 선택 합니다.
- 적합 한 회사에서 선택한 미르의 위쪽 및 아래쪽 가닥을 주문. 부정적인 제어를 위해 선택 된 미르 나 한 미르는 실험에 사용 되는 종의 알려진된 모든 유전자를 대상으로 하지 예측 한 스크램블된 버전을 사용 (예. 척 추가 있는 유전자, pcDNA6.2-GW/EmGFP-미르-neg에 미르에 대 한).
- 선택 된 미르의 각각 위쪽 및 아래쪽 가닥 anneal 고 미르 (예: pcDNA6.2-GW/EmGFP-미르) 표준 복제 전략을 사용 하 여의 식을 위한 플라스 미드로 복제.
참고: 목표 5' 미르 측면에 서 지역, 선택한 미르 시퀀스 및 3' 미르 측면에 서 지역에서는 3' UTR 취재 원 유전자는 RNA 중 합 효소 유형 II 발기인의 통제의 표현할 수 있는 구성 된 미르 식 카세트를 만드는 것입니다. - 연속 DNA를 사용 하 여 선택한 미르의 올바른 삽입을 확인 하기 위해.
- (37 ° C, 5% CO2) 습도 셀 문화 인큐베이터에서 HEK293 세포 성장 DMEM을 사용 하 여 중간 보충 10% 태아 둔감 한 혈 청, 1 mM NaPyruvate, 10 mM HEPES (pH 7.39) 및 1 x 페니실린/스 (펜/Strep).
- HEK293 세포 ~ 70% 합칠 때, 미르 식 벡터와 1:1 DNA 비율 칼슘 인산 염 방법6을 사용 하 여 대상된 유전자를 표현 하는 벡터의 각 하를 transfect 공동 다음과 같은 컨트롤이 포함 됩니다: (i) 세포 untransfected, (ii) 세포 어느 캐리어 DNA (예: pBluescript II SK(+)) 또는 (iii) 미르 제어 함께 타겟된 유전자를 표현 하는 벡터와 페.
참고: (i) 표현된 타겟된 유전자 해야 있는 쪽으로 미르 디자인 되었다, 동일한 종에서는 미르 대상 시퀀스는 절대적으로 두 종족 사이 뉴클레오티드 수준에서 보존 하지 않으면 합니다. (ii) 셀 라인 HEK293 이외는 사용할 수 있습니다. (transfection, electroporation 또는 liposome 기반 방법 등 iii) 대체 방법은 사용할 수 있습니다. -
transfection, 후 48 h 세포를 lyse, 단백질 젤 실행, 서쪽 오 점 수행 하 고 콘텐츠 대상 단백질을 인식 하는 항 체와 단백질 분석. 50 %의 최저 효율에 대 한 목표입니다.
참고: 때 려 눕 힘 효율성 또는 수 또는 (ii) 해당 하는 경우 대상 단백질의 활동을 측정 하 여 (i) 여 ELISA 분석, 평가, (예: 이온 채널에 대 한 전류 밀도) 또는 (iii) 만약 적합 한 mRNA 수준에서 qRT-PCR 항 체는 사용할 수 없습니다 (프로토콜 단계 3).- 문화 요리를 얼음에 놓고 셀 차가운 인산 염 버퍼 식 염 수 (PBS)을 한 번 씻어.
- PBS, 발음 다음 차가운 RIPA 버퍼 (50 mM Tris HCl pH 7.4, 150 mM NaCl, 2 mM EDTA, 1 %NP40, 0.1% 나트륨 라우릴 황산 염 (SDS), 프로 테아 제와 인산 가수분해 효소 저 해제를 포함, Ø 100 m m, Ø 60 m m의 요리에 대 한 0.5 mL의 요리에 대 한 1 mL)를 추가 합니다.
- 셀 스 크레이 퍼를 사용 하 여 접시에 부착 세포를 긁어와 부드럽게 사전 냉각된 microcentrifuge 튜브에 세포 현 탁 액을 전송.
- 4 ° C에서 15 분 동안 15000 x g에서 튜브 원심, 새로운 사전 냉각된 microcentrifuge 튜브에 상쾌한 전송 및 삭제는 펠 릿.
- BCA 단백질 분석 실험 키트 또는 다른 적당 한 방법 (예: Bradford 분석 실험)를 사용 하 여 단백질 농도 결정 합니다.
참고: 샘플 수 수-20 ° C 또는 나중 사용을 위해-80 ° C에서 냉동 하거나 즉시 처리 합니다. - 모든 샘플 같은 단백질 농도 같은 볼륨에 있는 모든 lysates 만회 하기 적절 한 얼음 세포의 용 해 버퍼를 추가 microcentrifuge 튜브 lysates의 적절 한 볼륨을 전송 합니다.
참고: 총 단백질의 30 ~ 50 µ g 단백질의 대부분을 위해 충분 해야 하지만 관심사의 단백질의 풍부에 따라 로드 되도록 적절 한 수량을 결정 한다. - 2 x Laemmli 버퍼의 적절 한 금액을 추가 (4 %SDS, 2-mercaptoethanol 10%, 20% 글리세롤, 0.004 %bromophenol 블루, 0.125 M Tris HCl, pH 6.8) 5 분 동안 95 ° C에서 샘플을 끓여 야 하 고.
- 분자량 표식 함께 아크릴 아 미드 젤에 샘플을 로드 합니다. 100 V 1-2 h에 젤을 실행 합니다.
참고: 젤 비율 관심사의 단백질의 크기에 따라 달라 집니다. - 전송 샌드위치를 조립 하 고 100 V 2 h 막에 젤에서 단백질을 전송. 니트로 또는 PVDF 막 될 수 있습니다. 1 분에 대 한 메탄올을 가진 PVDF를 활성화 하 고 전송 버퍼와 스택의 준비 하기 전에 그것을 씻어.
- 블로킹 버퍼를 사용 하 여 실 온에서 1 h 막 차단 (PBST에 5% 우유 (PBS + 0.1% Tween 20)), 다음 4 ° C에서 하룻밤 막 차단 버퍼에 희석 1 차 항 체로 품 어.
- PBST에 세 번 10 분 막을 세척 하 고 실 온에서 1 h에 대 한 블로킹 버퍼에 이차 항 체 HRP 활용으로 품 어.
- 4 번, PBS에 10 분 동안 막 씻고 막에 chemiluminescent 기판 적용 하 고 CCD 카메라 기반 영상 장치를 사용 하 여 chemiluminescent 신호를 캡처.
- 이미지 분석 소프트웨어를 사용 하 여 최저 효율 척도를.
- 두 가장 효율적인 미르 겹치지 시퀀스 추가 기능 분석 실험 대상으로 선택 합니다.
참고:-대상 효과 수 있습니다 결코 완전히 배제할 수 어떤 미르에 대 한. 그러나, 두 개의 독립적인 미르 비슷한 효과 있다면, 그것 매우 가능성이 크다이 같은 오프 대상 최저 때문입니다. - 선택한 미르의 최저 효율은 만족 스러운 경우 (< 50%), 기타 미르에 대 한 화면. 또는, 익스프레스 연동, 즉 가장 효율적인 miR(s) 익스프레스 그들 최저 효율 증가7에서 발생할 수 있습니다 같은 식 카세트에서 여러 복사본에서.
2. 결합 식의 Optogenetic 프로브 및 microRNAs 재조합 형 Adeno 관련 벡터의 건설
참고:이 프로토콜 다음 잘 설립 방법의 지식이 필요: 분자 클로닝, DNA 시퀀싱 및 rAAV 생산.
- 각 복제본에는 3' UTR의 구문 흥분 성의 optogenetic의 표현 및 재조합 rAAVs 생산을 위한 가장 효율적인 미르 식 카세트의 프로브, pAAV-Syn-ChETA-TdT-miR-X (그림 1A)와 같이 어디에 신경 관련 synapsin 발기인 드라이브 초고속 channelrhodopsin ChETA의 표현, 붉은 형광 기자 TdTomato, 그리고 miR(s) NheI 및 EcoRI 사이트5사이 삽입 합니다.
참고: (i) 하지는 ITR (그림 1A, 오렌지) ITR (거꾸로 단말기 반복)에서 길이 약 4.7 Kb rAAVs의 포장 제한을 능가. (ii) 미르 식 카세트 정지 codon WPRE (마 간염 바이러스 Posttranscriptional 규제 요소 사이 삽입 될 필요가 그림 1A)입니다. (형광 단백질, TdTomato, 등을 포함 iii)은 쉽게 지역화와 감염 (프로토콜 단계 4)의 강도 모니터링 수 매우 유용 합니다. - 미르 카세트의 올바른 삽입을 연속 DNA를 사용.
- 생산 및 titer rAAV1/28이전 게시 된 프로토콜 따라, 각 선택 된 미르에 대 한 하나의 rAAV1/2. 1 전형적인 실험 한 유전자의 최저에 대 한 동일한 유전자와 한 미르 컨트롤에 대 한 두 개의 독립적인 미르 포함 됩니다. ≥109 바이러스 성 게놈 (vg)의 바이러스 titer 목표로 / µ L.
주의: rAAVs Biosafety 수준 1 (BSL-1) 시설에서 처리 될 필요가 있다. 자세한 내용은 기관 Biosafety 위원회와 확인 하십시오.
참고: 실험실에는 바이러스 성 시설 또는 바이러스 titers 만족 하지 않은 경우 rAAV 생산 수 수 아웃소싱. 예를 들어 https://www.med.upenn.edu/gtp/vectorcore/ 또는 https://vcf.charite.de/en/metas/를 방문 하십시오.
3. qRT-PCR에 의해 미르 내 생 유전자의 최저 효율의 평가 대 한 기본 신경 문화에서 RNA 추출
참고: (i)이이 프로토콜 다음 잘 설립 방법의 지식이 필요: 준비 및 기본 신경 문화와 qRT-PCR의 유지 보수. (ii) 최저 효율 (단계 3.1-3.14)의 정량화 적어도 3 회 반복 (생물 복제). (qRT-PCR에 의해 mRNA 수준에서 때 려 눕 힘 효율성의 예측 iii)은 때 어떤 특정 항 체는 사용할 수 있는5isoforms 접합 또는 노크 등 단백질 함량의 분석은 배제 하는 경우에 적합 합니다.
-
기본 신경 문화 관심 뇌 영역에서 준비 합니다. 대뇌 피 질의 문화 이전 출판9, 다음 수정에 대 한 프로토콜을 따르십시오.
- 잘 당 500000 뉴런의 밀도에 6 잘 플레이트에서 하는 접시 신경 2.5 mL/잘 첨부 파일 매체와 3.3 mL/유지 보수 매체의 잘 사용 합니다.
- 사이토 자라 난 관찰 되는 경우 3-4 일에서 생체 외에서 (DIV)에 시 토 신 β-D-arabinofuranoside (1 µ M의 최종 농도)에 대 한의 7.5 µ M와 보완 유지 보수 매체의 0.5 mL/음을 추가 합니다.
-
5 미르 (기술 복제) 당 3 개의 우물을 감염-6 팀 사용 낮은 감염 복용량 뉴런의 ≥99 %를 감염 됩니다.
- 각 우물에서 매체의 2 mL을 제거 하 고 50ml 팔 콘 튜브에 수집.
- 바이러스는 신경 세포에 직접 추가, 부드럽게 혼합 하 고 37 ° c.에 인큐베이터에 접시를 장소
- 인큐베이터에서 수집 된 매체를 저장 합니다. 가스 평형 수 있도록 팔 콘 튜브의 캡을 풀어.
- 24 시간 후에 각 잘 (1.9 mL/잘) 제거 중간 다시를 추가 합니다.
-
17-18 DIV, RNA 추출에 대 한 신경 세포를 lyse.
주의: 세포 시 약 및 클로 프롬 매우 독성이 있다. 화학 후드 작업과 착용 보호 장비; 당신의 국가 및 기관 지침에 따라 폐기물의 처분.
참고: 단계 3.3-3.13, RNAse 무료 조건에서 작동 합니다. 장갑을 착용 하 고 유리 RNAse 무료 일회용 plasticware를 사용 하 여. RNA 핸들 하는 방법에 일반적인 조치에 대 한 상담 예 부록 A RNeasy 마이크로 핸드북 사용할 수 온라인.- 유리 180 ° c.에 오븐에 하룻밤 파스퇴르 펫을 품 어
- 번호판 기울기와 발음 완전 하 게 잘 사용 하 여 각 유리 진공 펌프에 연결 된 파스퇴르 피 펫에서 매체.
- 즉시 각 우물에 세포 시 약의 700 µ L를 추가 합니다.
- 락을 신중 하 고 간단히 손으로 접시를 흔들어 하 여 솔루션을 균등 하 게 확산.
- 솔루션을 위쪽 및 아래쪽 플라스틱 4-5 시간 또는 균질 정지를 얻을 때까지.
- 별도 1.5 mL Eppendorf 관에 각 우물에서 솔루션을 전송.
참고: 셀 lysates-80 ° C에 저장 하거나 즉시 처리 될 수 있습니다.
- 필요한 경우, 세포 lysates RT에 녹 그리고 3.5 단계로 바로 진행.
- 각 샘플 세포 lysates의 클로 프롬의 140 µ L를 추가 합니다.
참고: 클로 프롬은 휘발성과 어려운 플라스틱, Eppendorf 관을 가능한 한 빨리 닫습니다. - 15에 대 한 적극적으로 Eppendorf 관을 흔들어 s 또는 샘플은 유화 완전히 될 때까지.
- 1-2 분 동안 또는 액체 단계 분리를 시작 때까지 RT에서 샘플을 유지.
- 4 ° c.에 15 분 동안 12000 x g에서 샘플을 원심
- 위 수성 단계 (~ 320 µ L) 새로운 Eppendorf 관에 RNA를 포함 된 전송 및 남은 액체를 삭제.
참고: 낮은 핑크 유기 단계 또는 백색 반지는 피 펫의 끝을 가진 두 단계 사이 만지지 마십시오. - 수성 단계 100% 에탄올 (480 µ L)의 1.5 볼륨을 추가 하 고 혼합 3 번 위아래로 천천히 솔루션 플라스틱.
- 작은 샘플에서 RNA의 정화를 위한 상용 키트를 사용 하 여 RNA를 정화.
- 분 광 광도 계와 RNA 농도 및 샘플 순도 계량.
참고: (i) 기대 수익률의 ≥3.5 µ g /; 260/280와 260/230 비율 단백질 및 유기 화합물의 순도 한다 둘 다에 대 한 ≥1.9. (ii) RNA 샘플-80 ° C에 저장 하거나 즉시 처리 될 수 있습니다. - RNA의 Retrotranscribe 250, 500 또는 1000 ng 상용 키트와 함께
- QRT-PCR에 의해 관심의 내 생 유전자에 대 한 최저 효율을 계량. 자세한 프로토콜에 대 한 참조10을 참조 하십시오. ≥60% (그림 2)의 최저 효율을 목표로 합니다. ≥2 내부 관리 유전자 (예데이터 표준화. GAPDH, ACTB, TUBB3, PPIA) 사용 하는 여러 유전자 내부 제어 방법11.
참고: 쥐에서 작업 하는 경우 내부 관리 유전자에 대 한 다음 PCR 뇌관 사용: GAPDH fwd: 5' 3' GGTGCTGAGTATGTCGTGGA 및 GAPDH 계: 5' GATGATGACCCTTTTGGC 3'; ACTB-fwd: 5' 3' CATCACTATCGGCAATGAGC 및 ACTB 계: 5' TCATGGATGCCACAGGATT 3'; TUBB3-fwd: 5' 3' GCCTTTGGACACCTATTCAG 및 TUBB3 계: 5' TCACATTCTTTCCTCACGAC 3'; PPIA-fwd: 5 ' 3' CACTGGGGAGAAAGGATTTG 및 PPIA 계 5' CCATTATGGCGTGTGAAGTC 3'.
4. 평가 Optogenetics와 노크 다운 신경의 표적된 자극에 의해 그대로 신경 회로에 연 접 단백질의 역할
참고: 다음 프로토콜 electrophysiological 녹음 급성 뇌 조각과 electrophysiological 설치에 대 한 액세스에 이전 경험을 요구 한다.
- Stereotactically 이전 게시12자세한 프로토콜에 따라 두뇌에 rAAV1/2 주사. 정위 적 지도 사용 하 여 마우스13 또는 쥐 뇌14에 대 한 관심의 뇌 영역에 대 한 정위 적 좌표를 결정 합니다.
- 7-9 µ m; Ø의 긴 정강이로 주입 micropipettes를 micropipette 끌어당기는 사람을 사용 하 여 가 위 정강이에 주입 micropipettes를 클립. 얇은 마커 및 그래프 용지를 사용 하 여 주입 micropipettes 모든 2mm에 보정 표를.
- Anesthetize와 isoflurane 동물 하 고 정위 적 장치에 그것을 해결.
- 37 ° c.에 설정 하는 생리대는 작업을 통해 따뜻한 동물 유지
- 눈 윤활제와 눈을 보호 합니다.
- 전기 면도기로 머리에 모피를 면도.
- 목화 꽃 봉 오리를 사용 하 여 면도 머리에 povidone 요오드 확산.
- 해 현미경 중간 절 개를 확인 합니다.
- 그래서 bregma 및 람다 표시 되도록 면봉으로 두개골 표면 청소.
- 그것의 소유자에 주입 micropipette를 놓습니다. 정위 적 팔에 홀더를 연결 합니다.
- 결정 하는 x 및 y 좌표는 bregma 또는 람다 기준으로 사출 사이트의.
- 드릴을 사용 하 여 대상 영역 두개골 얇은.
참고: 부드러운 원형 움직임을 사용 하 고이 두뇌의 표면에 손상을 것입니다 두개골을 드릴 하지 마십시오. - 거기는 출혈 하는 경우 흡수 수건 종이와 과도 한 혈액.
참고: 과도 한 혈액이 하게된다 그것은 z 좌표를 제대로 확인 하기 어렵습니다. - 모 세관 작용에 의해 바이러스의 ≤2 µ L 주입 micropipette 로드.
- X 및 y를 주입 micropipette가지고 주입의 사이트의 좌표.
- 경질에서 z 좌표를 계산 하 고 뇌에 피펫으로 천천히 낮은.
- Z 좌표에 도달 하면 조직의 조정 수 있도록 3 분을 기다립니다.
- 1 mL 주사기 주입 micropipette의 뒷면에 있는 유연한 튜브를 통해 연결을 사용 하 여 낮은 긍정적인 압력을 적용 합니다. 시각적으로 해 부 현미경을 통해 주입 micropipette에서 바이러스의 방출의 속도 모니터링 하 고 참조 점으로 표시는 보정을 사용 하 여.
참고: 바이러스는 느린 속도로 주입 해야 (< 100 nL/min) 조직 손상을 방지 하기 위해. - 주입이 끝나면 5 분을 기다려, 0.2 m m에 의해 주입 micropipette 철회, 바이러스의 역류를 방지 하려면 또 다른 5 분 기다립니다.
- 사출 micropipette 천천히 그리고 완전히에서 철수는 두뇌 및 그것의 dispose 컨테이너 표 백제로 가득에.
- 생리 적인 솔루션으로 두개골을 습식 및 3-4 바늘으로 피부를 봉합.
- 상처에 gentamicin 연 고를 적용 합니다.
- 단일 집 음식과 깨끗 한 장에 동물 쥐 똥 고 그것까지 열 램프 아래에서 완벽 하 게 복구.
- ≥15 일 후 주입, 목을 벨 깊은 isoflurane 마 취 동물.
- Vibratome 사용 하 여 기름 (95% O2, 5% CO2)의 뇌 영역의 급성 뇌 조각 준비 (mM)에 포함 된 차가운 실제 솔루션: 123 NaCl, 1.25 KCl, 1.25 KH2포4, 1.5 MgCl2, 1 CaCl2, 25 NaHCO3, 2 NaPyruvate와 18 포도 (osmolarity 300 mOsm 조정). 예를 들어 목표 CA1 피라미드 뉴런 CA3에서 시 냅 스 전송 분석 하는 것입니다, 화살 조각의 hippocampal 형성 (350 µ m 두께)을 준비 합니다.
참고:이 단계 이후부터 환경 빛 optogenetic 조사의 활성화를 피하기 위해 낮은 조명 조건 하에서 작동 합니다. - 조각을 들고 뇌 조각을 위한 챔버에 같은 실제에서 37 ° C에서 30 분 동안 복구 하자. 녹음까지 실내 온도에 동일한 뇌 조각 챔버에 슬라이스를 유지.
참고: 이러한 조건을 사용 하 여, 조각은 유지할 수 있습니다 최대 6-8 h에 대 한 건강 한. - 하나는 전송 그것을 슬라이스 침수 녹음 실과 superfuse에 1.5 m m CaCl2 보충 하는 복구에 사용 되는 같은 실제의 2 mL/min (Ca2 +총: 2.5 m m) NaPyruvate 없이.
참고: 조각 준비 하 고 캘리포니아의2 + (1 mM) 독성을 최소화 하기 위해 낮은 농도에서 유지 됩니다. 녹음은 2.5 m m Ca2 + 기 릴리스를 수행 됩니다. - 짧게 표현한 형광 기자 (예신호 확인. TdTomato; 그림 3B) 에 현지화 및 감염의 강도 확인 합니다.
- (MM)에 포함 하는 세포내 솔루션 패치 전극 채우기: 110 K-구 루 콘, 22 3 MgCl2, 4 Mg-ATP, 0.5 나, 0.5 EGTA, 5 NaCl, KCl3-GTP, 20 K2-크 레 아 틴 인산 염, 10 HEPES-코 (pH 7.28, 290 m ω).
참고: 5-6 m ω의 저항을 피 펫을 패치 전극을 사용 합니다. - 적외선 조명 아래 단단한 물개 전체 셀 구성에서 감염 된 신경에서 시 냅 시스 입력을 받는 신경에 도달. 예를 들어 CA3 피라미드 뉴런 감염 된 경우 (그림 3C) CA1 영역의 중간 지 대에 인접에 피라미드 뉴런 패치.
참고: 직렬 저항 남아 있을 수 있는 교수진, 하지만 상수 및 낮은 (≤20 m ω) 이어야 한다. - 약리학을 사용 하 여 조사 시 냅 스 전류를 분리. 예를 들어 목표는 흥분 성의 시 냅 스 전송을 조사 하는, 10 µ M bicuculline 억제 시 냅 스 전송을 차단 합니다.
- 예를 들어 흥분 성의 postsynaptic 전류 (EPSCs), 광섬유 (Ø ≤250 µ m)에 (예감염 된 신경 somata를 결합 473 nm 청색 레이저를 사용 하 여 시 냅 스 전류를 일 깨우 다. CA3 피라미드 뉴런)입니다.
- 자극을 evoking 빛 펄스 당 하나 이상의 행동 잠재력의 가능성을 줄이기 위해 최소 길이 조정 합니다. ChETA를 사용 하 여, 2 ms15설정.
- 작지만 명확 하 게 감지 시 냅 스 전류를 레이저의 자극 강도 조정 (≤50 pA 피크 진폭 EPSCs-70의 지주 잠재력에 기록 CA3 CA1 피라미드 뉴런; 사이 mV 그림 3D)입니다. 직경에 있는 ChETA와 250 μ m의 광섬유를 사용 하 여, 자극 섬유에서 1-3 mW의 힘 종료 적합 해야 합니다.
참고: 중립 밀도 필터를 사용 하는 레이저 강도 조정할 수 없습니다, 경우. - 감염 된 신경 somata 하지만 그들의 축 삭에 473 nm 레이저 빛을 빛나게. 예를 들어 빛는 CA3 somata, 그리고 축 삭의 직접 도발은 피하려고 Schaffer 민간인에서.
- 테트로도톡신 (TTX; 0.5 µ M)를 적용, 나트륨 수로, 채널을 확인 하는 샘플의 차단기는 활동 전위 기반.
- 다른 기록에서 선택적 자극을 확인 하기 위해 조사 시 냅 스 전류를 선택적 차단제를 적용 합니다.
참고: 예를 들어 NBQX을 적용 (10 µ M)에 AMPA 형 조미료 수용 체-중재 EPSCs. - 반복적인 자극 (≤20 Hz에서 ≥2 자극)에 대 한 응답 같은 급성 뇌 조각에 갖는 광학 및 전기 시 냅 스 전류를 비교 합니다. 시 냅 스 촉진 이나 우울증 비슷한 정도의 제어 미르, 따라서 제안 유사한 세포 메커니즘 stimulations의 두 종류에 의해 활성화 됩니다를 사용 하 여 전기 및 광학 자극 사이 관찰 해야.
참고: 위의 단계는 광 자극 연 접 boutons, 따라서 시 냅 시스 전송의 일부 메커니즘을 우회의 직접 도발은 유도 하지 않습니다 보장 하기 위해 필요 합니다.
- 시 냅 스 전송 제어 미르와 미르 대상으로 조사를 받고 연 접 단백질 사이의 단일 및 반복 stimulations (≤20 Hz에서 ≥2 자극)에 대 한 응답을 비교 합니다.
결과
위에서 설명한 절차 평가 방법 시 냅 스 전송 하는 강력한 방법을 연 접 신경에서 시 냅 스 단백질의 분해에 의해 영향을 제공 합니다. 대안의 최저 연 접 Cav2.1의 isoforms를 결합 하는 방법에 대 한 대표적인 결과 (P/Q 타입) VGCCs CA3 CA1 흥분 성의 시 냅 스는 예를 들어 아래에 주어진 하에서 단기 시 냅 스가 소성을 조절.
Cav2.1 (P/Q 유형) 채널은 중앙 신 경계에서 가장 빠른 시 냅 스에서 우세 연 접 VGCCs. 대체 상호 배타적인 exons의 접합 37a와 37b는 기 공 형성 α1 소 단위 Cav2.1 (α1A)의, 생산 하 고 2 개의 주요 이체 Cav2.1 [EFa] Cav2.1 [EFb]16,17 18. 확인 하려면 여부 Cav2.1 [EFa] 및 Cav2.1 [EFb] 차동 조절 시 냅 스 전송 및 쥐 hippocampal 피라미드 신경이 소성, 우리가 먼저 개발 isoform 특정 미르 최저를 선택적으로 Cav 2.1 [EFa] 또는 Cav2.1 [EFb]5. 짧은 크기에도 불구 하 고 (97 bp)와 높은 유사성 (뉴클레오티드 수준에서 61.86% 정체성) exons 사이 37a와 37b, 우리에 대 한 세 미르 시퀀스 디자인 수 Cav2.1 [EFa] 쥐 (미르 EFa1: TCCTTATAGTGAATGCGGCCG; 미르 EFa2: ATGTCCTTATAGTGAATGCGG; 미르 EFa3: TTGCAAGCAACCCTATGAGGA) 2 쥐 Cav2.1 [EFb]에 대 한 (미르 EFb1: ATACATGTCCGGGTAAGGCAT; 미르 EFb2: ATCTGATACATGTCCGGGTAA) 예측 높은 최저 효율. 부정적인 제어 (미르 제어), 우리는 어떤 알려진된 척 추가 있는 유전자를 대상 하지 않는 시퀀스를 포함 하는 pcDNA6.2-GW/EmGFP-미르-neg 플라스 미드를 사용 합니다. 우리 미르 EFa1 EFa3 미르, 미르 EFb2 선택 하 고 그들의 식 카세트에는 3' UTR rAAVs의 생산을 위해 설계 된 pAAV-Syn-ChETA-TdT-miR-X, 벡터의 복제 HEK 293 세포 분리 채널에 대 한 첫 번째 화면을 바탕으로, 어디에 synapsin 모터 드라이브 초고속 channelrhodopsin ChETA, 빨간색 형광 단백질 TdTomato 및 삽입 된 미르 (그림 1)의 표현. 우리는 또한 미르가이 미르의 때 려 눕 힘 효율성을 증가 하는 EFb2의 식 카세트를 중복.
다음으로, 우리 위의 4 구문에 대 한 rAAV1/2를 준비 하 고 계량 그들의 최저 효율 및 기본 쥐 신경 문화 isoform 특정 qRT-PCR를 사용 하 여 선택. EFa1 미르와 미르 EFa3 감소 기본 Cav2.1 [EFa] ~ 70%의 mRNA만 하지의 Cav2.1 [EFb] 미르 EFb 네이티브 캘리포니아v2.1 [EFb] ~ 60%의 mRNA만 하지 Cav2.1 [EFa] (그림 2)의 감소 하는 동안.
우리 다음 stereotactically 4 rAAV1/2의 각에 주입 (그림 3A-C), P18 쥐의 해 마의 CA3 영역 (A P/M-L/D-V Bregma에서) −2.6의 좌표 / ± 2.9 / −2.9. 15 ~ 20-4 일 후 주입, 우리 rAAV1/2 주입 쥐에서 급성 hippocampal 슬라이스를 준비 하 고 식 (그림 3B) rAAVs의 지역화를 확인 하려면 TdTomato 형광을 사용. CA1 시 냅 스에 CA3에서 단기 시 냅 스가 소성 연 접 최저 Cav2.1 [EFa] 또는 Cav2.1의 [EFb]에 영향을 받는지 조사, 우리 간단한 473 nm 레이저 광 펄스 (2 ms 동안에와 함께 선택적으로 감염된 CA3 신경 자극 ; 그림 3C) 패치 피라미드 뉴런 (그림 3C) CA1 영역의 중간 지 대에 인접 하 여 결과 EPSCs를 기록 했다. 우리는 Cav2.1 스플라이스 isoforms의 최저 영향 반대 방향으로 결합 펄스 자극에 응답을 발견: 최저 Cav2.1의 [EFa] 미르 EFa1 (미르 EFa3) 쌍 펄스 촉진 (PPF) 증가 반면 Ca의 최저 v2.1 [EFb] (미르 EFb2) 그것은 (그림 3D, E) 폐지.
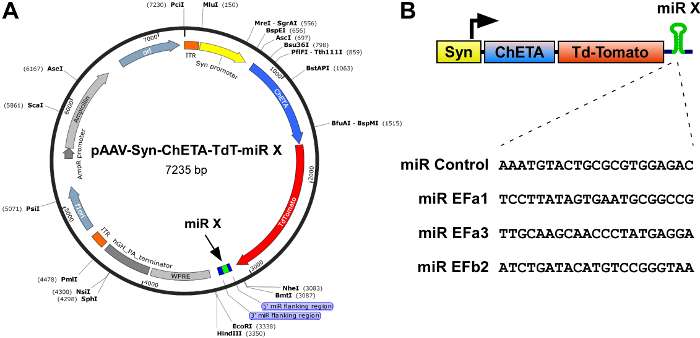
그림 1: 체계는 초고속 optogenetic 프로브 ChETA 및 Cav2.1 [EFa] 및 Cav2.1 [EFb]에 대 한 isoform 특정 미르의 결합 된 표현에 대 한 구문입니다. (A) 는 rAAV의 지도 구성 pAAV-Syn-ChETA-TdT-miR-X, synapsin 발기인 (Syn)을 포함, 초고속 channelrhodopsin ChETA 융합 TdTomato 하 고에 근 3' UTR, Cav2.1 스플라이스 isoform 특정 미르. 표시 된 제한 효소는 단일 커터. (B) 식 카세트의 상단, 체계. Synapsin 모터 드라이브 ChETA TdTomato와 isoform 특정 미르의 표정. 하단, 미르 카세트의 일부를 구성 하는 21-뉴클레오티드 대상 시퀀스의 반전 보수. 미르 EFb2에 대 한 두 개의 동일한 미르 카세트는 다른 후 하나에 표현 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
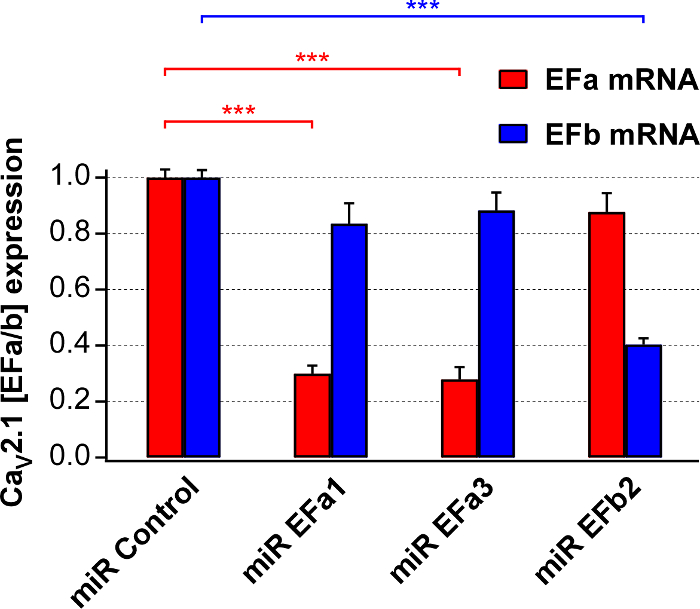
그림 2입니다. 최저 효율 및 Cav2.1 [EFa] 및 Cav2.1 [EFb] isoform 특정 미르의 선택의 평가. 17-18 DIV 기본 문화 중 Cav2.1 [EFa] (EFa1 미르와 미르 EFa3)을 대상으로 하는 미르를 표현 하는 rAAVs 6 DIV에 감염에서 분리 된 RNA에 Isoform 특정 qRT-PCR 분석 또는 Cav2.1 [EFb] (미르 EFb2). 데이터는 부정적인 제어 (미르 제어)로 정규화 됩니다. EFa1 미르와 미르 EFa3 크게 하 고 선택적으로 mRNA Cav2.1의 [EFa] 감소 (n = 8 및 7 문화, 각각), 미르 EFb 크게 하 고 선택적으로 감소 [EFb] 캘리포니아v2.1의 mRNA (n = 4 문화; * * * p < 0.001; 단방향의 분석 분산 테스트 테스트 후 Tukey Kramer에 의해 다음). 데이터는 ± SEM.를 의미 하는 대로 표시 됩니다. 이 그림에서 Thalhammer, A. 외 적응 되었습니다. 5. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3입니다. Optogenetics와 노크 다운 신경의 자극을 대상으로 평가의 역할 Cav2.1 [EFa] 및 Cav2.1 [EFb] 여 기본 마. (A) 체계의 vivo에서 감염에 사용 되는 rAAV 구문 식 카세트입니다. ((B)) Hippocampal 섹션 TdTomato 형광 CA3 영역 및 그것의 계획을 보여주는. (C) 실험 구성: 레이저 빔 CA3 somata에 지시 했다 및 패치 클램프 기록 CA1 피라미드 뉴런에서 수행 했다. (D) 2 ms 동안 블루 (473 nm) 레이저 광 펄스 20 Hz에서 났는 데 연상 EPSCs 누구의 PPF 미르 Cav2.1 [EFa]을 대상으로 하 여 증가 하며 Cav2.1에 대 한 미르 [EFb]에 의해 폐지. (E) 요약 (D)에서 실험에 대 한 대응 펄스 비율의 증가에서 보여주는 PPF 미르 EFa1 EFa3 미르와 미르 EFb2에 대 한 감소에 대 한 미르 컨트롤에 상대적인 (n = 9-11 녹음; * p = 0.02; * * p = 0.01; * * * p < 0.0004, 공분산 분석). 데이터는 ± SEM.를 의미 하는 대로 표시 됩니다. 이 그림에서 Thalhammer, A. 외 적응 되었습니다. 5. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
Optogenetic 프로브와 관심의 연 접 유전자에 대 한 미르의 공동 식 연 접 기능 그대로 신경 회로 내에 유전자 최저의 효과 하 강력한 방식을 제공 합니다. 이 실험적인 접근에 대 한 확인 하 고는 매우 효율적이 고 선택적 네이티브 시스템에 관심사의 유전자를 노크에 미르의 특성 중요 하다. 가능 하면 최종 대상에서 효과 대 한 관심의 동일한 mRNA에 대해 두 개 이상의 독립적인 미르 제어에 사용 되어야 한다. 구조 실험, 미르 저항 유전자는 시스템에 재는 특이성에 대 한 제어로 사용할 수 있습니다.
optogenetic 표현 하 동일한 구문을 사용 하 여 프로브와 한 미르 광학 조작 되어 연 접 신경만을 자극에 대 한 수 있습니다. 이건 전기 stimulations 가능 때문에 그들은 감염 되 고 감염 되지 않은 신경, 따라서 생산 하는 혼합과 희석 결과 구분 하지 않습니다. 광 stimulations 여러 활동 전위15일으킬 수 있다, 때문에 가장 빠른 optogenetic 프로브는 확장 팔레트15,19,,2021중에서 선택 하는 것 중요 하다. 또한, 광 자극 연 접 boutons의 직접 도발은 유도 하지 않습니다, 하나22를 조사 하고자 하는 시 냅 시스 전송의 단계 중 일부를 무시 하지 않으려면를 위해 필수적입니다.
우리가 여기, 설명 실험적인 접근 (4-6 개월) 제한 된 기간 내 동시에 관심의 여러 연 접 유전자의 생리 적인 관련성을 평가 하 가능 하 게. 그러나, 그것은 명심 knockdowns 거의 100% 도달 하는 것이 중요입니다. 또한, rAAVs 초기 발달 과정을 조사 하는 경우 시간 제약 조건을 나타내는 optogenetic 조사의 최대 최저의 전체 표현에 대 한 수 있도록 최소한 2 주 동안 표현 될 필요가 있다. 비록 더 많은 시간이 소요, 조건부 녹아웃 쥐 연 접 신경에 제한 일반적으로 결과 관심사의 유전자의 제거를 완료 하 고 따라서 유효한 상호 보완적인 접근 방식을 제공.
미르 기술의 특정 장점은 같은 발기인에서 여러 미르의 식을 것 이다. 주로이 속성 같은 미르 또는 동일한 대상 유전자에 대 한 다른 미르의 여러 복사본을 삽입 하 여 최저 효율을 높이기 위해 사용 되었습니다. 그러나 그것은 수 하는 데 사용 또한 최저 여러 유전자 표현에 대 한 다른 대상 유전자7,23미르. 이 속성은 여러 연 접 단백질 신호 통로 연 접 부에 침묵 하 사용할 수 있습니다.
여기, 우리는 급성 hippocampal 조각에 연 접 기능에 유전자 최저의 효과 특성 인공 미르와 optogenetics를 결합 했다. 비슷한 접근 방식은 조작 하 고 신경 회로 vivo에서조사 또한 사용 될 수 있습니다. 또한, chemogenetic 인공 미르 결합 접근 것 가능 하나가 더 긴 시간의 척도에 신경 회로
공개
저자는 공개 없다.
감사의 말
우리는 데모와 도움에 대 한 지원 및 카멜 Vitale F. Benfenati (Istituto 이탈리아 디 기술, IIT)을 감사 합니다. 이 작품은 IIT와 Compagnia 산 파올로 (부여 번호 9734 락)에 의해 투자 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Acrylamide | Sigma | Acrylamide/Bis-acrylamide, 30% solution | Toxic |
| Animal Temperature Controller with heat pad | WPI | ATC2000 | |
| BCA protein assay kit | ThermoFisher Scientific | 23225 | |
| BLOCK-iT Pol II miR RNAi Expression Vector kit | ThermoFisher Scientific | K4936-00 | |
| Brain slices Prechamber | Harvard Apparatus | BSC-PC | |
| CCD camera-based imager | Bio-Rad | ChemiDoc™ MP | |
| Cell Culture reagents | Life Technologies | ||
| Chemiluminescent substrate | GE Helthcare | ECL Western Blotting Reagents, RPN2106 | |
| Chloroform | Sigma | C2432 | Toxic |
| Cytosine β-D-arabinofuranoside | Sigma | C6645 | |
| Drill | Foredom | K.1030 | |
| EGTA | Sigma | E4378 | |
| Gentamicin ointment | Local pharmacy | ||
| Glucose | Sigma | G7021 | |
| Hepes | Sigma | 54459 | |
| Injection micropipettes | Narishige | GD1 | |
| Inorganic salts & detergents | Sigma | ||
| K2-creatine phosphate | Calbiochem | 237911 | |
| KGluconate | Fluka | 60245 | |
| Laser | Laserglow Technologies | LRS-0473-GFM-00100-03 | |
| Membrane | Amersham | Protran™ 0.2 µm NC | |
| MgATP | Sigma | A9187 | |
| Micropipette holder | Narishige | IM-H1 | |
| Micropipette puller | Narishige | PC-100 | |
| Na3GTP | Sigma | G8877 | |
| NaPyruvate | Sigma | P5280 | |
| Ocular lubricant | Local pharmacy | Lacrigel | |
| Phosphate inhibitors | Sigma | P0044, P5726 | |
| Protease inhibitors | Sigma | cOmplete™, EDTA-free Protease Inhibitor Cocktail | |
| Protein gel electrophoresis and blotting devices | Bio-Rad | Mini-Protean III Cell | |
| Providone iodine | Local pharmacy | Betadine | |
| Qiazol Lysis Reagent | Qiagen | 79306 | Toxic |
| QuantiTect Reverse Transcription Kit | Qiagen | 205311 | |
| RNeasy Micro Kit | Qiagen | 74004 | |
| Spectrophotometer | ThermoFisher Scientific | Nanodrop 2000 | |
| Stereotactic apparatus | WPI | ||
| Tetrodotoxin | Tocris | 1069 | Toxic |
| Vibratome | Leica | VT1200S |
참고문헌
- Lam, J. K., Chow, M. Y., Zhang, Y., Leung, S. W. siRNA Versus miRNA as Therapeutics for Gene Silencing. Mol Ther-Nucl Acids. 4, e252 (2015).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nat Neurosci. 14 (11), 1413-1415 (2011).
- Maejima, T., et al. Postnatal loss of P/Q-type channels confined to rhombic-lip-derived neurons alters synaptic transmission at the parallel fiber to purkinje cell synapse and replicates genomic Cacna1a mutation phenotype of ataxia and seizures in mice. J Neurosci. 33 (12), 5162-5174 (2013).
- Mark, M. D., et al. Delayed postnatal loss of P/Q-type calcium channels recapitulates the absence epilepsy, dyskinesia, and ataxia phenotypes of genomic Cacna1a mutations. J Neurosci. 31 (11), 4311-4326 (2011).
- Thalhammer, A., et al. Alternative Splicing of P/Q-Type Ca2+ Channels Shapes Presynaptic Plasticity. Cell Rep. 20 (2), 333-343 (2017).
- Sambrook, J., Russell, D. W. Calcium-phosphate-mediated Transfection of Eukaryotic Cells with Plasmid DNAs. CSH Protoc. 2006 (1), (2006).
- Chung, K. H., et al. Polycistronic RNA polymerase II expression vectors for RNA interference based on BIC/miR-155. Nucleic Acids Res. 34 (7), e53 (2006).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp. (57), e3348 (2011).
- Cingolani, L. A., et al. Activity-dependent regulation of synaptic AMPA receptor composition and abundance by beta3 integrins. Neuron. 58 (5), 749-762 (2008).
- Huang, H., Xu, Y., Cheng, C. Detection of alternative splicing during epithelial-mesenchymal transition. J Vis Exp. (92), e51845 (2014).
- Vandesompele, J., et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol. 3 (7), (2002).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1 (6), 3166-3173 (2006).
- Paxinos, G., Franklin, K. B. . The Mouse Brain in Stereotaxic Coordinates. , (2012).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2013).
- Gunaydin, L. A., et al. Ultrafast optogenetic control. Nat Neurosci. 13 (3), 387-392 (2010).
- Bourinet, E., et al. Splicing of alpha 1A subunit gene generates phenotypic variants of P- and Q-type calcium channels. Nat Neurosci. 2 (5), 407-415 (1999).
- Chaudhuri, D., et al. Alternative splicing as a molecular switch for Ca2+/calmodulin-dependent facilitation of P/Q-type Ca2+ channels. J Neurosci. 24 (28), 6334-6342 (2004).
- Soong, T. W., et al. Systematic identification of splice variants in human P/Q-type channel alpha1(2.1) subunits: implications for current density and Ca2+-dependent inactivation. J Neurosci. 22 (23), 10142-10152 (2002).
- Berndt, A., et al. High-efficiency channelrhodopsins for fast neuronal stimulation at low light levels. P Natl Acad Sci USA. 108 (18), 7595-7600 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96 (5), 1803-1814 (2009).
- Zhang, Y. P., Oertner, T. G. Optical induction of synaptic plasticity using a light-sensitive channel. Nat Methods. 4 (2), 139-141 (2007).
- Fowler, D. K., Williams, C., Gerritsen, A. T., Washbourne, P. Improved knockdown from artificial microRNAs in an enhanced miR-155 backbone: a designer's guide to potent multi-target RNAi. Nucleic Acids Res. 44 (5), e48 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유