Method Article
Alliant Optogenetics artificiel microARN pour caractériser les effets du gène Knockdown fonction présynaptique dans les Circuits de neurones intacts
Dans cet article
Résumé
Ce protocole prévoit un flux de travail sur la façon de combiner artificielle induite sur les micro-ARN interférence d’ARN avec optogenetics pour stimuler spécifiquement présynaptiques boutons avec une expression réduite de sélectives ou des gènes au sein des circuits de neurones intacts.
Résumé
Ce protocole vise à caractériser l’effet du gène fonction présynaptique dans les circuits de neurones intacts. Nous décrivons un flux de travail sur la façon de combiner des micro-ARN artificiel (miR)-mediated RNA interference avec optogenetics pour atteindre la stimulation sélective de manipuler boutons présynaptiques en tranches cérébrale aiguë. L’approche expérimentale implique l’utilisation d’une simple construction virale et un promoteur de neurone-spécifique unique pour piloter l’expression d’une sonde optogenetic et miR(s) artificiel contre un ou des gènes présynaptiques. Lorsqu’elle est injectée à le stereotactically dans la région du cerveau d’intérêt, la construction explicite rend possible de stimuler avec lumière exclusivement les neurones avec une expression réduite du ou les gènes incriminés. Cette stratégie ne requiert pas le développement et le maintien des lignées de souris génétiquement modifiées et peut en principe être appliquée à d’autres organismes et à n’importe quel gène neuronale de choix. Nous avons récemment appliqué afin d’étudier comment la précipitation d’isoformes d’épissage alternatif de présynaptiques canaux de calcium voltage-dépendant de type P/Q (VGCCs) régule la plasticité synaptique à court terme à CA3 de synapses excitatrices CA1 dans des tranches d’hippocampe aiguës. Une approche similaire pourrait également servir à manipuler et étudier le circuit neuronal in vivo.
Introduction
Ce protocole décrit une nouvelle approche pour caractériser l’effet du gène fonction présynaptique dans les circuits de neurones intacts. Une expérience sur une fonction présynaptique dans les circuits de neurones intacts est difficile car de nombreux boutons présynaptiques sont trop petites et loin de la soma pour permettre des interventions moléculaires et électrophysiologiques combinées. Même si l’interférence d’ARN offre un moyen puissant et flexible de précipitation de protéines synaptiques1, cette approche a été utilisée avec parcimonie pour étudier la fonction présynaptique parce qu’il est difficile de déceler les effets d’assommement traditionnelles les stimulations électriques, qui ne distinguent pas manipulé et naïve boutons présynaptique2. Ici, nous décrivons comment combiner des micro-ARN artificiel (miR)-mediated RNA interference avec technologie optogenetic récemment mis au point pour atteindre la stimulation sélective de manipuler boutons présynaptiques en tranches cérébrale aiguë.
Souris knock-out conditionnel en combinaison avec l’électrophysiologie pourraient également être utilisés pour étudier la fonction des protéines présynaptiques3,4, notre stratégie ne nécessite pas le développement et la maintenance de génétiquement modification des lignées de souris et peut également être facilement utilisée pour abattre les isoformes spécifiques d’un gène. Relative aux plus communément utilisé en épingle à cheveux court RNAs (interférents), miRs artificiels, qui nous occupent ici, offrent des avantages clés de précipitation dans les neurones. À la différence des interférents, elles peuvent être exprimées sous le contrôle d’une polymérase II promoteur1. Ainsi, un promoteur unique peut être utilisé pour piloter l’expression de miR et une sonde d’optogenetic, ainsi qu’un journaliste fluorescent. De cette façon, la taille de la construction peut être maintenue dans les limites de l’emballage des virus recombinants adéno-associés (rAAV, Figure 1 a). Aussi, l’utilisation d’une construction unique et un promoteur unique réduit la variabilité expérimentale parce qu’il permet une expression de la station miR, la sonde optogenetic et le journaliste fluorescent dans un rapport fixe.
Nous avons récemment appliqué cette technologie pour examiner le rôle des isoformes épissés alternativement des canaux calciques présynaptique dans l' hippocampe5. Une telle stratégie est généralement applicable à l’étude de la pertinence physiologique d’autres protéines exprimées de manière présynaptique dans n’importe quel circuit de cerveau d’intérêt.
Protocole
Toutes les expériences ont été effectuées conformément aux lignes directrices établies par le Conseil des Communautés européennes (Directive 2010/63/UE du 4 mars 2014) et ont été approuvés par le ministère italien de la santé.
1. conception de micro-ARN interférence à l’ARN et l’évaluation de leur efficacité dans les systèmes d’Expression hétérologue
Remarque : Ce protocole requiert la connaissance des méthodes bien établies suivants : clonage moléculaire, séquençage de l’ADN, entretien de lignées cellulaires, transfection de phosphate de calcium, quantitative real time PCR (qRT-PCR), préparation des lysats de cellules de lignées cellulaires et transfert Western.
- Déterminer si le gène d’intérêt est sous réserve de l’épissage alternatif. Pour un knockdown général du gène, sélectionnez exclusivement les exons constitutives ; pour une précipitation d’une isoforme épissée alternativement spécifique, sélectionnez l’exons épissés alternativement pertinentes.
- Utiliser un logiciel dédié (par exemple https://rnaidesigner.thermofisher.com/rnaiexpress/) pour concevoir des miRs artificiels pour l’interférence d’ARN contre la séquence d’intérêt.
Remarque : Il est important d’utiliser un outil de base de recherche des alignement Local (BLAST) pour vérifier les hors-cibles possibles au sein de la même espèce. - Sélectionnez les miRs classés trois albums pour le gène cible.
- Commander les brins dessus et le dessous des miRs sélectionnés auprès d’une société convenable. Contrôle négatif, utilisez une version brouillée d’un les miRs sélectionnés ou une miR prédit ne pas de cibler n’importe quel gène connu des espèces utilisées pour l’expérience (par exemple. pour les gènes de vertébrés, le miR présent dans pcDNA6.2-GW/EmGFP-miR-neg).
- Recuire les brins respectifs de haut et en bas des miRs sélectionnés et les clone dans un plasmide conçu pour l’expression des miRs (p. ex. pcDNA6.2-GW/EmGFP-miR) à l’aide de stratégies de clonage standards.
Remarque : Le but est de créer une cassette d’expression miR consistant en une région flanquante 5' miR, la séquence sélectionnée miR et une région 3' miR accompagnement qui peut être exprimée de la région 3' UTR d’un gène rapporteur sous le contrôle d’un promoteur II de type ARN polymérase. - Séquençage de l’ADN permet de valider l’insertion correcte des miRs sélectionnés.
- La croissance de cellules HEK293 dans un incubateur de culture cellulaire humidifié (37 ° C, 5 % de CO2) à l’aide de DMEM milieu additionné de 10 % sérum de veau fœtal, 1 mM NaPyruvate, 10 mM HEPES (pH 7.39) et 1 x pénicilline/streptomycine (Pen/Strep).
- Lorsque les cellules HEK293 sont environ 70 % anastomosé, co transfecter eux avec chacun des vecteurs d’expression de la miR et un vecteur exprimant le gène ciblé dans la proportion 1:1 ADN à l’aide de la méthode de phosphate de calcium6. Incluez les contrôles suivants : (i) celllulaire cellules, (ii) des cellules transfectées avec le vecteur exprimant le gène ciblé ainsi que chaque transporteur ADN (par exemple pBluescript SK(+)) II ou III miR contrôle.
Remarque : (i) le gène ciblé exprimé doit être de la même espèce vers laquelle les miRs ont été conçus, à moins que les séquences ciblées par les miRs sont absolument conservées au niveau des nucléotides entre les deux espèces. (ii) des lignées de cellules autres que HEK293 peuvent être utilisées. (iii) les autres méthodes de transfection, tels que l’électroporation ou méthodes axées sur les liposomes, peuvent être utilisées. -
48 h après la transfection, lyser les cellules, exécutez le gel de protéine, effectuer la tache occidentale et analyser la teneur en protéines avec un anticorps reconnaissant la protéine cible. Viser une efficacité défiant de ≥50 %.
Remarque : Le rendement défiant peut alternativement, ou en outre, être évalués (i) par analyse d’ELISA, (ii) en mesurant l’activité de la protéine cible, le cas échéant (p. ex. les densités de courant pour les canaux ioniques) ou (iii) par qRT-PCR au niveau du mRNA si approprié les anticorps ne sont pas disponibles (étape 3 du protocole).- Placez les récipients de culture sur la glace et laver les cellules avec glacee solution saline tamponnée au phosphate (PBS).
- Aspirer le PBS, puis ajoutez glacee tampon RIPA (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 2 mM EDTA, 1 % NP40, 0,1 % dodécylsulfate de sodium (SDS), contenant des inhibiteurs de la protéase et de la phosphatase ; 1 mL pour un plat de Ø 100 mm, 0,5 mL pour un plat de Ø 60 mm).
- Grattez le plat à l’aide d’un grattoir de cellules des cellules adhérentes et transférer doucement la suspension de cellules dans un tube de microcentrifuge refroidis.
- Centrifuger le tube à 15 000 x g pendant 15 min à 4 ° C, transférer le surnageant dans un nouveau tube de microcentrifuge refroidis et jeter le culot.
- Déterminer la concentration de la protéine à l’aide de la trousse de dosage protéique BCA ou autre méthode appropriée (p. ex. analyse de Bradford).
Remarque : Les échantillons peuvent être congelés à-20 ° C ou à-80 ° C pour une utilisation ultérieure ou traitées immédiatement. - Transférer un volume approprié de lysats aux tubes de microcentrifuge afin que tous les échantillons ont la même concentration de protéine et ajouter le tampon de lyse glacee adéquat pour compenser tous les lysats au même volume.
Remarque : 30 à 50 µg de protéines totales devraient suffire pour la plupart des protéines, mais la quantité appropriée à charger doit être déterminée selon l’abondance de la protéine d’intérêt. - Ajouter une quantité appropriée de 2 x Laemmli tampon (SDS de 4 %, 10 % de 2-mercaptoéthanol, 20 % de glycérol, 0,004 % bleu de bromophénol 0,125 M Tris-HCl, pH 6,8) et faire bouillir les échantillons à 95 ° C pendant 5 min.
- Charger les échantillons sur le gel d’acrylamide avec un marqueur de poids moléculaire. Exécutez le gel à 100 V pendant 1-2 h.
NOTE : Le pourcentage de gel dépend de la taille de la protéine d’intérêt. - Monter le sandwich de transfert et les protéines de transfert du gel sur une membrane à 100 V pendant 2 h. La membrane peut être soit de nitrocellulose ou de PVDF. Activer le PVDF avec du méthanol pendant 1 min et rincer avec tampon de transfert avant de préparer la pile.
- Bloquer la membrane pendant 1 h à température ambiante à l’aide d’un tampon de blocage (5 % de lait dans le PBST (PBS + 0,1 % Tween-20)), puis incuber la membrane pendant la nuit à 4 ° C avec l’anticorps primaire dilué dans un tampon bloquant.
- Laver la membrane pendant 10 min dans le PBST trois fois et il incubation avec l’anticorps secondaire conjugué HRP dans un tampon bloquant pendant 1 h à température ambiante.
- Laver la membrane pendant 10 min dans du PBS quatre fois, puis appliquez le substrat chimioluminescent à la membrane et capter les signaux chimioluminescents à l’aide d’un capteur CCD caméra-basée.
- Logiciel d’analyse image permet de quantifier l’efficacité défiant.
- Sélectionnez les deux miRs plus efficaces ciblant le non-cumul des séquences pour plus amples essais fonctionnels.
NOTE : Effets hors-cibles peuvent jamais être entièrement écartées pour n’importe quel miR. Toutefois, si deux miRs indépendants ont un effet similaire, il est extrêmement improbable que cela tient un knockdown hors cible même. - Si l’efficacité défiant des miRs sélectionnés n’est pas satisfaisante (< 50 %), écran pour autres miRs. Alternativement, exprimer la miR(s) plus efficace en tandem, c'est-à-dire exprimer en plusieurs copies de la même cassette d’expression, qui peut aboutir à une meilleure efficacité défiant7.
2. construction des vecteurs Recombinant adéno-associés pour combiné Expression de Optogenetic sondes et microARN
Remarque : Ce protocole requiert la connaissance des méthodes bien établies suivants : production du rAAV, séquençage de l’ADN et clonage moléculaire.
- Clone de chaque des cassettes d’expression miR plus efficaces dans la région 3' UTR de constructions conçues pour production de recombinants rAAVs et expression des excitateur optogenetic sondes, comme dans pAAV-Syn-ChETA-TdT-miR-X (Figure 1 a), où le promoteur synapsin neurone-spécifique des lecteurs expression de la channelrhodopsin ultrarapide ChETA, le reporter fluorescent rouge TdTomato et miR(s) inséré entre les sites de NheI et EcoRI5.
NOTE : (i) ne pas dépasser la limite d’emballage de rAAVs, qui est environ 4,7 Ko en longueur de RIR (répétition terminale inversée) à ITR (Figure 1 a, orange). (ii) la cassette d’expression de miR doit être inséré entre le codon stop et WPRE (Woodchuck Hepatitis Virus post-transcriptionnel Regulatory Element ; Figure 1 a). (iii) l’inclusion d’une protéine fluorescente, tels que TdTomato, est extrêmement utile car elle permet de contrôler facilement la localisation et l’intensité de l’infection (étape 4 du protocole). - Séquençage de l’ADN permet de valider l’insertion correcte des cassettes miR.
- Produire et titre rAAV1/2 selon le protocole publiées antérieurement8, un rAAV1/2 pour chaque miR sélectionné. Une expérience typique pour la précipitation d’un gène comprendrait deux miRs indépendantes contre le même gène et le contrôle d’un miR. Viser un titre de virus de ≥ 109 génomes viraux (vg) / µL.
ATTENTION : rAAVs doivent être manipulés dans un centre de biosécurité de niveau 1 (BSL-1). Adressez-vous à la Commission institutionnelle de la sécurité biologique pour des informations détaillées.
Remarque : Si le laboratoire ne dispose pas d’une installation virale ou si les titres viraux ne sont pas satisfaisants, rAAV production peut être externalisée. Par exemple, visitez https://www.med.upenn.edu/gtp/vectorcore/ ou https://vcf.charite.de/en/metas/.
3. extraction de l’ARN à partir des Cultures primaires de neurones pour évaluation de miR efficacité Knockdown de gènes endogènes par qRT-PCR
NOTE : (i) ce protocole requiert la connaissance des méthodes bien établies suivants : préparation et entretien des cultures primaires de neurones et qRT-PCR. (ii) répéter la quantification de l’efficacité défiant (étapes 3.1 – 3.14) au moins 3 fois (réplique biologique). (iii) estimation de l’efficacité défiant au niveau de l’ARNm par qRT-PCR est adaptée lorsque l’analyse de la teneur en protéines est exclue, par exemple quand faire tomber alternativement épissé isoformes pour lequel des anticorps spécifiques ne sont pas disponibles5.
-
Préparer des cultures primaires de neurones de la région du cerveau d’intérêt. Suivre le protocole cultures corticales donné dans la précédente publication9, avec les modifications suivantes :
- Neurones de plaque dans 6 plats à une densité de 500 000 neurones par puits. Utilisez 2,5 mL/puits du milieu de la pièce jointe et 3,3 mL/bien du milieu de l’entretien.
- Si on observe la prolifération astrocytaire, ajouter 0,5 mL/puits d’additionné de maintenance avec 7,5 µM de cytosine β-D-arabinofuranoside (pour une concentration finale de 1 µM) à 3 – 4 jours in vitro (DIV).
-
Infecter les trois puits par miR (technique réplique) à 5–DIV. 6 l’utilisation la plus faible dose infectieuse qui infectera ≥99 % des neurones.
- Retirer les 2 mL de milieu de chaque puits et ramasser dans un tube falcon de 50 mL.
- Ajouter le virus directement aux neurones, mélanger délicatement et remettre les plaques dans l’incubateur à 37 ° C.
- Stocker le milieu recueilli dans l’incubateur. Perdre le capuchon du tube falcon pour permettre l’équilibration du gaz.
- Après 24 h, ajouter le medium dos supprimé dans chaque puits (1,9 mL/puits).
-
À 17–18 DIV, lyser les neurones pour extraction de l’ARN.
ATTENTION : Réactif de lyse et le chloroforme sont très toxiques. Travailler sous une hotte chimique et portez les bons équipements ; éliminer les déchets selon vos directives nationales et institutionnelles.
Remarque : Pour obtenir la procédure 3.3 – 3.13, travailler dans des conditions sans RNAse. Porter des gants et utiliser la verrerie exempte de RNAse et contenants de plastique jetables. Pour les précautions générales sur la façon de poignée RNA, consulter par exemple annexe A du Guide du Micro RNeasy disponible en ligne.- Incuber le verre que pipettes Pasteur pendant la nuit dans un four à 180 ° C.
- Les plaques d’inclinaison et aspirer le milieu complètement de chaque bien en utilisant un verre pipette Pasteur relié à une pompe à vide.
- Immédiatement ajouter 700 µL de réactif de lyse dans chaque puits.
- Étendre uniformément la solution de la bascule et en secouant la plaque soigneusement et brièvement à la main.
- Déposer la solution haut et en bas 4 à 5 fois ou jusqu'à l’obtention d’une suspension homogène.
- Transvaser la solution dans chaque puits dans un séparé 1,5 mL tube Eppendorf.
Remarque : Les lysats cellulaires peuvent être conservés à-80 ° C ou traitées immédiatement.
- Si nécessaire, dégivrer cellule les lysats RT et passez immédiatement à l’étape 3.5.
- Ajouter 140 µL de chloroforme dans chaque échantillon de lysats cellulaires.
Remarque : Le chloroforme est volatil et difficile à pipeter, fermer les tubes Eppendorf dès que possible. - Secouer les tubes Eppendorf vigoureusement pendant 15 s ou jusqu'à ce que les échantillons sont entièrement émulsionnées.
- Conserver l’échantillon à la droite pendant 1 à 2 min ou jusqu'à ce que les phases liquides commencent à se séparer.
- Centrifuger les échantillons à 12 000 g pendant 15 min à 4 ° C.
- Transférer la phase aqueuse supérieure (~ 320 µL) contenant des ARN dans un nouveau tube Eppendorf et jeter le liquide restant.
Remarque : Ne pas toucher la phase organique rose inférieure ou l’anneau blanc entre les deux phases avec l’embout de la pipette. - Ajouter 1,5 volumes d’éthanol à 100 % (480 µL) à la phase aqueuse, et déposer la solution lentement monter et descendre 3 fois pour mélanger.
- Purifier les ARN utilisant un kit disponible dans le commerce, conçu pour la purification d’ARN à partir de petits échantillons.
- Quantifier la pureté concentration et échantillon de RNA avec un spectrophotomètre.
NOTE : (i) s’attendre à des rendements de ≥3.5 µg/puits ; les 260/280 et 260/230 rapports sur pureté sur les protéines et les composés organiques devrait tous deux être ≥1.9. (ii) les échantillons d’ARN peuvent être conservés à-80 ° C ou traitées immédiatement. - Retrotranscribe 250, 500 ou 1000 ng d’ARN avec un kit disponible dans le commerce.
- Quantifier l’efficacité défiant pour le gène endogène d’intérêt par qRT-PCR. Un protocole détaillé, voir référence10. Viser une efficacité défiant ≥60 % (Figure 2). Normaliser les données aux gènes de ménage ≥2 (par exemple. GAPDH, TUBB3, ACTB, ÉPFVP) à l’aide de la méthode multiples du gène contrôle interne11.
Remarque : Si vous travaillez dans la rat, utiliser les amorces PCR suivants pour les gènes de ménage : GAPDH-fwd : 5' GGTGCTGAGTATGTCGTGGA 3' et GAPDH-rev : 5' GATGATGACCCTTTTGGC 3' ; ACTB-fwd : 5' CATCACTATCGGCAATGAGC 3' et ACTB-rev : 5' TCATGGATGCCACAGGATT 3' ; TUBB3-fwd : 5' GCCTTTGGACACCTATTCAG 3' et TUBB3-rev : 5' TCACATTCTTTCCTCACGAC 3' ; ÉPFVP-fwd : 5' CACTGGGGAGAAAGGATTTG 3' et ÉPFVP-rev 5' CCATTATGGCGTGTGAAGTC 3'.
4. évaluation du rôle des protéines présynaptiques dans des Circuits de neurones intacts par une Stimulation ciblée des neurones Knocked-down avec Optogenetics
Remarque : Le protocole suivant nécessite une expérience antérieure avec les enregistrements électrophysiologiques en tranches cérébrale aiguë et l’accès à une installation électrophysiologique.
- Stereotactically injecter rAAV1/2 dans le cerveau après un protocole détaillé dans la précédente publication12. Déterminer les coordonnées stéréotaxiques pour la région du cerveau d’intérêt à l’aide d’Atlas stéréotaxiques pour souris13 ou rat cerveau14.
- Utiliser un micropipettes pour tirer micropipettes injection longue queue cylindrique de Ø 7 – 9 µm ; clip les micropipettes injection sur les manches avec des ciseaux. Utilisez un marqueur mince et du papier millimétré pour placer les marques de calibrage sur les micropipettes injection tous les 2 mm.
- Anesthésier l’animal à l’isoflurane et fixez-le à l’appareil stéréotaxique.
- Garder l’animal au chaud tout au long de l’opération avec un coussin chauffant à 37 ° C.
- Protéger les yeux avec lubrifiant oculaire.
- Se raser les poils sur la tête avec un rasoir électrique.
- Répandre la polyvidone iodée sur le crâne rasé à l’aide d’un coton-tige.
- Sous un microscope à dissection, faire une incision médiane.
- Nettoyer la surface du crâne avec un coton tige, donc à rendre visibles les bregma et lambda.
- Placez la micropipette d’injection dans sa porte. Visser le support sur le bras stéréotaxique.
- Déterminer x et y coordonnées du point d’injection par rapport à la bregma et/ou la lambda.
- Utilisez une perceuse pour fluidifier le crâne au-dessus de la zone cible.
Remarque : Utilisez des mouvements circulaires douces et évitez de percer à travers le crâne car cela endommagera la surface du cerveau. - Si le saignement se produit, absorber le sang excessif avec du papier essuie-tout.
NOTE : Excessive de sang il sera difficile de déterminer correctement la coordonnée z. - Charge ≤ 2 µL du virus dans une micropipette d’injection par capillarité.
- Porter la micropipette d’injection à x et y coordonnées du point d’injection.
- Calculer la coordonnée z de la dure-mère et abaissez la pipette lentement dans le cerveau.
- Lorsque la coordonnée z est atteinte, attendre 3 minutes pour permettre l’ajustement des tissus.
- S’applique à basse pression positive à l’aide d’une seringue de 1 mL reliée par un tube souple à l’arrière de la micropipette d’injection. Contrôler visuellement la vitesse d’éjection du virus de la micropipette d’injection à travers le microscope à dissection et l’utilisation des marques de calibrage comme points de référence.
NOTE : Virus doit être injecté à vitesse lente (< 100 nL/min) pour éviter d’endommager les tissus. - Lorsque l’injection est terminée, attendre 5 min, retirer la micropipette d’injection de 0,2 mm, attendez pendant 5 min, pour éviter le retour du virus.
- Retirer la micropipette d’injection lentement et complètement le cerveau et la jeter dans un récipient rempli d’eau de Javel.
- Mouiller le crâne avec une solution physiologique et la peau avec 3-4 points de suture.
- Gentamicine pommade sur la plaie.
- Single-maison l’animal dans une cage propre avec des aliments granulés et sous une lampe de chaleur jusqu'à ce qu’il entièrement récupère.
- ≥ 15 jours après l’injection, décapiter les animaux sous anesthésie isoflurane profonde.
- Préparer des tranches de cerveau aiguë de la région du cerveau d’intérêt avec un Vibratome utilisant gazés (95 % O2, 5 % de CO2) solution FSCA glacee, contenant (en mM) : 123 NaCl, 1,25 KCl, 1,25 KH2PO4, 1,5 MgCl2, 1 CaCl2, 25 NaHCO3, NaPyruvate 2 et 18 glucose (osmolarité réglée à 300 mOsm). Par exemple, si le but est d’analyser la transmission synaptique de CA3 de neurones pyramidaux CA1, préparer des tranches sagittales de la formation hippocampique (350 µm d’épaisseur).
Remarque : Cette étape à partir travailler dans des conditions de faible luminosité pour éviter l’activation de la sonde optogenetic par lumière environnementale. - Laisse les tranches de récupérer pendant 30 min à 37 ° C dans le FSCA même dans une chambre conçue pour la tenue des tranches de cerveau. Gardez les tranches dans la même chambre de tranches de cerveau à la température ambiante jusqu'à l’enregistrement.
Remarque : L’utilisation de ces conditions, tranches peuvent être maintenus en bonne santé pendant 6 – 8 h. - Transfert un trancher pour une chambre d’enregistrement submergées et superfuse avec 2 mL/min de l’aCSF même utilisé pour la récupération additionnée de 1,5 mM CaCl2 (total Ca2 +: 2,5 mM) et sans NaPyruvate.
NOTE : Les tranches sont préparés et maintenus en faible concentration de Ca2 + (1 mM) pour réduire la toxicité. Les enregistrements sont effectués en 2,5 mM Ca2 + en faveur de la libération des vésicules. - Vérifier brièvement le signal du reporter fluorescent exprimé (par exemple. TdTomato ; Figure 3 b) pour déterminer la localisation et l’intensité de l’infection.
- Remplir une électrode patch contenant une solution intracellulaire (en mM) : 110 K-gluconate, 22 5 NaCl, KCl, 3 MgCl2, 4 Mg-ATP, Na 0,5, EGTA 0,53-GTP, 20 K2-créatine phosphate, 10 HEPES-KOH (pH 7,28, 290 mΩ).
Remarque : Utilisez les électrodes patch avec une résistance de pipette de 5 – 6 mΩ. - Sous illumination infrarouge, atteindre la configuration cellule entière-fermeture hermétique d’un neurone reçoit des entrées synaptiques de neurones infectés. Par exemple, si les neurones pyramidaux CA3 étaient infectés, patch des neurones pyramidaux dans proximale au tractus médiale de la région CA1 (Figure 3).
Remarque : La résistance série peut être laissée sans compensation, mais elle doit être constante et faible (≤ 20 MΩ). - Pharmacologie permet d’isoler les courants synaptiques incriminés. Par exemple, si l’objectif est d’étudier la transmission synaptique excitatrice, bloque la transmission synaptique inhibitrice avec 10 µM bicuculline.
- Évoquent des courants synaptiques, par exemple, courants postsynaptiques excitateurs (EPSCs), utilisant un laser bleu nm 473 couplé à une fibre optique (Ø ≤250 µm) positionnée sur les corps cellulaires des neurones infectés (par exemple. Neurones pyramidaux Ca3).
- Ajuster la longueur de la stimulation à tout le moins, de réduire la possibilité d’évoquer plus d’un potentiel d’action par impulsion lumineuse. Si vous utilisez ChETA, réglez-le à 2 ms15.
- Ajuster l’intensité de stimulation du laser pour produire des courants synaptiques petits mais clairement décelables (≤50 amplitude de crête de pA pour EPSCs enregistré à un potentiel d’exploitation de -70 mV entre CA3 et CA1 neurones pyramidaux ; Figure 3D). Si vous utilisez ChETA une fibre optique de 250 µm de diamètre, stimulation forces de 1 à 3 mW à fibre de sortie devrait être adaptée.
Remarque : si laser force ne peut être réglementée, utilisez les filtres de densité neutre. - Briller la lumière de laser 473 nm sur les corps cellulaires des neurones infectés, mais pas sur leurs axones. Par exemple, briller la lumière sur les corps cellulaires CA3 et éloigner les collatérales de Schaffer, afin d’éviter une dépolarisation directe des axones.
- Appliquer la tétrodotoxine (TTX ; 0,5 µM), un bloqueur des canaux de sodium, à l’échantillon pour confirmer les canaux sont axés sur le potentiel d’action.
- Dans les différents enregistrements, appliquer un bloqueur sélectif au courant synaptique sous enquête pour confirmer que la stimulation est sélective.
NOTE : par exemple, appliquer NBQX (10 µM) au glutamate de type AMPA médiée par les récepteurs EPSCs. - Comparer des courants synaptiques optiquement et électriquement évoqués dans la même tranche cérébrale aiguë en réponse à une stimulation répétée (≥2 stimuli à ≤ 20 Hz). Un degré similaire de facilitation synaptique ou la dépression doit être observé entre la stimulation électrique et optique lorsque vous utilisez une miR de contrôle, ce qui suggère que les mécanismes cellulaires similaires sont activés par les deux types de stimulations.
Remarque : Les étapes ci-dessus sont nécessaires pour faire en sorte que la stimulation optique n’induit pas une dépolarisation directe de boutons présynaptiques, contournant ainsi certains mécanismes de la transmission synaptique.
- Comparer la transmission synaptique en réponse à des stimulations simples et répétitives (≥2 stimuli à ≤ 20 Hz) entre une miR de contrôle et miRs ciblant les protéines présynaptiques incriminés.
Résultats
Les procédures décrites ci-dessus fournissent une méthode robuste pour évaluer la transmission synaptique comment est affectée par la précipitation des protéines synaptiques des neurones présynaptiques. Les résultats représentatifs sur comment la précipitation d’alternative splice isoformes de présynaptique Cav2.1 VGCCs (type P/Q) réglemente la plasticité synaptique à court terme à CA3 de CA1 synapses excitatrices sont donnés ci-dessous à titre d’exemple.
Cav2.1 (type P/Q) canaux sont les VGCCs présynaptiques prédominants au niveau des synapses plus rapides dans le système nerveux central. Alternative d’épissage des exons mutuellement 37 bis et 37 b de la sous-unité de1 α formant des pores de Cav2.1 (α1 a) produit deux variantes principales, Cav2.1 [ALE] et Cav2.1 [EFb]16,17 ,18. Pour déterminer si Cav2.1 [ALE] Cav2.1 [EFb] différentiellement règlent la transmission synaptique et plasticité dans les neurones pyramidaux hippocampe de rat, nous avons développé tout d’abord miRs isoforme spécifique à la précipitation sélective Cav 2.1 [ALE] ou Cav2.1 [EFb]5. Malgré la taille courte (97 bp) et forte similarité (61.86 % d’identité au niveau du nucléotide) entre les exons 37 bis et 37 ter, nous pourrions concevoir trois séquences de miR contre rat Cav2.1 [ALE] (miR EFa1 : TCCTTATAGTGAATGCGGCCG ; miR Cfc2 : ATGTCCTTATAGTGAATGCGG ; miR EFa3 : TTGCAAGCAACCCTATGAGGA) et deux contre rat Cav2.1 [EFb] (miR EFb1 : ATACATGTCCGGGTAAGGCAT ; miR EFb2 : ATCTGATACATGTCCGGGTAA) avec le rendement élevé knockdown prédit. Comme contrôle négatif (miR contrôle), nous avons utilisé le plasmide pcDNA6.2-GW/EmGFP-miR-neg contenant une séquence qui ne cible pas n’importe quel gène vertébré connu. Après un premier écran dans les cellules HEK 293 contre canaux hétérologue, nous sélectionné miR EFa1, miR EFa3 et miR EFb2 et clonés leurs cassettes d’expression dans la région 3' UTR du vecteur pAAV-Syn-ChETA-TdT-miR-X, qui est conçu pour la production de rAAVs et où la promoteur synapsin lecteurs expression de la channelrhodopsin ultrarapide ChETA, la protéine fluorescente rouge TdTomato et miR inséré (Figure 1). Nous avons également reproduit la cassette d’expression du miR EFb2 pour accroître l’efficacité défiant de ce miR.
Ensuite, nous avons préparé rAAV1/2 pour les constructions de quatre ci-dessus et quantifié leurs efficacité défiant et la sélectivité dans les cultures de neurones de rat primaire à l’aide de l’isoforme spécifique qRT-PCR. miR EFa1 et miR EFa3 réduit ARNm de native Cav2.1 [ALE] d’environ 70 %, mais pas celui de Cav2.1 [EFb], tandis que miR EFb réduits ARNm de native Cav2.1 [EFb] de ~ 60 % mais non celle du Cav2.1 [ALE] (Figure 2).
Nous avons ensuite stereotactically injectée chacune des quatre rAAV1/2 dans la région CA3 de l’hippocampe de rats P18 (Figure 3 a-C), avec point de coordonnées (A-P/M-L/D-V de Bregma) 2.6 / ± 2,9 / −2.9. Quinze à vingt-quatre jours après injection, nous avons préparé des tranches d’hippocampe aiguës des rats rAAV1/2-injecté et TdTomato fluorescence permettant de confirmer l’expression et la localisation de rAAVs (Figure 3 b). Afin d’étudier si knockdown présynaptique de Cav2.1 [ALE] ou Cav2.1 [EFb] affecté à court terme plasticité synaptique à CA3 aux synapses CA1, nous avons stimulé les neurones CA3 sélectivement infectés avec bref 473 nm impulsions de lumière laser (2 ms de long ; La figure 3) et enregistré les EPSCs qui en résulte par rapiéçage des neurones pyramidaux dans proximale au tractus médiale de la région CA1 (Figure 3). Nous avons trouvé que la précipitation d’isoformes d’épissure Cav2.1 affecté des réponses à la stimulation d’impulsions pairées dans des directions opposées : précipitation de Cav2.1 [ALE] (miR EFa1 ou miR EFa3) boosté impulsions pairées facilitation (du Pakistan PPF) tandis que knockdown de Ca v2.1 [EFb] (miR EFb2) abolie (Figure 3D, E).
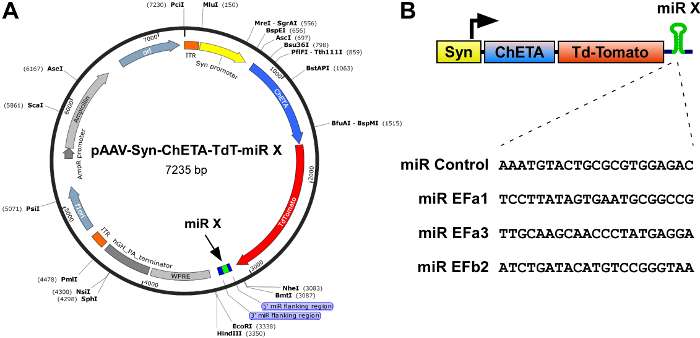
Figure 1 : Schéma des constructions pour l’expression combinée de la sonde optogenetic ultrarapide ChETA et miRs isoforme spécifique contre Cav2.1 [ALE] et Cav2.1 [EFb]. (A) carte du rAAV construire pAAV-Syn-ChETA-TdT-miR-X, contenant un promoteur synapsin (Syn), le channelrhodopsin ultrarapide ChETA fusionnés à TdTomato et, dans le proximal 3' UTR, une miR Cav2.1 épissure isoforme spécifique. Montré des enzymes de restriction sont fraises unique. (B) haut de la page, schéma de la cassette d’expression. Le promoteur synapsin lecteurs expression du clerge-TdTomato et une miR isoforme spécifique. Bas, complément inverse des séquences cibles 21 nucléotides, qui font partie de la cassette de miR. Pour miR EFb2 deux cassettes de miR identiques ont été exprimés en tandem l’un après l’autre. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
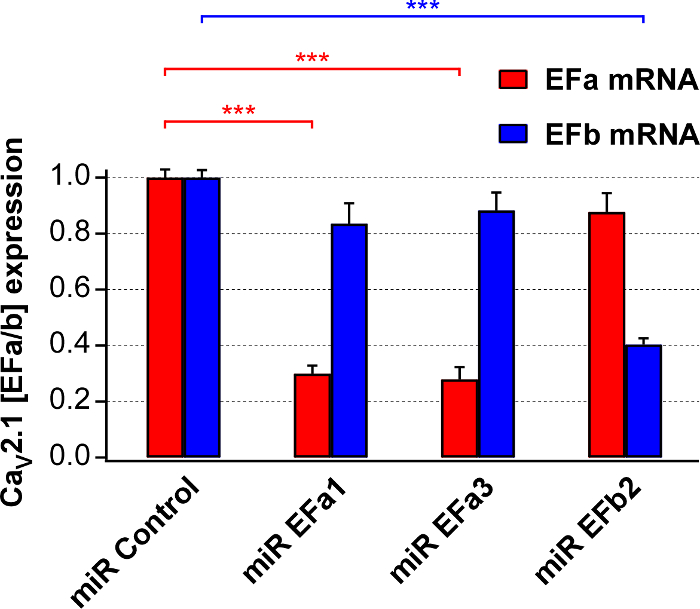
La figure 2. Évaluation de l’efficacité défiant et la sélectivité des miRs isoforme spécifique pour Cav2.1 [ALE] et Cav2.1 [EFb]. Analyse de l’isoforme spécifique qRT-PCR d’ARN isolé des cultures primaires de 17-18 DIV infectés à 6 DIV rAAVs exprimant miRs ciblant soit Cav2.1 [ALE] (miR EFa1 et miR EFa3) ou Cav2.1 [EFb] (miR EFb2). Les données sont normalisées au témoin négatif (miR contrôle). miR EFa1 et miR EFa3 significativement et de façon sélective réduisent les ARNm de Cav2.1 [ALE] (n = cultures 8 et 7, respectivement), tandis que miR EFb significativement et de façon sélective réduit les ARNm de Cav2.1 [EFb] (n = 4 cultures ; *** p < 0,001 ; aller simple analyse de test de variance suivie le post-test de Tukey-Kramer). Les données sont présentées en moyenne ± SEM Ce chiffre a été adapté de Thalhammer, a. et al. 5. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

La figure 3. Évaluant le rôle des Cav2.1 [ALE] et Cav2.1 [EFb] dans l’hippocampe natif de ciblé la stimulation des neurones démontés avec optogenetics. Schéma (A) de la cassette d’expression des constructions rAAV utilisé pour in vivo de l’infection. (B) section hippocampe montrant cette fluorescence TdTomato est limitée à la région CA3 et ses projections. (C) configuration expérimentale : faisceau laser a été dirigé sur les corps cellulaires CA3 et patch clamp enregistrements ont été effectués de neurones pyramidaux CA1. (D) 2 ms-long bleu (473 nm) EPSCs dont PPF est augmenté de miRs ciblage Cav2.1 [ALE] et abolie par miR pour Cav2.1 [EFb] évoquent des impulsions de lumière laser brillées à 20 Hz. (E) Résumé du rapport d’impulsions pairées pour expériences comme dans (D), montrant une augmentation de PPF pour miR EFa1 et miR EFa3 et une diminution de miR EFb2, relative à la station miR contrôle (n = 9-11 enregistrements ; * p = 0,02 ; ** p = 0,01 ; *** p < 0,0004 ; analyse de covariance). Les données sont présentées en moyenne ± SEM Ce chiffre a été adapté de Thalhammer, a. et al. 5. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La co-expression d’une sonde optogenetic et une miR contre un gène présynaptique d’intérêt offre une approche puissante pour caractériser l’effet du gène fonction présynaptique dans les circuits de neurones intacts. Pour cette approche expérimentale, il est important d’identifier et de caractériser les miRs qui sont hautement efficaces et sélective pour faire tomber le gène d’intérêt dans les systèmes natifs. Si possible, deux ou plusieurs miRs indépendantes contre l’ARNm même d’intérêt devraient servir à contrôler pour les éventuels effets hors cible. Expériences de sauvetage, dans lequel un gène résistant à la miR est réintroduit dans le système, utilisable comme un contrôle pour la spécificité.
À l’aide de la même construction pour exprimer une optogenetic sonde et une miR permet stimulant optiquement seulement les neurones présynaptiques qui ont été manipulés. Ce n’est pas possible avec les stimulations électriques parce qu’ils ne distinguent pas entre les neurones infectés et non infectés, produisant ainsi des résultats mixtes et dilués. Parce que les stimulations optiques peuvent induire plusieurs potentiels d’action15, il est important de choisir seulement les sondes optogenetic plus rapide, parmi une palette en expansion15,19,20,21. En outre, il est essentiel de s’assurer que la stimulation optique n’induit pas une dépolarisation directe de boutons présynaptiques, afin d’éviter de contourner certaines des étapes de la transmission synaptique, on veut enquêter sur22.
L’approche expérimentale, nous décrivons ici, permet d’évaluer en parallèle la pertinence physiologique de multiples gènes présynaptiques d’intérêt dans une période de temps limitée (4 – 6 mois). Toutefois, il est important de garder à l’esprit que les passes rabattues atteignent rarement 100 %. En outre, rAAVs doivent être exprimées au moins deux semaines, permettant l’expression maximale de coup de masse et complet de la sonde d’optogenetic, ce qui peut représenter une contrainte de temps dans les enquêtes sur les processus de développement précoces. Bien que plus chez des souris knockout temps, conditionnelle limitées aux neurones présynaptiques, a généralement lieu à terminer la suppression du gène d’intérêt et offre donc une approche complémentaire valide.
Un avantage spécifique de la technologie de miR, c’est qu’il permet l’expression de multiples miRs du même promoteur. Cette propriété a été principalement utilisée pour augmenter l’efficacité défiant en insérant plusieurs copies du même miR ou différents miRs contre le même gène cible. Il peut cependant être utilisé également pour knockdown gènes multiples en exprimant miRs contre cibles différents gènes7,23. Cette propriété peut être utilisée pour faire taire les nombreuses protéines présynaptiques pour disséquer les voies de signalisation présynaptiques.
Ici, nous avons combiné optogenetics avec miRs artificiels pour caractériser les effets du gène sur la fonction présynaptique des tranches d’hippocampe aiguës. Une approche similaire pourrait également être utilisée pour manipuler et sonde circuit neuronal en vivo. En outre, alliant miRs artificiels chemogenetic approches permettrait d’interroger un circuit neuronal sur des échelles temporelles plus longues.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Benfenati F. (Istituto Italiano di Tecnologia, ITI) pour l’appui et Carmela Vitale pour aider à la manifestation. Ce travail a été financé par l’IIT et la Compagnia San Paolo (subvention n° 9734 à bac).
matériels
| Name | Company | Catalog Number | Comments |
| Acrylamide | Sigma | Acrylamide/Bis-acrylamide, 30% solution | Toxic |
| Animal Temperature Controller with heat pad | WPI | ATC2000 | |
| BCA protein assay kit | ThermoFisher Scientific | 23225 | |
| BLOCK-iT Pol II miR RNAi Expression Vector kit | ThermoFisher Scientific | K4936-00 | |
| Brain slices Prechamber | Harvard Apparatus | BSC-PC | |
| CCD camera-based imager | Bio-Rad | ChemiDoc™ MP | |
| Cell Culture reagents | Life Technologies | ||
| Chemiluminescent substrate | GE Helthcare | ECL Western Blotting Reagents, RPN2106 | |
| Chloroform | Sigma | C2432 | Toxic |
| Cytosine β-D-arabinofuranoside | Sigma | C6645 | |
| Drill | Foredom | K.1030 | |
| EGTA | Sigma | E4378 | |
| Gentamicin ointment | Local pharmacy | ||
| Glucose | Sigma | G7021 | |
| Hepes | Sigma | 54459 | |
| Injection micropipettes | Narishige | GD1 | |
| Inorganic salts & detergents | Sigma | ||
| K2-creatine phosphate | Calbiochem | 237911 | |
| KGluconate | Fluka | 60245 | |
| Laser | Laserglow Technologies | LRS-0473-GFM-00100-03 | |
| Membrane | Amersham | Protran™ 0.2 µm NC | |
| MgATP | Sigma | A9187 | |
| Micropipette holder | Narishige | IM-H1 | |
| Micropipette puller | Narishige | PC-100 | |
| Na3GTP | Sigma | G8877 | |
| NaPyruvate | Sigma | P5280 | |
| Ocular lubricant | Local pharmacy | Lacrigel | |
| Phosphate inhibitors | Sigma | P0044, P5726 | |
| Protease inhibitors | Sigma | cOmplete™, EDTA-free Protease Inhibitor Cocktail | |
| Protein gel electrophoresis and blotting devices | Bio-Rad | Mini-Protean III Cell | |
| Providone iodine | Local pharmacy | Betadine | |
| Qiazol Lysis Reagent | Qiagen | 79306 | Toxic |
| QuantiTect Reverse Transcription Kit | Qiagen | 205311 | |
| RNeasy Micro Kit | Qiagen | 74004 | |
| Spectrophotometer | ThermoFisher Scientific | Nanodrop 2000 | |
| Stereotactic apparatus | WPI | ||
| Tetrodotoxin | Tocris | 1069 | Toxic |
| Vibratome | Leica | VT1200S |
Références
- Lam, J. K., Chow, M. Y., Zhang, Y., Leung, S. W. siRNA Versus miRNA as Therapeutics for Gene Silencing. Mol Ther-Nucl Acids. 4, e252 (2015).
- Kohl, M. M., et al. Hemisphere-specific optogenetic stimulation reveals left-right asymmetry of hippocampal plasticity. Nat Neurosci. 14 (11), 1413-1415 (2011).
- Maejima, T., et al. Postnatal loss of P/Q-type channels confined to rhombic-lip-derived neurons alters synaptic transmission at the parallel fiber to purkinje cell synapse and replicates genomic Cacna1a mutation phenotype of ataxia and seizures in mice. J Neurosci. 33 (12), 5162-5174 (2013).
- Mark, M. D., et al. Delayed postnatal loss of P/Q-type calcium channels recapitulates the absence epilepsy, dyskinesia, and ataxia phenotypes of genomic Cacna1a mutations. J Neurosci. 31 (11), 4311-4326 (2011).
- Thalhammer, A., et al. Alternative Splicing of P/Q-Type Ca2+ Channels Shapes Presynaptic Plasticity. Cell Rep. 20 (2), 333-343 (2017).
- Sambrook, J., Russell, D. W. Calcium-phosphate-mediated Transfection of Eukaryotic Cells with Plasmid DNAs. CSH Protoc. 2006 (1), (2006).
- Chung, K. H., et al. Polycistronic RNA polymerase II expression vectors for RNA interference based on BIC/miR-155. Nucleic Acids Res. 34 (7), e53 (2006).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp. (57), e3348 (2011).
- Cingolani, L. A., et al. Activity-dependent regulation of synaptic AMPA receptor composition and abundance by beta3 integrins. Neuron. 58 (5), 749-762 (2008).
- Huang, H., Xu, Y., Cheng, C. Detection of alternative splicing during epithelial-mesenchymal transition. J Vis Exp. (92), e51845 (2014).
- Vandesompele, J., et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol. 3 (7), (2002).
- Cetin, A., Komai, S., Eliava, M., Seeburg, P. H., Osten, P. Stereotaxic gene delivery in the rodent brain. Nat Protoc. 1 (6), 3166-3173 (2006).
- Paxinos, G., Franklin, K. B. . The Mouse Brain in Stereotaxic Coordinates. , (2012).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2013).
- Gunaydin, L. A., et al. Ultrafast optogenetic control. Nat Neurosci. 13 (3), 387-392 (2010).
- Bourinet, E., et al. Splicing of alpha 1A subunit gene generates phenotypic variants of P- and Q-type calcium channels. Nat Neurosci. 2 (5), 407-415 (1999).
- Chaudhuri, D., et al. Alternative splicing as a molecular switch for Ca2+/calmodulin-dependent facilitation of P/Q-type Ca2+ channels. J Neurosci. 24 (28), 6334-6342 (2004).
- Soong, T. W., et al. Systematic identification of splice variants in human P/Q-type channel alpha1(2.1) subunits: implications for current density and Ca2+-dependent inactivation. J Neurosci. 22 (23), 10142-10152 (2002).
- Berndt, A., et al. High-efficiency channelrhodopsins for fast neuronal stimulation at low light levels. P Natl Acad Sci USA. 108 (18), 7595-7600 (2011).
- Klapoetke, N. C., et al. Independent optical excitation of distinct neural populations. Nat Methods. 11 (3), 338-346 (2014).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96 (5), 1803-1814 (2009).
- Zhang, Y. P., Oertner, T. G. Optical induction of synaptic plasticity using a light-sensitive channel. Nat Methods. 4 (2), 139-141 (2007).
- Fowler, D. K., Williams, C., Gerritsen, A. T., Washbourne, P. Improved knockdown from artificial microRNAs in an enhanced miR-155 backbone: a designer's guide to potent multi-target RNAi. Nucleic Acids Res. 44 (5), e48 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon