Method Article
沿岸湿地におけるメタン循環微生物動態の可視化
要約
このプロトコルは、テキサス州南部の沿岸湿地で主要なメタン循環遺伝子を検出し、その空間分布を視覚化して、これらのダイナミックな生態系におけるメタン制御とその環境への影響の理解を深めます。
要約
沿岸湿地はメタンの最大の生物源であり、メタン生成菌が有機物をメタンに変換し、メタン栄養生物がメタンを酸化するため、メタンサイクルの調節に重要な役割を果たしています。テキサス州南部の湿地は、頻繁な気象現象、塩分濃度の変動、気候変動による人為的な活動の影響を受け、メタン循環に影響を与えています。これらのプロセスの生態学的重要性にもかかわらず、テキサス州南部の沿岸湿地におけるメタン循環は、まだ十分に調査されていません。このギャップに対処するために、メタン生成菌のバイオマーカーとしての mcrA やメタン栄養生物のバイオマーカーとしての pmoA1、 pmoA2、 mmoX など、メタン生成菌やメタン栄養生物に関連する遺伝子を検出する方法を開発し、最適化しました。また、本研究では、地理情報システム(GIS)ソフトウェアArcGIS Proを用いて、メタン生成菌とメタン栄養物質の存在量の空間的・時間的分布パターンを可視化することを目的とした。これらの分子技術と高度な地理空間可視化の統合により、テキサス州南部の湿地におけるメタン生成菌とメタン栄養生物のコミュニティの空間的および時間的分布に関する重要な洞察が得られました。したがって、この研究で確立された方法論は、湿地の微生物動態をマッピングするための堅牢なフレームワークを提供し、さまざまな環境条件下でのメタン循環の理解を深め、より広範な生態学的および環境変化研究をサポートします。
概要
沿岸湿地は、炭素隔離、蒸発散、メタン(CH4)排出などのプロセスを通じて、気候調節、生物多様性保全、水管理に貢献する重要な生態系です1。淡水湿地と海水湿地の両方を含むこれらの生態系2は、生産性が高く、二酸化炭素(CO2)の取り込みの重要なゾーンとして機能し、陸域および海洋環境3,4から有機物を捕捉します。これらの湿地内でのダイナミックな相互作用は、微生物のCH4の生産と消費を刺激し5、CH46の最大の天然源の1つとして位置付けられています。2番目に重要な温室効果ガスであるCH4は、CO2の約27〜30倍の地球温暖化係数を持っています4,7,8,9、気候変動の時代には沿岸湿地からのCH4排出量の研究が不可欠です。CH4の放出は、さまざまな環境要因、特に塩分の影響を受け、微生物プロセスに重要な役割を果たしています10。淡水湿地は、硫酸塩レベルが低いため、大気中のメタンに大きく寄与し、微生物のCH4産生が促進されますが、塩水湿地は一般的に硫酸塩濃度が高いため、CH4の排出量が少なくなる傾向があります11,12,13。
沿岸湿地からのCH4排出量は、一般に、メタン生成菌とメタン栄養生物14として知られる2つの微生物群によって制御されている。メタン生成菌は、ギ酸、酢酸、水素、メチル化化合物などの基質をメタン生成として知られるプロセスを通じて分解することにより、無酸素堆積物中にCH4を生成します15。この経路における重要な酵素は、メチルコエンザイムMレダクターゼ(MCR)であり、メタン生成15,16,17の最終および律速ステップを触媒する。MCRのαサブユニットをコードするmcrA遺伝子は、すべてのメタン生成古細菌に見出される機能マーカーである18。さらに、沿岸湿地では、メタン生成帯の上に硫酸塩-メタン移行帯(SMTZ)が形成され、上向きに拡散するメタンと下向きに移動する硫酸塩が収束して枯渇します19。このゾーン内では、嫌気性メタン栄養古細菌(ANME)がMCR酵素を使用してメタンを二酸化炭素に酸化し、硫酸塩還元細菌(SRB)が硫酸塩を硫化物に還元します。SRBは、水素と酢酸でメタン生成菌を凌駕し、硫酸塩が枯渇するまでメタン生成を制限します16,17。
対照的に、好気性メタン栄養細菌は、好気性環境20でCH4を酸化し、さまざまな形態のメタンモノオキシゲナーゼ(MMO)を利用します。これらには、細胞質内膜に埋め込まれた銅含有酵素である粒子状メタンモノオキシゲナーゼ(pMMO)や、細胞質に見られる鉄含有酵素である可溶性メタンモノオキシゲナーゼ(sMMO)が含まれます。ただし、pMMOの場合、3つの遺伝子オペロンpmoCAB21があります。その中で、pmoA遺伝子はすべてのメタン栄養生物にとって最も保守的です。pmoAには、pmoA1とpmoA2の2つの異なるバイオマーカー遺伝子があります22。さらに、メタン栄養生物を包括的に理解するために、mmoX遺伝子は、sMMO含有メタン栄養生物を同定するための分子生物学のツールとして使用されています23。メタン生成菌と好気性メタン栄養生物の代謝経路と環境要件におけるこの違いは、沿岸湿地生態系におけるメタン循環を調節する複雑な微生物相互作用を浮き彫りにしています。
テキサス州南部の生産的な塩水環境であるボカチカ(BC)湿地は、メキシコ湾(GOM)からの潮汐の影響を受け、特に高塩分濃度のラグナマドレ24に近いため、表面の塩分レベルが変動します。この潮汐作用は、満潮と干潮を交互に繰り返すため、酸素濃度が変動し25 、堆積物26のメタン生成菌とメタン栄養生物の活性が変化する可能性がある。対照的に、沿岸の淡水湿地は、CH4 フラックス27の重要なホットスポットであると考えられています。レサカ・デル・ランチョ・ビエホ(RV)やロサノ・バンコ(LB)など、テキサス州南部の沿岸淡水湿地は、GOMの潮汐の影響から遠く離れており、水文学的な管理が明確です。RVは、水位が低いときには川の水によって補完されるパルスフローを経験しますが、LBはそのようなサプリメントなしでオフラインフローシステムとして機能します。さらに、RVとLBは、人工的に汲み上げられた淡水の大量排出とオックスボー湖であるため、それぞれ低い塩分レベルを維持しています。さまざまな環境要因が、テキサス州南部の沿岸湿地全体のメタン循環に大きな影響を与える可能性があります。しかし、テキサス州南部の沿岸湿地でのメタン循環は、まだ徹底的に調査されていない領域です。
ポリメラーゼ連鎖反応(PCR)とリアルタイムPCR(定量PCR[qPCR]とも呼ばれる)は、環境サンプル中の特定の遺伝子の相対的な存在量を検出および定量するための基本的で広く利用されている技術です。これらの技術は、DNAの標的領域を特異的に増幅して、CH4サイクリング関連遺伝子の存在と相対量を示し、潜在的なメタンサイクリングの指標を提供します。それにもかかわらず、PCRプライマーセットの利用可能性および有効性は、抽出された環境DNA中の様々な阻害因子によって制限される可能性があり、環境のタイプによって影響を受ける28,29。そこで、本研究では、主にテキサス州南部の沿岸湿地におけるCH4循環関連遺伝子の存在を検出するための最適なPCR法を確立し(図1)、これらの生態系におけるそれらの定量化された相対存在量を可視化しました。この研究の結果は、他の沿岸地域に適用して、多様な沿岸生態系におけるCH4サイクルと微生物動態の理解を深めることができます。
プロトコル
1.サンプル収集
- 沈殿物グラブサンプラーまたはショベルを使用して沈殿物サンプルを収集します。
注:サンプルは、2023年と2024年の涼しい季節(10月から2月、平均気温は20°C)と暖かい季節(4月から6月、平均気温は27°C)に、3つの異なる沿岸湿地の2つのステーションから収集されました。沿岸の淡水湿地からサンプルを採取する際には堆積物グラブサンプラーを使用し(図2)、潮汐の影響を受けた沿岸の塩水湿地ではシャベルを使用しました。 - 最初にサンプラーを浅い水域に下げ、自重で堆積物表面(上部50cm以内)に沈むようにし、 図2に示すように堆積物構造への乱れを最小限に抑えます。
- 深さが通常60 cmから215 cm30であった水柱から引き出し、沈殿物サンプルをジップロックバッグに移し、すぐにアイスボックスに保管します。
注:次のステーションに進む前に、グラブサンプラーを脱イオン(DI)水で洗浄して洗浄してください。 - すべてのサンプルは、すぐに-20°Cでラボに保管してください。
- 各サンプリングサイトで、マルチパラメータ水質計を使用して、塩分濃度や その場の温度 などの地表水質パラメータを測定します。
注:プローブは、各ステーションで使用した後、脱イオン水(DI水)ですすいでください。
2. ゲノムDNA抽出
- ゲノムDNA抽出の手順を開始する前に、サンプルを室温で解凍します。
- 約500 mgの沈殿物サンプルを15 mLチューブに移し、4,250 × g で3分間遠心分離して水分をすべて除去します。
- DNA抽出キットを使用して、製造元のプロトコル31 に従って土壌用のゲノムDNAを抽出し、少し変更を加え、すぐに-20°Cで保存します。
注: この変更は、冗長性を減らし、ワークフローを効率化するために行われました。- 最大500 mgの土壌サンプルをガラスビーズ/セラミック球体含有チューブに加えます。
- 978 μLのリン酸ナトリウムバッファーをビーズ/球状チューブ内のサンプルに加えます。
- ビーズ/球体含有チューブ内のサンプルに122 μLのバッファー溶解溶液を加えて、外部汚染物質を可溶化します。
- ビーズミルホモジナイザーを使用して、速度レベルの5倍で20秒間均質化し、2回繰り返します。
注:この研究ではビーズミルホモジナイザーを使用したため、速度を調整しました。 - 混合物を14,000 × gで10分間遠心分離します 。
- 上清を清潔な2.0mL微量遠心チューブに移します。
- 250 μLのタンパク質沈殿液(PPS)を添加して、可溶化した核酸を細胞破片および溶解マトリックスから分離します。チューブを10倍反転させて混ぜます。
- 14,000 × g で5分間遠心分離してペレットを沈殿させ、細胞の破片と溶解マトリックスを除去します。
- 上清を清潔な15 mL微量遠心チューブに移します。
- 1.0 mLのBinding Matrix懸濁液を15 mLチューブの上清に加えます。
注意: Binding Matrixサスペンションを振って再懸濁してから追加してください。 - DNAを結合マトリックスに結合させるには、チューブをローテーターに2分間置きます。
- すべてのチューブをラックに置き、3分間インキュベートして、結合マトリックスが沈降するまで待ちます。
- 3分後、750 μLを廃棄し、残りの上清をピペットを使用してペレットと穏やかに混合します。
- 混合物750μLをSPINフィルターに移し、14,000 μg×で1分間遠心分離します。 キャッチチューブを空にして再利用します。残りの混合物で繰り返します。
- 調製した洗浄液500μL(適量のエタノールを添加)を加えて、不純物をさらに可溶化します。ピペットチップからの液体の力を使用して、ペレットを穏やかに再懸濁します。
- 14,000 × g で1分間遠心分離し、不純物を除去します。キャッチチューブを空にして再利用します。
- 何も加えずに、再度14,000 × g で2分間遠心分離します。
- キャッチチューブを新しい清潔なキャッチチューブと交換し、SPINフィルターを室温で5分間風乾します。
- 50 μL の DNAse フリーウォーター (DES) を加え、14,000 × g で 1 分間遠心分離します。
注:このプロトコルでは、抽出された環境DNA(eDNA)の最適な回収と安定性を確保するために、DNA溶出に50μLのDESを使用しました。
3. DNA定量
- 抽出したDNA1 μLと蛍光色素200 μLを0.5 mLチューブに加え、ピペッティングで十分に混合します。
- 光が透過しないように、すぐにチューブをアルミホイルで包み、室温で5分間インキュベートします。
- 蛍光光度計を使用して、メーカーのプロトコルに従ってONE DNA濃度モードでDNA濃度を測定します。
4. 従来のPCRによる16S rRNA、 pmoA1 、 pmoA2 、 mmoX 、 およびmcrA の検出
- 従来のPCR(cPCR)を実行する前に、氷のバケツですべてのサンプルと試薬を解凍します。
- 抽出したすべてのeDNAサンプルを10 ng/μLに希釈します。
注:プライマーのリストを 表1に示します。 - 各サンプルについて、12.5 μL の 2x PCR マスターミックス、0.5 μL のフォワードおよびリバースプライマー (10 μM) (プライマーリストについては 表 1 を参照)、10 ng/μL eDNA 1 μL 1 μL、およびヌクレアーゼフリー水 10.5 μL を含む 25 μL cPCR 反応混合物を調製します。
注:ピペッティングエラーを最小限に抑えるために、1つの追加サンプルに十分な量のマスターミックスを準備します。 - 95°Cで2分間の初期変性、続いて95°Cで45秒間の変性、72°Cで30秒間の伸長、および72°Cで5mの延長からなるプロトコルに従ってcPCR反応を行い、プライマーごとに異なるアニーリング温度を使用します(異なる遺伝子に使用される異なるプライマーのアニーリング温度については表1を参照)。
注: mcrA 遺伝子の場合、MLプライマーは、最初の5サイクル32のアニーリングステップと伸長ステップの間に0.1°C / sの遅いランプ速度を使用して所望のバンドを示した。 - エチジウムブロマイド(EtBr)で染色したアガロースゲル中のcPCR産物を可視化します。
注:50 bpラダーには2.5%アガロースゲルを使用し、1 kbラダーには0.9%ゲルを使用します。2.5%アガロースゲルには1x TAEバッファーを、0.9%アガロースゲルには0.5x TAEバッファーを使用してください。
5. 定量的リアルタイムPCRによる pmoA1 、 pmoA2 、 mmoX、 mcrA の検出
注: pmoA1、 pmoA2、 mmoX、 およびmcrA の存在量などのメタン生成およびメタン栄養生物を標的とする遺伝子を、リアルタイムPCRシステムを用いたqPCRによって観察した。
- 各遺伝子の標準試料を別々に調製し、各遺伝子の標準曲線を求めます。
- 各遺伝子のゲル電気泳動中に最も明るいバンドを生成したサンプルを使用して、cPCRで標的遺伝子を増幅します。セクション4に記載されている方法とプライマーに従ってください。
- ゲル抽出キットを使用して増幅産物を精製し、セクション3に記載されている方法に従ってDNA濃度を測定し、-20°Cで保存します。
注:精製した標準試料を別々のチューブに分注して、さらに使用してください。 - qPCRのコピー数計算ウェブサイトを使用して、測定したDNA濃度から遺伝子コピーを計算します。
- qPCRを実行する前に、計算された標準のコピー数をヌクレアーゼフリー水で希釈し、各標準を108 から 102 コピー/μLの範囲で調製します。
- 各コピー番号の 3 回の繰り返しを使用して、ネガティブコントロール(NTC、テンプレート DNA なし)を使用して標準曲線を調製します。
注:各標準曲線のR2 値は0.99を超えていました。
- すべてのサンプル、スタンダード、およびNTCについて、20 μL qPCR反応混合物を調製します。すべてのサンプルに対してqPCR解析をトリプリケートで実施します。
- 開始する前に、qPCRマスターミックス、プライマー、ヌクレアーゼフリー水、標準試料、サンプルを含むすべての反応成分をアイスラックに置きます。
- 各サンプル、標準試料、NTCについて、10 μLのSYBR Greenマスターミックス、10 μMのフォワードプライマーとリバースプライマー各0.5 μL、8 μLのヌクレアーゼフリー水、10 ng/μLテンプレートDNA、標準水、またはDI水のいずれかをそれぞれ含んだ20 μL qPCR反応混合物を調製します。
注:示されているプライマーセットを使用して、従来のPCRの qPCRでpmoA1 および mcrA 遺伝子の最適な結果を得ることができます( 表1を参照)。精度を向上させるには、各サンプルをトリプリケートで実行します。次の手順は、サンプルあたり合計容量が 60 μL のトリプリケートサンプルを調製するための効率的な方法です。- 反応混合物を調製して、マスターミックス、特定の遺伝子のフォワードプライマーとリバースプライマー、およびヌクレアーゼフリーの水(テンプレートDNAを除く)を2 mLチューブに組み合わせます。
注:ピペッティングエラーを考慮して反応混合物の量を準備してください。例えば、24 個のサンプルと 8 個の標準試料がある場合、ピペッティングエラーを最小限に抑えるために、32 個の反応ではなく 33 個の反応の総容量を計算します。この場合、トリプリケート反応に必要な総容量は、990 μLのマスターミックス(33サンプル×3回の繰り返し×10 μL)、49.5 μLのフォワードプライマー(33サンプル×3回の繰り返し×0.5 μL)、49.5 μLのリバースプライマー(33サンプル×3回の繰り返し×0.5 μL)、792 μLのヌクレアーゼフリー水(33サンプル×3回の繰り返し×8 μL)となります。 - サンプル数と標準に従ってPCRチューブを準備します。
- 調製した反応混合物57 μLを各PCRチューブに分注します。
注:各サンプルに対して三重でqPCRを実行するには、サンプルあたり57 μLの総反応混合物量を調製します(テンプレートDNA、標準、または水を除く)。この容量は、1つのサンプルに対して3つのウェルに均等に分割され、各ウェルに19μLが割り当てられます。 - 各チューブに3 μLのテンプレートDNA、標準水、またはヌクレアーゼフリー水を加え、チューブの底を軽くたたいて混合します。
注:1つのサンプルに対して調製された反応混合物の総量は、現在、各チューブで60μLになります。
- 反応混合物を調製して、マスターミックス、特定の遺伝子のフォワードプライマーとリバースプライマー、およびヌクレアーゼフリーの水(テンプレートDNAを除く)を2 mLチューブに組み合わせます。
- 調製した反応混合物20 μLを各チューブから96ウェルqPCRプレートの指定ウェルに分注します。アプリケーターを使用して、PCRプレートを接着剤PCRシーリングフィルムでシールします。
- 密封されたプレートを1,000 × g で1分間遠心分離し、ウェル内の気泡を排除するための適切な混合を確保します。
- PCRプレートをサーマルサイクラーに入れます。qPCR装置の電源を入れ、関連ソフトウェアを開いてプロトコルを設定します。
- qPCRマスターミックスのガイドラインに従ってプロトコールをセットアップします。次のプロトコルを使用します:95°Cで10分間、続いて95°Cで15秒間、72°Cで30秒間の延長ステップ。 表1 の関連するプライマーに指定されているアニーリング温度で、アニーリングステップを45秒間実行します。すべてのqPCRランを35サイクル実施します。
- サンプル含有プレートと同じ構成で、スタンダードおよびNTCを使用して96ウェルqPCRプレートをセットアップします。
- 絶対定量標準曲線法を使用して、増幅された製品と各サンプル33の遺伝子コピー数を定量する。
6. テキサス州南部沿岸湿地の地図におけるメタン循環遺伝子の可視化
- 地理情報システム (GIS) ソフトウェア ArcGIS Pro を開き、プロジェクト ファイルを Study Area という名前でコンピューター上の指定したフォルダーに保存します。
- 左上の「地図」をクリックします |[ベースマップ] をクリックし、ベースマップとして [ラベル付きテレイン] を選択します。
- [ 検索] |検索 し、検索バーが開いたら、エリアの名前を入力して分析エリアを見つけます。エリアが表示されます。
- ジオリファレンスを使用して特定の領域を描画します。
- [表示] |最上位レイヤーの [カタログ ウィンドウ] をクリックします。
- カタログから フォルダ をダブルクリックします |ファイル名。
- ジオデータベース (*.gdb) ファイルを右クリックし、[新規作成] |[フィーチャクラス] と [フィーチャクラスの作成] が表示されます。
- 「名前」と「エイリアス」と入力し、下部にある「完了」をクリックします。
- [表示] |目次。エイリアスの名前がコンテンツ ウィンドウに表示されます。
- 最上層から[編集]をクリックします |作成します。[フィーチャ作成] ウィンドウが開きます。[フィーチャ作成] ウィンドウで [エイリアス] をダブルクリックすると、[Configure Tool Feedback Options] が表示されます。
- [ライン]を選択し、マップ上にラインをスケッチして、分析範囲の外側の境界を作成します。終了したら、マップをダブルクリックします。
- GIS ソフトウェアを最小化してから、スプレッドシートを開きます。最初の列に サンプル名 を入力し、2 番目の列に 緯度 を入力し、3 番目の列に 経度 を入力します。次の 4 つの列は、 pmoA1、 pmoA2、 mmoX、および mcrA の qPCR データに使用します。
- ファイルを CSV形式で コンピューターの特定のフォルダーに保存します。
- GIS ソフトウェアを再度開き、[ データの追加] |XY ポイント データ。
- [ 入力テーブル ] ボックスで、コンピューター上のフォルダーから CSV ファイルを選択します。 [出力フィーチャクラス] でファイル名を変更し、[ 実行 ] をクリックして、マップ上にサンプリング ポイントを表示します。
- 上部のvsearchバーをクリックして、 Krigingを検索します。
- サンプリング・ステーション・ファイルを選択し、 次にpmoA1を選択します。
- [環境]をクリックします | レイヤーとマスクでサンプリングステーションを選択 |「実行」をクリックします。
- 手順 6.9、6.10、および 6.11 で説明したプロトコルに従って、すべての分析範囲に対して pmoA2、mmoX、および mcrA の Kriging を作成します。
- マップのレイアウトを作成します。
- [最上層から 挿入 ]をクリックします |[新しいレイアウト] をクリックし、[ ANSI - ランドスケープ] を選択します。
- [マップフレーム]をクリックし、クリギングのあるマップを選択し、長方形を描画してレイアウト内のすべてのマップを配置します。これにより、マップがレイアウトに表示されます。
- 方位記号を選択し、レイアウトに配置して北方向を示します。
- [縮尺記号] を選択すると、マップ上のエリアの縮尺が表示されます。
- [凡例] をクリックして凡例を表示し、レイアウトに配置します。
- [格子線] をクリックし、黒色の経緯線オプションのいずれかを選択します。これにより、緯度と経度のグリッドが作成され、コンテンツ ウィンドウに「Black Horizontal Label Graticule」というラベルで表示されます。
- 「Black Horizontal Label Graticule」をダブルクリックし、「Components」を選択します。Ticks 1 と Grid をクリックし、右側の十字記号をクリックしてこれらのコンポーネントを削除します。
- 最上層から [共有 ]をクリックし、[ レイアウトのエクスポート]をクリックします。ファイル タイプとして [PDF] を選択し、[ 名前ボックス] を使用してファイルをコンピューターに保存し、垂直方向の解像度を 500 DPI に設定し、[ エクスポート ] をクリックしてマップの PDF ファイルを作成します。
結果
テキサス州南部の沿岸湿地におけるCH4サイクリング関連遺伝子(mcrA、pmoA1、pmoA2、mmoX)の分布と存在量を理解するために、各サンプルから抽出されたeDNAをcPCRとqPCRで解析しました。各バイオマーカーのユニバーサルプライマーは、以前の研究(表1)22,34,35,36,37からcPCRを実行するために選択され、サンプルの特性および環境条件に基づいてアニーリング温度および濃度を最適化するための修正が加えられた。例えば、16S rRNA、pmoA1、およびpmoA2は、そのほとんどが標準アニーリング温度をかなり下回る濃度で増幅されたため、標準アニーリング温度では増幅されませんでした(データは示さず)。さらに、cPCRプロセスでは、10 ng/μLのDNA濃度ではpmoA1、pmoA2、およびmmoX遺伝子に明確なバンドが示されましたが、5 ng/μLのテンプレートDNAを使用すると、mcrA遺伝子に対してより明るいバンドが示されました(Supplemental File 1-Supplemental Figure S1)。
cPCR解析により、テキサス州南部の3種類の沿岸湿地における遺伝子検出の空間的変動性が明らかになりました。表2に示すように、沿岸の淡水湿地であるLBおよびRVのすべてのサンプルでmcrA遺伝子が検出されました。しかし、cPCRでは、塩水湿地のサンプル堆積物中にmcrA遺伝子を検出できなかったため、塩分濃度とメタン生成菌の分布との間には関連性がある可能性が示唆されました(Supplemental File 1-Supplemental Figure S2)。mcrAの検出については、MLF-MLR、MCRf-MCRr、ME1F-ME2R、およびMcrA 159F-McrA 345Rを含む4つのプライマーペアをこの研究で使用しました(表1)。その中で、MLプライマーペアのみが南テキサス湿地のメタン生成菌群集を検出できました(補足ファイル1-補足図S2、補足図S3、および補足図S4)。対照的に、好気性メタン栄養生物では、pmoA1遺伝子はすべてのRVサンプルで検出されましたが、LBおよびBCサンプルでは検出されませんでした(補足ファイル1-補足図S5)。pmoA1の同定には、A189をフォワードプライマーとして、A682とmb661をリバースプライマーとして使用し、A189-A682プライマーペアもamoA35,38を検出することができます。しかし、このプライマーペアは、ゲル画像が非常にかすかなバンドを示したこの研究では、cPCRの遺伝子の存在を検出することができ、pmoA1遺伝子の存在量が少ないことを示唆しています。別のリバースプライマーmb661は、フォワードプライマー38としてA189を用いてpmoA1遺伝子を特異的に同定するように設計した。mb661をリバースプライマーとして使用した場合、cPCRはより明るいバンドを示し(Supplemental File 1-Supplemental Figure S6)、これは後にqPCRで使用されました。興味深いことに、pmoA2遺伝子は2つのBCサンプルと1つのLBサンプルで検出されましたが、1つのRVサンプルでは検出されませんでした(補足ファイル1-補足図S7)。以前の研究では、pmoA2のアニーリング温度は66°Cと60°Cであり、60°Cでは245 bpと438 bpの2つの異なるサイズのアンプリコンが観察されましたが、66 °Cでは、206f-703bプライマーは438 bpの製品サイズ22のpmoA2のみを増幅できます。しかし、本研究では、アニーリング温度60°Cでの増幅に成功し、LBおよびBC部位において予想サイズ(438bp)のバンドを作製しました(Supplemental File 1-Supplemental Figure S7)。さらに、mmoX遺伝子はLBサンプルで検出されましたが、1つのRVサンプルには存在しませんでした(Supplemental File 1-Supplemental Figure S8)そしてBCサンプルでは完全に存在しませんでした。mmoXに使用したプライマーペアは、この研究でテキサス州南部の湿地を研究するのにも適していました。55°C36のアニーリング温度は、cPCRでmmoXの明るいバンドを生成しました(補足ファイル1-補足図S8)。サンプルの完全性を検証するために、16S rRNAをポジティブコントロールとして使用し、cPCR中にすべてのサンプルで16S rRNAの増幅に成功し、サンプルが汚染されていないことが示唆されました(補足ファイル1-補足図S9)。
遺伝子存在量の時間的および空間的変化を評価するために、cPCRで同定された最適化されたプライマーセットを使用して、すべての標的遺伝子に対してqPCR分析を実施しました。 pmoA2 および mmoX 遺伝子のqPCRは、cPCRで使用したのと同じプライマーで実施しました。しかし、 pmoA1 遺伝子にはA189-mb661プライマーペアを、 mcrA 遺伝子にはMLF-MLRプライマーペアを選択したところ、どちらもcPCRで良好な結果が得られました。テキサス州南部の湿地全体での季節差と塩分濃度の変動も、微生物群集の動態に影響を与える可能性があるため、考慮されました。 図3 と 図4に示すように、2つの異なるサンプリング期間間で、メタン生成菌とメタン栄養生物の遺伝子存在量に差がありました。沿岸の淡水湿地では塩分濃度の季節変動はなかったが、沿岸の塩水湿地では塩分の季節差が観察され39、これがメタン生成菌とメタン栄養生物の存在量の変動を説明することができる。 図3 は、涼しい季節には、 mmoX がこれらすべての湿地で非常に豊富に存在し、1.46×104 コピー/μLと最も豊富であったことを示しています。LB、RV、BCの1つのステーションには、 pmoA2 がわずかに含まれていました。しかし、qPCRは、涼しい季節に存在量が少ないため、 pmoA1 と mcrA を検出することができませんでした。対照的に、 pmoA1 は温暖な季節に最も多く存在し、最も多く存在×103 コピー/μLでした(図4)。 mmoX と mcrA はLBの表面堆積物サンプル(上部50cm以内)でも検出され、温暖期には比較的少ない存在量にもかかわらず、それぞれ1.92×102 コピー/μLと2.04×102 コピー/μLの最大存在量を示しました。興味深いことに、温暖な季節には 、pmoA2 はまったく検出されず、BCサンプルから標的遺伝子はいずれも検出されませんでしたが、これは、テキサス州南部の暖かい季節にこの塩水湿地39 に固有の環境要因の影響を受けている可能性があります。
この研究は、沿岸湿地全体でのCH4循環関連遺伝子の分布における明確な空間的および季節的変動を示しています。具体的には、mcrA遺伝子は淡水LBサンプルでのみ検出され、生息地の好みを示唆しています。mmoX遺伝子とpmoA2遺伝子は、涼しい季節にはすべてのサンプルに存在し、pmoA1は暖かい季節の淡水環境に存在しました。これらの結果は、環境条件と季節シフトの両方がCH4サイクリング関連の微生物活動に及ぼす影響を強調しています。図3と図4に示すように、クリギング補間を用いた可視化の強化により、沿岸湿地生態系におけるCH4循環関連の微生物活動の理解が進みました。
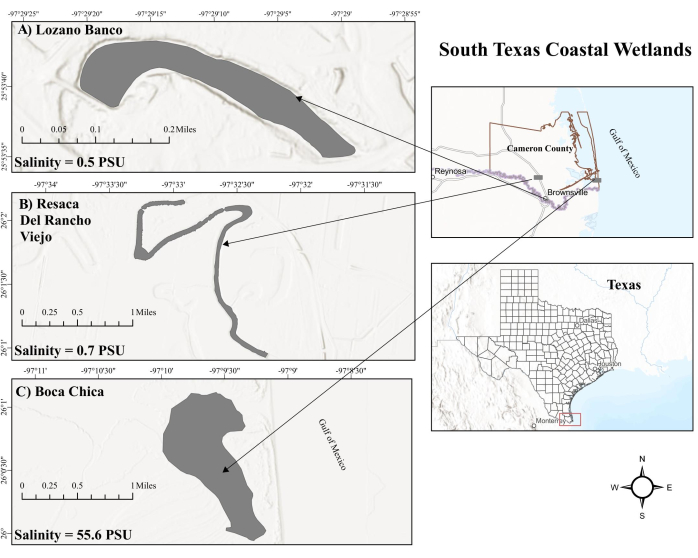
図1:テキサス州南部の沿岸湿地の地図。 (A)ロサノバンコ。LBは沿岸の淡水湿地です。(B)レサカデルランチョビエホ。RVは沿岸の淡水湿地でもあります。(C)ボカチカ湿地。BC州は、潮汐の影響を受けた高塩水沿岸の塩水湿地です。略語:LB = Lozano Banco;RV = レサカ・デル・ランチョ・ビエホ;BC =ボカチカ;PSU = 実用的な塩分単位。 この図の拡大版を表示するには、ここをクリックしてください。
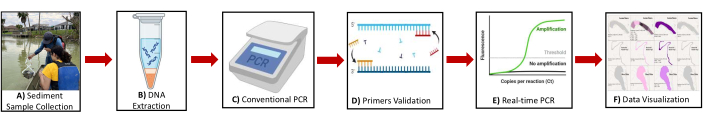
図2:プロトコルの概要を示す概略図。 主なステップの図には、(A)沈殿物サンプルの収集、(B)DNA抽出、(C)従来型PCR、(D)プライマーの検証、(E)リアルタイムPCR、(F)メタン生成菌およびメタン栄養生物のバイオマーカー遺伝子を特定するためのデータの視覚化が含まれます。 この図の拡大版を表示するには、ここをクリックしてください。
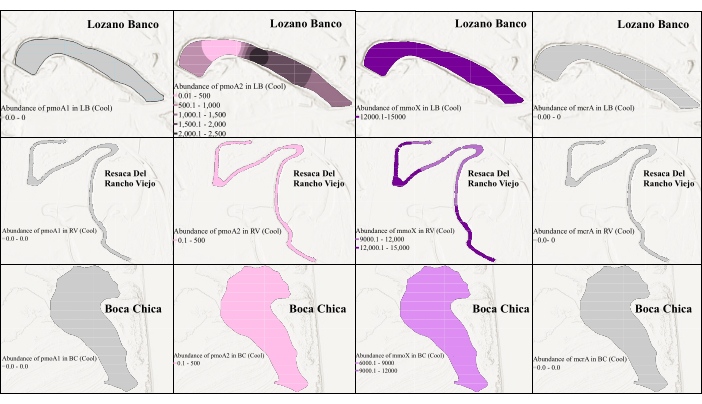
図3:涼しい季節におけるメタン生成菌とメタン栄養生物のバイオマーカー遺伝子の空間分布。 図は、涼しい季節の mmoX の豊富さを示しています。ここで、灰色は、存在量が少ないためにqPCRが遺伝子を検出できなかったことを示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:温暖期におけるメタン生成菌とメタン栄養生物のバイオマーカー遺伝子の空間分布。 ここで、灰色は、qPCRが遺伝子の存在量が少ないために検出できなかったことを表しています。この図は、ロサノ・バンコとレサカ・デル・ランチョ・ビエホの温暖な季節の pmoA1 の存在量を示していますが、ボカ・チカでは存在量は検出されませんでした。 この図の拡大版を表示するには、ここをクリックしてください。
| プライマー名 | 遺伝子 | この研究では、アニーリング温度(°C) | 製品の長さ(bp) | シーケンス (5'-3') | 参考 | |
| 1055階 | 16S rRNA | 55 | 337 | ATGGCTGTCGTCAGCT | (Harms et al., 2003) | |
| 1392R | ACGGGCGGTGTGTac | |||||
| A189F型 | pmoA1の | 55 | 525 | GGNGACTGGGACTTCTGG | (ホームズ他、1995) | |
| A682R型 | GAASGCNGAGAAGAASGC | |||||
| A189F型 | 56 | 470 | GGNGACTGGGACTTCTGG | (コステロ&リドストローム、1999年) | ||
| mb661Rの | CCG、GMG、CAA、CGT、CYT、TACC | |||||
| 206F | pmoA2の | 60 | 438 | GGNGACTGGGACTTCTG ガトガクトカッガッガッチャッガッチャッコ | (Tchawa Yimga et al., 2003) | |
| 703bさん | GAASGCNGAGAAGAASGC GGCGACCGGAACGGT | |||||
| 536階 | mmoXの | 55 | 362 | CGCTGTGGAAGGGCATGAAGCG | (Fuse et al., 1998) | |
| 898R | GCTCGACCTTGAACTTGGAGCC | |||||
| MCRfの | mcrAの | 46 | ~490 | タイゲイカラトグジット | (Springer et al., 1995) | |
| MCRrの | ACRTTCATNGCRTARTT | |||||
| ME1F | 50 | 763 | GCMATGCARATHGGWATGTC | (ヘイルズら、1996) | ||
| ME2Rの | TCATKGCRTAGTTDGGRTAGT | |||||
| MLFの | 55 | ~470名 | GGTGGTGTMGGATTCA CACARTAYGCWACAGC | (ルートン他、2002) | ||
| MLRの | TTCATTGCRTAGTTWGGRTAGTT | |||||
| マクラ159F | 62 | 186 | AAAGTGCGGAGCAGCAATCACC | (Vaksmaa et al., 2017) | ||
| マクラ345R | TCGTCCCATTCCTGCTGCATTGC | |||||
表1:この研究でメタン循環に関連する機能遺伝子を検出するために使用したプライマーセット。 これらのプライマーペアはすべて従来のPCRに使用され、最後に、テキサス州南部の沿岸湿地でメタン生成菌およびメタン栄養生物関連遺伝子を検出するために大胆なプライマーペアが設定されました。
| 遺伝子 | サンプル | ||||||||
| ロサノ・バンコ | レサカ・デル・ランチョ・ビエホ | ボカチカ | |||||||
| LB-1 | RV-1の | RV-2の | M1の | M2の | B1 の壁紙 | B2 の | MG1の | MG2の | |
| pmoA1の | - | + | + | - | - | - | - | - | - |
| pmoA2の | + | + | + | - | + | - | - | + | - |
| mmoXの | + | - | + | - | - | - | - | - | - |
| mcrAの | + | + | + | - | - | - | - | - | - |
表2:従来のPCRを使用した涼しい季節の3つの異なるタイプの水域の遺伝子の検出。 '+'、現在;'-'、欠席。略語:LB =ロサノバンコ、RV =レサカデルランチョビエホ、M =泥、B =バティス、MG =マングローブ。
補足ファイル1:mcrA、pmoA1、pmoA2、mmoX、および16S rRNA遺伝子のゲル電気泳動画像。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
沿岸湿地は、重要な温室効果ガスである大気中のメタンに大きく寄与していると認識されています40。湿地41,42,43におけるメタンフラックスとメタン生成菌に関する研究は行われてきたが、メタン栄養生物がさまざまな環境やさまざまな管理慣行の下で、特に水位が変動する湿地でどのように機能するかについてはほとんど知られていない44。さらに、心電DNA中のフミン酸のような阻害剤の広範な存在は、抽出および増幅プロセス45を複雑にし、潜在的に偽陰性の結果46につながる。この課題は、eDNAに作用するプライマーの効率が変動するため、さらに複雑になり、このような研究における体系的な検証の必要性が示唆されている47。したがって、この研究は、研究が進んでいないテキサス州南部の沿岸湿地におけるメタン循環を理解するための基本的な方法論を確立します。PCR技術の開発と検証に焦点を当てることにより、この研究は、これらのダイナミックな生態系における主要なメタン循環遺伝子の検出を前進させます。
この研究の重要な側面の1つは、微生物メタン循環関連遺伝子の視覚化であり、これは、さまざまな季節や塩分濃度勾配にわたるこれらの遺伝子の空間分布パターンを観察する上で重要な役割を果たします。このような視覚化は、単なる補助的なツールではありません。これは、メタン循環の可能性があることを示す重要なメタン生成微生物およびメタン栄養微生物の存在領域を特定するために不可欠であり、それによってこれらのプロセスに影響を与える環境条件の理解を深めます。
この研究では、cPCRおよびqPCRを使用して、pmoA1、pmoA2、mmoX、mcrAなどのメタン生成およびメタン栄養マーカー遺伝子を同定するための方法論を特定しました。mcrA遺伝子を標的とする4つのプライマーペアとpmoA1遺伝子を標的とする2つのペアを使用し、各セットから1ペアのみ、従来のPCRとリアルタイムPCRの両方でこれらの遺伝子を効果的に検出しました。以前の研究では、pmoA1を検出するために3つのプライマーペアが使用されていました。その中で、A189-A682プライマーはメタン栄養生物の多様性を検出できませんでした。それどころか、彼らは主にamoA遺伝子を増幅し、非特異的なPCR産物を産出した48。この研究では、使用したプライマーペアが、メタン栄養生物の集団が多い環境でのみpmoA1遺伝子の検出に有効であることがわかりました。さらに、その研究では、A189-mb661プライマーペアを使用してメタン栄養生物が最も豊富に得られ、これらのプライマーが淡水生態系に適していることを示しています48。したがって、これらのプライマーペアは、さらなる分析としてqPCRに使用されました。
mcrAに使用された4つのプライマーペアのうち、MLプライマーはすべての環境でメタン生成菌種を増幅することができました49。MEプライマーは増幅範囲が狭いです。彼らは、さまざまな種類の自然環境であらゆる種類のメタン生成菌種を検出することはできません。MCRプライマーは縮退性が高いため、PCRアニーリング温度に敏感です。この縮重により、それらは広範囲の標的配列に結合することができ、多くの場合、複数のミスマッチに対応できます。しかし、これはまた、アニーリング温度のわずかな変化がそれらの結合効率および特異性に大きく影響し、不十分な増幅につながり、その結果、メタン生成菌種49,50の偽陰性結果につながる可能性があることも示している。
一方、多様性の低いメタン生成菌コミュニティでは、PCRの最終段階で、PCR産物の高蓄積がテンプレートの再アニーリングを引き起こし、プライマーの結合を防ぎ、これも目的のバンドを検出できない49。興味深いことに、McrA 159F-McrA 345Rプライマーペアは、硝酸塩依存性の嫌気性メタン栄養生物 Candidatus M. nitroreducens archaea51を同定するために特別に設計されており、この研究ではこれらのプライマーペアを使用して嫌気性メタン栄養生物を検出できませんでした。しかし、メタンの嫌気性酸化(AOM)は、鉄(Fe)、マンガン(Mn)、硫酸塩(SO42-)52などの代替電子受容体の還元と結合することができ、この方法を使用してANMEを検出できない理由を説明している可能性があります。さらに、調査地域の特定の環境条件が原因である可能性があります。したがって、qPCRでは、MLプライマーを使用してメタン生成物質の存在量を検出し、コミュニティの多様性が低い条件下でも信頼性の高い増幅を提供しました49。
さらに、フミン酸や非標的種DNAなどのPCR阻害剤は、環境サンプル中に広く存在しており、PCR効率を低下させる可能性がある53。高濃度のDNAはcPCRによって遺伝子を検出できなかったため、PCR阻害剤54の効果を減らすために、cPCRを実行する前にすべてのDNAサンプルを希釈した。16S rRNA遺伝子は、細菌および古細菌の普遍的なマーカーとして、我々のPCR条件を検証し、すべてのサンプル55,56にわたってDNAの完全性を確認するための堅牢なベースラインを提供した。しかし、塩水域はPCR阻害剤の濃度が高いと認識されている46。さらに、塩分濃度は硫酸塩濃度と関連しているため、沿岸湿地のCH4排出量に間接的に影響を与えます。塩水湿地の塩分濃度が高いと、硫酸塩減少細菌とメタン生成菌との競合によりメタン生成が抑制される硫酸塩濃度の上昇と相関していますが、淡水湿地の硫酸塩濃度が低いと、メタン排出量が多くなります11,41。さらに、海水湿地と淡水湿地との間のCH4排出量の違いは、海との潮汐関係によっても影響を受けており57、BC州におけるcPCRによるメタン循環関連遺伝子の検出が失敗したことも説明できるかもしれない。この研究では、cPCRはLBおよびRVサンプル中のすべての標的遺伝子を正常に検出しましたが、BCサンプル中のこれらの遺伝子の存在を検出することはできず、pmoA2遺伝子が唯一の例外でした。さらに、qPCRはすべてのサンプルでmmoXを検出できましたが、cPCRはBCで検出できませんでした。このことは、qPCRがcPCRと比較してPCR阻害剤に対してより大きな回復力を示すことを示しており、これは検出メカニズムにおける感度の向上に起因する58。もう一つの理由は、qPCRはPCRサイクルの指数関数的な段階でPCR産物を特定するのに対し、cPCRはプラトー期でそれらを検出することです。この区別により、qPCRは、試薬が枯渇する進行した反応サイクル中に生成物の劣化に対する感受性を低下させることを可能にする47。
この研究では、テキサス州南部沿岸湿地でメタン循環関連遺伝子を同定するPCR技術を確立し、PCR阻害剤とプライマー効率の変動に関連する課題を克服することができました。 mcrA 遺伝子を標的とする4つのプライマーペアと pmoA1 遺伝子を標的とする2つのペアを使用し、各セットから1ペアのみ、従来のPCRとリアルタイムPCRの両方でこれらの遺伝子を効果的に検出しました。この研究では、 pmoA1のa189-mb6661、 pmoA2の206f-703b、 mmoXの536F-898R、 mcrAのMLなど、メタン循環関連遺伝子のプライマーペアのセットを結論付けています。このことは、テキサス州南部のものを例に挙げて、沿岸湿地におけるメタン循環関連遺伝子を検出するための適切なプライマー選択の重要性を示唆しています。さらに、この研究では、 mmoX は涼しい季節に最も豊富に存在し、 pmoA1 は暖かい季節に豊富であることが示されました。
したがって、この研究の結果は、メタン循環に関与する微生物プロセスの科学的理解の基礎を提供し、テキサス州南部の沿岸湿地の季節的および空間的変動にわたる環境要因の影響を強調しています。これらの知見に基づき、今後の研究では、水田や淡水湿地などの他の生態系でもこのアプローチをさらに検証し、堅牢性と一般化可能性を高めることを目指しています。さらに、これらの研究には、堆積物メタン濃度や間隙水硫化物などの地球化学的分析、メタゲノミクスやトランスクリプトミクスなどの分子技術も含まれており、これらの基礎に基づいてメタン循環ダイナミクスをより包括的に理解することができます。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
C-REAL会員の皆様には、フィールド観察やラボ分析にご協力いただき、誠にありがとうございます。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tubes | ThermoFisher Scientific | AB0620 | https://www.thermofisher.com/order/catalog/product/AB0620?SID=srch-srp-AB0620 |
| 0.5 mL PCR Tubes | Promega | E4941 | https://www.promega.com/products/biochemicals-and-labware/tips-and-accessories/0_5ml-pcr-tubes/?catNum=E4941 |
| 10 μL tips | ThermoFisher Scientific | 05-408-187 | Fisherbrand SureGrip Pipet Tip Racked or Reload System Tips Natural; 10μL; | Fisher Scientific |
| 15 mL centrifuge tube | ThermoFisher Scientific | 14-959-53A | https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/p-193301 |
| 200 μL tips | ThermoFisher Scientific | 05-408-190 | Fisherbrand SureGrip Pipet Tip Racked or Reload System Tips Natural; 200μL; | Fisher Scientific |
| 1000 μL tips | ThermoFisher Scientific | 02-707-402 | https://www.fishersci.com/shop/products/sureone-micropoint-pipette-tips-specific-standard-fit/02707402?gclid=Cj0KCQiAp NW6BhD5ARIsACmEb kUsQ9Lu0YIq5i4vWege 17qPdtxIYZyvmJH1cDo ARuwereO1V4GLz9UaA lDREALw_wcB&ef_id=C j0KCQiApNW6BhD5ARI sACmEbkUsQ9Lu0YIq5i 4vWege17qPdtxIYZyvmJ H1cDoARuwereO1V4GLz 9UaAlDREALw_wcB:G:s &ppc_id=PLA_goog_2175 7693617_171052169911_02 707402__715434303113_1555 377385658230343&ev_chn=sh op&s_kwcid=AL!4428!3!71543430 3113!!!g!2366517300713!&gad_source=1 |
| Applied Biosystem Power SYBR Green Master Mix | ThermoFisher Scientific | 4368577 | https://www.thermofisher.com/order/catalog/product/4368577 |
| ArcGIS Pro | esri | https://www.esri.com/en-us/arcgis/products/arcgis-pro/overview?srsltid=AfmBOopatJ4 JvHJfscHRcAaDx0Jz5_Jrl8l5 vYkkBvfOqE-uNSsMghN1 | |
| CFX Duet Real-Time PCR system | Bio-Rad | 12016265 | https://www.bio-rad.com/en-us/product/cfx-duet-real-time-pcr-system?ID=97722926-9ed9-16a4-1d83-c92f587e427a |
| Corning Lambda plus single channel pipettor volume 0.5-10 μL | Sigma-Aldrich | CLS4071-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4071 |
| Corning Lambda plus single channel pipettor volume 100-1000 μL | Sigma-Aldrich | CLS4075-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4075 |
| Corning Lambda plus single channel pipettor volume 20-200 μL | Sigma-Aldrich | CLS4074-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4074 |
| FastDNA spin kit for soil | MP Biomedical | 116560200-CF | https://www.mpbio.com/us/116560000-fastdna-spin-kit-for-soil-samp-cf?srsltid=AfmBOoqOxxGilzY3IHNIZR ajegGTr9MoX1oMZUh 3dcbJqe0UvvukY128 |
| Gene copy calculator | Science Primer | https://scienceprimer.com/copy-number-calculator-for-realtime-pcr . | |
| High speed benchtop centrifuge | ThermoFisher Scientific | 75004241 | https://newlifescientific.com/products/thermo-scientific-sorvall-st16-high-speed-benchtop-centrifuge-75004241?gad_source=1&gclid=Cj0KCQiApN W6BhD5ARIsACmEbkVC_-cCIN9j 20TvYq8iDsBlUR5cPK_1_wN OBEcjMdv-CYVoGCfeOLYaAv enEALw_wcB |
| High speed microcentrifuge | VWR | 75838-336 | https://us.vwr.com/store/product/20546590/null |
| Lysing Matrix E tube | glass bead/ceramic sphere-containing tube | ||
| Microcentrifuge tube | ThermoFisher Scientific | 02-681-320 | https://www.fishersci.com/shop/products/fisherbrand-low-retention-microcentrifuge-tubes-8/02681320?gclid=Cj0KCQiAp NW6BhD5ARIsACm EbkWbG4_o3oUiGk HJPU-_31-CuexDwQ fmWPnfyhBOf2BHXsy K3fFW1toaAgJbEALw_ wcB&ef_id=Cj0KCQiAp NW6BhD5ARIsACmEb kWbG4_o3oUiGkHJPU- _31-CuexDwQfmWPnfy hBOf2BHXsyK3fFW1toa AgJbEALw_wcB:G:s&ppc _id=PLA_goog_21757693 617_171052169911_0268 1320__715434303113_10 349826094968484711&ev _chn=shop&s_kwcid=AL!4 428!3!715434303113!!!g!23 66517300713!&gad_source=1 |
| PCR Master mix | Promega | M7502 | https://www.promega.com/products/pcr/taq-polymerase/master-mix-pcr/?catNum=M7502 |
| Quantiflour ONE dsDNA system | Promega | E4871 | https://www.promega.com/products/rna-analysis/dna-and-rna-quantitation/quantifluor-one-dsdna-system/?gad_source=1&gbraid=0AAAAAD _rg189yJTY3cxeVqMdu8RPx10 Ma&gclid=CjwKCAjwxNW2BhAk EiwA24Cm9FUgViPNyWq7UfZL VeeoroLAZ5JIP6w07RGK_4D0w oZgAqf-G1XTmxoCxm8QAvD_B wE&catNum=E4871 |
| Quantus Fluorometer | Promega | E6150 | https://www.promega.com/products/microplate-readers-fluorometers-luminometers/fluorometers/quantus-fluorometer/?catNum=E6150 |
| YSI Pro 2030 | YSI a xylem brand | 603174 | https://www.ysi.com/product/id-p2030/pro2030-kits |
参考文献
- Xu, T., et al. Wetlands of international importance: Status, threats, and future protection. Int J Environ Res Public Health. 16 (10), 1818 (2019).
- Corn, M. L. . Deepwater Horizon oil spill: coastal wetland and wildlife impacts and response. , (2010).
- Hendriks, I. E., Sintes, T., Bouma, T. J., Duarte, C. M. Experimental assessment and modeling evaluation of the effects of the seagrass Posidonia oceanica on flow and particle trapping. Marine Ecology Progress Series. 356, 163-173 (2008).
- Krause, S. J. E., Treude, T. Deciphering cryptic methane cycling: Coupling of methylotrophic methanogenesis and anaerobic oxidation of methane in hypersaline coastal wetland sediment. Geochimica et Cosmochimica Acta. 302, 160-174 (2021).
- Reddy, K. R., DeLaune, R. D., Inglett, P. W. . Biogeochemistry of Wetlands: Science and Applications. , (2022).
- La, W., et al. Sulfate concentrations affect sulfate reduction pathways and methane consumption in coastal wetlands. Water Research. 217, 118441 (2022).
- Derwent, R. G. Global warming potential (GWP) for methane: Monte Carlo analysis of the uncertainties in Global Tropospheric Model predictions. Atmosphere. 11 (5), 486 (2020).
- Potter, C., et al. Methane emissions from natural wetlands in the United States: Satellite-derived estimation based on ecosystem carbon cycling. Earth Interactions. 10 (22), 1-12 (2006).
- . Understanding global warming potentials Available from: https://www.epa.gov/ghgemissions/understanding-global-warming-potentials (2024)
- Wallenius, A. J., Dalcin Martins, P., Slomp, C. P., Jetten, M. S. M. Anthropogenic and environmental constraints on the microbial methane cycle in coastal sediments. Front Microbiol. 12, 631621 (2021).
- Qu, Y., et al. Salinity causes differences in stratigraphic methane sources and sinks. Environmental Science and Ecotechnology. 19, 100334 (2024).
- Vizza, C., West, W. E., Jones, S. E., Hart, J. A., Lamberti, G. A. Regulators of coastal wetland methane production and responses to simulated global change. Biogeosciences. 14 (2), 431-446 (2017).
- van Dijk, G., et al. Salinization lowers nutrient availability in formerly brackish freshwater wetlands; unexpected results from a long-term field experiment. Biogeochemistry. 143 (1), 67-83 (2019).
- Aronson, E., Allison, S., Helliker, B. R. Environmental impacts on the diversity of methane-cycling microbes and their resultant function. Front Microbiol. 4, 225 (2013).
- Reeburgh, W. S. Oceanic methane biogeochemistry. Chem Rev. 107 (2), 486-513 (2007).
- Thauer, R. K. Biochemistry of methanogenesis: a tribute to Marjory Stephenson. Marjory Stephenson Prize Lecture. Microbiology (Reading). 144 (Pt 9), 2377-2406 (1998).
- Thauer, R. K. Anaerobic oxidation of methane with sulfate: on the reversibility of the reactions that are catalyzed by enzymes also involved in methanogenesis from CO2. Curr Opin Microbiol. 14 (3), 292-299 (2011).
- Friedrich, M. W. Methyl-coenzyme M reductase genes: Unique functional markers for methanogenic and anaerobic methane-oxidizing Archaea. Methods in Enzymology. 397, 428-442 (2005).
- Reeburgh, W. S. Oceanic methane biogeochemistry. Chem Rev. 107 (2), 486-513 (2007).
- Rasigraf, O., Schmitt, J., Jetten, M. S. M., Lüke, C. Metagenomic potential for and diversity of N-cycle driving microorganisms in the Bothnian Sea sediment. Microbiologyopen. 6 (4), e00475 (2017).
- McDonald, I. R., Bodrossy, L., Chen, Y., Murrell, J. C. Molecular ecology techniques for the study of aerobic methanotrophs. Appl Environ Microbiol. 74 (5), 1305-1315 (2008).
- Tchawa Yimga, M., Dunfield, P. F., Ricke, P., Heyer, J., Liesack, W. Wide distribution of a novel pmoA-like gene copy among type II methanotrophs, and its expression in Methylocystis strain SC2. Appl Environ Microbiol. 69 (9), 5593-5602 (2003).
- Knief, C. Diversity and habitat preferences of cultivated and uncultivated aerobic methanotrophic bacteria evaluated based on pmoA as molecular marker. Front Microbiol. 6, 1346 (2015).
- Huang, I. -. S., et al. Preliminary assessment of microbial community structure of Wind-Tidal Flats in the Laguna Madre, Texas, USA. Biology. 9 (8), 183 (2020).
- Wilding, T. K., Brown, E., Collier, K. J. Identifying dissolved oxygen variability and stress in tidal freshwater streams of northern New Zealand. Environ Monit Assess. 184 (10), 6045-6060 (2012).
- Roy Chowdhury, T., Mitsch, W. J., Dick, R. P. Seasonal methanotrophy across a hydrological gradient in a freshwater wetland. Ecological Engineering. 72, 116-124 (2014).
- Sun, Q. -. Q., et al. Carbon dioxide and methane fluxes: Seasonal dynamics from inland riparian ecosystems, northeast China. Sci Total Environ. 465, 48-55 (2013).
- Lee, S., et al. Comparison and selection of conventional PCR primer sets for studies associated with nitrogen cycle microorganisms in surface soil. Appl Sci. 12 (20), 10314 (2022).
- Bae, K. -. S., et al. Development of diagnostic systems for wide range and highly sensitive detection of two waterborne hepatitis viruses from groundwater using the conventional reverse transcription nested PCR assay. J Virol Methods. 299, 114344 (2022).
- Lecusay, D. . Assessment and Monitoring of Deltaic Wetlands and Fluvial Systems: Refining and Validating a Multimetric Index of Resaca Ecosystem Health. , (2021).
- . FastDNA SPIN Kit for Soil (Cat No. 116560200) Available from: https://www.mpbio.com/media/productattachment/LS082019-EN-FastDNA-SPIN-Kit-for-Soil-116560200-Manual.pdf (2025)
- Luton, P. E., Wayne, J. M., Sharp, R. J., Riley, P. W. The mcrA gene as an alternative to 16S rRNA in the phylogenetic analysis of methanogen populations in landfill. Microbiology (Reading, England). 148 (Pt 11), 3521-3530 (2002).
- Changsoo, L., Jaai, K., Seung Gu, S., Seokhwan, H. Absolute and relative QPCR quantification of plasmid copy number in Escherichia coli. J Biotechnol. 123 (3), 273-280 (2006).
- Harms, G., et al. Real-time PCR quantification of nitrifying bacteria in a municipal wastewater treatment plant. Environ Sci Technol. 37 (2), 343-351 (2003).
- Holmes, A. J., Costello, A., Lidstrom, M. E., Murrell, J. C. Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related. FEMS Microbiol Lett. 132 (3), 203-208 (1995).
- Fuse, H., et al. Oxidation of trichloroethylene and dimethyl sulfide by a marine Methylomicrobium strain containing soluble methane monooxygenase. Biosci Biotechnol Biochem. 62 (10), 1925-1931 (1998).
- Springer, E., Sachs, M. S., Woese, C. R., Boone, D. R. Partial gene sequences for the A subunit of methyl-coenzyme M reductase (mcrI) as a phylogenetic tool for the family Methanosarcinaceae. Int J Syst Bacteriol. 45 (3), 554-559 (1995).
- Costello, A. M., Lidstrom, M. E. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments. Appl Environ Microbiol. 65 (11), 5066-5074 (1999).
- Flores, E. A. . Effects of Nutrient Enrichment on Mangrove and Saltmarsh Habitats. , (2022).
- Minjie, H., Jordi, S., Xianyu, Y., Josep, P., Chuan, T. Patterns and environmental drivers of greenhouse gas fluxes in the coastal wetlands of China: A systematic review and synthesis. Environ Res. 186, 109576 (2020).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Liu, D. Y., Ding, W. X., Jia, Z. J., Cai, Z. C. Relation between methanogenic archaea and methane production potential in selected natural wetland ecosystems across China. Biogeosciences. 8 (2), 329-338 (2011).
- Ke, Z., et al. Methane emissions and methanogenic community investigation from constructed wetlands in Chengdu City. Urban Climate. 39, 100956 (2021).
- Chowdhury, T. R., Dick, R. P. Ecology of aerobic methanotrophs in controlling methane fluxes from wetlands. Applied Soil Ecology. 65, 8-22 (2013).
- Maja, S., et al. Humic substances cause fluorescence inhibition in real-time polymerase chain reaction. Anal Biochem. 487, 30-37 (2015).
- Sanches, T. M., Schreier, A. D. Optimizing an eDNA protocol for estuarine environments: Balancing sensitivity, cost and time. PLOS ONE. 15 (5), e0233522 (2020).
- Xia, Z., et al. Conventional versus real-time quantitative PCR for rare species detection. Ecol Evol. 8 (23), 11799-11807 (2018).
- Bourne, D. G., McDonald, I. R., Murrell, J. C. Comparison of pmoA PCR primer sets as tools for investigating methanotroph diversity in three Danish soils. Appl Environ Microbiol. 67 (9), 3802-3809 (2001).
- Juottonen, H., Galand, P. E., Yrjala, K. Detection of methanogenic Archaea in peat: comparison of PCR primers targeting the mcrA gene. Res Microbiol. 157 (10), 914-921 (2006).
- Lueders, T., Friedrich, M. W. Evaluation of PCR amplification bias by terminal restriction fragment length polymorphism analysis of small-subunit rRNA and mcrA genes by using defined template mixtures of methanogenic pure cultures and soil DNA extracts. Appl Environ Microbiol. 69 (1), 320-326 (2003).
- Vaksmaa, A., Jetten, M. S., Ettwig, K. F., Luke, C. McrA primers for the detection and quantification of the anaerobic archaeal methanotroph 'Candidatus Methanoperedens nitroreducens'. Appl Microbiol Biotechnol. 101 (4), 1631-1641 (2017).
- Ren, G., et al. Electron acceptors for anaerobic oxidation of methane drive microbial community structure and diversity in mud volcanoes. Environ Microbiol. 20 (7), 2370-2385 (2018).
- Goldberg, C. S., et al. Critical considerations for the application of environmental DNA methods to detect aquatic species. Methods in Ecology and Evolution. 7 (11), 1299-1307 (2016).
- McKee, A. M., Spear, S. F., Pierson, T. W. The effect of dilution and the use of a post-extraction nucleic acid purification column on the accuracy, precision, and inhibition of environmental DNA samples. Biological Conservation. 183, 70-76 (2015).
- Gohl, D. M., et al. Systematic improvement of amplicon marker gene methods for increased accuracy in microbiome studies. Nat Biotechnol. 34 (9), 942-949 (2016).
- Ballarini, A., Segata, N., Huttenhower, C., Jousson, O. Simultaneous quantification of multiple bacteria by the BactoChip microarray designed to target species-specific marker genes. PLOS ONE. 8 (2), e55764 (2013).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: A review. Eur J Soil Biol. 37 (1), 25-50 (2001).
- Smith, C. J., Osborn, A. M. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiol Ecol. 67 (1), 6-20 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved