Method Article
تصور الديناميكيات الميكروبية لتدوير الميثان في الأراضي الرطبة الساحلية
In This Article
Summary
يكتشف البروتوكول جينات دورة الميثان الرئيسية في الأراضي الرطبة الساحلية في جنوب تكساس ويصور توزيعها المكاني لتعزيز فهم تنظيم الميثان وآثاره البيئية في هذه النظم البيئية الديناميكية.
Abstract
الأراضي الرطبة الساحلية هي أكبر مصدر حيوي للميثان ، حيث تقوم الميثانوجينات بتحويل المواد العضوية إلى غاز الميثان ويقوم الميثانو بأكسدة الميثان ، وبالتالي تلعب دورا مهما في تنظيم دورة الميثان. تؤثر الأراضي الرطبة في جنوب تكساس ، والتي تخضع لأحداث الطقس المتكررة ، وتقلب مستويات الملوحة ، والأنشطة البشرية المنشأ بسبب تغير المناخ ، على دورة غاز الميثان. على الرغم من الأهمية البيئية لهذه العمليات ، لا يزال تدوير الميثان في الأراضي الرطبة الساحلية في جنوب تكساس غير مستكشف بشكل كاف. لمعالجة هذه الفجوة ، قمنا بتطوير وتحسين طريقة للكشف عن الجينات المتعلقة بالميثانوجينات والميثانوتروف ، بما في ذلك mcrA كمؤشر حيوي للميثانوجينات و pmoA1 و pmoA2 و mmoX كمؤشرات حيوية للميثانوتروفات. بالإضافة إلى ذلك ، هدفت هذه الدراسة إلى تصور أنماط التوزيع المكاني والزماني لوفرة الميثانوجين والميثانوتروف باستخدام برنامج نظام المعلومات الجغرافية (GIS) ArcGIS Pro. قدم دمج هذه التقنيات الجزيئية مع التصور الجغرافي المكاني المتقدم رؤى مهمة حول التوزيع المكاني والزماني لمجتمعات الميثانوجين والميثانوتروف عبر الأراضي الرطبة في جنوب تكساس. وبالتالي ، فإن المنهجية الموضوعة في هذه الدراسة تقدم إطارا قويا لرسم خرائط الديناميكيات الميكروبية في الأراضي الرطبة ، وتعزيز فهمنا لدورة الميثان في ظل ظروف بيئية مختلفة ، ودعم دراسات التغيير البيئي والبيئي الأوسع.
Introduction
الأراضي الرطبة الساحلية هي أنظمة بيئية حيوية تساهم في تنظيم المناخ والحفاظ على التنوع البيولوجي وإدارة المياه من خلال عمليات مثل عزل الكربون والتبخر والنتح وانبعاثات الميثان (CH4)1. هذه النظم الإيكولوجية ، بما في ذلك المياه العذبة والأراضي الرطبة للمياه المالحة2 ، عالية الإنتاجية وتعمل كمناطق حرجة لامتصاص ثاني أكسيد الكربون (CO2) والتقاط المواد العضوية من البيئات الأرضية والبحرية3،4. تحفز التفاعلات الديناميكية داخل هذه الأراضي الرطبة إنتاج واستهلاك CH4 الميكروبي5 ، مما يجعلها واحدة من أكبر المصادر الطبيعية ل CH46. باعتباره ثاني أهم غازات الدفيئة ، فإن CH4 لديه إمكانية الاحتباس الحراري بحوالي 27-30 مرة أكبر من ثاني أكسيد الكربون24،7،8،9 ، مما يجعل دراسة انبعاثات CH4 من الأراضي الرطبة الساحلية ضرورية في عصر تغير المناخ. يتأثر انبعاث CH4 بعوامل بيئية مختلفة ، وخاصة الملوحة ، وتلعب دورا مهما في العمليات الميكروبية10. تساهم الأراضي الرطبة في المياه العذبة بشكل كبير في غاز الميثان في الغلاف الجوي بسبب انخفاض مستويات الكبريتات ، مما يسهل زيادة إنتاج CH4 الميكروبي ، بينما تميل الأراضي الرطبة للمياه المالحة عموما إلى إصدار أقل من CH4 بسبب ارتفاع تركيزات الكبريتات11،12،13.
يتم التحكم في انبعاثات CH4 من الأراضي الرطبة الساحلية بشكل عام بواسطة مجموعتين من الكائنات الحية الدقيقة ، تعرف باسم الميثانوجينات والميثانو14. تنتج الميثانوجينات CH4 في رواسب نقص الأكسجين عن طريق تكسير ركائز مثل الفورمات أو الأسيتات أو الهيدروجين أو المركبات الميثيلية من خلال عملية تعرف باسم تكوينالميثان 15. الإنزيم المهم في هذا المسار هو اختزال ميثيل إنزيم M (MCR) ، لأنه يحفز الخطوة النهائية والمحددة للمعدل من تكوين الميثان15،16،17. الجين mcrA ، الذي يشفر الوحدة الفرعية ألفا ل MCR ، هو علامة وظيفية يمكن العثور عليها في جميع العتائق الميثانية18. علاوة على ذلك ، في الأراضي الرطبة الساحلية ، تتشكل المنطقة الانتقالية للكبريتات والميثان (SMTZ) فوق المنطقة الميثانية ، حيث يتقارب الميثان الذي ينتشر لأعلى وتتحرك الكبريتات لأسفل وتستنفد19. داخل هذه المنطقة ، تقوم العتائق اللاهوائية بالتغذية الميثانية (ANME) بتأكسد الميثان إلى ثاني أكسيد الكربون باستخدام إنزيم MCR ، بينما تقلل البكتيريا المختزلة للكبريتات (SRB) من الكبريتات إلى كبريتيد. يتفوق SRB على الميثانوجينات للهيدروجين والأسيتات ، مما يحد من إنتاج الميثان حتى يتم استنفاد الكبريتات16،17.
في المقابل ، تؤكسد البكتيريا الميثانوغذية الهوائية CH4 في البيئات الهوائية20 ، باستخدام أشكال مختلفة من أحادي الأكسجين الميثان (MMO). وتشمل هذه أحادي الأكسجين الميثان الجسيمي (pMMO) ، وهو إنزيم يحتوي على النحاس مضمن في الغشاء داخل الهيولى ، وميثان أحادي الأكسجين القابل للذوبان (sMMO) ، وهو إنزيم يحتوي على الحديد موجود في السيتوبلازم. ومع ذلك ، بالنسبة ل pMMO ، هناك ثلاثة مشغلات جينية pmoCAB21. من بينها ، جين pmoA هو الأكثر تحفظا لجميع الميثانوتروف. هناك نوعان مختلفان من جينات المؤشرات الحيوية ل pmoA: pmoA1 و pmoA222. علاوة على ذلك ، من أجل فهم شامل للميثانوتروف ، يتم استخدام جين mmoX كأداة في البيولوجيا الجزيئية لتحديد الميثانوتروف المحتوية على sMMO23. يسلط هذا التمييز في مسارات التمثيل الغذائي والمتطلبات البيئية للميثانوجينات والميثانوتروف الهوائية الضوء على التفاعلات الميكروبية المعقدة التي تنظم دورة الميثان في النظم البيئية للأراضي الرطبة الساحلية.
تشهد الأراضي الرطبة في بوكا تشيكا (BC) ، وهي بيئة مياه مالحة منتجة في جنوب تكساس ، تأثيرات المد والجزر من خليج المكسيك (GOM) ، مما يؤدي إلى مستويات ملوحة سطحية متغيرة ، خاصة بسبب قربها من لاجونا مادري24 شديدة الملوحة. يتسبب هذا الإجراء المد والجزر ، بالتناوب بين المد والجزر المرتفع والمنخفض ، في تذبذب مستويات الأكسجين25 مما قد يغير نشاط الميثانوجين والميثانوتروف في الرواسب26. في المقابل ، تعتبر الأراضي الرطبة للمياه العذبة الساحلية نقطة ساخنة مهمة ل CH4 تدفقات27. تتمتع الأراضي الرطبة الساحلية للمياه العذبة في جنوب تكساس ، بما في ذلك Resaca Del Rancho Viejo (RV) و Lozano Banco (LB) ، البعيدة عن تأثيرات المد والجزر في GOM ، بإدارة هيدرولوجية متميزة. تشهد عربة سكن متنقلة تدفقات نبضية تكملها مياه النهر أثناء انخفاض مستويات المياه ، بينما يعمل LB كنظام تدفق غير متصل بدون مثل هذه المكملات. علاوة على ذلك ، يحافظ RV و LB على مستويات ملوحة أقل بسبب التصريف العالي للمياه العذبة التي يتم ضخها صناعيا وكونها بحيرة قوس الثور ، على التوالي. يمكن أن تؤثر العوامل البيئية المختلفة بشكل كبير على تدوير الميثان عبر الأراضي الرطبة الساحلية في جنوب تكساس. ومع ذلك ، لا يزال ركوب الميثان في الأراضي الرطبة الساحلية في جنوب تكساس منطقة لم يتم التحقيق فيها بدقة بعد.
يمثل تفاعل البوليميراز المتسلسل (PCR) و PCR في الوقت الفعلي (ويسمى أيضا تفاعل البوليميراز المتسلسل الكمي [qPCR]) تقنيات أساسية ومستخدمة على نطاق واسع لاكتشاف وقياس الوفرة النسبية لجينات معينة في العينات البيئية. تعمل هذه التقنيات على وجه التحديد على تضخيم المناطق المستهدفة من الحمض النووي للإشارة إلى وجود الجينات المرتبطة بركوب الدراجات CH4 وكميتها النسبية ، مما يوفر مؤشرات على دورة الميثان المحتملة. ومع ذلك ، فإن توافر وفعالية مجموعات التمهيدي PCR قد يكون محدودا بعوامل مثبطة مختلفة في الحمض النووي البيئي المستخرج ، والتي تتأثر بأنواع البيئات28،29. وبالتالي ، أنشأت هذه الدراسة بشكل أساسي طريقة تفاعل البوليميراز المتسلسل المثلى للكشف عن وجود الجينات المرتبطة بركوب الدراجات CH4 في الأراضي الرطبة الساحلية في جنوب تكساس (الشكل 1) ثم تصور وفرة نسبية كمية في هذه النظم البيئية. يمكن تطبيق نتائج هذه الدراسة على المناطق الساحلية الأخرى لتعزيز فهم دورة CH4 والديناميكيات الميكروبية في النظم البيئية الساحلية المتنوعة.
Protocol
1. جمع العينات
- اجمع عينات الرواسب باستخدام جهاز أخذ عينات أو مجرفة للرواسب.
ملاحظة: تم جمع العينات من محطتين من ثلاث أراضي رطبة ساحلية متميزة خلال المواسم الباردة (أكتوبر - فبراير ، متوسط درجة الحرارة 20 درجة مئوية) والدافئ (أبريل - يونيو ، متوسط درجة الحرارة 27 درجة مئوية) في عامي 2023 و 2024. تم استخدام جهاز أخذ عينات من الرواسب عند جمع العينات من الأراضي الرطبة للمياه العذبة الساحلية (الشكل 2) وتم استخدام مجرفة للأراضي الرطبة الساحلية المتأثرة بالمد والجزر. - قم بخفض جهاز أخذ العينات في المسطح المائي الضحل أولا واتركه يغرق في سطح الرواسب (داخل أعلى 50 سم) تحت وزنه ، مما يقلل من اضطراب بنية الرواسب كما هو موضح في الشكل 2.
- اسحبه من عمود الماء حيث كان العمق عادة من 60 سم إلى 215 سم30 ، وانقل عينات الرواسب إلى أكياس بسحاب ، وقم بتخزينها في صندوق ثلج على الفور.
ملاحظة: قم بتنظيف وغسل جهاز أخذ العينات بالماء منزوع الأيونات (DI) قبل المتابعة إلى المحطات التالية. - قم بتخزين جميع العينات عند -20 درجة مئوية على الفور في المختبر.
- في كل موقع أخذ عينات ، قم بقياس معلمات جودة المياه السطحية مثل الملوحة ودرجة الحرارة في الموقع باستخدام مقياس جودة المياه متعدد المعلمات.
ملاحظة: تم شطف المجسات بالماء منزوع الأيونات (DI water) بعد استخدامها في كل محطة.
2. استخراج الحمض النووي الجيني
- قم بإذابة العينات في درجة حرارة الغرفة قبل البدء في إجراء استخراج الحمض النووي الجيني.
- انقل ما يقرب من 500 مجم من عينات الرواسب إلى أنبوب سعة 15 مل وجهاز طرد مركزي بسعة 4,250 × جم لمدة 3 دقائق لإزالة كل المياه.
- استخرج الحمض النووي الجيني باستخدام مجموعة استخراج الحمض النووي للتربة باتباع بروتوكول الشركةالمصنعة 31 مع القليل من التعديل وتخزينه في -20 درجة مئوية على الفور.
ملاحظة: تم إجراء التغييرات لتقليل التكرار وسير العمل الفعال.- أضف ما يصل إلى 500 مجم من عينة التربة إلى أنبوب يحتوي على حبة زجاجية / كرة خزفية.
- أضف 978 ميكرولتر من محلول فوسفات الصوديوم إلى العينة في الأنبوب المحتوي على حبة / كرة.
- أضف 122 ميكرولتر من محلول التحلل العازل إلى العينة في الأنبوب المحتوي على الخرزة / الكرة لإذابة الملوثات الخارجية.
- قم بالتجانس باستخدام مجانس مطحنة الخرز بمستوى 5 أضعاف مستوى السرعة لمدة 20 ثانية وكرر 2x.
ملاحظة: تم استخدام الخالط مطحنة الخرزة في هذه الدراسة ، ولهذا السبب تم تعديل السرعة. - الطرد المركزي الخليط لمدة 10 دقائق عند 14,000 × جم.
- انقل المادة الطافية إلى أنبوب نظيف للطرد المركزي الدقيق سعة 2.0 مل.
- أضف 250 ميكرولتر من محلول ترسيب البروتين (PPS) لفصل الأحماض النووية الذائبة عن الحطام الخلوي ومصفوفة التحلل. امزج عن طريق قلب الأنبوب 10x.
- جهاز طرد مركزي عند 14,000 × جم لمدة 5 دقائق لترسيب الحبيبات وإزالة الحطام الخلوي ومصفوفة التحلل.
- انقل المادة الطافية إلى أنبوب نظيف للطرد المركزي الدقيق سعة 15 مل.
- أضف 1.0 مل من تعليق مصفوفة الربط إلى المادة الطافية في أنبوب 15 مل.
ملاحظة: قم بهز تعليق مصفوفة الربط لإعادة التعليق قبل إضافته. - اسمح بربط الحمض النووي بمصفوفة الربط عن طريق وضع الأنابيب على دوار لمدة 2 دقيقة.
- ضع جميع الأنابيب على رف واحتضانها لمدة 3 دقائق للسماح بتسوية مصفوفة الربط.
- بعد 3 دقائق ، تخلص من 750 ميكرولتر واخلط المادة الطافية المتبقية برفق مع الحبيبات باستخدام ماصة.
- انقل 750 ميكرولتر من الخليط إلى مرشح SPIN وجهاز طرد مركزي عند 14,000 × جم لمدة 1 دقيقة. أفرغ أنبوب الالتقاط وأعد استخدامه. كرري العملية مع الخليط المتبقي.
- أضف 500 ميكرولتر من محلول الغسيل المحضر (مع إضافة الكمية المناسبة من الإيثانول) لزيادة إذابة الشوائب. أعد تعليق الحبيبات برفق باستخدام قوة السائل من طرف الماصة.
- جهاز طرد مركزي عند 14,000 × جم لمدة 1 دقيقة لإزالة الشوائب. أفرغ أنبوب الالتقاط وأعد استخدامه.
- جهاز الطرد المركزي مرة أخرى عند 14,000 × جم لمدة دقيقتين دون إضافة أي شيء.
- استبدل أنبوب الالتقاط بأنبوب التقاط جديد ونظيف وجفف مرشح SPIN بالهواء لمدة 5 دقائق في درجة حرارة الغرفة.
- أضف 50 ميكرولتر من الماء الخالي من الحمض النووي (DES) وجهاز الطرد المركزي عند 14,000 × جم لمدة 1 دقيقة.
ملاحظة: في هذا البروتوكول ، تم استخدام 50 ميكرولتر من DES لشطف الحمض النووي لضمان الاسترداد والاستقرار الأمثل للحمض النووي البيئي المستخرج (eDNA).
3. قياس الحمض النووي
- أضف 1 ميكرولتر من الحمض النووي المستخرج مع 200 ميكرولتر من صبغة الفلورسنت في أنبوب 0.5 مل واخلطه جيدا عن طريق سحب العينات.
- لف الأنبوب على الفور بورق الألمنيوم حتى لا يتغلغل الضوء ويحتضن في درجة حرارة الغرفة لمدة 5 دقائق.
- قم بقياس تركيز الحمض النووي باستخدام مقياس الفلور في وضع تركيز الحمض النووي ONE باتباع بروتوكول الشركة المصنعة.
4. الكشف عن 16S rRNA و pmoA1 و pmoA2 و mmoX و mcrA بواسطة تفاعل البوليميراز المتسلسل التقليدي
- قبل تشغيل تفاعل البوليميراز المتسلسل التقليدي (cPCR)، قم بإذابة جميع العينات والكواشف في دلو ثلج.
- تمييع جميع عينات eDNA المستخرجة إلى 10 نانوغرام / ميكرولتر.
ملاحظة: ترد قائمة بالبادئات في الجدول 1. - قم بإعداد خليط تفاعل cPCR سعة 25 ميكرولتر لكل عينة ، بما في ذلك 12.5 ميكرولتر من 2x PCR Master mix ، و 0.5 ميكرولتر من الاشعال الأمامية والعكسية (10 ميكرومتر) (انظر الجدول 1 للحصول على قائمة التمهيدي) ، و 1 ميكرولتر من 10 نانوغرام / ميكرولتر eDNA ، و 10.5 ميكرولتر من الماء الخالي من النوكلياز.
ملاحظة: قم بإعداد المزيج الرئيسي بحجم كاف لعينة إضافية واحدة لتقليل أخطاء سحب العينات. - قم بإجراء تفاعل cPCR باتباع البروتوكول الذي يتكون من تمسخ أولي عند 95 درجة مئوية لمدة دقيقتين ، متبوعا ب 40 دورة من التمسخ عند 95 درجة مئوية لمدة 45 ثانية ، والتمديد عند 72 درجة مئوية لمدة 30 ثانية ، والتمديد النهائي عند 72 درجة مئوية لمدة 5 أمتار ، مع درجات حرارة تلدين متفاوتة لبادئات مختلفة (انظر الجدول 1 للحصول على درجات حرارة التلدين لبادئات مختلفة تستخدم لجينات مختلفة).
ملاحظة: بالنسبة لجين mcrA ، أظهرت بادئات ML النطاق المطلوب باستخدام معدل منحدر بطيء يبلغ 0.1 درجة مئوية / ثانية بين خطوات التلدين والتمديد للدورات الخمس الأولى32. - تصور منتجات cPCR في هلام الاغاروز الملطخ ببروميد الإيثيديوم (EtBr).
ملاحظة: استخدم جل الاغاروز 2.5٪ لسلم 50 نقطة أساس و 0.9٪ جل لسلم 1 كيلو بايت. استخدم 1x TAE buffer لجل الاغاروز 2.5٪ و 0.5x TAE المؤقت لجل الاغاروز 0.9٪.
5. الكشف عن pmoA1 و pmoA2 و mmoX و mcrA عن طريق تفاعل البوليميراز المتسلسل الكمي في الوقت الحقيقي
ملاحظة: لوحظت وفرة الجينات المستهدفة بالميثانوجين والميثانوفوروف مثل pmoA1 و pmoA2 و mmoX و mcrA بواسطة qPCR باستخدام نظام تفاعل البوليميراز المتسلسل في الوقت الفعلي.
- قم بإعداد المعايير لكل جين على حدة للحصول على المنحنى القياسي لكل جين.
- تضخيم الجين المستهدف باستخدام cPCR ، باستخدام العينات التي أنتجت ألمع نطاق أثناء الرحلان الكهربائي الهلامي لكل جين. اتبع الطريقة والبادئات الموضحة في القسم 4.
- قم بتنقية المنتجات المضخمة باستخدام مجموعة استخراج الهلام وقياس تركيز الحمض النووي باتباع الطريقة الموضحة في القسم 3 وتخزينها في -20 درجة مئوية.
ملاحظة: Aliquot المعايير المنقاة في أنابيب منفصلة لمزيد من الاستخدام. - احسب النسخ الجينية من تركيز الحمض النووي المقاس باستخدام موقع حساب رقم النسخ ل qPCR.
- قم بتخفيف رقم النسخة المحسوب للمعيار بالماء الخالي من النوكلياز لتحضير كل معيار ، يتراوح من 108 إلى 102 نسخة / ميكرولتر ، قبل تشغيل qPCR.
- قم بإعداد المنحنى القياسي باستخدام ثلاث نسخ مكررة لكل رقم نسخة، بما في ذلك عنصر تحكم سلبي (NTC، بدون قالب DNA).
ملاحظة: كانت قيمة R2 لكل منحنى قياسي أكبر من 0.99.
- قم بإعداد خليط تفاعل qPCR سعة 20 ميكرولتر لجميع العينات والمعايير و NTC. قم بإجراء تحليل qPCR بثلاث نسخ لجميع العينات.
- ضع جميع مكونات التفاعل ، بما في ذلك مزيج qPCR الرئيسي ، والبادئات ، والمياه الخالية من النوكلياز ، والمعايير ، والعينات ، على رف ثلج قبل البدء.
- قم بإعداد خليط تفاعل qPCR سعة 20 ميكرولتر لكل عينة ، وقياسي ، و NTC ، يحتوي على 10 ميكرولتر من مزيج SYBR Green الرئيسي ، و 0.5 ميكرولتر من كل 10 ميكرومتر بادئات أمامية وعكسية ، و 8 ميكرولتر من الماء الخالي من النوكلياز ، و 1 ميكرولتر من الحمض النووي القالب 10 نانوغرام / ميكرولتر ، أو الماء القياسي ، أو DI على التوالي.
ملاحظة: استخدم مجموعات التمهيدي الموضحة لتحقيق أفضل النتائج لجينات pmoA1 و mcrA في تفاعل البوليميراز المتسلسل التقليدي ل qPCR (انظر الجدول 1). لتحسين الدقة، قم بتشغيل كل عينة ثلاث نسخ. توفر الخطوات التالية طريقة فعالة لإعداد عينات ثلاثية النسخ بحجم إجمالي يبلغ 60 ميكرولتر لكل عينة.- قم بإعداد خليط التفاعل للجمع بين المزيج الرئيسي ، والبادئات الأمامية والعكسية للجين المحدد ، والماء الخالي من النوكلياز في أنبوب سعة 2 مل ، باستثناء الحمض النووي للقالب.
ملاحظة: قم بإعداد حجم خليط التفاعل مع مراعاة خطأ سحب العينات. على سبيل المثال، إذا كان هناك 24 عينة و8 معايير، فاحسب الحجم الإجمالي ل 33 تفاعلا بدلا من 32 تفاعلا لتقليل أخطاء سحب العينات. في هذه الحالة ، سيكون الحجم الإجمالي المطلوب للتفاعلات الثلاثية على النحو التالي: 990 ميكرولتر من المزيج الرئيسي (33 عينة × 3 مكررات × 10 ميكرولتر) ، 49.5 ميكرولتر من البادئات الأمامية (33 عينة × 3 مكررات × 0.5 ميكرولتر) ، 49.5 ميكرولتر من البادئات العكسية (33 عينة × 3 مكررات × 0.5 ميكرولتر) ، و 792 ميكرولتر من الماء الخالي من النوكلياز (33 عينة × 3 مكررات × 8 ميكرولتر). - تحضير أنابيب PCR حسب عدد العينات والمعايير.
- قم بتوزيع 57 ميكرولتر من خليط التفاعل المحضر في كل أنبوب تفاعل البوليميراز المتسلسل (PCR).
ملاحظة: لإجراء qPCR لكل عينة في ثلاث نسخ ، قم بإعداد حجم خليط تفاعل إجمالي يبلغ 57 ميكرولتر لكل عينة (باستثناء قالب الحمض النووي أو المعيار أو الماء). سيتم تقسيم هذا الحجم بالتساوي إلى ثلاثة آبار لعينة واحدة ، مع تخصيص 19 ميكرولتر لكل بئر. - أضف 3 ميكرولتر من قالب الحمض النووي أو الماء القياسي أو الخالي من النوكلياز إلى كل أنبوب واخلطه عن طريق النقر برفق على قاع الأنبوب.
ملاحظة: سيكون الحجم الإجمالي لخليط التفاعل المحضر لعينة واحدة 60 ميكرولتر الآن في كل أنبوب.
- قم بإعداد خليط التفاعل للجمع بين المزيج الرئيسي ، والبادئات الأمامية والعكسية للجين المحدد ، والماء الخالي من النوكلياز في أنبوب سعة 2 مل ، باستثناء الحمض النووي للقالب.
- Aliquot 20 ميكرولتر من خليط التفاعل المحضر من كل أنبوب في الآبار المخصصة للوحة qPCR 96 بئرا. أغلق لوحة PCR بغشاء مانع للتسرب PCR لاصق باستخدام قضيب.
- قم بالطرد المركزي للوحة محكمة الغلق عند 1,000 × جم لمدة 1 دقيقة لضمان الخلط المناسب للتخلص من أي فقاعات داخل الآبار.
- ضع لوحة PCR في جهاز التدوير الحراري. قم بتشغيل جهاز qPCR ثم افتح البرنامج ذي الصلة لإعداد البروتوكول.
- قم بإعداد البروتوكول وفقا لإرشادات المزيج الرئيسي qPCR. استخدم البروتوكول التالي: 95 درجة مئوية لمدة 10 دقائق ، متبوعة ب 95 درجة مئوية لمدة 15 ثانية ، وخطوة تمديد عند 72 درجة مئوية لمدة 30 ثانية. قم بتنفيذ خطوة التلدين عند درجة حرارة التلدين المحددة للبادئات ذات الصلة في الجدول 1 لمدة 45 ثانية. قم بإجراء جميع عمليات تشغيل qPCR لمدة 35 دورة.
- قم بإعداد لوحة qPCR ذات 96 بئرا مع المعايير و NTCs في نفس تكوين اللوحة المحتوية على العينة.
- استخدم طريقة المنحنى القياسي للقياس الكمي المطلق لتحديد كمية المنتج المضخم ورقم نسخة الجينات في كلعينة 33.
6. تصور جينات دورة الميثان في خريطة الأراضي الرطبة الساحلية في جنوب تكساس
- افتح برنامج نظام المعلومات الجغرافية (GIS) ArcGIS Pro واحفظ ملف المشروع باسم منطقة الدراسة في المجلد المحدد على الكمبيوتر.
- انقر فوق الخريطة في أعلى اليسار | خريطة الأساس وحدد التضاريس مع التسميات كخريطة الأساس.
- انقر فوق تحديد موقع | ابحث وعندما يفتح شريط البحث ، حدد موقع منطقة الدراسة عن طريق كتابة اسم المنطقة ؛ ستظهر المنطقة.
- ارسم المنطقة المحددة باستخدام الإسناد الجغرافي.
- انقر فوق عرض | جزء الكتالوج من الطبقة العليا.
- انقر نقرا مزدوجا فوق مجلد من الكتالوج | اسم الملف.
- انقر بزر الماوس الأيمن على ملف قاعدة البيانات الجغرافية (.gdb) ثم انقر فوق جديد | ستظهر فئة الميزة وإنشاء فئة الميزة .
- اكتب مربع الاسم والاسم المستعار وانقر فوق إنهاء في الأسفل.
- انقر فوق عرض | المحتويات. سيظهر اسم الاسم المستعار في جزء المحتويات.
- انقر فوق تحرير من الطبقة العليا | إنشاء. سيتم فتح جزء إنشاء الميزات . انقر نقرا مزدوجا فوق الاسم المستعار في جزء إنشاء الميزات ، وستظهر خيارات تكوين ملاحظات الأداة .
- حدد خطوط، ثم ارسم خطوطا على الخريطة لإنشاء حدود خارجية لمنطقة الدراسة. انقر نقرا مزدوجا على الخريطة عند الانتهاء.
- تصغير برنامج GIS، ثم افتح جدول بيانات. اكتب اسم العينة في العمود الأول، وأدخل خط العرض في العمود الثاني، وخط الطول في العمود الثالث. استخدم الأعمدة الأربعة التالية لبيانات qPCR ل pmoA1 و pmoA2 و mmoX و mcrA.
- احفظ الملف بتنسيق CSV في أي مجلد محدد للكمبيوتر.
- افتح برنامج نظم المعلومات الجغرافية مرة أخرى وانقر فوق إضافة بيانات | بيانات نقطة XY.
- حدد ملف CSV من المجلد الموجود على الكمبيوتر في المربع جدول الإدخال . أعد تسمية اسم الملف في فئة معالم الإخراج، ثم انقر فوق تشغيل لعرض نقاط أخذ العينات على الخريطة.
- انقر فوق شريط البحث في الجزء العلوي وابحث في Kriging.
- حدد ملف محطة أخذ العينات ثم حدد pmoA1.
- انقر فوق البيئة | حدد محطة أخذ العينات في الطبقة والقناع | انقر فوق تشغيل.
- اتبع البروتوكولات المذكورة في الخطوات 6.9 و 6.10 و 6.11 لإنشاء Kriging ل pmoA2 و mmoX و mcrA لجميع مناطق الدراسة.
- إنشاء تخطيط للخريطة.
- انقر فوق إدراج من الطبقة العليا | تخطيط جديد، وحدد ANSI - أفقي.
- انقر فوق Map Frame ، وحدد الخريطة باستخدام Kriging ، وضع جميع الخرائط في التخطيط عن طريق رسم مستطيل. سيؤدي ذلك إلى جعل الخريطة مرئية في التخطيط.
- حدد السهم الشمالي وضعه في التخطيط للإشارة إلى الاتجاه الشمالي.
- حدد شريط المقياس لعرض مقياس المنطقة على الخريطة.
- انقر فوق وسيلة الإيضاح لعرض وسائل الإيضاح ، ثم ضعها في التخطيط.
- انقر فوق الشبكة وحدد أيا من خيارات graticule الأسود. سيؤدي هذا إلى إنشاء الشبكة بخطوط الطول والعرض وعرضها في جزء المحتويات مع التسمية Black Horizontal Label Graticule.
- انقر نقرا مزدوجا فوق Black Horizontal Label Graticule ، ثم حدد المكونات. انقر فوق Ticks 1 و Grid ، وقم بإزالة هذه المكونات بالنقر فوق علامة التقاطع على يمينها.
- انقر فوق مشاركة من الطبقة العلوية ، ثم انقر فوق تصدير التخطيط. حدد نوع الملف كPDF، واحفظ الملف على الكمبيوتر باستخدام مربع الاسم، واضبط الدقة الرأسية على 500 نقطة في البوصة، وانقر فوق تصدير لإنشاء ملف PDF للخريطة.
النتائج
لفهم توزيع ووفرة الجينات المرتبطة بركوب الدراجات CH4 (mcrA و pmoA1 و pmoA2 و mmoX) في الأراضي الرطبة الساحلية في جنوب تكساس ، تم تحليل الحمض النووي الإلكتروني المستخرج من كل عينة بواسطة cPCR و qPCR. تم اختيار بادئات عالمية لكل مؤشر حيوي لتشغيل cPCR من الدراسات السابقة (الجدول 1) 22،34،35،36،37 ، وتم إجراء تعديلات لتحسين درجات حرارة التلدين وتركيزاته بناء على خصائص العينة والظروف البيئية. على سبيل المثال ، لم يتم تضخيم 16S rRNA و pmoA1 و pmoA2 باستخدام درجة حرارة التلدين القياسية لأن معظمها تم تضخيمه أقل بكثير من درجة حرارة التلدين القياسية (البيانات غير معروضة). علاوة على ذلك ، أثناء عملية cPCR ، أظهر تركيز 10 نانوغرام / ميكرولتر من الحمض النووي نطاقا مميزا لجينات pmoA1 و pmoA2 و mmoX ، بينما أظهر استخدام 5 نانوغرام / ميكرولتر من الحمض النووي للقالب نطاقا أكثر إشراقا لجين mcrA (الملف التكميلي 1-الشكل التكميلي S1).
كشف تحليل cPCR عن التباين المكاني في الكشف عن الجينات عبر ثلاثة أنواع من الأراضي الرطبة الساحلية في جنوب تكساس. كما هو موضح في الجدول 2 ، تم اكتشاف جينات mcrA في جميع العينات من LB و RV ، وهي أراضي رطبة ساحلية للمياه العذبة. ومع ذلك ، لم يتمكن cPCR من اكتشاف أي جين mcrA في الرواسب التي تم أخذ عينات منها في الأراضي الرطبة للمياه المالحة ، مما يشير إلى وجود صلة محتملة بين الملوحة وتوزيع الميثانوجين (الملف التكميلي 1 - الشكل التكميلي S2). للكشف عن mcrA ، تم استخدام أربعة أزواج أولية في هذه الدراسة ، بما في ذلك MLF-MLR و MCRf-MCRr و ME1F-ME2R و McrA 159F-McrA 345R (الجدول 1). من بينها ، تمكنت أزواج ML التمهيدي فقط من اكتشاف مجتمع الميثانوجين في الأراضي الرطبة في جنوب تكساس (الملف التكميلي 1-الشكل التكميلي S2 ، الشكل التكميلي S3 ، والشكل التكميلي S4). في المقابل ، بالنسبة للميثانوتروف الهوائية ، تم اكتشاف جين pmoA1 في جميع عينات RV ولكنه كان غائبا في عينات LB و BC (الملف التكميلي 1 - الشكل التكميلي S5). لتحديد pmoA1 ، تم استخدام A189 كأساس أمامي و A682 و mb661 كبادئات عكسية ، حيث يمكن لأزواج التمهيدي A189-A682 أيضا اكتشاف amoA35،38. ومع ذلك ، كان هذا الزوج التمهيدي قادرا على اكتشاف وجود الجينات في cPCR في هذه الدراسة حيث أظهرت صور الهلام نطاقا باهتا جدا ، مما يشير إلى انخفاض وفرة الجين pmoA1. تم تصميم برايمر عكسي آخر mb661 لتحديد جين pmoA1 على وجه التحديد باستخدام A189 باعتباره التمهيدي الأمامي38. عندما تم استخدام mb661 كأساس عكسي ، أظهر cPCR نطاقا أكثر إشراقا (الملف التكميلي 1-الشكل التكميلي S6) ، والذي تم استخدامه لاحقا في qPCR. ومن المثير للاهتمام ، أن pmoA2 تم اكتشاف الجين في عينتين من BC وعينة LB واحدة ولكنه كان غائبا في عينة RV واحدة (الملف التكميلي 1-الشكل التكميلي S7). وجدت دراسة سابقة أن درجة حرارة التلدين هي 66 درجة مئوية و 60 درجة مئوية ل pmoA2 ، حيث لوحظ عند 60 درجة مئوية مضخمين مختلفين الحجم ، 245 و 438 نقطة أساس ، بينما عند 66 درجة مئوية ، يمكن للبادئات 206f-703b تضخيم pmoA2 فقط بحجم منتج438 نقطة أساس 22. ومع ذلك ، في هذه الدراسة ، كان التضخيم ناجحا عند درجة حرارة تلدين تبلغ 60 درجة مئوية ، مما أدى إلى إنتاج نطاق بالحجم المتوقع (438 نقطة أساس) في مواقع LB و BC (الملف التكميلي 1 - الشكل التكميلي S7). بالإضافة إلى ذلك ، تم اكتشاف جين mmoX في عينة LB ولكنه كان غائبا في عينة RV واحدة (الملف التكميلي 1-الشكل التكميلي S8) وكان غائبا تماما في عينات BC. كانت أزواج التمهيدي المستخدمة في mmoX مناسبة أيضا لدراسة الأراضي الرطبة في جنوب تكساس في هذه الدراسة. أنتجت درجة حرارة التلدين البالغة 55 درجة مئوية36 نطاقا ساطعا ل mmoX في cPCR (الملف التكميلي 1 - الشكل التكميلي S8). للتحقق من سلامة العينة ، تم استخدام 16S rRNA كعنصر تحكم إيجابي مع تضخيم ناجح ل 16S rRNA في جميع العينات أثناء cPCR ، مما يشير إلى أن العينات لم تكن ملوثة (الملف التكميلي 1 - الشكل التكميلي S9).
لتقييم التغيرات الزمانية والمكانية في وفرة الجينات ، تم إجراء تحليل qPCR على جميع الجينات المستهدفة باستخدام مجموعات أولية محسنة تم تحديدها في cPCR. تم إجراء qPCR لجينات pmoA2 و mmoX بنفس البادئات المستخدمة في cPCR. ومع ذلك ، بالنسبة لجين pmoA1 ، تم استخدام زوج التمهيدي A189-mb661 ، وبالنسبة لجين mcrA ، تم اختيار زوج التمهيدي MLF-MLR ، حيث أنتج كلاهما نتائج جيدة في cPCR. كما تم النظر في الاختلافات الموسمية وتباين الملوحة عبر الأراضي الرطبة في جنوب تكساس ، حيث يمكن أن تؤثر على ديناميكيات المجتمع الميكروبي. كما هو موضح في الشكل 3 والشكل 4 ، كان هناك اختلاف في وفرة جينات الميثانوجينات والميثانوتروف بين فترتي أخذ عينات مختلفتين. وفي حين لم يكن هناك تباين موسمي في الملوحة في الأراضي الرطبة الساحلية للمياه العذبة، لوحظ اختلاف موسمي في الملوحة في الأراضي الرطبة الساحليةللمياه المالحة 39، وهو ما يمكن أن يفسر التباين في وفرة الميثانوجين والميثانوتروفو. يوضح الشكل 3 أنه خلال الموسم البارد ، كان mmoX وفيرا للغاية في جميع هذه الأراضي الرطبة بأعلى وفرة تبلغ 1.46 × 104 نسخ / ميكرولتر. كانت هناك نسبة صغيرة من pmoA2 في محطة واحدة من LB و RV و BC. ومع ذلك ، لم يتمكن qPCR من اكتشاف pmoA1 و mcrA بسبب الوفرة المنخفضة خلال الموسم البارد. في المقابل ، كان pmoA1 وفيرا في الغالب في الموسم الدافئ مع أعلى وفرة تبلغ 2.44 × 103 نسخ / ميكرولتر (الشكل 4). كما تم الكشف عن mmoX و mcrA في عينات الرواسب السطحية ل LB (ضمن أعلى 50 سم) ، مما يدل على وفرة قصوى تبلغ 1.92 × 102 نسخة / ميكرولتر و 2.04 × 102 نسخة / ميكرولتر ، على التوالي ، على الرغم من وفرة منخفضة نسبيا خلال الموسم الدافئ. ومن المثير للاهتمام ، أنه خلال الموسم الدافئ ، لم يتم اكتشاف pmoA2 على الإطلاق ، ولم يتم اكتشاف أي من الجينات المستهدفة في عينات BC ، ومن المحتمل أن تكون متأثرة بالعوامل البيئية الفريدة لهذه الأراضي الرطبة ذات المياه المالحة39 خلال الموسم الدافئ في جنوب تكساس.
توضح هذه الدراسة اختلافات مكانية وموسمية مميزة في توزيع الجينات المرتبطة بركوب الدراجات CH4 عبر الأراضي الرطبة الساحلية. على وجه التحديد ، تم اكتشاف جينات mcrA فقط في عينة LB للمياه العذبة ، مما يشير إلى تفضيل الموائل. كانت جينات mmoX و pmoA2 موجودة في جميع العينات في المواسم الباردة ، بينما ظهرت pmoA1 في بيئات المياه العذبة خلال المواسم الدافئة. تسلط هذه النتائج الضوء على تأثير كل من الظروف البيئية والتحولات الموسمية على الأنشطة الميكروبية المرتبطة بركوب الدراجات CH4 . أدى التصور المعزز باستخدام استيفاء kriging ، كما هو موضح في الشكل 3 والشكل 4 ، إلى تعزيز فهمنا للأنشطة الميكروبية المتعلقة بركوب الدراجات CH4 في النظم البيئية للأراضي الرطبة الساحلية.
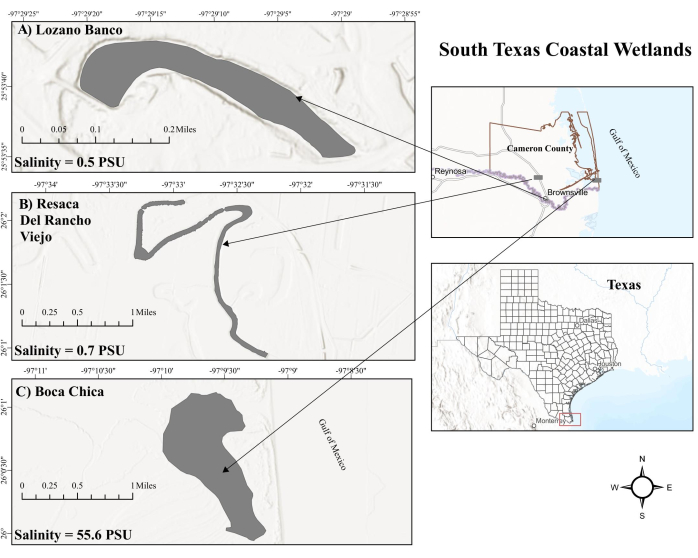
الشكل 1: خريطة الأراضي الرطبة الساحلية في جنوب تكساس. (أ) لوزانو بانكو. LB هي أرض رطبة ساحلية للمياه العذبة. (ب) ريساكا ديل رانشو فيجو. RV هي أيضا أرض رطبة ساحلية للمياه العذبة. (ج) الأراضي الرطبة في بوكا تشيكا. BC هي أرض رطبة ساحلية شديدة الملوحة متأثرة بالمد والجزر. الاختصارات: LB = Lozano Banco; عربة سكن متنقلة = Resaca del Rancho Viejo ؛ قبل الميلاد = بوكا تشيكا. PSU = وحدات الملوحة العملية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
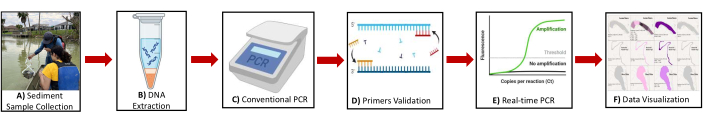
الشكل 2: رسم تخطيطي يوضح نظرة عامة على البروتوكول. يتضمن التوضيح للخطوات الرئيسية (أ) جمع عينات الرواسب (ب) استخراج الحمض النووي (ج) تفاعل البوليميراز المتسلسل التقليدي (د) التحقق من صحة التمهيدي (ه) تفاعل البوليميراز المتسلسل في الوقت الفعلي (F) تصور البيانات لتحديد جينات المؤشرات الحيوية للميثانوجين والميثانوتروف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
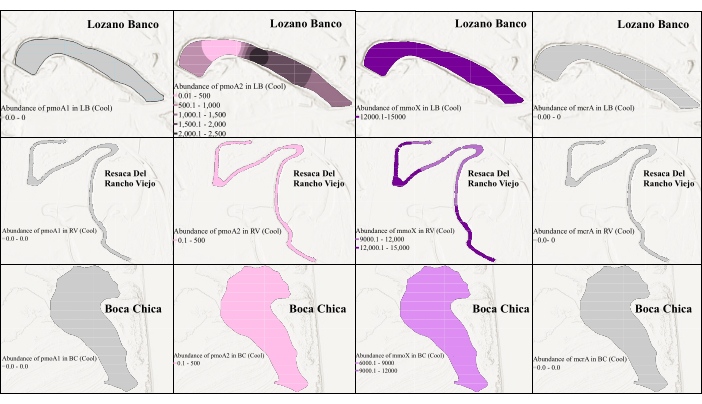
الشكل 3: التوزيع المكاني لجينات الميثانوجين والميثانوتروف الحيوية في الموسم البارد. يوضح الشكل وفرة mmoX خلال الموسم البارد. هنا ، يشير اللون الرمادي إلى أن qPCR لم يتمكن من اكتشاف الجين بسبب الوفرة المنخفضة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التوزيع المكاني لجينات المؤشرات الحيوية للميثانوجين والميثانوتروف في الموسم الدافئ. هنا ، يمثل اللون الرمادي أن qPCR لم يتمكن من اكتشاف الجين بسبب وفرته المنخفضة. يوضح الشكل وفرة pmoA1 خلال الموسم الدافئ في Lozano Banco و Resaca Del Rancho Viejo ، بينما لم يتم اكتشاف وفرة في بوكا تشيكا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم التمهيدي | الجين | درجة حرارة التلدين (درجة مئوية) في هذه الدراسة | طول المنتج (bp) | التسلسل (5'-3') | مرجع | |
| 1055 فهرنهايت | 16S rRNA | 55 | 337 | ATGGCTGTCGTCAGCT | (هارمز وآخرون ، 2003) | |
| 1392 ص | ACGGGCGGTGTGTAC | |||||
| أ 189 إف | pmoA1 | 55 | 525 | GGNGACTGGGACTTCTGG | (هولمز وآخرون ، 1995) | |
| أ 682 آر | GAASGCNGAGAAGAASGC | |||||
| أ 189 إف | 56 | 470 | GGNGACTGGGACTTCTGG | (كوستيلو وليدستروم ، 1999) | ||
| mb661R | CCG GMG CAA CGT CYT TACC | |||||
| 206 فهرنهايت | pmoA2 | 60 | 438 | GGNGACTGGGACTTCTG GATCGACTTCAAGGATCG | (تشاوا ييمغا وآخرون ، 2003) | |
| 703 ب | GAASGCNGAGAAGAASGC GGCGACCGGAACGACGGT | |||||
| 536 فهرنهايت | mmoX | 55 | 362 | CGCTGTGGAAGGGCATGAAGCG | (فيوز وآخرون ، 1998) | |
| 898 ص | GCTCGACCTTGAACTTGGAGCC | |||||
| MCRf | مكرأ | 46 | ~490 | تايجايكاراثجيت | (سبرينغر وآخرون ، 1995) | |
| MCRr | ACRTTCATNGCRTARTT | |||||
| ME1F | 50 | 763 | GCMATGCARATHGGWATGTC | (هالز وآخرون ، 1996) | ||
| ME2R | TCATKGCRTAGTTDGGRTAGT | |||||
| MLF | 55 | ~ 470 | GGTGGTGTMGGATTCA CACARTAYGCWACAGC | (لوتون وآخرون ، 2002) | ||
| MLR | TTCATTGCRTAGTTWGGRTAGTT | |||||
| ماك آر إيه 159 فهرنهايت | 62 | 186 | AAAGTGCGGAGCAGCAATCACC | (Vaksmaa et al. ، 2017) | ||
| ماكريا 345 آر | TCGTCCCATTCCTGCTGCATTGC | |||||
الجدول 1: مجموعات التمهيدي المستخدمة في هذه الدراسة للكشف عن الجينات الوظيفية المتعلقة بدورة الميثان. تم استخدام كل هذه الأزواج التمهيدية في تفاعل البوليميراز المتسلسل التقليدي ، وأخيرا ، تم إعداد الأزواج الجريئة للكشف عن الجينات المرتبطة بالميثانوجين والميثانوتروف في الأراضي الرطبة الساحلية في جنوب تكساس.
| الجين | العينات | ||||||||
| لوزانو بانكو | ريساكا ديل رانشو فيجو | بوكا تشيكا | |||||||
| رطل -1 | RV-1 | RV-2 | م1 | م 2 | ب 1 | ب 2 | إم جي 1 | إم جي 2 | |
| pmoA1 | - | + | + | - | - | - | - | - | - |
| pmoA2 | + | + | + | - | + | - | - | + | - |
| mmoX | + | - | + | - | - | - | - | - | - |
| مكرأ | + | + | + | - | - | - | - | - | - |
الجدول 2: الكشف عن الجينات في ثلاثة أنواع مختلفة من المسطحات المائية في الموسم البارد باستخدام تفاعل البوليميراز المتسلسل التقليدي. '+' ، الحاضر ؛ "-" ، غائب. الاختصارات: LB = Lozano Banco ، RV = Resaca del Rancho Viejo ، M = طين ، B = باتيس ، MG = مانغروف.
الملف التكميلي 1: صور الرحلان الكهربائي للهلام لجينات mcrA و pmoA1 و pmoA2 و mmoX و 16S rRNA. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يتم التعرف على الأراضي الرطبة الساحلية كمساهمين رئيسيين في غاز الميثان في الغلاف الجوي ، وهو أحد غاز الدفيئة المهم40. على الرغم من وجود دراسات حول تدفق الميثان والميثانوجينات في الأراضي الرطبة41،42،43 ، إلا أنه لا يعرف سوى القليل عن كيفية عمل الميثانوتروف عبر بيئات مختلفة أو في ظل ممارسات إدارية مختلفة ، خاصة في الأراضي الرطبة ذات مستويات المياه المتقلبة44. علاوة على ذلك ، فإن الوجود الواسع النطاق للمثبطات مثل الأحماض الدبالية في الحمض النووي الإلكتروني يعقد عمليات الاستخراج والتضخيم45 ، مما قد يؤدي إلى نتائج سلبيةخاطئة 46. يزداد هذا التحدي تعقيدا بسبب الكفاءة المتغيرة للبادئات التي تعمل على الحمض النووي الإلكتروني ، مما يشير إلى الحاجة إلى التحقق المنهجي في مثل هذه الدراسات47. وبالتالي ، فإن هذا البحث يؤسس منهجية تأسيسية لفهم دورة الميثان في الأراضي الرطبة الساحلية في جنوب تكساس التي لم تتم دراستها جيدا. من خلال التركيز على تطوير تقنيات تفاعل البوليميراز المتسلسل والتحقق من صحتها ، تعمل هذه الدراسة على تطوير اكتشاف جينات دورة الميثان الرئيسية في هذه النظم البيئية الديناميكية.
أحد الجوانب الحاسمة لهذا البحث هو تصور الجينات المرتبطة بدورة الميثان الميكروبية ، والتي تلعب دورا مهما في مراقبة أنماط التوزيع المكاني لهذه الجينات عبر المواسم المختلفة وتدرجات الملوحة. مثل هذا التصور ليس مجرد أداة تكميلية. من الضروري تحديد مناطق وجود الميكروبات الميثانولوجية والميثانية الكبيرة مما يشير إلى أنه يمكن أن يكون هناك دورة محتملة للميثان ، وبالتالي تعزيز فهمنا للظروف البيئية التي تؤثر على هذه العمليات.
في هذه الدراسة ، تم تحديد المنهجية لتحديد جينات علامات الميثانوجين والميثانوتروف مثل pmoA1 و pmoA2 و mmoX و mcrA باستخدام cPCR و qPCR. تم استخدام أربعة أزواج أولية تستهدف جين mcrA وزوجين يستهدفان جين pmoA1 ، واكتشف زوج واحد فقط من كل مجموعة هذه الجينات بشكل فعال في كل من تفاعل البوليميراز المتسلسل التقليدي وفي الوقت الفعلي. استخدمت دراسة سابقة ثلاثة أزواج أولية للكشف عن pmoA1. من بينها ، لم تستطع بادئات A189-A682 اكتشاف تنوع الميثانوتروف. بدلا من ذلك ، قاموا في الغالب بتضخيم جين amoA وأنتجوا منتجات PCR غير محددة48. وجدت تلك الدراسة أن زوج التمهيدي المستخدم كان فعالا في الكشف عن جين pmoA1 فقط في البيئات ذات العدد الكبير من الميثانوتروف. علاوة على ذلك ، تم الحصول على أعلى وفرة من الميثانوتروف باستخدام أزواج التمهيدي A189-mb661 في تلك الدراسة ، مما يشير إلى أن هذه البادئات مناسبة للنظم البيئية للمياه العذبة48. وبالتالي ، تم استخدام أزواج التمهيدي هذه ل qPCR لمزيد من التحليل.
من بين أزواج التمهيدي الأربعة المستخدمة في mcrA ، تمكنت بادئات ML من تضخيم أنواع الميثانوجين في جميع البيئات49. بادئات ME لها نطاق تضخيم ضيق. لا يمكنهم اكتشاف جميع أنواع أنواع الميثانوجين في أنواع مختلفة من البيئات الطبيعية. تتميز بادئات MCR بمستوى عال من الانحطاط ، مما يجعلها حساسة لدرجة حرارة التلدين PCR. يسمح لهم هذا الانحطاط بالارتباط بمجموعة واسعة من التسلسلات المستهدفة ، وغالبا ما يستوعب حالات عدم التطابق المتعددة. ومع ذلك ، يشير هذا أيضا إلى أن التغيير الطفيف في درجة حرارة التلدين يمكن أن يؤثر بشكل كبير على كفاءة الربط وخصوصيتها مما يؤدي إلى عدم كفاية التضخيم ، وبالتالي نتائج سلبية خاطئة لأنواع الميثانوجين49،50.
من ناحية أخرى ، في مجتمع الميثانوجين منخفض التنوع ، خلال المراحل الأخيرة من تفاعل البوليميراز المتسلسل ، يؤدي التراكم العالي لمنتجات تفاعل البوليميراز المتسلسل إلى إعادة تلدين القالب ويمنع البادئات من الارتباط ، والذي يفشل أيضا في اكتشاف النطاقات المرغوبة49. ومن المثير للاهتمام ، أن أزواج التمهيدي McrA 159F-McrA 345R تم تصميمها خصيصا لتحديد الميثانوروف اللاهوائي المعتمد على النترات Candidatus M. nitroreducens archaea51 ، ولم تتمكن هذه الدراسة من اكتشاف الميثانوتروف اللاهوائية باستخدام أزواج التمهيدي هذه. ومع ذلك ، يمكن أن تقترن الأكسدة اللاهوائية للميثان (AOM) بتقليل مستقبلات الإلكترون البديلة مثل الحديد (Fe) والمنغنيز (Mn) والكبريتات (SO42-) 52 ، مما قد يفسر عدم القدرة على اكتشاف ANME باستخدام هذه الطريقة. علاوة على ذلك ، قد يكون ذلك بسبب الظروف البيئية الخاصة لمنطقة الدراسة. وهكذا ، بالنسبة ل qPCR ، تم استخدام بادئات ML للكشف عن وفرة الميثانوجين ، حيث وفرت تضخيما موثوقا به حتى في ظل ظروف التنوع المجتمعي المنخفض49.
بالإضافة إلى ذلك ، توجد مثبطات تفاعل البوليميراز المتسلسل مثل الأحماض الدبالية أو الحمض النووي للأنواع غير المستهدفة على نطاق واسع في العينات البيئية ، والتي يمكن أن تقلل من كفاءة تفاعل البوليميراز المتسلسل53. نظرا لأن التركيز العالي للحمض النووي لم يتمكن من اكتشاف أي جين بواسطة cPCR ، فقد تم تخفيف جميع عينات الحمض النووي قبل تشغيل cPCR لتقليل تأثير مثبطات تفاعل البوليميراز المتسلسل54. قدم جين 16S rRNA ، كعلامة عالمية للبكتيريا والعتائق ، أساسا قويا للتحقق من صحة ظروف تفاعل البوليميراز المتسلسل لدينا وتأكيد سلامة الحمض النووي في جميع العينات55،56. ومع ذلك ، من المعروف أن مناطق المياه المالحة تحتوي على تركيزات أعلى من مثبطات تفاعل البوليميراز المتسلسل46. علاوة على ذلك ، تؤثر الملوحة بشكل غير مباشر على انبعاثات CH4 في الأراضي الرطبة الساحلية ، لأنها مرتبطة بتركيزات الكبريتات. ترتبط الملوحة العالية في الأراضي الرطبة بالمياه المالحة بمستويات الكبريتات المرتفعة التي تثبط إنتاج الميثان بسبب التنافس بين البكتيريا المختزلة للكبريتات والميثانوجينات ، في حين أن تركيزات الكبريتات المنخفضة في الأراضي الرطبة للمياه العذبة تؤدي إلى ارتفاع انبعاثات الميثان11،41. بالإضافة إلى ذلك ، تتأثر اختلافات انبعاث CH4 بين المياه المالحة والأراضي الرطبة للمياه العذبة أيضا بصلاتها المد والجزر بالمحيط57 ، مما قد يفسر أيضا الكشف غير الناجح عن الجينات المرتبطة بدورة الميثان بواسطة cPCR في كولومبيا البريطانية. في هذه الدراسة ، نجح cPCR في اكتشاف جميع الجينات المستهدفة في عينات LB و RV لكنه فشل في اكتشاف وجود هذه الجينات في عينات BC ، مع كون جين pmoA2 هو الاستثناء الوحيد. علاوة على ذلك ، تمكن qPCR من اكتشاف mmoX في جميع العينات ، بينما لم يتمكن cPCR من اكتشافه في BC. يشير هذا إلى أن qPCR يظهر مرونة أكبر لمثبطات تفاعل البوليميراز المتسلسل مقارنة ب cPCR ، ويعزى ذلك إلى حساسيته المعززة في آليات الكشف58. سبب آخر هو أن qPCR يحدد منتجات تفاعل البوليميراز المتسلسل خلال المرحلة الأسية من دورة تفاعل البوليميراز المتسلسل ، بينما يكتشفها cPCR في مرحلة الهضبة. يمكن هذا التمييز qPCR من إظهار قابلية منخفضة لتدهور المنتج أثناء دورات التفاعل المتقدمة ، حيث يتم استنفاد الكواشف47.
أنشأت هذه الدراسة تقنية تفاعل البوليميراز المتسلسل لتحديد الجينات المرتبطة بدورة الميثان في الأراضي الرطبة الساحلية في جنوب تكساس للتغلب على التحديات المرتبطة بمثبطات تفاعل البوليميراز المتسلسل والكفاءات الأولية المتغيرة. تم استخدام أربعة أزواج أولية تستهدف جين mcrA وزوجين يستهدفان جين pmoA1 ، واكتشف زوج واحد فقط من كل مجموعة هذه الجينات بشكل فعال في كل من تفاعل البوليميراز المتسلسل التقليدي وفي الوقت الفعلي. تخلص هذه الدراسة إلى مجموعة أزواج التمهيدي للجينات المرتبطة بتدوير الميثان ، بما في ذلك a189-mb6661 ل pmoA1 ، و 206f-703b ل pmoA2 ، و 536F-898R ل mmoX ، و ML ل mcrA. يشير هذا إلى أهمية اختيار التمهيدي المناسب للكشف عن الجينات المرتبطة بدورة الميثان في الأراضي الرطبة الساحلية ، مع تلك الموجودة في جنوب تكساس كأمثلة. علاوة على ذلك ، أظهرت الدراسة أن mmoX كان أكثر وفرة خلال الموسم البارد بينما كان pmoA1 وفيرا خلال الموسم الدافئ.
وبالتالي ، فإن نتائج هذه الدراسة توفر الأساس للفهم العلمي للعمليات الميكروبية المشاركة في دورة الميثان ، مما يسلط الضوء على تأثير العوامل البيئية عبر الاختلافات الموسمية والمكانية في الأراضي الرطبة الساحلية في جنوب تكساس. بناء على هذه النتائج ، تهدف الدراسات المستقبلية إلى زيادة التحقق من صحة هذا النهج في النظم البيئية الأخرى ، مثل حقول الأرز والأراضي الرطبة في المياه العذبة لزيادة المتانة وقابلية التعميم. علاوة على ذلك ، ستشمل هذه الدراسات أيضا التحليل الجيوكيميائي مثل تركيزات الميثان في الرواسب وكبريتيد المسام ، والتقنيات الجزيئية مثل علم الميتاجينوميات والنسخ ، والتي ستستند إلى هذا العمل الأساسي لتوفير فهم أكثر شمولا لديناميكيات تدوير الميثان.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
ونحن ممتنون لأعضاء C-REAL على مساعدتهم في المراقبة الميدانية والتحليلات المختبرية.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tubes | ThermoFisher Scientific | AB0620 | https://www.thermofisher.com/order/catalog/product/AB0620?SID=srch-srp-AB0620 |
| 0.5 mL PCR Tubes | Promega | E4941 | https://www.promega.com/products/biochemicals-and-labware/tips-and-accessories/0_5ml-pcr-tubes/?catNum=E4941 |
| 10 μL tips | ThermoFisher Scientific | 05-408-187 | Fisherbrand SureGrip Pipet Tip Racked or Reload System Tips Natural; 10μL; | Fisher Scientific |
| 15 mL centrifuge tube | ThermoFisher Scientific | 14-959-53A | https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/p-193301 |
| 200 μL tips | ThermoFisher Scientific | 05-408-190 | Fisherbrand SureGrip Pipet Tip Racked or Reload System Tips Natural; 200μL; | Fisher Scientific |
| 1000 μL tips | ThermoFisher Scientific | 02-707-402 | https://www.fishersci.com/shop/products/sureone-micropoint-pipette-tips-specific-standard-fit/02707402?gclid=Cj0KCQiAp NW6BhD5ARIsACmEb kUsQ9Lu0YIq5i4vWege 17qPdtxIYZyvmJH1cDo ARuwereO1V4GLz9UaA lDREALw_wcB&ef_id=C j0KCQiApNW6BhD5ARI sACmEbkUsQ9Lu0YIq5i 4vWege17qPdtxIYZyvmJ H1cDoARuwereO1V4GLz 9UaAlDREALw_wcB:G:s &ppc_id=PLA_goog_2175 7693617_171052169911_02 707402__715434303113_1555 377385658230343&ev_chn=sh op&s_kwcid=AL!4428!3!71543430 3113!!!g!2366517300713!&gad_source=1 |
| Applied Biosystem Power SYBR Green Master Mix | ThermoFisher Scientific | 4368577 | https://www.thermofisher.com/order/catalog/product/4368577 |
| ArcGIS Pro | esri | https://www.esri.com/en-us/arcgis/products/arcgis-pro/overview?srsltid=AfmBOopatJ4 JvHJfscHRcAaDx0Jz5_Jrl8l5 vYkkBvfOqE-uNSsMghN1 | |
| CFX Duet Real-Time PCR system | Bio-Rad | 12016265 | https://www.bio-rad.com/en-us/product/cfx-duet-real-time-pcr-system?ID=97722926-9ed9-16a4-1d83-c92f587e427a |
| Corning Lambda plus single channel pipettor volume 0.5-10 μL | Sigma-Aldrich | CLS4071-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4071 |
| Corning Lambda plus single channel pipettor volume 100-1000 μL | Sigma-Aldrich | CLS4075-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4075 |
| Corning Lambda plus single channel pipettor volume 20-200 μL | Sigma-Aldrich | CLS4074-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4074 |
| FastDNA spin kit for soil | MP Biomedical | 116560200-CF | https://www.mpbio.com/us/116560000-fastdna-spin-kit-for-soil-samp-cf?srsltid=AfmBOoqOxxGilzY3IHNIZR ajegGTr9MoX1oMZUh 3dcbJqe0UvvukY128 |
| Gene copy calculator | Science Primer | https://scienceprimer.com/copy-number-calculator-for-realtime-pcr . | |
| High speed benchtop centrifuge | ThermoFisher Scientific | 75004241 | https://newlifescientific.com/products/thermo-scientific-sorvall-st16-high-speed-benchtop-centrifuge-75004241?gad_source=1&gclid=Cj0KCQiApN W6BhD5ARIsACmEbkVC_-cCIN9j 20TvYq8iDsBlUR5cPK_1_wN OBEcjMdv-CYVoGCfeOLYaAv enEALw_wcB |
| High speed microcentrifuge | VWR | 75838-336 | https://us.vwr.com/store/product/20546590/null |
| Lysing Matrix E tube | glass bead/ceramic sphere-containing tube | ||
| Microcentrifuge tube | ThermoFisher Scientific | 02-681-320 | https://www.fishersci.com/shop/products/fisherbrand-low-retention-microcentrifuge-tubes-8/02681320?gclid=Cj0KCQiAp NW6BhD5ARIsACm EbkWbG4_o3oUiGk HJPU-_31-CuexDwQ fmWPnfyhBOf2BHXsy K3fFW1toaAgJbEALw_ wcB&ef_id=Cj0KCQiAp NW6BhD5ARIsACmEb kWbG4_o3oUiGkHJPU- _31-CuexDwQfmWPnfy hBOf2BHXsyK3fFW1toa AgJbEALw_wcB:G:s&ppc _id=PLA_goog_21757693 617_171052169911_0268 1320__715434303113_10 349826094968484711&ev _chn=shop&s_kwcid=AL!4 428!3!715434303113!!!g!23 66517300713!&gad_source=1 |
| PCR Master mix | Promega | M7502 | https://www.promega.com/products/pcr/taq-polymerase/master-mix-pcr/?catNum=M7502 |
| Quantiflour ONE dsDNA system | Promega | E4871 | https://www.promega.com/products/rna-analysis/dna-and-rna-quantitation/quantifluor-one-dsdna-system/?gad_source=1&gbraid=0AAAAAD _rg189yJTY3cxeVqMdu8RPx10 Ma&gclid=CjwKCAjwxNW2BhAk EiwA24Cm9FUgViPNyWq7UfZL VeeoroLAZ5JIP6w07RGK_4D0w oZgAqf-G1XTmxoCxm8QAvD_B wE&catNum=E4871 |
| Quantus Fluorometer | Promega | E6150 | https://www.promega.com/products/microplate-readers-fluorometers-luminometers/fluorometers/quantus-fluorometer/?catNum=E6150 |
| YSI Pro 2030 | YSI a xylem brand | 603174 | https://www.ysi.com/product/id-p2030/pro2030-kits |
References
- Xu, T., et al. Wetlands of international importance: Status, threats, and future protection. Int J Environ Res Public Health. 16 (10), 1818 (2019).
- Corn, M. L. . Deepwater Horizon oil spill: coastal wetland and wildlife impacts and response. , (2010).
- Hendriks, I. E., Sintes, T., Bouma, T. J., Duarte, C. M. Experimental assessment and modeling evaluation of the effects of the seagrass Posidonia oceanica on flow and particle trapping. Marine Ecology Progress Series. 356, 163-173 (2008).
- Krause, S. J. E., Treude, T. Deciphering cryptic methane cycling: Coupling of methylotrophic methanogenesis and anaerobic oxidation of methane in hypersaline coastal wetland sediment. Geochimica et Cosmochimica Acta. 302, 160-174 (2021).
- Reddy, K. R., DeLaune, R. D., Inglett, P. W. . Biogeochemistry of Wetlands: Science and Applications. , (2022).
- La, W., et al. Sulfate concentrations affect sulfate reduction pathways and methane consumption in coastal wetlands. Water Research. 217, 118441 (2022).
- Derwent, R. G. Global warming potential (GWP) for methane: Monte Carlo analysis of the uncertainties in Global Tropospheric Model predictions. Atmosphere. 11 (5), 486 (2020).
- Potter, C., et al. Methane emissions from natural wetlands in the United States: Satellite-derived estimation based on ecosystem carbon cycling. Earth Interactions. 10 (22), 1-12 (2006).
- . Understanding global warming potentials Available from: https://www.epa.gov/ghgemissions/understanding-global-warming-potentials (2024)
- Wallenius, A. J., Dalcin Martins, P., Slomp, C. P., Jetten, M. S. M. Anthropogenic and environmental constraints on the microbial methane cycle in coastal sediments. Front Microbiol. 12, 631621 (2021).
- Qu, Y., et al. Salinity causes differences in stratigraphic methane sources and sinks. Environmental Science and Ecotechnology. 19, 100334 (2024).
- Vizza, C., West, W. E., Jones, S. E., Hart, J. A., Lamberti, G. A. Regulators of coastal wetland methane production and responses to simulated global change. Biogeosciences. 14 (2), 431-446 (2017).
- van Dijk, G., et al. Salinization lowers nutrient availability in formerly brackish freshwater wetlands; unexpected results from a long-term field experiment. Biogeochemistry. 143 (1), 67-83 (2019).
- Aronson, E., Allison, S., Helliker, B. R. Environmental impacts on the diversity of methane-cycling microbes and their resultant function. Front Microbiol. 4, 225 (2013).
- Reeburgh, W. S. Oceanic methane biogeochemistry. Chem Rev. 107 (2), 486-513 (2007).
- Thauer, R. K. Biochemistry of methanogenesis: a tribute to Marjory Stephenson. Marjory Stephenson Prize Lecture. Microbiology (Reading). 144 (Pt 9), 2377-2406 (1998).
- Thauer, R. K. Anaerobic oxidation of methane with sulfate: on the reversibility of the reactions that are catalyzed by enzymes also involved in methanogenesis from CO2. Curr Opin Microbiol. 14 (3), 292-299 (2011).
- Friedrich, M. W. Methyl-coenzyme M reductase genes: Unique functional markers for methanogenic and anaerobic methane-oxidizing Archaea. Methods in Enzymology. 397, 428-442 (2005).
- Reeburgh, W. S. Oceanic methane biogeochemistry. Chem Rev. 107 (2), 486-513 (2007).
- Rasigraf, O., Schmitt, J., Jetten, M. S. M., Lüke, C. Metagenomic potential for and diversity of N-cycle driving microorganisms in the Bothnian Sea sediment. Microbiologyopen. 6 (4), e00475 (2017).
- McDonald, I. R., Bodrossy, L., Chen, Y., Murrell, J. C. Molecular ecology techniques for the study of aerobic methanotrophs. Appl Environ Microbiol. 74 (5), 1305-1315 (2008).
- Tchawa Yimga, M., Dunfield, P. F., Ricke, P., Heyer, J., Liesack, W. Wide distribution of a novel pmoA-like gene copy among type II methanotrophs, and its expression in Methylocystis strain SC2. Appl Environ Microbiol. 69 (9), 5593-5602 (2003).
- Knief, C. Diversity and habitat preferences of cultivated and uncultivated aerobic methanotrophic bacteria evaluated based on pmoA as molecular marker. Front Microbiol. 6, 1346 (2015).
- Huang, I. -. S., et al. Preliminary assessment of microbial community structure of Wind-Tidal Flats in the Laguna Madre, Texas, USA. Biology. 9 (8), 183 (2020).
- Wilding, T. K., Brown, E., Collier, K. J. Identifying dissolved oxygen variability and stress in tidal freshwater streams of northern New Zealand. Environ Monit Assess. 184 (10), 6045-6060 (2012).
- Roy Chowdhury, T., Mitsch, W. J., Dick, R. P. Seasonal methanotrophy across a hydrological gradient in a freshwater wetland. Ecological Engineering. 72, 116-124 (2014).
- Sun, Q. -. Q., et al. Carbon dioxide and methane fluxes: Seasonal dynamics from inland riparian ecosystems, northeast China. Sci Total Environ. 465, 48-55 (2013).
- Lee, S., et al. Comparison and selection of conventional PCR primer sets for studies associated with nitrogen cycle microorganisms in surface soil. Appl Sci. 12 (20), 10314 (2022).
- Bae, K. -. S., et al. Development of diagnostic systems for wide range and highly sensitive detection of two waterborne hepatitis viruses from groundwater using the conventional reverse transcription nested PCR assay. J Virol Methods. 299, 114344 (2022).
- Lecusay, D. . Assessment and Monitoring of Deltaic Wetlands and Fluvial Systems: Refining and Validating a Multimetric Index of Resaca Ecosystem Health. , (2021).
- . FastDNA SPIN Kit for Soil (Cat No. 116560200) Available from: https://www.mpbio.com/media/productattachment/LS082019-EN-FastDNA-SPIN-Kit-for-Soil-116560200-Manual.pdf (2025)
- Luton, P. E., Wayne, J. M., Sharp, R. J., Riley, P. W. The mcrA gene as an alternative to 16S rRNA in the phylogenetic analysis of methanogen populations in landfill. Microbiology (Reading, England). 148 (Pt 11), 3521-3530 (2002).
- Changsoo, L., Jaai, K., Seung Gu, S., Seokhwan, H. Absolute and relative QPCR quantification of plasmid copy number in Escherichia coli. J Biotechnol. 123 (3), 273-280 (2006).
- Harms, G., et al. Real-time PCR quantification of nitrifying bacteria in a municipal wastewater treatment plant. Environ Sci Technol. 37 (2), 343-351 (2003).
- Holmes, A. J., Costello, A., Lidstrom, M. E., Murrell, J. C. Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related. FEMS Microbiol Lett. 132 (3), 203-208 (1995).
- Fuse, H., et al. Oxidation of trichloroethylene and dimethyl sulfide by a marine Methylomicrobium strain containing soluble methane monooxygenase. Biosci Biotechnol Biochem. 62 (10), 1925-1931 (1998).
- Springer, E., Sachs, M. S., Woese, C. R., Boone, D. R. Partial gene sequences for the A subunit of methyl-coenzyme M reductase (mcrI) as a phylogenetic tool for the family Methanosarcinaceae. Int J Syst Bacteriol. 45 (3), 554-559 (1995).
- Costello, A. M., Lidstrom, M. E. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments. Appl Environ Microbiol. 65 (11), 5066-5074 (1999).
- Flores, E. A. . Effects of Nutrient Enrichment on Mangrove and Saltmarsh Habitats. , (2022).
- Minjie, H., Jordi, S., Xianyu, Y., Josep, P., Chuan, T. Patterns and environmental drivers of greenhouse gas fluxes in the coastal wetlands of China: A systematic review and synthesis. Environ Res. 186, 109576 (2020).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Liu, D. Y., Ding, W. X., Jia, Z. J., Cai, Z. C. Relation between methanogenic archaea and methane production potential in selected natural wetland ecosystems across China. Biogeosciences. 8 (2), 329-338 (2011).
- Ke, Z., et al. Methane emissions and methanogenic community investigation from constructed wetlands in Chengdu City. Urban Climate. 39, 100956 (2021).
- Chowdhury, T. R., Dick, R. P. Ecology of aerobic methanotrophs in controlling methane fluxes from wetlands. Applied Soil Ecology. 65, 8-22 (2013).
- Maja, S., et al. Humic substances cause fluorescence inhibition in real-time polymerase chain reaction. Anal Biochem. 487, 30-37 (2015).
- Sanches, T. M., Schreier, A. D. Optimizing an eDNA protocol for estuarine environments: Balancing sensitivity, cost and time. PLOS ONE. 15 (5), e0233522 (2020).
- Xia, Z., et al. Conventional versus real-time quantitative PCR for rare species detection. Ecol Evol. 8 (23), 11799-11807 (2018).
- Bourne, D. G., McDonald, I. R., Murrell, J. C. Comparison of pmoA PCR primer sets as tools for investigating methanotroph diversity in three Danish soils. Appl Environ Microbiol. 67 (9), 3802-3809 (2001).
- Juottonen, H., Galand, P. E., Yrjala, K. Detection of methanogenic Archaea in peat: comparison of PCR primers targeting the mcrA gene. Res Microbiol. 157 (10), 914-921 (2006).
- Lueders, T., Friedrich, M. W. Evaluation of PCR amplification bias by terminal restriction fragment length polymorphism analysis of small-subunit rRNA and mcrA genes by using defined template mixtures of methanogenic pure cultures and soil DNA extracts. Appl Environ Microbiol. 69 (1), 320-326 (2003).
- Vaksmaa, A., Jetten, M. S., Ettwig, K. F., Luke, C. McrA primers for the detection and quantification of the anaerobic archaeal methanotroph 'Candidatus Methanoperedens nitroreducens'. Appl Microbiol Biotechnol. 101 (4), 1631-1641 (2017).
- Ren, G., et al. Electron acceptors for anaerobic oxidation of methane drive microbial community structure and diversity in mud volcanoes. Environ Microbiol. 20 (7), 2370-2385 (2018).
- Goldberg, C. S., et al. Critical considerations for the application of environmental DNA methods to detect aquatic species. Methods in Ecology and Evolution. 7 (11), 1299-1307 (2016).
- McKee, A. M., Spear, S. F., Pierson, T. W. The effect of dilution and the use of a post-extraction nucleic acid purification column on the accuracy, precision, and inhibition of environmental DNA samples. Biological Conservation. 183, 70-76 (2015).
- Gohl, D. M., et al. Systematic improvement of amplicon marker gene methods for increased accuracy in microbiome studies. Nat Biotechnol. 34 (9), 942-949 (2016).
- Ballarini, A., Segata, N., Huttenhower, C., Jousson, O. Simultaneous quantification of multiple bacteria by the BactoChip microarray designed to target species-specific marker genes. PLOS ONE. 8 (2), e55764 (2013).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: A review. Eur J Soil Biol. 37 (1), 25-50 (2001).
- Smith, C. J., Osborn, A. M. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiol Ecol. 67 (1), 6-20 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.