Method Article
הדמיה של דינמיקה מיקרוביאלית של מחזור מתאן בביצות חוף
In This Article
Summary
הפרוטוקול מזהה גנים מרכזיים של מחזור מתאן בביצות החוף של דרום טקסס ומדמיין את התפוצה המרחבית שלהם כדי לשפר את ההבנה של ויסות המתאן והשפעותיו הסביבתיות במערכות אקולוגיות דינמיות אלה.
Abstract
ביצות חוף הן המקור הביוטי הגדול ביותר למתאן, שבו מתאנוגנים ממירים חומר אורגני למתאן ומתאנוטרופים מחמצנים מתאן, ובכך ממלאים תפקיד קריטי בוויסות מחזור המתאן. שטחי הביצות בדרום טקסס, הנתונים לאירועי מזג אוויר תכופים, רמות מליחות משתנות ופעילויות אנתרופוגניות עקב שינויי אקלים, משפיעים על מחזור המתאן. למרות החשיבות האקולוגית של תהליכים אלה, מחזור המתאן בביצות החוף של דרום טקסס עדיין לא נחקר מספיק. כדי להתמודד עם הפער הזה, פיתחנו וביצענו אופטימיזציה של שיטה לאיתור גנים הקשורים למתנוגנים ומתאנוטרופים, כולל mcrA כסמן ביולוגי למתנוגנים ו-pmoA1, pmoA2 ו-mmoX כסמנים ביולוגיים למתאנוטרופים. בנוסף, מחקר זה נועד להמחיש את דפוסי ההתפלגות המרחביים והזמניים של שפע מתאנוגן ומתאנוטרוף באמצעות תוכנת מערכת המידע הגיאוגרפית (GIS) ArcGIS Pro. השילוב של טכניקות מולקולריות אלה עם הדמיה גיאו-מרחבית מתקדמת סיפק תובנות קריטיות לגבי ההתפלגות המרחבית והזמנית של קהילות מתאנוגן ומתאנוטרוף ברחבי ביצות דרום טקסס. לפיכך, המתודולוגיה שנקבעה במחקר זה מציעה מסגרת איתנה למיפוי דינמיקה מיקרוביאלית באזורי ביצות, שיפור ההבנה שלנו לגבי מחזור מתאן בתנאים סביבתיים משתנים, ותמיכה במחקרי שינוי אקולוגיים וסביבתיים רחבים יותר.
Introduction
ביצות חוף הן מערכות אקולוגיות חיוניות התורמות לוויסות האקלים, שימור המגוון הביולוגי וניהול מים באמצעות תהליכים כגון קיבוע פחמן, אידוי דיות ופליטת מתאן (CH4)1. מערכות אקולוגיות אלה, כולל ביצות מים מתוקים ומים מלוחים2, הן פרודוקטיביות ביותר ופועלות כאזורים קריטיים לספיגת פחמן דו חמצני (CO2) ולוכדות חומר אורגני מסביבות יבשתיות וימיות 3,4. האינטראקציות הדינמיות בתוך אזורי ביצות אלה מעוררות ייצור וצריכה של CH4 מיקרוביאלי5, וממצבות אותם כאחד המקורות הטבעיים הגדולים ביותר של CH46. כגז החממה השני בחשיבותו, ל-CH4 יש פוטנציאל התחממות גלובלית גדול פי 27-30 מזה של CO2 4,7,8,9, מה שהופך את חקר פליטות CH 4 מביצות חוף לחיוני בעידן שינויי האקלים. פליטת CH4 מושפעת מגורמים סביבתיים שונים, במיוחד מליחות, הממלאים תפקיד מכריע בתהליכים מיקרוביאליים10. ביצות מים מתוקים תורמות באופן משמעותי למתאן באטמוספירה בשל רמות הסולפט הנמוכות שלהן, מה שמאפשר ייצור CH4 מיקרוביאלי גדול יותר, בעוד שביצות מים מלוחים נוטות בדרך כלל לפלוט פחות CH4 בגלל ריכוזי סולפט גבוהים יותר 11,12,13.
פליטות CH4 מביצות חוף נשלטות בדרך כלל על ידי שתי קבוצות של מיקרואורגניזמים, הידועים כמתאנוגנים ומתאנוטרופים14. מתאנוגנים מייצרים CH4 במשקעים אנוקסיים על ידי פירוק מצעים כמו פורמט, אצטט, מימן או תרכובות מתילציה בתהליך המכונה מתאנוגנזה15. האנזים החשוב במסלול זה הוא מתיל-קואנזים M רדוקטאז (MCR), מכיוון שהוא מזרז את השלב הסופי ומגביל הקצב של מתאנוגנזה 15,16,17. הגן mcrA, המקודד את תת-יחידת האלפא של MCR, הוא סמן פונקציונלי שניתן למצוא בכל הארכאות המתנוגניות18. יתר על כן, בביצות החוף, אזור המעבר סולפט-מתאן (SMTZ) נוצר מעל האזור המתנוגני, שבו מתאן מתפזר כלפי מעלה וסולפט נע כלפי מטה מתכנסים ומתרוקנים19. בתוך אזור זה, ארכאה מתאנוטרופית אנאירובית (ANME) מחמצנת מתאן לפחמן דו חמצני באמצעות האנזים MCR, בעוד שחיידקים מפחיתי סולפט (SRB) מפחיתים סולפט לסולפיד. SRB עולה על מתאנוגנים למימן ואצטט, ומגביל את ייצור המתאן עד לדלדול הסולפט16,17.
לעומת זאת, חיידקים מתאנוטרופיים אירוביים מחמצנים CH4 בסביבות אירוביות20, תוך שימוש בצורות שונות של מתאן מונואוקסיגנאז (MMO). אלה כוללים חלקיקי מתאן מונואוקסיגנאז (pMMO), אנזים המכיל נחושת המוטבע בקרום התוך-ציטופלזמי, ומתאן מונואוקסיגנאז מסיס (sMMO), אנזים המכיל ברזל שנמצא בציטופלזמה. עם זאת, עבור pMMO, ישנם שלושה אופרון גנים pmoCAB21; ביניהם, הגן pmoA הוא השמרני ביותר עבור כל המתאנוטרופים. ישנם שני גנים שונים של סמנים ביולוגיים ל-pmoA: pmoA1 ו-pmoA222. יתר על כן, להבנה מקיפה של מתאנוטרופים, הגן mmoX משמש ככלי בביולוגיה מולקולרית לזיהוי מתאנוטרופים המכילים sMMO23. הבחנה זו במסלולים מטבוליים ובדרישות הסביבתיות של מתאנוגנים ומתאנוטרופים אירוביים מדגישה את האינטראקציות המיקרוביאליות המורכבות המווסתות את מחזור המתאן במערכות אקולוגיות של ביצות חופיות.
ביצת בוקה צ'יקה (BC), סביבת מים מלוחים פרודוקטיבית בדרום טקסס, חווה השפעות גאות ממפרץ מקסיקו (GOM), מה שמוביל לרמות מליחות פני השטח המשתנות, במיוחד בשל קרבתו ללגונה מאדרה24. פעולת גאות זו, לסירוגין בין גאות ושפל, גורמת לתנודות ברמות החמצן25 שעלולות לשנות את פעילות המתאנוגן והמתאנוטרוף במשקעים26. לעומת זאת, ביצות מים מתוקים בחוף נחשבות למוקד חם משמעותי לשטפי CH4 27. לביצות המים המתוקים בדרום טקסס, כולל Resaca Del Rancho Viejo (RV) ו-Lozano Banco (LB), המרוחקות מהשפעות הגאות והשפל של GOM, יש ניהול הידרולוגי מובהק. RV חווה זרימות דופק בתוספת מי נהר במהלך מפלס מים נמוך, בעוד LB פועלת כמערכת זרימה לא מקוונת ללא תוספת כזו. יתר על כן, RV ו-LB שומרים על רמות מליחות נמוכות יותר עקב הזרמה גבוהה של מים מתוקים שנשאבים באופן מלאכותי והיותם אגם קשת שוורים, בהתאמה. הגורמים הסביבתיים השונים יכולים להשפיע באופן משמעותי על מחזור המתאן על פני ביצות החוף של דרום טקסס. עם זאת, מחזור מתאן בביצות החוף של דרום טקסס נותר אזור שטרם נחקר ביסודיות.
תגובת שרשרת פולימראז (PCR) ו-PCR בזמן אמת (נקראת גם PCR כמותי [qPCR]) מייצגות טכניקות בסיסיות ונפוצות לאיתור וכימות השפע היחסי של גנים ספציפיים בדגימות סביבתיות. טכניקות אלו מגבירות באופן ספציפי אזורים ממוקדים של DNA כדי לציין את הנוכחות והכמות היחסית של גנים הקשורים למחזור CH4, ומספקות אינדיקטורים למחזור מתאן פוטנציאלי. עם זאת, הזמינות והיעילות של ערכות פריימר PCR עשויות להיות מוגבלות על ידי גורמים מעכבים שונים ב-DNA הסביבתי המופק, המושפעים מסוגי הסביבות28,29. לפיכך, מחקר זה ביסס בעיקר שיטת PCR אופטימלית לזיהוי נוכחותם של גנים הקשורים למחזור CH4 בביצות החוף של דרום טקסס (איור 1) ולאחר מכן המחיש את השפע היחסי הכמותי שלהם במערכות אקולוגיות אלה. ניתן ליישם את התוצאות ממחקר זה על אזורי חוף אחרים כדי לשפר את ההבנה של מחזור CH4 ודינמיקה מיקרוביאלית במערכות אקולוגיות חופיות מגוונות.
Protocol
1. איסוף דוגמאות
- אסוף דגימות משקעים באמצעות דגימת תפיסת משקעים או חפירה.
הערה: דגימות נאספו משתי תחנות של שלוש ביצות חוף נפרדות במהלך העונות הקרירות (אוקטובר-פברואר, הטמפרטורה הממוצעת היא 20 מעלות צלזיוס) והחמות (אפריל-יוני, הטמפרטורה הממוצעת היא 27 מעלות צלזיוס) של 2023 ו-2024. נעשה שימוש בדגימת תפיסת משקעים כאשר דגימות נאספו מביצות מים מתוקים לאורך החוף (איור 2), ואת חפירה שימשה עבור ביצות מים מלוחים המושפעות מגאות ושפל. - הורד תחילה את הדגימה לתוך גוף המים הרדוד ואפשר לו לשקוע אל פני המשקע (בתוך 50 הס"מ העליונים) תחת משקלו האישי, תוך מזעור ההפרעה למבנה המשקעים כפי שמוצג באיור 2.
- משוך אותו מעמוד המים שבו העומק היה בדרך כלל 60 ס"מ עד 215 ס"מ30, העביר את דגימות המשקעים לשקיות עם רוכסן, ואחסן אותן מיד בקופסת קרח.
הערה: נקה ושטוף את האחיזה SAMPLER במים נטולי יונים (DI) לפני שתמשיך לתחנות הבאות. - אחסן את כל הדגימות בטמפרטורה של -20 מעלות צלזיוס מיד במעבדה.
- בכל אתר דגימה יש למדוד פרמטרים של איכות מים עיליים כגון מליחות וטמפרטורה באתרם באמצעות מד איכות מים רב-פרמטרי.
הערה: הבדיקות נשטפו במים נטולי יונים (DI water) לאחר השימוש בכל תחנה.
2. מיצוי DNA גנומי
- הפשירו את הדגימות בטמפרטורת החדר לפני תחילת ההליך למיצוי DNA גנומי.
- העבירו כ-500 מ"ג דגימות משקעים לצינור של 15 מ"ל וצנטריפוגה ב-4,250 × גרם למשך 3 דקות כדי להסיר את כל המים.
- חלץ DNA גנומי באמצעות ערכת מיצוי DNA לאדמה בהתאם לפרוטוקולהיצרן 31 עם שינוי קטן ואחסן בטמפרטורה של -20 מעלות צלזיוס באופן מיידי.
הערה: השינויים בוצעו כדי להפחית יתירות וזרימת עבודה יעילה.- הוסף עד 500 מ"ג של דגימת אדמה לצינור המכיל חרוז זכוכית/כדור קרמיקה.
- הוסף 978 מיקרוליטר של מאגר נתרן פוספט לדגימה בצינור המכיל חרוז/כדור.
- הוסף 122 מיקרוליטר של תמיסת ליזה חיץ לדגימה בצינור המכיל חרוז/כדור כדי להמיס מזהמים חיצוניים.
- הומוגניזציה באמצעות הומוגנייזר טחנת חרוזים במהירות פי 5 מרמת המהירות למשך 20 שניות וחזור על הפעולה פי 2.
הערה: במחקר זה נעשה שימוש בהומוגנייזר של טחנת חרוזים, וזו הסיבה שהמהירות הותאמה. - צנטריפוגה את התערובת למשך 10 דקות בחום של 14,000 × גרם.
- העבירו את הסופרנטנט לצינור מיקרו-צנטריפוגה נקי של 2.0 מ"ל.
- הוסף 250 מיקרוליטר של תמיסת משקעים חלבונית (PPS) כדי להפריד את חומצות הגרעין המסיסות מהפסולת התאית וממטריצת הליזינג. מערבבים על ידי היפוך הצינור פי 10.
- צנטריפוגה בעוצמה של 14,000 × גרם למשך 5 דקות כדי לזרז את הגלולה, להסיר את הפסולת התאית ואת מטריצת הליזינג.
- העבירו את הסופרנטנט לצינור מיקרו-צנטריפוגה נקי של 15 מ"ל.
- הוסף 1.0 מ"ל של תרחיף מטריצת הכריכה לסופרנטנט בצינור 15 מ"ל.
הערה: נער את מתלה מטריצת הכריכה כדי להשעות מחדש לפני הוספתו. - אפשר את קשירת ה-DNA למטריצת הקישור על ידי הנחת הצינורות על מסובב למשך 2 דקות.
- מניחים את כל הצינורות על מתלה ודוגרים למשך 3 דקות כדי לאפשר שקיעה של מטריצת הכריכה.
- לאחר 3 דקות, השליכו 750 מיקרוליטר וערבבו בעדינות את הסופרנטנט שנותר עם הגלולה בעזרת פיפטה.
- מעבירים 750 מיקרוליטר מהתערובת לפילטר ספין וצנטריפוגה בחום של 14,000 × גרם למשך דקה. רוקן את צינור התפיסה ועשה בו שימוש חוזר. חזור על הפעולה עם התערובת הנותרת.
- הוסף 500 מיקרוליטר מתמיסת הכביסה המוכנה (בתוספת הכמות המתאימה של אתנול) כדי להמיס עוד יותר זיהומים. השעו בעדינות את הגלולה באמצעות כוח הנוזל מקצה הפיפט.
- צנטריפוגה בטמפרטורה של 14,000 × גרם למשך דקה אחת להסרת זיהומים. רוקן את צינור התפיסה ועשה בו שימוש חוזר.
- שוב צנטריפוגה ב -14,000 × גרם למשך 2 דקות מבלי להוסיף דבר.
- החלף את צינור התפיסה בצינור תפיסה חדש ונקי וייבש באוויר את מסנן ה-SPIN למשך 5 דקות בטמפרטורת החדר.
- הוסף 50 מיקרוליטר מים ללא DNA (DES) וצנטריפוגה ב-14,000 × גרם למשך דקה אחת.
הערה: בפרוטוקול זה, נעשה שימוש ב-50 מיקרוליטר של DES לפליטת DNA כדי להבטיח התאוששות ויציבות אופטימלית של ה-DNA הסביבתי המופק (eDNA).
3. כימות DNA
- הוסף 1 מיקרוליטר של DNA מופק עם 200 מיקרוליטר צבע פלואורסצנטי בשפופרת של 0.5 מ"ל וערבב היטב על ידי פיפטינג.
- עטפו את הצינור מיד בנייר אלומיניום כך שהאור לא יוכל לחדור ולדגור בטמפרטורת החדר למשך 5 דקות.
- מדוד את ריכוז ה-DNA באמצעות פלואורומטר במצב ריכוז DNA ONE בהתאם לפרוטוקול היצרן.
4. זיהוי של 16S rRNA, pmoA1 , pmoA2 , mmoX ו-mcrA על ידי PCR קונבנציונאלי
- לפני הפעלת PCR קונבנציונלי (cPCR), הפשירו את כל הדגימות והריאגנטים בדלי קרח.
- יש לדלל את כל דגימות ה-eDNA שחולצו ל-10 ננוגרם/מיקרוליטר.
הערה: רשימה של פריימרים ניתנת בטבלה 1. - הכן תערובת תגובה cPCR של 25 מיקרוליטר עבור כל דגימה, כולל 12.5 מיקרוליטר של תערובת 2x PCR Master, 0.5 מיקרוליטר של פריימרים קדימה ואחורה (10 מיקרומטר) (ראה טבלה 1 לרשימת פריימר), 1 מיקרוליטר של 10 ננוגרם/מיקרוליטר eDNA ו-10.5 מיקרוליטר מים נטולי נוקלאז.
הערה: הכן את תערובת המאסטר עם נפח מספיק לדגימה נוספת אחת כדי למזער שגיאות פיפטינג. - בצע תגובת cPCR בהתאם לפרוטוקול המורכב מדנטורציה ראשונית ב-95 מעלות צלזיוס למשך 2 דקות, ואחריה 40 מחזורי דנטורציה ב-95 מעלות צלזיוס למשך 45 שניות, הארכה ב-72 מעלות צלזיוס למשך 30 שניות, והארכה סופית ב-72 מעלות צלזיוס למשך 5 מ', עם טמפרטורת חישול משתנה עבור פריימרים שונים (ראה טבלה 1 לטמפרטורות חישול של פריימרים שונים המשמשים לגנים שונים).
הערה: עבור גן mcrA , פריימרים של ML הראו את הרצועה הרצויה באמצעות קצב רמפה איטי של 0.1 מעלות צלזיוס לשנייה בין שלבי החישול וההארכה בחמשת המחזורים הראשונים32. - דמיינו מוצרי cPCR בג'ל אגרוז צבוע מראש באתידיום ברומיד (EtBr).
הערה: השתמש בג'ל אגרוז 2.5% לסולם של 50 bp ובג'ל 0.9% לסולם של 1 kb. השתמש במאגר 1x TAE עבור ג'ל אגרוז של 2.5% ובופר TAE של 0.5x עבור ג'ל אגרוז של 0.9%.
5. זיהוי pmoA1 , pmoA2 , mmoX ו-mcrA על ידי PCR כמותי בזמן אמת
הערה: גנים ממוקדי מתאנוגן ומתאנוטרופים כגון pmoA1, pmoA2, mmoX ו-mcrA נצפו על ידי qPCR באמצעות מערכת PCR בזמן אמת.
- הכן את התקנים לכל גן בנפרד כדי לקבל את העקומה הסטנדרטית עבור כל גן.
- הגבירו את הגן הממוקד עם cPCR, באמצעות הדגימות שיצרו את הרצועה הבהירה ביותר במהלך אלקטרופורזה של הג'ל של כל גן. עקוב אחר השיטה והפריימרים המתוארים בסעיף 4.
- טהר את המוצרים המוגברים באמצעות ערכת מיצוי ג'ל ומדוד את ריכוז ה-DNA לפי השיטה המתוארת בסעיף 3 ואחסן ב-20 מעלות צלזיוס.
הערה: ציטוט התקנים המטוהרים לצינורות נפרדים לשימוש נוסף. - חשב עותקי גנים מריכוז ה-DNA הנמדד באמצעות אתר חישוב מספר העותקים עבור qPCR.
- יש לדלל את מספר העותק המחושב של התקן במים נטולי נוקלאז כדי להכין כל תקן, בטווח שבין 108 ל-102 עותקים/מיקרוליטר, לפני הפעלת ה-qPCR.
- הכן את העקומה הסטנדרטית באמצעות שלושה שכפולים של כל מספר עותק, כולל בקרה שלילית (NTC, ללא DNA של תבנית).
הערה: ערך R2 של כל עקומה סטנדרטית היה גדול מ-0.99.
- הכן תערובת תגובה של 20 מיקרוליטר qPCR עבור כל הדגימות, התקנים וה-NTC. בצע את ניתוח ה-qPCR בשלוש פעמים עבור כל הדגימות.
- הנח את כל רכיבי התגובה, כולל תערובת מאסטר qPCR, פריימרים, מים נטולי נוקלאז, תקנים ודגימות, על מדף קרח לפני שמתחילים.
- הכן תערובת תגובה של 20 מיקרוליטר qPCR עבור כל דגימה, סטנדרטית ו-NTC, המכילה 10 מיקרוליטר של תערובת מאסטר SYBR Green, 0.5 מיקרוליטר מכל פריימרים של 10 מיקרומטר קדימה ואחורה, 8 מיקרוליטר של מים נטולי נוקלאז, ו-1 מיקרוליטר של DNA תבנית של 10 ננוגרם/מיקרוליטר, או מים סטנדרטיים או DI בהתאמה.
הערה: השתמש בערכות הפריימר שהוכחו כמניבות תוצאות מיטביות עבור גנים pmoA1 ו-mcrA ב-PCR קונבנציונלי עבור qPCR (ראה טבלה 1). כדי לשפר את הדיוק, הפעל כל דגימה בשלוש עותקים. השלבים הבאים מספקים שיטה יעילה להכנת דגימות משולשות בנפח משולב של 60 מיקרוליטר לדגימה.- הכן את תערובת התגובה לשילוב תערובת המאסטר, פריימרים קדימה ואחורה עבור הגן הספציפי, ומים נטולי נוקלאז בצינור של 2 מ"ל, למעט ה-DNA של התבנית.
הערה: הכן את נפח תערובת התגובה בהתחשב בשגיאת פיפטינג. לדוגמה, אם יש 24 דגימות ו-8 תקנים, חשב את הנפח הכולל עבור 33 תגובות במקום 32 תגובות כדי למזער שגיאות פיפטינג. במקרה זה, הנפח הכולל הנדרש לתגובות משולשות יהיה כדלקמן: 990 מיקרוליטר של תערובת מאסטר (33 דגימות x 3 שכפולים x 10 מיקרוליטר), 49.5 מיקרוליטר של פריימרים קדמיים (33 דגימות x 3 שכפולים x 0.5 מיקרוליטר), 49.5 מיקרוליטר של פריימרים הפוכים (33 דגימות x 3 שכפולים x 0.5 מיקרוליטר), ו-792 מיקרוליטר של מים נטולי נוקלאז (33 דגימות x 3 שכפולים x 8 מיקרוליטר). - הכן צינורות PCR בהתאם למספר הדגימות והתקנים.
- הוציאו 57 מיקרוליטר מתערובת התגובה המוכנה לכל צינור PCR.
הערה: כדי לבצע qPCR עבור כל דגימה במשולש, הכינו נפח תערובת תגובה כולל של 57 מיקרוליטר לדגימה (לא כולל DNA של תבנית, סטנדרטי או מים). נפח זה יחולק באופן שווה לשלוש בארות לדגימה אחת, כאשר 19 מיקרוליטר יוקצו לכל באר. - הוסף 3 מיקרוליטר של DNA תבנית, מים סטנדרטיים או נטולי נוקלאז לכל צינור וערבב על ידי הקשה עדינה על תחתית הצינור.
הערה: הנפח הכולל של תערובת התגובה שהוכנה לדגימה אחת יהיה 60 מיקרוליטר כעת בכל צינור.
- הכן את תערובת התגובה לשילוב תערובת המאסטר, פריימרים קדימה ואחורה עבור הגן הספציפי, ומים נטולי נוקלאז בצינור של 2 מ"ל, למעט ה-DNA של התבנית.
- יש לצרוך 20 מיקרוליטר מתערובת התגובה המוכנה מכל צינור לבארות המיועדות של צלחת qPCR של 96 בארות. אטום את לוחית ה-PCR עם סרט איטום PCR דביק באמצעות מוליך.
- צנטריפוגה את הצלחת האטומה ב-1,000 × גרם למשך דקה אחת כדי להבטיח ערבוב נכון כדי לחסל בועות בתוך הבארות.
- הנח את לוחית ה-PCR במחזור התרמי. הפעל את מכשיר ה-qPCR ולאחר מכן פתח את התוכנה הקשורה כדי להגדיר את הפרוטוקול.
- הגדר את הפרוטוקול בהתאם להנחיות qPCR master mix. השתמש בפרוטוקול הבא: 95 מעלות צלזיוס למשך 10 דקות, ואחריו 95 מעלות צלזיוס למשך 15 שניות, ומדרגת הארכה ב-72 מעלות צלזיוס למשך 30 שניות. בצע את שלב החישול בטמפרטורת החישול שצוינה עבור הפריימרים הרלוונטיים בטבלה 1 למשך 45 שניות. בצע את כל ריצות ה-qPCR במשך 35 מחזורים.
- הגדר את לוחית ה-qPCR עם 96 בארות עם תקנים ו-NTC באותה תצורה כמו הצלחת המכילה דגימה.
- השתמש בשיטת העקומה הסטנדרטית לכימות מוחלט כדי לכמת את המוצר המוגבר ואת מספר עותק הגן בכל דגימה33.
6. הדמיה של גנים מחזורי מתאן במפת ביצות החוף של דרום טקסס
- פתח את תוכנת מערכת המידע הגיאוגרפי (GIS) ArcGIS Pro ושמור את קובץ הפרויקט עם השם Study Area בתיקייה שצוינה במחשב.
- לחץ על מפה בפינה השמאלית העליונה | מפת בסיס ובחר שטח עם תוויות כמפת הבסיס.
- לחץ על איתור | חפש וכאשר סרגל החיפוש נפתח, אתר את אזור המחקר על ידי הקלדת שם האזור; האזור יופיע.
- צייר את האזור הספציפי באמצעות הפניה גיאוגרפית.
- לחץ על תצוגה | חלונית קטלוג מהשכבה העליונה.
- לחץ פעמיים על תיקייה מהקטלוג | שם קובץ.
- לחץ לחיצה ימנית על קובץ מסד נתונים גיאוגרפי (.gdb) ולאחר מכן לחץ על חדש | מחלקת תכונה ויצירת מחלקת תכונות יופיעו.
- הקלד שם וכינוי ולחץ על סיום בתחתית.
- לחץ על תצוגה | תוכן. שם הכינוי יופיע בחלונית התוכן.
- לחץ על ערוך מהשכבה העליונה | יצירה. החלונית יצירת תכונות תיפתח. לחץ פעמיים על הכינוי בחלונית יצירת תכונות, והאפשרות קביעת תצורה של אפשרויות משוב של כלי תופיע.
- בחר קווים ולאחר מכן שרטט קווים על המפה כדי ליצור גבול חיצוני של אזור המחקר. לחץ פעמיים על המפה בסיום.
- מזער תוכנת GIS ולאחר מכן פתח גיליון עבודה. הקלד את שם הדגימה בעמודה הראשונה, הזן את קו הרוחב בעמודה השניה ואת קו האורך בעמודה השלישית. השתמש בארבע העמודות הבאות עבור נתוני qPCR של pmoA1, pmoA2, mmoX ו-mcrA.
- שמור את הקובץ בתבנית CSV בכל תיקיה ספציפית במחשב.
- פתח שוב את תוכנת ה-GIS ולחץ על הוסף נתונים | נתוני נקודת XY.
- בחר את קובץ ה- CSV מהתיקיה במחשב בתיבה טבלת קלט . שנה את שם הקובץ במחלקת תכונת הפלט ולאחר מכן לחץ על הפעל כדי להציג את נקודות הדגימה במפה.
- לחץ על סרגל ה-vsearch בחלק העליון וחפש ב-Kriging.
- בחר את קובץ תחנת הדגימה ולאחר מכן בחר pmoA1.
- לחץ על הסביבה | בחר את תחנת הדגימה בשכבה ובמסיכה | לחץ על הפעל.
- עקוב אחר הפרוטוקולים המוזכרים בשלבים 6.9, 6.10 ו-6.11 כדי ליצור Kriging עבור pmoA2, mmoX ו-mcrA עבור כל אזור המחקר.
- צור פריסה של המפה.
- לחץ על הוספה מהשכבה העליונה | פריסה חדשה ובחר ANSI - לרוחב.
- לחץ על מסגרת מפה, בחר את המפה עם הקריגינג, ומקם את כל המפות בפריסה על ידי ציור מלבן. פעולה זו תהפוך את המפה לגלויה בפריסה.
- בחר את החץ הצפוני ומקם אותו בפריסה כדי לציין את הכיוון צפון.
- בחר סרגל קנה מידה כדי להציג את קנה המידה של האזור במפה.
- לחץ על מקרא כדי להציג את המקרא, ולאחר מכן מקם אותו בפריסה.
- לחצו על Grid ובחרו באחת מאפשרויות ה-graticule השחור. פעולה זו תיצור את הרשת עם קווי האורך והרוחב ותציג אותה בחלונית התוכן עם התווית Black Horizontal Label Graticule.
- לחץ פעמיים על Black Horizontal Label Graticule ולאחר מכן בחר רכיבים. לחצו על Ticks 1 ו-Grid, והסירו את הרכיבים הללו על ידי לחיצה על סימן הצלב מימינם.
- לחץ על שתף מהשכבה העליונה ולאחר מכן לחץ על ייצוא פריסה. בחרו בסוג הקובץ כ - PDF, שמרו את הקובץ במחשב באמצעות התיבה 'שם', קבעו את הרזולוציה האנכית ל- 500 DPI ולחצו על 'ייצוא ' ליצירת קובץ PDF של המפה.
תוצאות
כדי להבין את התפוצה והשפע של גנים הקשורים למחזור CH4 (mcrA, pmoA1, pmoA2 ו-mmoX) בביצות החוף של דרום טקסס, ה-eDNA המופק מכל דגימה נותח על ידי cPCR ו-qPCR. פריימרים אוניברסליים עבור כל סמן ביולוגי נבחרו להפעלת cPCR ממחקרים קודמים (טבלה 1)22,34,35,36,37, ונעשו שינויים כדי לייעל את טמפרטורות החישול והריכוזים על סמך מאפייני הדגימה ותנאי הסביבה. לדוגמה, 16S rRNA, pmoA1 ו-pmoA2 לא התגברו באמצעות טמפרטורת החישול הסטנדרטית מכיוון שרובם הוגברו הרבה מתחת לטמפרטורת החישול הסטנדרטית (נתונים לא מוצגים). יתר על כן, במהלך תהליך ה-cPCR, ריכוז של 10 ננוגרם/מיקרוליטר DNA הראה פס מובהק עבור גנים pmoA1, pmoA2 ו-mmoX, בעוד ששימוש ב-5 ננוגרם/מיקרוליטר של DNA תבנית הראה פס בהיר יותר עבור גן mcrA (קובץ משלים 1-איור משלים S1).
ניתוח ה-cPCR חשף שונות מרחבית בזיהוי גנים על פני שלושה סוגים של ביצות חוף בדרום טקסס. כפי שמוצג בטבלה 2, גנים של mcrA זוהו בכל הדגימות מ-LB ו-RV, שהם ביצות מים מתוקים בחוף. עם זאת, cPCR לא הצליח לזהות שום גן mcrA במשקעים שנדגמו בביצת המים המלוחים, מה שמרמז על קשר פוטנציאלי בין מליחות להתפלגות מתאנוגן (קובץ משלים 1 - איור משלים S2). לזיהוי mcrA, נעשה שימוש בארבעה זוגות פריימרים במחקר זה, כולל MLF-MLR, MCRf-MCRr, ME1F-ME2R ו-McrA 159F-McrA 345R (טבלה 1); ביניהם, רק זוגות פריימר ML הצליחו לזהות קהילת מתאנוגן בביצות דרום טקסס (קובץ משלים 1 - איור משלים S2, איור משלים S3 ואיור משלים S4). לעומת זאת, עבור מתאנוטרופים אירוביים, הגן pmoA1 זוהה בכל דגימות הקרוואנים אך נעדר בדגימות LB ו-BC (קובץ משלים 1 - איור משלים S5). לזיהוי pmoA1, A189 שימש כפריימר קדימה ו-A682 ו-mb661 כפריימרים הפוכים, כאשר זוגות פריימרים A189-A682 יכולים לזהות גם amoA35,38. עם זאת, זוג פריימר זה הצליח לזהות נוכחות של גנים ב-cPCR במחקר זה שבו תמונות הג'ל הראו פס חלש מאוד, מה שמרמז על השפע הנמוך של הגן pmoA1. פריימר הפוך נוסף mb661 תוכנן לזהות את הגן pmoA1 במיוחד עם A189 כפריימר קדימה38. כאשר mb661 שימש כפריימר הפוך, ה-cPCR הראה פס בהיר יותר (קובץ משלים 1-איור משלים S6), ששימש מאוחר יותר ב-qPCR. מעניין לציין שהגן pmoA2 זוהה בשתי דגימות BC ודגימת LB אחת אך נעדר בדגימת RV אחת (קובץ משלים 1 - איור משלים S7). מחקר קודם מצא את טמפרטורת החישול כ-66 מעלות צלזיוס ו-60 מעלות צלזיוס עבור pmoA2, כאשר ב-60 מעלות צלזיוס נצפו שני מגברים בגדלים שונים, 245 ו-438 bp, בעוד שב-66 מעלות צלזיוס, פריימרים 206f-703b יכולים להגביר רק pmoA2 עם 438 bp גודל מוצר22. עם זאת, במחקר זה, ההגברה הצליחה בטמפרטורת חישול של 60 מעלות צלזיוס, ויצרה פס בגודל הצפוי (438 bp) באתרי LB ו-BC (קובץ משלים 1 - איור משלים S7). בנוסף, הגן mmoX זוהה בדגימת LB אך נעדר בדגימת RV אחת (קובץ משלים 1 - איור משלים S8) ונעדר לחלוטין בדגימות BC. זוגות הפריימרים ששימשו ל-mmoX התאימו גם לחקר ביצות דרום טקסס במחקר זה. טמפרטורת חישול של 55 מעלות צלזיוס36 ייצרה פס בהיר עבור mmoX ב-cPCR (קובץ משלים 1-איור משלים S8). כדי לאמת את תקינות הדגימה, 16S rRNA שימש כבקרה חיובית עם הגברה מוצלחת של 16S rRNA בכל הדגימות במהלך cPCR, מה שמצביע על כך שהדגימות לא היו מזוהמות (קובץ משלים 1 - איור משלים S9).
כדי להעריך שינויים זמניים ומרחביים בשפע הגנים, ניתוח qPCR נערך על כל הגנים הממוקדים באמצעות ערכות פריימר אופטימליות שזוהו ב-cPCR. ה-qPCR של הגנים pmoA2 ו-mmoX נערך עם אותם פריימרים המשמשים ב-cPCR. עם זאת, עבור הגן pmoA1, נעשה שימוש בזוג הפריימר A189-mb661, ועבור הגן mcrA, נבחר זוג הפריימר MLF-MLR, מכיוון ששניהם הניבו תוצאות טובות ב-cPCR. הבדלים עונתיים ושונות מליחות בין אדמות ביצות בדרום טקסס נלקחו בחשבון גם כן, מכיוון שהם יכולים להשפיע על הדינמיקה של הקהילה המיקרוביאלית. כפי שמוצג באיור 3 ובאיור 4, היה הבדל בשפע הגנים של מתאנוגנים ומתאנוטרופים בין שתי תקופות דגימה שונות. בעוד שלא הייתה שונות עונתית במליחות בביצות המים המתוקים החופיות, נצפה הבדל עונתי במליחות בביצות המים המלוחים החופיות39, מה שיכול להסביר את השונות בשפע המתאנוגן והמתאנוטרוף. איור 3 מראה שבמהלך העונה הקרירה, ה-mmoX היה נפוץ מאוד בכל אזורי הביצות האלה עם השפע הגבוה ביותר של 1.46 ×-104 עותקים למיקרוליטר. היה אחוז קטן של pmoA2 בתחנה אחת של LB, RV ו-BC. עם זאת, qPCR לא הצליח לזהות pmoA1 ו-mcrA בגלל השפע הנמוך במהלך העונה הקרירה. לעומת זאת, pmoA1 היה נפוץ בעיקר בעונה החמה עם השכיחות הגבוהה ביותר של 2.44 ×-103 עותקים למיקרוליטר (איור 4). ה-mmoX וה-mcrA זוהו גם בדגימות המשקעים על פני השטח של LB (בטווח של 50 הס"מ העליונים), והראו את השפע המרבי של 1.92 ×-102 עותקים למיקרוליטר ו-2.04 ×-102 עותקים/מיקרוליטר, בהתאמה, למרות שכיחותם הנמוכה יחסית בעונה החמה. מעניין לציין שבמהלך העונה החמה, pmoA2 לא זוהה כלל, ואף אחד מגני המטרה לא זוהה בדגימות BC, ככל הנראה בהשפעת גורמים סביבתיים ייחודיים לביצת המים המלוחיםהזו 39 במהלך העונה החמה בדרום טקסס.
מחקר זה מדגים וריאציות מרחביות ועונתיות מובהקות בהתפלגות הגנים הקשורים למחזור CH4 על פני ביצות החוף. באופן ספציפי, גנים mcrA זוהו רק בדגימת LB של מים מתוקים, מה שמרמז על העדפת בית גידול. הגנים mmoX ו-pmoA2 היו נוכחים בכל הדגימות בעונות הקרירות, בעוד ש-pmoA1 הוצג בסביבות מים מתוקים בעונות חמות. תוצאות אלה מדגישות את ההשפעה של תנאי הסביבה ושינויים עונתיים על פעילויות מיקרוביאליות הקשורות לרכיבה על CH4 . ויזואליזציה משופרת באמצעות אינטרפולציה של קריגינג, כפי שמוצג באיור 3 ובאיור 4, קידמה את הבנתנו את הפעילויות המיקרוביאליות הקשורות למחזור CH4 במערכות אקולוגיות של ביצות חופיות.
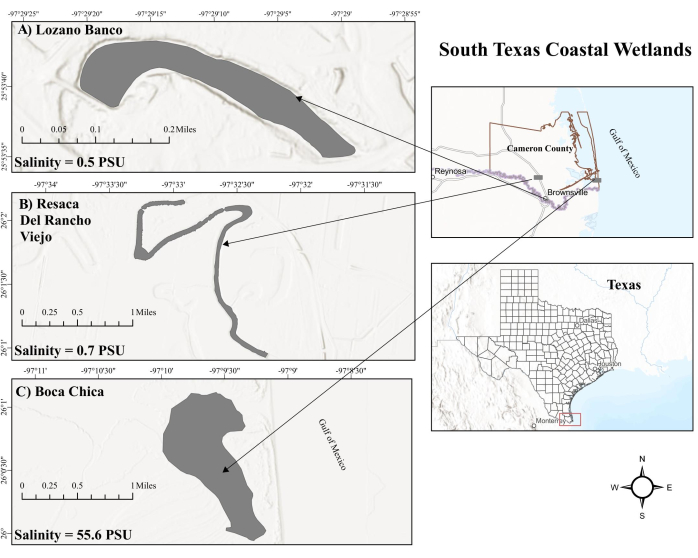
איור 1: מפה של ביצות החוף של דרום טקסס. (א) לוזאנו בנקו. LB היא ביצת מים מתוקים על החוף. (ב) Resaca del Rancho Viejo. RV הוא גם ביצת מים מתוקים על החוף. (ג) ביצת בוקה צ'יקה. BC היא ביצת מים מלוחים היפר-מלוחים המושפעת מגאות ושפל. קיצורים: LB = Lozano Banco; RV = Resaca Del Rancho Viejo; BC = בוקה צ'יקה; PSU = יחידות מליחות מעשיות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
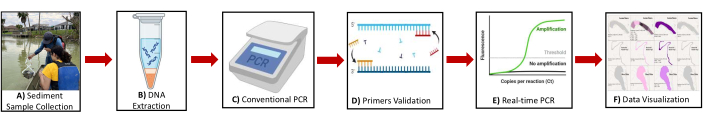
איור 2: דיאגרמה סכמטית המציגה את הסקירה הכללית של הפרוטוקול. המחשה של השלבים העיקריים כוללת: (א) איסוף דגימות משקעים (B) מיצוי DNA (C) PCR קונבנציונלי (D) אימות פריימר (E) PCR בזמן אמת (F) הדמיית נתונים לזיהוי גנים ביולוגיים של מתאנוגן ומתאנוטרופים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
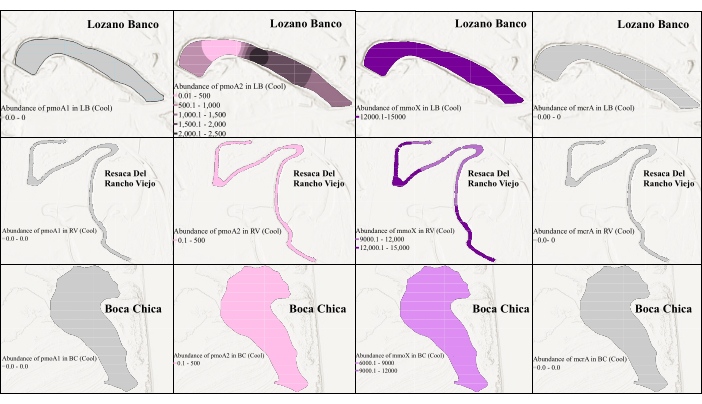
איור 3: התפלגות מרחבית של גנים של מתנוגן וסמנים ביולוגיים של מתאנוטרופים בעונה הקרירה. האיור מראה את השפע של mmoX במהלך העונה הקרירה. כאן, הצבע האפור מצביע על כך שה-qPCR לא הצליח לזהות את הגן בגלל שפע נמוך. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: התפלגות מרחבית של גנים של מתאנוגן וסמנים ביולוגיים של מתאנוטרופים בעונה החמה. כאן, הצבע האפור מייצג שה-qPCR לא הצליח לזהות את הגן בשל השפע הנמוך שלו. האיור מראה את השפע של pmoA1 במהלך העונה החמה ב-Lozano Banco וב-Resaca Del Rancho Viejo, בעוד שלא זוהה שפע בבוקה צ'יקה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| שם פריימר | גן | טמפרטורת חישול (°C) במחקר זה | אורך המוצר (bp) | רצף (5'-3') | הפניה | |
| 1055ו | 16S rRNA | 55 | 337 | ATGGCTGTCGTCAGCT | (Harms et al., 2003) | |
| 1392R | ACGGGCGGTGTAC | |||||
| A189F | pmoA1 | 55 | 525 | GGNGACTGGGACTTCTGG | (הולמס ואחרים, 1995) | |
| A682R | GAASGCNGAGAAGAASGC | |||||
| A189F | 56 | 470 | GGNGACTGGGACTTCTGG | (קוסטלו ולידסטרום, 1999) | ||
| mb661R | CCG GMG CAA CGT CYT TACC | |||||
| 206ו | pmoA2 | 60 | 438 | GGNGACTGGGACTTCTG GATCGACTTCAAGGATCG | (Tchawa Yimga et al., 2003) | |
| 703ב | GAASGCNGAGAAGAASGC GGCGACCGGAACGACGT | |||||
| 536ו | ממוקס | 55 | 362 | CGCTGTGGAAGGGCATGAAGCG | (פיוז ואחרים, 1998) | |
| 898R | GCTCGACCTTGAACTTGGAGCC | |||||
| MCRf | מק"ר | 46 | ~490 | TAYGAYCARATHTGGYT | (ספרינגר ואחרים, 1995) | |
| MCRr | ACRTTCATNGCRTARTT | |||||
| ME1F | 50 | 763 | GCMATGCARATHGGWATGTC | (Hales et al., 1996) | ||
| ME2R | TCATKGCRTAGTTDGGRTAGT | |||||
| MLF | 55 | ~470 | GGTGGTGTMGGATTCA CACARTAYGCWACAGC | (לוטון ואחרים, 2002) | ||
| מ.ל.ר | TTCATTGCRTAGTTWGGRTAGTT | |||||
| McrA 159F | 62 | 186 | AAAGTGCGGAGCAGCAATCACC | (Vaksmaa et al., 2017) | ||
| McrA 345R | TCGTCCCATCTCTGCTGCATTGC | |||||
טבלה 1: ערכות פריימר המשמשות במחקר זה לאיתור גנים פונקציונליים הקשורים למחזור מתאן. כל זוגות הפריימרים הללו שימשו ל-PCR קונבנציונלי, ולבסוף, הנועזים הוקמו לאיתור גנים הקשורים למתנוגן ומתאנוטרופים בביצות החוף של דרום טקסס.
| גן | דגימות | ||||||||
| לוזאנו בנקו | Resaca Del Rancho Viejo | בוקה צ'יקה | |||||||
| ליב-1 | RV-1 | RV-2 | M1 | מ"ר | ב1 | ב2 | MG1 | MG2 | |
| pmoA1 | - | + | + | - | - | - | - | - | - |
| pmoA2 | + | + | + | - | + | - | - | + | - |
| ממוקס | + | - | + | - | - | - | - | - | - |
| מק"ר | + | + | + | - | - | - | - | - | - |
טבלה 2: איתור גנים בשלושה סוגים שונים של גופי מים בעונה הקרירה באמצעות PCR קונבנציונלי. '+', נוכח; '-', נעדר. קיצורים: LB = Lozano Banco, RV = Resaca del Rancho Viejo, M = בוץ, B = Batis, MG = מנגרוב.
קובץ משלים 1: תמונות אלקטרופורזה של ג'ל עבור גנים mcrA, pmoA1, pmoA2, mmoX ו-16S rRNA. אנא לחץ כאן להורדת קובץ זה.
Discussion
ביצות חוף מוכרות כתורמות משמעותיות למתאן אטמוספרי, גז חממה חשוב40. למרות שהיו מחקרים על שטף מתאן ומתאנוגנים באזורי ביצות 41,42,43, מעט ידוע על האופן שבו מתאנוטרופים פועלים בסביבות שונות או תחת שיטות ניהול שונות, במיוחד באזורי ביצות עם מפלס מים משתנה 44. יתר על כן, נוכחותם הנרחבת של מעכבים כגון חומצות הומיות ב-eDNA מסבכת תהליכי מיצוי והגברה45, מה שעלול להוביל לתוצאות שליליות כוזבות46. אתגר זה מסובך עוד יותר על ידי היעילות המשתנה של פריימרים העובדים על eDNA, מה שמרמז על הצורך באימות שיטתי במחקרים כאלה47. לפיכך, מחקר זה מבסס מתודולוגיה בסיסית להבנת מחזור מתאן בביצות החוף של דרום טקסס. על ידי התמקדות בפיתוח ואימות של טכניקות PCR, מחקר זה מקדם את האיתור של גנים מרכזיים של מחזור מתאן במערכות אקולוגיות דינמיות אלה.
אחד ההיבטים הקריטיים של מחקר זה הוא הדמיה של גנים הקשורים למחזור מתאן מיקרוביאלי, הממלא תפקיד מכריע בהתבוננות בדפוסי ההתפלגות המרחבית של גנים אלה על פני עונות שונות ושיפועי מליחות. הדמיה כזו אינה רק כלי משלים; זה חיוני לזיהוי אזורים עם נוכחות משמעותית של חיידקים מתאנוגניים ומתאנוטרופיים המצביעה על כך שיכול להיות מחזור מתאן פוטנציאלי, ובכך לשפר את ההבנה שלנו לגבי התנאים הסביבתיים המשפיעים על תהליכים אלה.
במחקר זה, המתודולוגיה צוינה לזיהוי גנים של סמני מתאנוגן ומתאנוטרוף כגון pmoA1, pmoA2, mmoX ו-mcrA באמצעות cPCR ו-qPCR. נעשה שימוש בארבעה זוגות פריימרים המכוונים לגן mcrA ושני זוגות המכוונים לגן pmoA1 , ורק זוג אחד מכל קבוצה זיהה ביעילות את הגנים הללו הן ב-PCR קונבנציונלי והן בזמן אמת. מחקר קודם השתמש בשלושה זוגות פריימרים לזיהוי pmoA1; ביניהם, פריימרים A189-A682 לא הצליחו לזהות את מגוון המתאנוטרוף. במקום זאת, הם הגבירו בעיקר את הגן amoA והניבו תוצרי PCR לא ספציפיים48. מחקר זה מצא כי זוג הפריימרים ששימש היה יעיל לזיהוי הגן pmoA1 רק בסביבות עם אוכלוסייה גבוהה של מתאנוטרופים. יתר על כן, השפע הגבוה ביותר של מתאנוטרופים הושג באמצעות זוגות פריימרים A189-mb661 במחקר זה, מה שמצביע על כך שפריימרים אלה מתאימים למערכות אקולוגיות של מים מתוקים48. לפיכך, זוגות פריימר אלה שימשו ל-qPCR כניתוח נוסף.
בין ארבעת זוגות הפריימרים ששימשו ל-mcrA, פריימרים ML הצליחו להגביר מיני מתאנוגן בכל הסביבות49. לפריימרים ME יש טווח הגברה צר; הם לא יכולים לזהות כל מיני מתאנוגן בסוגים שונים של סביבות טבעיות. לפריימרים MCR יש רמה גבוהה של ניוון, מה שהופך אותם לרגישים לטמפרטורת חישול PCR. ניוון זה מאפשר להם להיקשר למגוון רחב של רצפי מטרה, ולעתים קרובות להכיל אי-התאמות מרובות. עם זאת, זה גם מצביע על כך ששינוי קטן בטמפרטורת החישול יכול להשפיע באופן משמעותי על יעילות הקישור והספציפיות שלהם ולהוביל להגברה לא מספקת וכתוצאה מכך לתוצאות שליליות כוזבות עבור מיני המתאנוגן49,50.
מצד שני, בקהילת המתאנוגן בעלת המגוון הנמוך, במהלך השלבים האחרונים של PCR, הצטברות גבוהה של מוצרי PCR מובילה לחישול מחדש של התבנית ומונעת קשירה של פריימרים, שגם לא מצליחים לזהות את הרצועות הרצויות49. מעניין לציין שזוגות פריימרים McrA 159F-McrA 345R תוכננו במיוחד כדי לזהות Candidatus M. nitroreducens archaea51 מתאנוטרופי אנאירובי תלוי חנקה, ומחקר זה לא הצליח לזהות מתאנוטרופים אנאירוביים באמצעות זוגות פריימר אלה. עם זאת, ניתן לחבר את החמצון האנאירובי של מתאן (AOM) להפחתה של מקבלי אלקטרונים חלופיים כגון ברזל (Fe), מנגן (Mn) וסולפט (SO42-)52, מה שעשוי להסביר את חוסר היכולת לזהות ANME בשיטה זו. יתר על כן, זה יכול להיות בגלל התנאים הסביבתיים הספציפיים של אזור המחקר. לפיכך, עבור qPCR, נעשה שימוש בפריימרים של ML לאיתור שפע מתאנוגן, מכיוון שהוא סיפק הגברה אמינה גם בתנאים של מגוון קהילתי נמוך49.
בנוסף, מעכבי PCR כגון חומצות הומיות או DNA של מינים שאינם מטרה נמצאים באופן נרחב בדגימות סביבתיות, מה שיכול להפחית את יעילות ה-PCR53. מכיוון שהריכוז הגבוה של ה-DNA לא יכול היה לזהות גן כלשהו על ידי cPCR, כל דגימות ה-DNA דוללו לפני הפעלת cPCR כדי להפחית את ההשפעה של מעכבי PCR54. הגן 16S rRNA, כסמן אוניברסלי לחיידקים וארכאונים, סיפק בסיס חזק לאימות תנאי ה-PCR שלנו ולאישור שלמות ה-DNA בכל הדגימות55,56. עם זאת, אזורי מים מלוחים מוכרים כבעלי ריכוזים גבוהים יותר של מעכבי PCR46. יתר על כן, מליחות משפיעה בעקיפין על פליטת CH4 בביצות החוף, מכיוון שהיא קשורה לריכוזי סולפט. מליחות גבוהה יותר בביצות מים מלוחים קשורה לרמות סולפט גבוהות המדכאות את ייצור המתאן עקב תחרות בין חיידקים מפחיתי סולפט ומתאנוגנים, בעוד שריכוזי סולפט נמוכים יותר בביצות מים מתוקים מביאים לפליטת מתאן גבוהה יותר11,41. בנוסף, הבדלי פליטת CH4 בין מים מלוחים לביצות מים מתוקים מושפעים גם מקשרי הגאות והשפל שלהם לאוקיינוס57, מה שעשוי גם להסביר את הזיהוי הלא מוצלח של גנים הקשורים למחזור מתאן על ידי cPCR ב-BC. במחקר זה, cPCR זיהה בהצלחה את כל הגנים הממוקדים בדגימות LB ו-RV אך לא הצליח לזהות את נוכחותם של גנים אלה בדגימות BC, כאשר הגן pmoA2 היה היוצא מן הכלל היחיד. יתר על כן, qPCR הצליח לזהות mmoX בכל הדגימות, בעוד ש-cPCR לא הצליח לזהות אותו ב-BC. זה מצביע על כך ש-qPCR מראה עמידות רבה יותר למעכבי PCR בהשוואה ל-cPCR, המיוחסת לרגישות המוגברת שלו במנגנוני זיהוי58. סיבה נוספת היא ש-qPCR מזהה מוצרי PCR בשלב האקספוננציאלי של מחזור ה-PCR, בעוד ש-cPCR מזהה אותם בשלב המישור. הבחנה זו מאפשרת ל-qPCR להפגין רגישות מופחתת לפירוק המוצר במהלך מחזורי תגובה מתקדמים, שבהם ריאגנטים מתרוקנים47.
מחקר זה ביסס טכניקת PCR לזיהוי גנים הקשורים למחזור מתאן בביצות החוף של דרום טקסס כדי להתגבר על האתגרים הקשורים למעכבי PCR ויעילות פריימר משתנה. נעשה שימוש בארבעה זוגות פריימרים המכוונים לגן mcrA ושני זוגות המכוונים לגן pmoA1 , ורק זוג אחד מכל קבוצה זיהה ביעילות את הגנים הללו הן ב-PCR קונבנציונלי והן בזמן אמת. מחקר זה מסכם את מערך זוגות הפריימרים לגנים הקשורים למחזור מתאן, כולל a189-mb6661 עבור pmoA1, 206f-703b עבור pmoA2, 536F-898R עבור mmoX ו-ML עבור mcrA. זה מצביע על החשיבות של בחירת פריימר מתאימה לזיהוי גנים הקשורים למחזור מתאן בביצות החוף, עם אלה בדרום טקסס כדוגמאות. יתר על כן, המחקר הראה כי mmoX היה נפוץ ביותר במהלך העונה הקרירה בעוד ש-pmoA1 היה בשפע במהלך העונה החמה.
לפיכך, תוצאות מחקר זה מספקות את הבסיס להבנה מדעית של תהליכים מיקרוביאליים המעורבים במחזור מתאן, ומדגישות את ההשפעה של גורמים סביבתיים על פני שינויים עונתיים ומרחביים בביצות החוף של דרום טקסס. בהתבסס על ממצאים אלה, מחקרים עתידיים שואפים לתקף גישה זו במערכות אקולוגיות אחרות, כגון שדות אורז וביצות מים מתוקים כדי להגביר את החוסן ויכולת ההכללה. יתר על כן, מחקרים אלה יכללו גם ניתוח גיאוכימי כגון ריכוזי מתאן במשקעים וגופרית מי נקבוביות, וטכניקות מולקולריות כגון מטגנומיקה וטרנסקריפטומיקה, שיתבססו על עבודת יסוד זו כדי לספק הבנה מקיפה יותר של דינמיקת מחזור המתאן.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
אנו מודים לחברי C-REAL על עזרתם בתצפיות בשטח וניתוחי מעבדה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tubes | ThermoFisher Scientific | AB0620 | https://www.thermofisher.com/order/catalog/product/AB0620?SID=srch-srp-AB0620 |
| 0.5 mL PCR Tubes | Promega | E4941 | https://www.promega.com/products/biochemicals-and-labware/tips-and-accessories/0_5ml-pcr-tubes/?catNum=E4941 |
| 10 μL tips | ThermoFisher Scientific | 05-408-187 | Fisherbrand SureGrip Pipet Tip Racked or Reload System Tips Natural; 10μL; | Fisher Scientific |
| 15 mL centrifuge tube | ThermoFisher Scientific | 14-959-53A | https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/p-193301 |
| 200 μL tips | ThermoFisher Scientific | 05-408-190 | Fisherbrand SureGrip Pipet Tip Racked or Reload System Tips Natural; 200μL; | Fisher Scientific |
| 1000 μL tips | ThermoFisher Scientific | 02-707-402 | https://www.fishersci.com/shop/products/sureone-micropoint-pipette-tips-specific-standard-fit/02707402?gclid=Cj0KCQiAp NW6BhD5ARIsACmEb kUsQ9Lu0YIq5i4vWege 17qPdtxIYZyvmJH1cDo ARuwereO1V4GLz9UaA lDREALw_wcB&ef_id=C j0KCQiApNW6BhD5ARI sACmEbkUsQ9Lu0YIq5i 4vWege17qPdtxIYZyvmJ H1cDoARuwereO1V4GLz 9UaAlDREALw_wcB:G:s &ppc_id=PLA_goog_2175 7693617_171052169911_02 707402__715434303113_1555 377385658230343&ev_chn=sh op&s_kwcid=AL!4428!3!71543430 3113!!!g!2366517300713!&gad_source=1 |
| Applied Biosystem Power SYBR Green Master Mix | ThermoFisher Scientific | 4368577 | https://www.thermofisher.com/order/catalog/product/4368577 |
| ArcGIS Pro | esri | https://www.esri.com/en-us/arcgis/products/arcgis-pro/overview?srsltid=AfmBOopatJ4 JvHJfscHRcAaDx0Jz5_Jrl8l5 vYkkBvfOqE-uNSsMghN1 | |
| CFX Duet Real-Time PCR system | Bio-Rad | 12016265 | https://www.bio-rad.com/en-us/product/cfx-duet-real-time-pcr-system?ID=97722926-9ed9-16a4-1d83-c92f587e427a |
| Corning Lambda plus single channel pipettor volume 0.5-10 μL | Sigma-Aldrich | CLS4071-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4071 |
| Corning Lambda plus single channel pipettor volume 100-1000 μL | Sigma-Aldrich | CLS4075-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4075 |
| Corning Lambda plus single channel pipettor volume 20-200 μL | Sigma-Aldrich | CLS4074-1EA | https://www.sigmaaldrich.com/US/en/product/sigma/cls4074 |
| FastDNA spin kit for soil | MP Biomedical | 116560200-CF | https://www.mpbio.com/us/116560000-fastdna-spin-kit-for-soil-samp-cf?srsltid=AfmBOoqOxxGilzY3IHNIZR ajegGTr9MoX1oMZUh 3dcbJqe0UvvukY128 |
| Gene copy calculator | Science Primer | https://scienceprimer.com/copy-number-calculator-for-realtime-pcr . | |
| High speed benchtop centrifuge | ThermoFisher Scientific | 75004241 | https://newlifescientific.com/products/thermo-scientific-sorvall-st16-high-speed-benchtop-centrifuge-75004241?gad_source=1&gclid=Cj0KCQiApN W6BhD5ARIsACmEbkVC_-cCIN9j 20TvYq8iDsBlUR5cPK_1_wN OBEcjMdv-CYVoGCfeOLYaAv enEALw_wcB |
| High speed microcentrifuge | VWR | 75838-336 | https://us.vwr.com/store/product/20546590/null |
| Lysing Matrix E tube | glass bead/ceramic sphere-containing tube | ||
| Microcentrifuge tube | ThermoFisher Scientific | 02-681-320 | https://www.fishersci.com/shop/products/fisherbrand-low-retention-microcentrifuge-tubes-8/02681320?gclid=Cj0KCQiAp NW6BhD5ARIsACm EbkWbG4_o3oUiGk HJPU-_31-CuexDwQ fmWPnfyhBOf2BHXsy K3fFW1toaAgJbEALw_ wcB&ef_id=Cj0KCQiAp NW6BhD5ARIsACmEb kWbG4_o3oUiGkHJPU- _31-CuexDwQfmWPnfy hBOf2BHXsyK3fFW1toa AgJbEALw_wcB:G:s&ppc _id=PLA_goog_21757693 617_171052169911_0268 1320__715434303113_10 349826094968484711&ev _chn=shop&s_kwcid=AL!4 428!3!715434303113!!!g!23 66517300713!&gad_source=1 |
| PCR Master mix | Promega | M7502 | https://www.promega.com/products/pcr/taq-polymerase/master-mix-pcr/?catNum=M7502 |
| Quantiflour ONE dsDNA system | Promega | E4871 | https://www.promega.com/products/rna-analysis/dna-and-rna-quantitation/quantifluor-one-dsdna-system/?gad_source=1&gbraid=0AAAAAD _rg189yJTY3cxeVqMdu8RPx10 Ma&gclid=CjwKCAjwxNW2BhAk EiwA24Cm9FUgViPNyWq7UfZL VeeoroLAZ5JIP6w07RGK_4D0w oZgAqf-G1XTmxoCxm8QAvD_B wE&catNum=E4871 |
| Quantus Fluorometer | Promega | E6150 | https://www.promega.com/products/microplate-readers-fluorometers-luminometers/fluorometers/quantus-fluorometer/?catNum=E6150 |
| YSI Pro 2030 | YSI a xylem brand | 603174 | https://www.ysi.com/product/id-p2030/pro2030-kits |
References
- Xu, T., et al. Wetlands of international importance: Status, threats, and future protection. Int J Environ Res Public Health. 16 (10), 1818 (2019).
- Corn, M. L. . Deepwater Horizon oil spill: coastal wetland and wildlife impacts and response. , (2010).
- Hendriks, I. E., Sintes, T., Bouma, T. J., Duarte, C. M. Experimental assessment and modeling evaluation of the effects of the seagrass Posidonia oceanica on flow and particle trapping. Marine Ecology Progress Series. 356, 163-173 (2008).
- Krause, S. J. E., Treude, T. Deciphering cryptic methane cycling: Coupling of methylotrophic methanogenesis and anaerobic oxidation of methane in hypersaline coastal wetland sediment. Geochimica et Cosmochimica Acta. 302, 160-174 (2021).
- Reddy, K. R., DeLaune, R. D., Inglett, P. W. . Biogeochemistry of Wetlands: Science and Applications. , (2022).
- La, W., et al. Sulfate concentrations affect sulfate reduction pathways and methane consumption in coastal wetlands. Water Research. 217, 118441 (2022).
- Derwent, R. G. Global warming potential (GWP) for methane: Monte Carlo analysis of the uncertainties in Global Tropospheric Model predictions. Atmosphere. 11 (5), 486 (2020).
- Potter, C., et al. Methane emissions from natural wetlands in the United States: Satellite-derived estimation based on ecosystem carbon cycling. Earth Interactions. 10 (22), 1-12 (2006).
- . Understanding global warming potentials Available from: https://www.epa.gov/ghgemissions/understanding-global-warming-potentials (2024)
- Wallenius, A. J., Dalcin Martins, P., Slomp, C. P., Jetten, M. S. M. Anthropogenic and environmental constraints on the microbial methane cycle in coastal sediments. Front Microbiol. 12, 631621 (2021).
- Qu, Y., et al. Salinity causes differences in stratigraphic methane sources and sinks. Environmental Science and Ecotechnology. 19, 100334 (2024).
- Vizza, C., West, W. E., Jones, S. E., Hart, J. A., Lamberti, G. A. Regulators of coastal wetland methane production and responses to simulated global change. Biogeosciences. 14 (2), 431-446 (2017).
- van Dijk, G., et al. Salinization lowers nutrient availability in formerly brackish freshwater wetlands; unexpected results from a long-term field experiment. Biogeochemistry. 143 (1), 67-83 (2019).
- Aronson, E., Allison, S., Helliker, B. R. Environmental impacts on the diversity of methane-cycling microbes and their resultant function. Front Microbiol. 4, 225 (2013).
- Reeburgh, W. S. Oceanic methane biogeochemistry. Chem Rev. 107 (2), 486-513 (2007).
- Thauer, R. K. Biochemistry of methanogenesis: a tribute to Marjory Stephenson. Marjory Stephenson Prize Lecture. Microbiology (Reading). 144 (Pt 9), 2377-2406 (1998).
- Thauer, R. K. Anaerobic oxidation of methane with sulfate: on the reversibility of the reactions that are catalyzed by enzymes also involved in methanogenesis from CO2. Curr Opin Microbiol. 14 (3), 292-299 (2011).
- Friedrich, M. W. Methyl-coenzyme M reductase genes: Unique functional markers for methanogenic and anaerobic methane-oxidizing Archaea. Methods in Enzymology. 397, 428-442 (2005).
- Reeburgh, W. S. Oceanic methane biogeochemistry. Chem Rev. 107 (2), 486-513 (2007).
- Rasigraf, O., Schmitt, J., Jetten, M. S. M., Lüke, C. Metagenomic potential for and diversity of N-cycle driving microorganisms in the Bothnian Sea sediment. Microbiologyopen. 6 (4), e00475 (2017).
- McDonald, I. R., Bodrossy, L., Chen, Y., Murrell, J. C. Molecular ecology techniques for the study of aerobic methanotrophs. Appl Environ Microbiol. 74 (5), 1305-1315 (2008).
- Tchawa Yimga, M., Dunfield, P. F., Ricke, P., Heyer, J., Liesack, W. Wide distribution of a novel pmoA-like gene copy among type II methanotrophs, and its expression in Methylocystis strain SC2. Appl Environ Microbiol. 69 (9), 5593-5602 (2003).
- Knief, C. Diversity and habitat preferences of cultivated and uncultivated aerobic methanotrophic bacteria evaluated based on pmoA as molecular marker. Front Microbiol. 6, 1346 (2015).
- Huang, I. -. S., et al. Preliminary assessment of microbial community structure of Wind-Tidal Flats in the Laguna Madre, Texas, USA. Biology. 9 (8), 183 (2020).
- Wilding, T. K., Brown, E., Collier, K. J. Identifying dissolved oxygen variability and stress in tidal freshwater streams of northern New Zealand. Environ Monit Assess. 184 (10), 6045-6060 (2012).
- Roy Chowdhury, T., Mitsch, W. J., Dick, R. P. Seasonal methanotrophy across a hydrological gradient in a freshwater wetland. Ecological Engineering. 72, 116-124 (2014).
- Sun, Q. -. Q., et al. Carbon dioxide and methane fluxes: Seasonal dynamics from inland riparian ecosystems, northeast China. Sci Total Environ. 465, 48-55 (2013).
- Lee, S., et al. Comparison and selection of conventional PCR primer sets for studies associated with nitrogen cycle microorganisms in surface soil. Appl Sci. 12 (20), 10314 (2022).
- Bae, K. -. S., et al. Development of diagnostic systems for wide range and highly sensitive detection of two waterborne hepatitis viruses from groundwater using the conventional reverse transcription nested PCR assay. J Virol Methods. 299, 114344 (2022).
- Lecusay, D. . Assessment and Monitoring of Deltaic Wetlands and Fluvial Systems: Refining and Validating a Multimetric Index of Resaca Ecosystem Health. , (2021).
- . FastDNA SPIN Kit for Soil (Cat No. 116560200) Available from: https://www.mpbio.com/media/productattachment/LS082019-EN-FastDNA-SPIN-Kit-for-Soil-116560200-Manual.pdf (2025)
- Luton, P. E., Wayne, J. M., Sharp, R. J., Riley, P. W. The mcrA gene as an alternative to 16S rRNA in the phylogenetic analysis of methanogen populations in landfill. Microbiology (Reading, England). 148 (Pt 11), 3521-3530 (2002).
- Changsoo, L., Jaai, K., Seung Gu, S., Seokhwan, H. Absolute and relative QPCR quantification of plasmid copy number in Escherichia coli. J Biotechnol. 123 (3), 273-280 (2006).
- Harms, G., et al. Real-time PCR quantification of nitrifying bacteria in a municipal wastewater treatment plant. Environ Sci Technol. 37 (2), 343-351 (2003).
- Holmes, A. J., Costello, A., Lidstrom, M. E., Murrell, J. C. Evidence that particulate methane monooxygenase and ammonia monooxygenase may be evolutionarily related. FEMS Microbiol Lett. 132 (3), 203-208 (1995).
- Fuse, H., et al. Oxidation of trichloroethylene and dimethyl sulfide by a marine Methylomicrobium strain containing soluble methane monooxygenase. Biosci Biotechnol Biochem. 62 (10), 1925-1931 (1998).
- Springer, E., Sachs, M. S., Woese, C. R., Boone, D. R. Partial gene sequences for the A subunit of methyl-coenzyme M reductase (mcrI) as a phylogenetic tool for the family Methanosarcinaceae. Int J Syst Bacteriol. 45 (3), 554-559 (1995).
- Costello, A. M., Lidstrom, M. E. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments. Appl Environ Microbiol. 65 (11), 5066-5074 (1999).
- Flores, E. A. . Effects of Nutrient Enrichment on Mangrove and Saltmarsh Habitats. , (2022).
- Minjie, H., Jordi, S., Xianyu, Y., Josep, P., Chuan, T. Patterns and environmental drivers of greenhouse gas fluxes in the coastal wetlands of China: A systematic review and synthesis. Environ Res. 186, 109576 (2020).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Liu, D. Y., Ding, W. X., Jia, Z. J., Cai, Z. C. Relation between methanogenic archaea and methane production potential in selected natural wetland ecosystems across China. Biogeosciences. 8 (2), 329-338 (2011).
- Ke, Z., et al. Methane emissions and methanogenic community investigation from constructed wetlands in Chengdu City. Urban Climate. 39, 100956 (2021).
- Chowdhury, T. R., Dick, R. P. Ecology of aerobic methanotrophs in controlling methane fluxes from wetlands. Applied Soil Ecology. 65, 8-22 (2013).
- Maja, S., et al. Humic substances cause fluorescence inhibition in real-time polymerase chain reaction. Anal Biochem. 487, 30-37 (2015).
- Sanches, T. M., Schreier, A. D. Optimizing an eDNA protocol for estuarine environments: Balancing sensitivity, cost and time. PLOS ONE. 15 (5), e0233522 (2020).
- Xia, Z., et al. Conventional versus real-time quantitative PCR for rare species detection. Ecol Evol. 8 (23), 11799-11807 (2018).
- Bourne, D. G., McDonald, I. R., Murrell, J. C. Comparison of pmoA PCR primer sets as tools for investigating methanotroph diversity in three Danish soils. Appl Environ Microbiol. 67 (9), 3802-3809 (2001).
- Juottonen, H., Galand, P. E., Yrjala, K. Detection of methanogenic Archaea in peat: comparison of PCR primers targeting the mcrA gene. Res Microbiol. 157 (10), 914-921 (2006).
- Lueders, T., Friedrich, M. W. Evaluation of PCR amplification bias by terminal restriction fragment length polymorphism analysis of small-subunit rRNA and mcrA genes by using defined template mixtures of methanogenic pure cultures and soil DNA extracts. Appl Environ Microbiol. 69 (1), 320-326 (2003).
- Vaksmaa, A., Jetten, M. S., Ettwig, K. F., Luke, C. McrA primers for the detection and quantification of the anaerobic archaeal methanotroph 'Candidatus Methanoperedens nitroreducens'. Appl Microbiol Biotechnol. 101 (4), 1631-1641 (2017).
- Ren, G., et al. Electron acceptors for anaerobic oxidation of methane drive microbial community structure and diversity in mud volcanoes. Environ Microbiol. 20 (7), 2370-2385 (2018).
- Goldberg, C. S., et al. Critical considerations for the application of environmental DNA methods to detect aquatic species. Methods in Ecology and Evolution. 7 (11), 1299-1307 (2016).
- McKee, A. M., Spear, S. F., Pierson, T. W. The effect of dilution and the use of a post-extraction nucleic acid purification column on the accuracy, precision, and inhibition of environmental DNA samples. Biological Conservation. 183, 70-76 (2015).
- Gohl, D. M., et al. Systematic improvement of amplicon marker gene methods for increased accuracy in microbiome studies. Nat Biotechnol. 34 (9), 942-949 (2016).
- Ballarini, A., Segata, N., Huttenhower, C., Jousson, O. Simultaneous quantification of multiple bacteria by the BactoChip microarray designed to target species-specific marker genes. PLOS ONE. 8 (2), e55764 (2013).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: A review. Eur J Soil Biol. 37 (1), 25-50 (2001).
- Smith, C. J., Osborn, A. M. Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology. FEMS Microbiol Ecol. 67 (1), 6-20 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved