Method Article
哺乳類の細胞分裂量的共焦点反射顕微鏡を介して 3 D 行列
* これらの著者は同等に貢献しました
要約
このプロトコルは細胞分裂の同期を統合することで効率的に 3 D コラーゲン マトリックス中の哺乳類の細胞分裂を研究生細胞イメージング、共焦点反射の時間分解顕微鏡を使用して 3 D の行列の部イベントの監視定量画像解析。
要約
どの哺乳類の細胞分裂の研究の規制 3 d 環境生理学的な関連性や治療の意義にもかかわらず主として未踏のままです。探査の欠如の原因は、実験的限界と非効率的な三次元培養における細胞分裂の研究をレンダリング技術の課題です。ここでは、哺乳類の細胞分裂と細胞マトリックス 3 D コラーゲン マトリックス相互作用を効率的に勉強するイメージング ベースの方法をについて説明します。蛍光 H2B の付いたセルは、機械的振り払いテクニックが続きます、チミジンをブロックし、ノコダゾール治療の組み合わせを使用して同期されます。同期セルに 3 D コラーゲン マトリックスに埋め込まれています。細胞分裂は細胞の顕微鏡を使用して監視されます。コラーゲン線維の変形中に、細胞分裂、細胞マトリックスの相互作用の指標である後の監視し、量的共焦点反射の顕微鏡検査を使用して量を示されます。メソッドは、哺乳類の細胞分裂と細胞マトリックス相互作用の生理学的関連性の高い 3 D 環境での勉強を効率的かつ一般的なアプローチを提供します。このアプローチは、正常組織および病気の開発の分子基盤に新しい洞察力を提供するだけでなく、新規診断と治療的アプローチの設計ができます。
概要
細胞分裂は、うち規制組織や臓器の開発において重要な役割を果たしている細胞の生命の重大なイベントです。異常な細胞分裂、自然な遺伝的変異、ヒトの老化プロセス、およびがん1,2,3,4、5の進行に関与しています。正常細胞と比較して腫瘍細胞の増殖の増加率は、癌細胞の挙動は腫瘍の種類と患者の中でもかなり異質であるという事実にもかかわらずの特徴のひとつです。前臨床試験の有望な結果にもかかわらずいくつかの新たに開発された抗がん剤薬が臨床試験6,7,8,9,10 に有効であるには表示されません。、11。実験および臨床モデルの妥当性は考慮すべき。三次元 (3 D) マトリックス、線維芽細胞とコラーゲンが豊富な 3 D 結合組織、線維肉腫細胞 3 D 間質の細胞外マトリックス (ECM) の転移性癌細胞などの正常な哺乳類やがん細胞の多くの種類を分けます。ただし、二次元 (2 D) 基板上に培養した細胞を実験哺乳類の細胞分裂との試金の大半を行った。組織, 機械的性質および両方正常と病理組織12,13,14,の 3 D の ECM の生化学的なシグナルを設計された 3 D マトリックスが要約より15,16,17。
どの哺乳類の細胞分裂の研究の規制環境が生理学的な関連性や治療の意義18,19にもかかわらず主未踏のまま 3 D で。技術的な問題と 3 D マトリックスの細胞分裂の勉強に関連する実験課題がある可能性があります。細胞分裂は、全体の細胞周期20のほんの時間を構成します。前の仕事は人間の乳房腺 MCF 7、ひと骨肉腫 U2OS、人間の肝臓などの多くの哺乳類細胞の増殖率を示す 2D 基板21、相手と比較して 3 D の行列の hepg2 細胞がはるかに低い 22。さらに、3 D マトリックスに埋め込まれた細胞は、フォーカスのうち住セルイメージ投射の間に移動します。これらすべての要因は、イメージング技術を用いた三次元培養における細胞分裂イベントのキャプチャの非常に低い効率に貢献します。
ECM と細胞間相互作用は、細胞分裂の調節に重要な役割を再生します。ここでは、3 D コラーゲン マトリックス中の哺乳類の細胞分裂を効率的に勉強する方法をについて説明します。メソッドは、細胞、細胞分裂、同期生細胞イメージング、共焦点反射の時間分解顕微鏡を使用して 3 D の行列の部イベントの監視に分裂のマーカーの取り込みを含むと定量的画像解析。蛍光標識ヒストン H2B が最初に導入された細胞に細胞分裂を区別し、中間期の細胞マーカーとして。その後、セルは、機械的振り払いテクニックが続きます、チミジンをブロックし、ノコダゾール治療の組み合わせを使用して同期されます。3 D コラーゲン マトリックスに同期された細胞が直接カプセル化されます。複数のセルの細胞分裂イベントは、効率的に低倍率のタイムラプス住セルイメージ投射を使用して監視されます。細胞マトリックスの相互作用の指標となるコラーゲン線維の変形は、高倍率で反射共焦点の顕微鏡検査を使用して監視されます。
監視し前に、中、後 2 つの転移性癌細胞株、ひと浸潤性膵癌 MDA MB 231、3 D コラーゲンのひと線維肉腫 HT1080 細胞の有糸分裂細胞マトリックスの相互作用を定量化するこのテクニックを使いました以前行列19。紹介した方法は、3 D 環境と細胞マトリックスの相互作用で両方の哺乳類の細胞分裂の研究に効率的で一般的なアプローチを提供します。MDA MB 231 細胞ラインは、ホワイト ペーパーで例として使用されます。このプロトコルは正常組織および病気の開発の分子基盤に新しい洞察力を提供し、新規診断と治療的アプローチの設計もできます。
プロトコル
提供されるプロトコルのホームウッド制度検討委員会 (HIRB) のガイドラインに従います。
1. 細胞分裂のマーカーとしての H2B mCherry 安定式
-
(HEK 293 t) から人間の萌芽期の腎臓 293 t レンチ ウイルス粒子の生成細胞
- 細胞培養培地 (ダルベッコ変更イーグル培地 (DMEM) 含む高グルコース (4.5 g/L)、ピルビン酸ナトリウム 10% 胎仔ウシ血清 (FBS)、1% の 10 の6セル/皿 × 5 の密度で 10 cm 細胞培養ディッシュ上 HEK 293 t 細胞をプレートします。ペニシリン-ストレプトマイシン (ペン/連鎖球菌))。37 ° C、5% 二酸化炭素 (CO2) で 24 時間インキュベートします。当日 transfection の細胞の目的の密度は、約 70-80% です。
注: HEK 293 t 細胞はここで MDA MB 231 セルを変換する H2B mCherry を表現する安定したセルラインを生成するために後で使用されるウイルスの粒子を生成する使用は。細胞はプレート全体が均等かどうかを確認します。セルの追加ドロップ プレート、賢明なと軽く移動前後の板は均等に助けることができます。細胞をプレートまたは結果として、ウイルス粒子の異なるボリュームのコレクションその他のサイズのフラスコでシードもことができます。 - (レンチウイルスベクター、CMV ΔR 8.91、ままだった VSVG) 3 つのプラスミドとトランスフェクション試薬を用いた HEK 293 t 細胞を transfect します。ホスホ グリセリン酸キナーゼ プロモーター (PGK) とレンチウイルスベクターのエンコーディング H2B mCherry プラスミドが複製されます。CMV ΔR 8.91 3 必要な HIV 遺伝子、ギャグ、ポル、および回転が含まれています。ままだった VSVG には VSV G エンベロープ遺伝子が含まれています。
注: から選択する複数のトランスフェクション エージェントがあります。- 使用する前に室温 (RT) に到達するトランスフェクション試薬のバイアルを許可します。反転または渦流バイアルを簡潔に。
- H2B mCherry プラスミドの 6 μ g、CMV ΔR 8.91、8 μ g および 2 μ g のままだった-VSVG、低下した血清中メディアの 1 mL の成っている DNA のミックス 16 μ g。室温で 5 分間インキュベートします。
注: 量と 3 つのベクトル比変化は、別のレンチ ウイルスの転送ベクトルの最適化します。 - 48 μ L を追加 (DNA の比率 1:3 の使用: トランスフェクション試薬) 上記の DNA 溶液にトランスフェクション試薬の少なくとも 15 分間インキュベート常温と。
注: トランスフェクション試薬と DNA の比率は様々 な異なるレンチ ウイルスの転送ベクトルの最適化します。トランスフェクション試薬は、1.5 mL 遠心管の側を接触しないことを確認します。 - セルに drop-wise ステップ 1.1.2.3 で行われた DNA 脂質複雑なソリューションを追加します。ゆっくり旋回プレートの複合体の均等を確保するためのプレート。
- トランスフェクション後、約 6 時間の培地を吸引し、新鮮な細胞培養液を追加 (高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs と 1 %dmem ペン/連鎖球菌)。
- 培養上清中の 24、48、および 72 時間後トランスフェクションを収穫します。各収穫後媒体を交換 (DMEM、4.5 G/L グルコース、ピルビン酸ナトリウム 10 %fbs、1% とペン/連鎖球菌)。
- レンチ ウイルス粒子は、細胞の残骸を削除する 0.45 μ m のフィルターを通してフィルターします。また、細胞の残骸を分離する上清をスピンします。上澄みの伝達をすぐに使用できます。 または-80 ° C で保存することができます。
- 細胞培養培地 (ダルベッコ変更イーグル培地 (DMEM) 含む高グルコース (4.5 g/L)、ピルビン酸ナトリウム 10% 胎仔ウシ血清 (FBS)、1% の 10 の6セル/皿 × 5 の密度で 10 cm 細胞培養ディッシュ上 HEK 293 t 細胞をプレートします。ペニシリン-ストレプトマイシン (ペン/連鎖球菌))。37 ° C、5% 二酸化炭素 (CO2) で 24 時間インキュベートします。当日 transfection の細胞の目的の密度は、約 70-80% です。
-
セルの世代ライン安定発現 H2B mCherry
注: このプロトコルは、MDA MB 231 セルの詳細で説明されます。実験前に、ひと乳癌細胞 MDA-MB-231 (物理科学腫瘍学センター, NIH) 高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% を含む DMEM で培養しているペン/連鎖球菌。- 35 mm ディッシュで 1 x 10 の5セルの密度で MDA MB 231 細胞をプレートします。
注: 異なる培養細胞用めっきの密度最適化する必要があります、したがって MDA MB 231 セルの最適密度から異なる場合があります。 - セルをめっき後 24 h ウイルスと新鮮な培地 1 mL に 1 mL を追加 (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% ペン/連鎖球菌)。
- セルを一夜にして 6 時間の期間にインキュベートします。
注: ウイルスとインキュベーション時間量の異なる培養細胞用に最適化する必要があります。たとえば、セル見ていない健康的なウイルスの付加の後で数時間場合、は、ウイルスと新鮮な培地 2 mL に 1 mL を使用して (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% ペン/連鎖球菌) 1.2.2 のステップのため。1.2.3 のステップでインキュベーション時間の長さを削減できます。 - 培地を吸引し、新鮮な培地 10 mL を追加 (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs と 1% ペン/連鎖球菌)。37 ° C と 5% CO2で 72 に 24 h の間孵化させなさい。
- 落射蛍光顕微鏡を用いた細胞の H2B mCherry の式を確認します。
注意: 細胞の伝達効率が低い場合手順 2.2 でウイルスと 2.3 の手順でインキュベーション時間のボリュームを増加可能性があります。
- 35 mm ディッシュで 1 x 10 の5セルの密度で MDA MB 231 細胞をプレートします。
2. 安定した H2B mCherry を発現している細胞の同期
- 24 ウェル プレートの各ウェルに細胞の 50 ~ 60% 合流、すなわちプレート 2 × 104 MDA MB 231 にセルのプレート。
- 24 h の CO2を 37 ° C、5% で文化を孵化させなさい。
- 0.5 ml 中の成長培地を交換 (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% ペン/連鎖球菌) 2 mM チミジンを含むと 24 h のためのインキュベーターに残します。
注: 細胞チミジンは細胞増殖 (G1) の段階で阻止される/DNA 合成 (S) 遷移と DNA 合成が阻害されたため S フェーズを通して。インキュベーション時間の長さは、様々 な異なる培養細胞用に最適化する必要があります。 - リン酸緩衝生理食塩水 (PBS) で 3 回、それらを洗浄することによりチミジン露出から細胞をリリースします。その後、正常な細胞培養培地で細胞をインキュベート (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs と 1% ペン/連鎖球菌) 5 時間。
注: チミジンの暴露から細胞のリリースにより、細胞の成長 (G2) に進行する細胞/細胞の分裂 (M) 期以前 G1/S 段階で逮捕、以前 s 逮捕のセル G1 期に相します。リリース時間の長さを変化、異なる培養細胞用に最適化する必要があります。 - 12 h ノコダゾール 250 ng/mL で細胞をブロックします。
注: すべてノコダゾールにさらされる細胞の G2/M 段階で阻止されます。ノコダゾールは細胞傷害性です。ノコダゾールへの長期暴露アポトーシスを引き起こすことができます。細胞死が認められた場合は、期間または別のセル行のエクスポー ジャーの集中を調整します。正常に同期される細胞は球形の形態を展示いたします。 - 45 セルを振る軌道シェーカーを使用して 150 を 200 rpm で 1 分に s。
注: が基板にこだわらず、分裂期の細胞はプロセス中に揺り動かされます。 - 遠心チューブに培地を分注して細胞を抽出するメディアを削除し、新鮮な媒体の 0.5 mL を追加 (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% ペン/連鎖球菌) プレートの各ウェル。
- 2.6 および 2.7 の 3 回の手順を繰り返します。
- 収集した培 3 分の 800 の x g で分裂期の細胞を遠心します。
注: この手順は、細胞培地から、ノコダゾールを削除する使用されます。
3. 同期された定款はマイク行列にコラーゲン細胞します。
注: タイプ I コラーゲン結合組織の ECM の人間の体内で最も豊富な蛋白質であるし、機能が、3 D 環境17,23,24 によってモジュレートされますどの真核細胞を調査するため多用されています。.コラーゲンは酢酸に可溶です。中和後 20-37 ° c コラーゲン溶液を温暖化、コラーゲン モノマーはコラーゲン線維の網目に重合します。
- DMEM 粉末、炭酸水素ナトリウム (NaHCO3) 3.7 g、4-(2-hydroxyethyl)-1-piperazineethanesulfonic 酸 (HEPES) に蒸留水を 50 mL に 1 g のパケットを溶解することにより 10 の x DMEM ソリューションを準備します。ソリューションをフィルターし、蒸留水 50 mL の NaOH ペレットの 2 g を溶解することにより水酸化ナトリウム (NaOH) の 1 M を準備します。フィルターそして因数 1.5 mL 遠心チューブにソリューション。
注: この手順では、通常 DMEM ソリューションを使用しないでください。大量のコラーゲン溶液添加培地を希釈します。したがって集中 DMEM 溶液を調製して、コラーゲン マトリックスに DMEM の最終濃度が通常 DMEM として同じであることを確認します。 - ステップ 2.9 から収集したセルと作業を続けます。新鮮な細胞培養液 0.5 mL、中、約 0.25 - の再中断セルを吸引 (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% ペン/連鎖球菌)。
注: コラーゲン マトリックス内の特定のセル密度を到達するには、懸濁液における細胞の初期密度が低すぎるですることはできません。したがって、再度セルを中断するために使用中のボリューム使用可能なセルの合計数異なります。 - ステップ 3.2 検定とソリューションに細胞の密度の計算での再懸濁細胞ソリューションの場所 10 μ L。
-
3 D コラーゲン行列を作成するすべてのコンポーネントに必要なボリュームを決定します。500 μ L の 2 μ g/μ L コラーゲン ・ ゲルを使用ここでは例として。
- 40,000 セル/mL (または 20,000 細胞コラーゲンゲルの 500 μ L) を取得するために必要な細胞液の量を計算します。この μ L に、DMEM を必要とされる 10 倍の X. 50 μ L。政府短期証券の 50 μ L 必要になります。
- コラーゲンは必要な私の在庫量を計算します。コラーゲンの濃度、私は 4 μ g/μ L の周りです。Μ L に必要なコラーゲンの量は Y です。
- コラーゲン溶液中の酢酸を中和するために必要な水酸化ナトリウム量を計算: Y μ L コラーゲン * 0.023 * 1000 = Z μ L 水酸化ナトリウムが必要があります。
- 充填剤溶液の量を決定する: (500 μ L 合計ゲル - X µL 細胞 - 50 μ L 10 DMEM - FBS の 50 μ L - Y μ L コラーゲン - Z μ L X NaOH) = R μ L
注: フィラー ソリューションは蒸留水。フィラー ソリューションの計算量が負の数の場合、細胞懸濁液の元の細胞密度が低すぎます。再びスピンダウンし、中の小さいボリュームで再停止する必要がありますセル (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs、および 1% ペン/連鎖球菌)。
- きれいな 1.5 mL 遠心チューブに次の順序でコンポーネントを追加: 媒体、DMEM、FBS、純水 (DI)、コラーゲン、水酸化ナトリウム x 10 のセル。コラーゲン溶液のゲル化を遅く氷の上にすべてのコンポーネントを配置します。気泡の形成を防ぐために適切なピペッティング テクニックを使用します。
- 水酸化ナトリウムを追加すると、ソリューションを 1 mL ピペットを使い、慎重に混ぜます。
注: コラーゲンのゲル化は水酸化ナトリウムの添加後すぐに右に開始されます。慎重かつ迅速に、ミキシングを行う必要があります。 - 一度ソリューションはよく混ぜ、24 ウェル プレートの各ウェルにソリューションの 500 μ L を追加します。37 ° C のインキュベーターで 24 ウェル プレートを配置します。新鮮な細胞培養培地を 37 ° C の水浴に配置します。
注意: プラスチック製の底板、低倍率生細胞顕微鏡レンズの作動距離が 1 mm. ガラス底高の短い作動距離のため高倍率生細胞顕微鏡用プレート上での使用します。倍率のレンズ。 - 予め温めておいた媒体を 500 μ l 添加 (DMEM、高グルコース (4.5 g/L)、ピルビン酸ナトリウム、10 %fbs と 1% ペン/連鎖球菌) 3.7 のステップを完了した後 30 分のゲルの上に。
4. ライブ 3 D コラーゲン マトリックス (低倍率) の分割の細胞の細胞イメージング
注: セルのイメージは、位相差顕微鏡は対物レンズ 10 倍搭載、イメージング ソフトウェアによって制御される電荷結合素子 (CCD) カメラを使用して 2 分間隔で収集されます。
- 対物レンズの上にマウントされている生きているセル ユニットをオンにします。温度は 37 ° C で安定、CO2の濃度は 5% で、湿度は 75% まで待ちます。
- 顕微鏡でライブセル ユニットにゲルの 24 ウェル プレートを置きます。プレートの下部を見つけるし、プレートの底から約 500 μ m で焦点を当て顕微鏡まで対物レンズを移動します。
プレートの底は完全に 3 D のマトリックスに埋め込まれていないに近すぎるされているコラーゲン マトリックスのメモ: セル。イメージング プレートの底から 500 μ m にあるセルは、セルがエッジ効果16,17,25の影響を受けないことになります。 - セル、周りにステージを移動し、イメージングのための複数の位置を選択します。
- 2 分間隔でコマ撮り実験を設定します。
注: 2 分間隔の間に取ることができる位置の最大数は、電動ステージの移動速度と画像を取り込むための露光時間の長さに制限されます。
5. コラーゲン ネットワーク変形細胞分裂 (高倍率顕微鏡)
- 対物レンズの上にマウントされている生きているセル ユニットをオンにします。温度は 37 ° C で安定、CO2の濃度は 5% で、湿度は 75% まで待ちます。
- 無染色の 3 D コラーゲン マトリックスのコラーゲン線維を視覚化するには、共焦点顕微鏡サンプルを照らすために使用 488 nm レーザー反射光 (488 nm) だけをキャプチャするを構成します。レーザーを使用して、水浸対物レンズ、NA X 60 = 1.2 WD = 200 μ m、イメージング ソフトウェアによって制御されます。
- 生きているセル単位にサンプル (コラーゲン マトリックスのセル) を置きます。プレートの下部を見つけるし、プレートの下から約 100 μ m で焦点を当て顕微鏡まで対物レンズを移動します。イメージング プレートの底から 100 μ m にあるセルは、セルは、エッジ効果の影響を受けないことになります。
注: ここで水浸漬の目的はため油浸型レンズの代わりに油浸型レンズのワーキングディ スタンスは約 100 μ m で、のみです。プレートの底にガラスの厚さは通常約 100 μ m、油浸型レンズの使用が問題します。 - セル、周りにステージを移動し、イメージングのための複数の位置を選択します。
注: 共焦点顕微鏡光学的サンプルのセクション、焦点面からの信号をキャプチャします。ライブのセルは、タイムラプスの実験中にフォーカスを出入りして動くことがあります。時間の長い期間にわたって細胞画像のキャプチャを有効にするには、z は、5 μ m 間隔で連続スライスから画像を収集するために使用されます。25 μ m にまたがる 5 スライスの合計が作成されます。 - 5 分間隔でコマ撮り実験を設定します。
注: 5 分を使用ここでは H2B mCherry、反射はコラーゲン、スキャンおよび Z スタックをスキャンするスキャン蛍光を含む複数のスキャン モードがそれぞれの位置に適用されるため、セクション 4 で使用 2 分ではなく間隔として。複数のスキャン ・ モードの使用は、低倍率の画像と比較して位置をスキャンの速度を低減します。 - コラーゲン マトリックス粒子画像流速測定法 (PIV) のサブピクセルの解像度20を用いたセルによって出る力により細胞近傍の変形を定量化します。H2B mCherry とコラーゲン線維の両方の信号を明確に可視化 2次元画像にこの分析を実行することができます。異方性のローパスのコラーゲン ネットワーク20の信号を向上させるフィルタ リングを適用します。
- K+1 のフレームは、15 × 15 のウィンドウ領域を抽出するフレーム k から (x,y) にあるサブ画像領域の局所変位を測定するためにピクセルがフレームk(x,y) を中心と。特定場所 (x,y) に一致する最適 * フレームk+1 で得られた画像で最大の正規化相互相関係数を特色にする場所。変形ベクトル (x,y) として計算されます *-(x,y)。
結果
この記事の目標は、3 D マトリックスは、哺乳類の細胞分裂過程を研究し、中と細胞分裂後にセルと 3 D の細胞外マトリックスの相互作用を定量化するイメージング ベースの方法を提示することです。細胞分裂の観察を容易にするには、我々 はレンチ ウイルス伝達を使用して MDA MB 231 セルに H2B mCherry を組み込みます。蛍光タンパク質を用いた共役 H2B は、間期の細胞分裂期の細胞を区別するためにセル有糸分裂19,20,26中のさまざまな段階を定義する分裂のマーカーとして使用されます。このメソッドを使用すると、安定した 3 D コラーゲン マトリックス (図 1 a) の H2B mCherry を表現する MDA MB 231 セル部門全体のプロセスを監視することができました。有糸分裂の段階 (前期; フレーム 1、図 1 a) 原子膜の溶解を開始染色体の再構成 (prometaphase: フレーム 2);細胞体 (中期; フレーム 3) の中で染色体の整列(後期; フレーム 4) 染色体の分離2 つの娘細胞 (終期/細胞質分裂、フレーム 5) 体の分離と核膜、染色体を再編します。
3 D マトリックスの細胞の増殖率は通常 3 D 効率19の細胞分裂の監視を描画する 2 D 基板の同等のよりはるかに低い。3 D の細胞分裂の勉強の効率を上げる、チミジン、ノコダゾールと同期、分裂期は、MDA MB 231 セルを選択して手ふれする手法を組み合わせた手法を採用しました。同期セルされたコラーゲン マトリックスに埋め込まれます。複数のセルの分割プロセスがリアルタイムで監視された住セルイメージ投射倍率 10 倍で。3 D (図 2) の有糸分裂の効率的にモニタリングすることができますコラーゲン マトリックス (図 2) の成立後最初の 2 時間以内に約 70% の細胞が分けられます。
細胞とその周囲のコラーゲン マトリックスの相互作用を監視、共焦点反射顕微鏡画像コラーゲン線維と細胞のイメージを蛍光顕微鏡を組み合わせます。60 X レンズは、コラーゲン線維の高品質の画像のキャプチャが可能です。各視野のより少ないセルをキャプチャするには、高倍率のレンズを用いたイメージングくらい低いスループットが低倍率 10 X、20 X での使用に比較します。細胞の正常な同期を高める効率性と、そのような実験のスループット同期の細胞のほとんどはコラーゲン マトリックスの形成の後最初の 2 時間以内の分割以来。行列の変形の間に、細胞分裂後は可視化 (代表のスナップショットは、図 1 bに示すように) カスタム PIV ソフトウェアを用いて定量化し、。我々 は定量化し、間期と分裂期の細胞分裂期に同期中に行列の変形を比較します。マトリックス変形が非常に小さな変更ことがわかった (図 3 a)、相、分裂中に、分裂段階 (図 3 b) 変形未満においては。この結果は、哺乳動物細胞がある最小の添付ファイルと周囲のマトリックスとの相互作用、分裂期中を示しています。
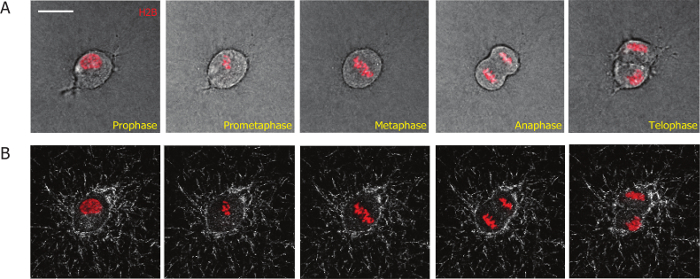
図 1: MDA MB 231 セルの高倍率の生細胞イメージング ビデオから得られる代表的な顕微鏡写真が H2B mCherry を安定して表現するコラーゲン マトリックスに埋め込まれました。(A)赤ラベル MDA MB 231 細胞の有糸分裂の進行の異なった段階は H2B mCherry によって定義されます。(B)細胞分裂のプロセス中に膠原線維 (白) は時間依存共焦点反射顕微鏡による可視化します。スケール バー = 20 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 2: 3 D コラーゲン マトリックスで同期の細胞の分裂。細胞を G2/m 期同期, コラーゲン マトリックスに埋め込まれた.ランダムに同期格差なし細胞制御に対し、同期された細胞の約 70% は最初の 2 時間以内分割します。エラー バー SEM (平均値の標準誤差) を =。この図の拡大版を表示するのにはここをクリックしてください。
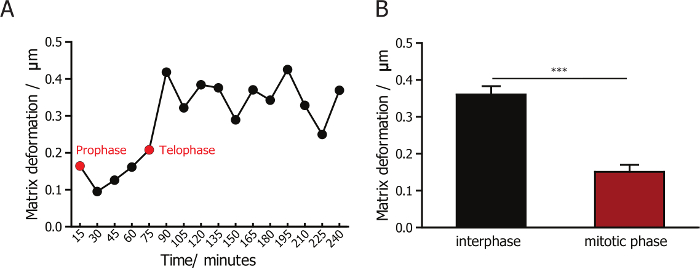
図 3: 中間期および有糸分裂の間に細胞の MDA MB 231 の行列の変形の定量化します。(A)行列 MDA MB 231 セルのマトリックスに埋め込まれた変形の大きさの変更。緑の矢印は前期を表し、赤の矢印は終期を。細胞分裂の間にマトリックス変形が最小限であることを示す MDA MB 231 細胞間期と分裂期の間にマトリックス変形の定量化を(B) 。エラー バー SEM (平均値の標準誤差) を =。* p < 0.05。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
3 D の細胞分裂の前の研究は、実験的限界と技術的な課題18,19による効率的でした。3 D コラーゲン マトリックス中の哺乳類の細胞分裂の学習の効率化のための重要なステップは、: (1); 細胞分裂マーカーの蛍光標識定款(2) 細胞分裂; の同期(3) 生細胞イメージング、共焦点反射の時間分解顕微鏡と定量的イメージング解析を用いた 3 D マトリックス部イベントの監視します。
2 D 基板上の分裂期の細胞はその形態に基づく間期細胞と区別できる、すなわち分裂細胞は円形で、やっと基板を付ける間期細胞が広がる一方、基板にしっかりと接続します。3 D マトリックス中ただし、細胞の形態以来やっと広がるいくつかの細胞分裂期細胞のための信頼性の高いマーカーではない、マトリックス27,28の円形のまま。したがって、3 D の行列の細胞分裂の研究のための細胞に分裂のマーカーを紹介する不可欠です。前期、prometaphase、中期、後期、終期/細胞質分裂を含むさまざまな細胞分裂段階のため信頼性の高いマーカーとして役立った MDA MB 231 細胞で H2B mCherry 安定して表現しました。我々 は以前 3 D マトリックス中間期細胞から分裂期の細胞を区別するためにこのアプローチを使用します。このマーカーの助けを借りて、ことができましたまた HT1080 細胞分裂期別の細胞ラインの長さを測定する 2 D 基板上と 3 D 行列19の分割します。
血清飢餓29、分裂振り払い30,31,32, やノコダゾール32ブロック二重チミジンを含むセルを同期する複数の方法があります。我々 はチミジン処理と G2/M 段階に MDA MB 231 細胞を効率よく同期ノコダゾール治療を組み合わせます。細胞チミジンはチミジンキナーゼによって G1/S 遷移および DNA 合成が阻害されたため S 期全体で阻止されます。チミジンの暴露から細胞のリリースは G2/セル G1/S 段階で逮捕の段階と細胞は S 期で逮捕の G1 セル進行しましょう。ノコダゾールにさらされているすべてのセルは G2/M 段階で阻止されます。丸めを細胞が分裂期に入るが、動揺オフ板からとコラーゲン行列に直接カプセル化します。我々 は、細胞の約 70% がコラーゲン マトリックス (図 2) に組み込まれている後 2 時間以内分割することを示した。また、同期の前にコラーゲン マトリックスでセルを埋め込むことができる、しかし、コラーゲンの架橋ネットワーク物理的障壁を提示、生体分子拡散と対流33,の率の減少34. 確かに、我々 はチミジンとノコダゾールを使用してコラーゲン マトリックス内のセルを同期しようとしましたが、効率的な同期化を取得できませんでした。この結果は、非効率的な拡散とコラーゲン マトリックスを通して薬の対流によるものでしょう。
反射は、コラーゲンを含む多くの生体高分子の固有の光学特性です。共焦点反射顕微鏡技術を視覚化し、合成高分子と 3 D コラーゲン マトリックス23,24,35,36 から調製した多孔質材料の微地形を quantitates ,37。私たちの研究室では、コラーゲンの濃度変化38としてコラーゲン繊維の極性の変更を監視する技術を設けています。ここでは、細胞マトリックスの相互作用を表すために反射型の共焦点画像の時間経過のビデオをもとにコラーゲン繊維の変形を監視する方法をについて説明します。ここで示した代表的な結果表示分裂 MDA MB 231 セルの行列の変形はこれらのセルの哺乳類細胞が最小限の添付ファイルとの相互作用であることを示唆している間期より大幅に少ない、19分裂期に入るときの周囲の行列。
以前は、監視し前に、・中・後 HT1080 細胞の有糸分裂細胞マトリックス相互作用を定量化する共焦点反射顕微鏡を使用しました。我々 はまた、間期と分裂期の間に β 1 インテグリン ノックダウン HT1080 細胞マトリックス変形を監視しました。Β 1 インテグリンを著しく破壊間期細胞によって行列の変形を低減します。ただし、HT1080 野生型細胞19とラウンド β 1 インテグリンのノックダウン (KD) 細胞の分裂期の間にマトリックス変形の違いはありません。
蛍光共役を採用するコラーゲン線維を視覚化する代替方法 I 型コラーゲン。我々 は以前19細胞で生成されたコラーゲン マトリックスのイメージ トラックへのこのアプローチを使用しました。このアプローチでは、ただし、時間がかかり、少ないかに (FITC) などの蛍光色素をコラーゲン効率のラベリングが必要です。その一方で、反射の共焦点の顕微鏡検査は時間とリソースを節約し、蛍光退色に関連付けられている問題を除外する変更されていないコラーゲンを直接適用できます。また、このメソッドは、個々 の蛍光チャネルを必要としない、従ってすべての蛍光染料と互換性が。
本稿で紹介した方法は、潜在的 3 D コラーゲン マトリックスの分割哺乳類セルの任意の型に適用できます。H2B mCherry マーカーのレンチ ウイルス伝達による他の哺乳類細胞への取り込みがに従って全く同じ手順、用紙に記載されている細胞の種類はレンチ ウイルスによる伝達の効率を変化している可能性がありますが39します。 両方の伝達、細胞の密度およびウイルスの力価は、効率化のため最適化すること。高伝達効率を達成することはできない場合、細胞を蛍光アシスト セル (FACS) を並べ替えによって選ばれるかもしれない。チミジンのブロックとノコダゾールは、哺乳類細胞、HeLa40などの他のいくつかの種類を正常に同期に適用されます。機械的振り払いを切り上げるし、ほとんど分裂期30,31中に基板を付ける任意のセル型に適用でした。また、共焦点反射顕微鏡と行列の変形の定量化を使用してコラーゲン線維の画像は他の種類の哺乳類の細胞分裂に直接適用できます。
ここで紹介した方法は、哺乳類の細胞分裂と細胞マトリックス相互作用の 3 D 環境での勉強を効率的かつ一般的なアプローチです。アプローチ正常組織および病気の開発の分子基盤に当社のプローブを容易にし、診断の小説の設計を促進して治療のアプローチは、将来的に。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
この作品は、NIH によって支えられた R01CA174388 と U54CA143868 を与えます。著者は魏堂陳のサポートのためのジョンズ ・ ホプキンス大学からプラ賞を認めたいと思います。この資料は、国立科学財団大学院研究奨学金助成金第 1232825 の下に支えられて仕事に基づいています。
資料
| Name | Company | Catalog Number | Comments |
| Human embryonic kidney 293T | ATCC | ||
| MDA-MB-231 | Physical Sciences Oncology Center, NIH | ||
| DMEM | Corning | 10-013-CV | |
| DMEM powder | ThermoFisher Scientific | 12100-046 | |
| Fetal bovine serum | Hyclone | SH30910.03 | |
| Penicillin-Streptomycin 100X | Sigma-Aldrich | P0781 | |
| Fugene HD | Promega | E2311 | |
| Lipofectamine 2000 | Life technologies | 11668-07 | |
| Plasmid encoding H2B-mCherry in a lentiviral vector | Addgene | plasmid 21217 | |
| Thymidine | Sigma-Aldrich | T1895 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| Opti-MEM | Life Technologies | 31985-070 | |
| Sodium bicarbonate | GibcoBRL | 11810-025 | |
| HEPES | Sigma-Aldrich | 113375-100 | |
| Collagen | Corning | 354236 | |
| NaOH | J.T. Bake | 3722-01 | |
| Millex-HV syringe filter unit, 0.45-μm, PVDF, 33 mm | Millipore | SLHVM33RS | |
| Nikon TE2000E epifluorescence microscope | Nikon | TE2000E | |
| Cascade 1K CCD camera | Roper Scientific | ||
| NIS-Elements AR imaging software | Nikon | ||
| Nikon A1 confocal microscope | Nikon | A1 |
参考文献
- Ly, D. H., Lockhart, D. J., Lerner, R. A., Schultz, P. G. Mitotic misregulation and human aging. Science. 287 (5462), 2486-2492 (2000).
- Gascoigne, K. E., Taylor, S. S. How do anti-mitotic drugs kill cancer cells?. J Cell Sci. 122 (Pt 15), 2579-2585 (2009).
- Brinkley, B. R. Managing the centrosome numbers game: from chaos to stability in cancer cell division. Trends Cell Biol. 11 (1), 18-21 (2001).
- Phillip, J. M., Aifuwa, I., Walston, J., Wirtz, D. The Mechanobiology of Aging. Annu Rev Biomed Eng. 17, 113-141 (2015).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Martin, M. D., et al. Effect of ablation or inhibition of stromal matrix metalloproteinase-9 on lung metastasis in a breast cancer model is dependent on genetic background. Cancer Res. 68 (15), 6251-6259 (2008).
- Knox, J. J., Hotte, S. J., Kollmannsberger, C., Winquist, E., Fisher, B., Eisenhauer, E. A. Phase II study of Triapine in patients with metastatic renal cell carcinoma: a trial of the National Cancer Institute of Canada Clinical Trials Group (NCIC IND.161). Invest New Drugs. 25 (5), 471-477 (2007).
- Komlodi-Pasztor, E., Sackett, D. L., Fojo, A. T. Inhibitors targeting mitosis: tales of how great drugs against a promising target were brought down by a flawed rationale. Clin Cancer Res. 18 (1), 51-63 (2012).
- Tong, W. G., et al. Phase I and pharmacologic study of SNS-032, a potent and selective Cdk2, 7, and 9 inhibitor, in patients with advanced chronic lymphocytic leukemia and multiple myeloma. J Clin Oncol. 28 (18), 3015-3022 (2010).
- Matulonis, U. A., et al. Phase II study of MLN8237 (alisertib), an investigational Aurora A kinase inhibitor, in patients with platinum-resistant or -refractory epithelial ovarian, fallopian tube, or primary peritoneal carcinoma. Gynecol Oncol. 127 (1), 63-69 (2012).
- Boss, D. S., et al. Clinical evaluation of AZD1152, an i.v. inhibitor of Aurora B kinase, in patients with solid malignant tumors. Ann Oncol. 22 (2), 431-437 (2011).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Giri, A., et al. The Arp2/3 complex mediates multigeneration dendritic protrusions for efficient 3-dimensional cancer cell migration. FASEB J. 27 (10), 4089-4099 (2013).
- Fraley, S. I., Feng, Y., Giri, A., Longmore, G. D., Wirtz, D. Dimensional and temporal controls of three-dimensional cell migration by zyxin and binding partners. Nat Commun. 3, 719 (2012).
- Fraley, S. I., et al. A distinctive role for focal adhesion proteins in three-dimensional cell motility. Nat Cell Biol. 12 (6), 598-604 (2010).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. J Cell Biol. 205 (2), 155-162 (2014).
- He, L., et al. Local 3D matrix confinement determines division axis through cell shape. Oncotarget. 7 (6), 6994-7011 (2016).
- Held, M., et al. CellCognition: time-resolved phenotype annotation in high-throughput live cell imaging. Nat Methods. 7 (9), 747-754 (2010).
- Fallica, B., Maffei, J. S., Makin, G., Zaman, M. Alteration of cellular behavior and response to PI3K pathway inhibition by culture in 3D collagen gels. PLoS One. 7 (10), e48024 (2012).
- Meli, L., Jordan, E. T., Clark, D. S., Linhardt, R. J., Dordick, J. S. Influence of a three-dimensional, microarray environment on human Cell culture in drug screening systems. Biomaterials. 33 (35), 9087-9096 (2012).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Protoc Cell Biol. 10, 1-20 (2010).
- Gunzer, M., Kampgen, E., Brocker, E. B., Zanker, K. S., Friedl, P. Migration of dendritic cells in 3D-collagen lattices. Visualisation of dynamic interactions with the substratum and the distribution of surface structures via a novel confocal reflection imaging technique. Adv Exp Med Biol. 417, 97-103 (1997).
- Geraldo, S., Simon, A., Vignjevic, D. M. Revealing the cytoskeletal organization of invasive cancer cells in 3D. J Vis Exp. (80), e50763 (2013).
- Lleres, D., James, J., Swift, S., Norman, D. G., Lamond, A. I. Quantitative analysis of chromatin compaction in living cells using FLIM-FRET. J Cell Biol. 187 (4), 481-496 (2009).
- Poincloux, R., et al. Contractility of the cell rear drives invasion of breast tumor cells in 3D Matrigel. Proc Natl Acad Sci U S A. 108 (5), 1943-1948 (2011).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods Mol Biol. 761, 75-83 (2011).
- Jackman, J., O'Connor, P. M. Methods for synchronizing cells at specific stages of the cell cycle. Curr Protoc Cell Biol. 8, (2001).
- Zwanenburg, T. S. Standardized shake-off to synchronize cultured CHO cells. Mutat Res. 120 (2-3), 151-159 (1983).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol Biol. 296, 157-166 (2005).
- Kihara, T., Ito, J., Miyake, J. Measurement of biomolecular diffusion in extracellular matrix condensed by fibroblasts using fluorescence correlation spectroscopy. PLoS One. 8 (11), e82382 (2013).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys J. 83 (3), 1650-1660 (2002).
- Harjanto, D., Maffei, J. S., Zaman, M. H. Quantitative analysis of the effect of cancer invasiveness and collagen concentration on 3D matrix remodeling. PLoS One. 6 (9), e24891 (2011).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin Cell Dev Biol. 20 (8), 931-941 (2009).
- Petroll, W. M. Differential interference contrast and confocal reflectance imaging of collagen organization in three-dimensional matrices. Scanning. 28 (6), 305-310 (2006).
- Fraley, S. I., et al. Three-dimensional matrix fiber alignment modulates cell migration and MT1-MMP utility by spatially and temporally directing protrusions. Sci Rep. 5, 14580 (2015).
- Ikeda, Y., Collins, M. K., Radcliffe, P. A., Mitrophanous, K. A., Takeuchi, Y. Gene transduction efficiency in cells of different species by HIV and EIAV vectors. Gene Ther. 9 (14), 932-938 (2002).
- Ma, H. T., Poon, R. Y. Synchronization of HeLa cells. Methods Mol Biol. 761, 151-161 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved