Method Article
בתרבית של חלוקת התא במטריצות תלת-ממד באמצעות מיקרוסקופ השתקפות קונאפוקלית כמותיים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מחקרים ביעילות בתרבית של חלוקת התא במטריצות קולגן תלת-ממד על-ידי שילוב סינכרון של חלוקת התא, בפיקוח מחלקת האירועים מטריצות תלת-ממד בעזרת טכניקת דימות לחיות תאים, מיקרוסקופיה זמן לפתור השתקפות קונפוקלי וניתוח כמותי הדמיה.
Abstract
המחקר של חלוקת התא איך יונקים מוסדר ב- 3D הסביבה נשאר נחקרו במידה רבה למרות הרלוונטיות פיזיולוגיים שלה משמעות טיפולית. הסיבות האפשריות חוסר חקר הן מגבלות ניסיוני אתגרים טכניים לעיבוד המחקר של חלוקת התא בתרבות 3D לא יעיל. כאן, אנו מתארים שיטה מבוססת הדמיה ללמוד ביעילות בתרבית של חלוקת התא ואינטראקציות תא מטריצה ב- 3D קולגן מטריצות. תאים עם תוויות עם ויזת עבודה H2B פלורסנט מסונכרנים באמצעות השילוב של תימידין הטיפול חסימה ו nocodazole, ואחריו טכניקה לנער-off מכני. תאים מסונכרן מוטבעים ואז לתוך מטריצה תלת-ממד קולגן. חלוקת התא נעשה בעזרת מיקרוסקופ לחיות תאים. להרכב של סיבי קולגן במהלך ואחרי חלוקת התא, אשר מצביע על אינטראקציה עם תא-מטריקס, ניתן לנטר, לכמת באמצעות מיקרוסקופ השתקפות קונאפוקלית כמותית. השיטה מספקת גישה כללית ויעילה ללמוד בתרבית של חלוקת התא ואינטראקציות מטריצה תא סביבה תלת-ממד רלוונטי מבחינה פיזיולוגית. גישה זו לא רק מספק תובנות הרומן הבסיס המולקולרי של הפיתוח של הרקמות ושל מחלות, אלא מאפשר גם על עיצוב האתר של רומן גישות איבחוניות.
Introduction
מיטוזה התא הוא אירוע קריטי בחיים הסלולר, ויסות אשר ממלא תפקיד מכריע בהתפתחות רקמת ו עוגב. מיטוזה חריג הייתה שם טבעי וריאציות גנטיות, תהליכי הזדקנות האדם, ואת ההתקדמות של סרטן1,2,3,4,5. שיעור מוגבר של התפשטות של תאים סרטניים לעומת תאים נורמליים הוא אחד גולת הכותרת של סרטן, למרות העובדה כי התנהגויות תא הם די הטרוגניות בין סוגים שונים של גידולים, אפילו בקרב חולים. למרות תוצאות מבטיחות פרה, תרופות antimitotic פיתח הוכיחו לא יעילים ניסויים קליניים6,7,8,9,10 ,11. הרלוונטיות של מודלים ניסיוניים פרה חייב להילקח בחשבון. סוגים רבים של תאים נורמליים מידע יונקים וסרטן לחלק במטריצות תלת מימדי (3D), כמו fibroblasts תאים fibrosarcoma קולגן-עשיר רקמות החיבור תלת-ממד, ו תאי סרטן גרורתי תלת-ממד מטריצה חוץ-תאית סטרומה (ECM). עם זאת, הרוב המכריע של חלוקת תאים בתרבית של ניסויים, מבחני בוצעו על תאים תרבותי על מימדי מצעים (2D). מטריקס תלת-ממד מהונדסים יכול כדאי לסכם את מיקרו תכונות מכניות, אותות ביוכימיים ECM תלת-ממד של שתי רקמות רגילה, פיפטות12,13,14, 1516,,17.
המחקר של חלוקת התא איך יונקים מוסדר ב- 3D סביבות נשאר נחקרו במידה רבה למרות הרלוונטיות פיזיולוגית והן של משמעות טיפולית18,19. סיבות אפשריות כוללים את בעיות טכניות ניסיוני אתגרים הקשורים לומד חלוקת התא ב- 3D מטריצות. תא מיטוזה מהווה חלק קטן הטמפורלי מחזור התא כל20. עבודה קודמים הראו את קצב התפשטות של תאים בתרבית של רבים, כגון בשד האנושי אדנוקרצינומה MCF-7, אוסטאוסרקומה האנושי U2OS כבד אנושי HepG2, הוא נמוך בהרבה מטריצות 3D לעומת מקביליהם על מצעים 2D21, 22. יתר על כן, תאים נעוץ מטריצות 3D להיכנס ולצאת להתמקד במהלך הדמיה לחיות תאים. כל הגורמים הללו תורמים היעילות נמוכה במיוחד של לכידת אירועים תאית בתרבות תלת-ממד באמצעות טכניקות הדמיה.
אינטראקציות בין תאים ECM לשחק תפקידים חיוניים בוויסות חלוקות תאים. כאן, אנו מתארים גישה ללמוד ביעילות בתרבית של חלוקת התא ב- 3D קולגן מטריצות. השיטה כוללת שילוב של סמנים mitotic התאים, הסינכרון של חלוקת התא, כמו גם הפיקוח על חטיבת םיעוריא מטריצות תלת-ממד באמצעות טכניקת דימות לחיות תאים, זמן לפתור השתקפות קונאפוקלית מיקרוסקופ, ו ניתוח ההדמיה כמותית. התווית על-ידי קרינה פלואורסצנטית היסטון חלבון ויזת עבודה H2B הוא הציג לראשונה לתוך התאים כסמן כדי להבדיל mitotic לאטמוספרה תאים. אז התאים מסונכרנים באמצעות השילוב של תימידין הטיפול חסימה ו nocodazole, ואחריו טכניקה לנער-off מכני. תאים מסונכרן מכן אנקפסולציה ישירות לתוך קולגן 3D מטריצות. חלוקת התא אירועים של תאים מרובים מנוטרים ביעילות באמצעות הדמיה לחיות תאים זמן לשגות ההגדלה נמוך. להרכב של סיבי קולגן, אשר מצביע על אינטראקציה עם תא-מטריקס, נעשה באמצעות מיקרוסקופ קונפוקלי השתקפות בהגדלה-גבוהה.
השתמשנו בעבר בטכניקה זו כדי לפקח ולכמת תא-מטריצת אינטראקציה לפני, במהלך ואחרי של מיטוזה של שתי שורות תאים סרטן גרורתי, האנושי קרצינומה ductal פולשנית מד א-MB-231 תאים אנושיים fibrosarcoma HT1080, קולגן תלת-ממד מטריצות19. השיטות המובאות כאן מספקים גישה כללית ויעילה ללמוד שני חלוקת תאים בתרבית של אינטראקציות תא מטריצה וסביבה תלת-ממד. שורת התאים של מד א-MB-231 משמש כדוגמה לאורך הנייר. פרוטוקול זה מספק תובנות הרומן הבסיס המולקולרי של הפיתוח של הרקמות ושל מחלות, העלולה לאפשר גם על עיצוב האתר של רומן גישות איבחוניות.
Protocol
פרוטוקול סיפק עוקב אחר הקווים המנחים של הומווד מוסדיים סקירה לוח (HIRB).
1. יציב ביטוי של ויזת עבודה H2B-mCherry כסמן עבור תא מיטוזה
-
דור של חלקיקי lentiviral כליה אנושית עובריים 293T (HEK 293T) תאים
- צלחת התאים HEK 293T על צלחת תרבות תא 10 ס מ על הצפיפות של 5 x 106 תאים/צלחת במדיום התרבות התא (של Dulbecco ששינה רשנה בינוני (DMEM) גלוקוז גבוהות ביותר המכיל ביותר (4.5 g/L), נתרן פירובט, 10% סרום שור עוברית (FBS) ו- 1% פניצילין-סטרפטומיצין (עט/דלקת)). תקופת דגירה של 24 שעות ביממה ב- 37 מעלות צלזיוס ו-5% פחמן דו-חמצני (CO2). Confluency הרצוי של התאים ביום של תרביות תאים הוא כ- 70-80%.
הערה: HEK 293T תאים משמשים כאן כדי לייצר חלקיקים נגיפיים, אשר ישמש מאוחר יותר מגלי מד א-MB-231 תאים כדי ליצור קו תא stably לבטא ויזת עבודה H2B-mCherry. ודא כי תאים מופצים באופן שווה לאורך הלוח. תוספת של התאים טיפה חכם לצלחת, בעדינות נע הלוך ושוב את הצלחת יכול לסייע בחלוקת אפילו. התאים יכולים גם להיות נזרע צלחות או מבחנות בגדלים אחרים, אשר תגרום באוסף של אמצעי אחסון שונים של נגיפים. - Transfect התאים HEK 293T באמצעות תגובה כימית תרביות תאים עם שלושה פלסמידים (וקטור lentiviral, CMV ΔR 8.91 ו- pMDG-VSVG). פלסמיד קידוד ויזת עבודה H2B-mCherry שוכפל ב וקטור lentiviral עם phosphoglycerate קינאז יזם (PGK) CMV ΔR 8.91 מכיל שלושה הנדרשים HIV גנים, מחסום פה, polו rev. pMDG-VSVG מכיל את הגן המעטפה VSV-G.
הערה: ישנם סוכנים תרביות תאים מרובים לבחירה.- לאפשר את בקבוקון תרביות תאים ריאגנט לטמפרטורת החדר (RT) לפני השימוש. ' היפוך ' או מערבולת המבחנה בקצרה.
- מיקס 16 µg של ה-DNA, אשר מורכב של 6 µg של פלסמיד ויזת עבודה H2B-mCherry, µg 8 של CMV ΔR 8.91 2 µg של pMDG-VSVG, ב- 1 מ"ל של מדיה מופחת סרום. דגירה-RT במשך 5 דקות.
הערה: הסכום יחס של שלושת הווקטורים מגוונות ויש אופטימיזציה עבור וקטורים שונים העברה lentiviral. - להוסיף 48 µL (השתמש יחס 1:3 של ה-DNA: ריאגנט תרביות תאים) מהתרכובת תרביות תאים בתוך תמיסת DNA לעיל, ואז דגירה -RT למשך 15 דקות לפחות.
הערה: היחס של ה-DNA לעומת תקנים ריאגנט הוא מגוונים והם ממוטבים עבור וקטורים שונים העברה lentiviral. ודא כי הכימית תרביות תאים לא פנה אל הצד של הצינור צנטריפוגה 1.5 mL. - הוסף הפתרון מורכבות הדנ א-השומנים שבוצעו בשלב 1.1.2.3 drop-wise לתאים. מערבולת בעדינות את הצלחת על מנת להבטיח את ההפצה אפילו של הקומפלקס בצלחת.
- כ- 6 שעות לאחר תרביות תאים, תשאף המדיום ולהוסיף תא טריים תרבות בינוני (DMEM עם גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת).
- לקצור את supernatant 24, 48, 72 h תקנים שלאחר. להחליף את המדיום לאחר כל הקציר (DMEM, גלוקוז 4.5 g/L, נתרן פירובט, עם 10% FBS ו- 1% עט/דלקת).
- לסנן את החלקיקים lentiviral דרך מסנן מיקרומטר 0.45 לפנות את הפסולת הסלולר. לחלופין, ספין למטה תגובת שיקוע כדי להפריד את ההריסות התא. תגובת שיקוע יכול לשמש עבור התמרה חושית מיד, או שניתן לאחסן ב- 80 ° c
- צלחת התאים HEK 293T על צלחת תרבות תא 10 ס מ על הצפיפות של 5 x 106 תאים/צלחת במדיום התרבות התא (של Dulbecco ששינה רשנה בינוני (DMEM) גלוקוז גבוהות ביותר המכיל ביותר (4.5 g/L), נתרן פירובט, 10% סרום שור עוברית (FBS) ו- 1% פניצילין-סטרפטומיצין (עט/דלקת)). תקופת דגירה של 24 שעות ביממה ב- 37 מעלות צלזיוס ו-5% פחמן דו-חמצני (CO2). Confluency הרצוי של התאים ביום של תרביות תאים הוא כ- 70-80%.
-
הדור של תא קווים ויזת עבודה H2B לביטוי stably-mCherry
הערה: פרוטוקול זה מתואר בפירוט עבור תאים מד א-MB-231. לפני השימוש בהניסוי, מתורבתים בשד האנושי קרצינומה של תאים מד א-MB-231 (מרכז אונקולוגיה למדעי גופני, NIH) ב- DMEM המכילה גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/סטרפ.- צלחת התאים מד א-MB-231-הצפיפות של תאים5 עונה 1 פרק 10 לצלחת תרבות 35 מ מ.
הערה: הצפיפות של ציפוי עבור שורות תאים שונים צריך להיות מותאם, ולכן עשויים להיות שונים מאלה צפיפות מיטבית עבור התאים מד א-MB-231. - 24 שעות לאחר ציפוי התאים, להוסיף 1 מ"ל של וירוס ו- 1 מ"ל בינוני טריים (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת).
- תקופת דגירה התאים של פרק זמן של 6 שעות ללון.
הערה: הן את עוצמת הקול של הווירוס, זמן הדגירה צריך להיות אופטימיזציה עבור שורות תאים שונים. לדוגמה, אם התאים לא נראים בריאים שעות ספורות לאחר התוספת של הנגיף, להשתמש 1 מ"ל של וירוס ו- mL 2 בינוני טריים (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת) עבור שלב 1.2.2. ניתן גם לצמצם את משך זמן הדגירה בשלב 1.2.3. - האחות המדיום ולהוסיף 10 מ"ל בינוני טריים (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו 1% עט/דלקת). תקופת דגירה של בין 24 עד 72 h-CO 37 ° C ו-5%2.
- בדוק את הביטוי של ויזת עבודה H2B-mCherry בתאים באמצעות מיקרוסקופ epifluorescence.
הערה: אם היעילות התמרה חושית נמוכות בתאים, הנפח של וירוס בשלב 2.2, זמן הדגירה בשלב 2.3 יכול להיות מוגברת.
- צלחת התאים מד א-MB-231-הצפיפות של תאים5 עונה 1 פרק 10 לצלחת תרבות 35 מ מ.
2. סינכרון של התאים Stably לבטא ויזת עבודה H2B-mCherry
- צלחת התאים ב- 50-60% confluency, כלומר לוחית 2 x 104 מד א-MB-231 תאי כל טוב של צלחת 24-. טוב.
- דגירה התרבות-37 מעלות צלזיוס ו-5% CO2 במשך 24 שעות ביממה.
- להחליף את מדיום הגידול 0.5 מיליליטר בינוני (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת) המכיל 2 מ מ תימידין ולהשאיר בחממה במשך 24 שעות ביממה.
הערה: תאים נחשפים תימידין נעצרים בשלב צמיחת תאים (G1) / המעבר סינתזה (S) דנ א וברחבי S-שלב בשל עיכוב של סינתזת ה-DNA. אורך זמן הדגירה צריכים להיות מגוונים והם ממוטבים עבור שורות תאים שונים. - לשחרר את התאים מחשיפה תימידין בשטיפה בתמיסת פוספט buffered (PBS) שלוש פעמים. לאחר מכן, דגירה תאים תאים נורמליים תרבות בינוני (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו 1% עט/דלקת) במשך 5 שעות.
הערה: שחרורו של התאים מן החשיפה תימידין מאפשר את התאים להתקדמות הגידול תא (G2) / שלב mitotic (ז) עבור תאים בעבר נעצרה בשלב G1/S, והשלב לשלב G1 עבור תאים בעבר נעצר ב ה-S. משך הזמן לשחרר עליו להיות מגוונים, אופטימיזציה עבור שורות תאים שונים. - לחסום את התאים עם 250 ננוגרם למ"ל של nocodazole במשך 12 שעות.
הערה: כל התאים חשופים nocodazole נעצרים בשלב G2/M Nocodazole הוא ציטוטוקסיות. חשיפה ממושכת nocodazole יכול לגרום אפופטוזיס. להתאים את התקופה או ריכוז של חשיפה עבור שורות תאים שונים אם מקרי מוות התאים שנצפו. תאים המסונכרנים בהצלחה תערוכת ציורים של מורפולוגיה כדורית. - לנער את התאים עבור 45 s כדי 1 דקות שימוש של תפקודי לב / ב- 150-200 סל"ד.
הערה: Mitotic תאים, אשר יש הדבקות הקטן המצע, להיות ניערתי מעליי בתהליך. - להסיר את המדיום כדי לחלץ תאים, על-ידי pipetting של המדיום לתוך שפופרת צנטרפוגה, ולאחר מכן להוסיף 0.5 מיליליטר בינוני טריים (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת) כל אחד טוב של הצלחת.
- חזור על שלבים 2.6 ו 2.7 שלוש פעמים.
- Centrifuge של המדיום שנאספו המכילות את התאים mitotic ב g x 800 למשך 3 דקות.
הערה: שלב זה משמש כדי להסיר את nocodazole של המדיום התא.
3. התאגדות של מסונכרן תאים לתוך הקולגן אני מטריצות
הערה: מסוג קולגן הוא החלבון הנפוץ ביותר בגוף האדם, את ה-ECM של רקמות החיבור, ולכן נעשה שימוש נרחב כדי לחקור כיצד האיקריוטים תא פונקציות מאופנן מאת סביבה תלת-ממד17,23,24 . קולגן הוא מסיס חומצה אצטית. לאחר נטרול ומחמם את הפתרון קולגן 20-37 מעלות צלזיוס, קולגן מונומרים פולימריזציה לתוך meshwork של קולגן הסיבים.
- הכינו את הפתרון x DMEM 10 על ידי המסת מנה של אבקת DMEM, 3.7 גר' נתרן ביקרבונט (NaHCO3) 1g של חומצה-(2-hydroxyethyl)-1-piperazineethanesulfonic 4 (HEPES) 50 מ ל מים מזוקקים. לסנן את הפתרון ולאחר מכן להכין 1 מ' של הידרוקסיד הנתרן (NaOH) על ידי המסת 2 גר' כדורי NaOH 50 מ ל מים מזוקקים. מסנן, aliquot הפתרון לתוך צינורות צנטריפוגה 1.5 mL.
הערה: פתרון DMEM רגילים אין להשתמש בשלב זה. התוספת של נפח משמעותי של הפתרון קולגן לדלל את המדיום. לכן הפתרון DMEM מרוכז מוכן כדי להבטיח הריכוז הסופי של DMEM ב קולגן המטריצה יהיה זהה DMEM רגילה. - להמשיך לעבוד עם התאים שנאספו משלב 2.9. האחות על בינוני, וכן להשעות מחדש תאים בערך 0.25 - 0.5 מ של התא טריים תרבות בינוני (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת).
הערה: כדי להגיע צפיפות תא ספציפי ב קולגן המטריצה, הצפיפות הראשונית של התאים ההשעיה אפשרות נמוך מדי. לפיכך, הנפח של המדיום להתרגל מחדש להשעות את התאים יהיה תלוי המספר הכולל של התאים הזמינים. - מקום 10 µL של הפתרון תא מחדש מושעה מ שלב 3.2 on a hemocytometer לספור צפיפות התאים בפתרון.
-
לקבוע את אמצעי האחסון הדרושים עבור כל הרכיבים להפוך את מטריצת קולגן תלת-ממד. µL 500 של ג'ל קולגן µg/µL 2 משמש כאן כדוגמה.
- חישוב הנפח של הפתרון תא הנצרך תאים למ"ל 40,000 (או תאים 20,000 עבור µL 500 של קולגן ג'ל). מספר זה ב- µL שווה 50 אקס µL של 10 x יהיה צורך DMEM. µL 50 של FBS יהיה צורך.
- חישוב הנפח של קולגן שאני מדמין הדרושים. הריכוז של קולגן אני הוא סביב µg 4/µL. כמות הקולגן הצורך ב- µL הוא Y.
- לחשב עוצמת הקול של נתרן הידרוקסידי צריך לנטרל חומצה אצטית בפתרון קולגן: קולגן µL Y * 0.023 * 1000 = Z µL NaOH הדרושים.
- לקבוע את עוצמת הקול של הפתרון מלוי: (500 µL הכולל ג'ל - תאים X µL - 50 µL 10 X DMEM - 50 µL של FBS - Y µL קולגן - Z µL NaOH) = R µL
הערה: הפתרון המילוי הוא מזוקקים מים. אם הנפח מחושב של הפתרון המילוי הוא מספר שלילי, צפיפות התא המקורי ההשעיה התא הוא נמוך מדי. התאים צריכים להיות טוו למטה שוב, תלוי מחדש אמצעי אחסון קטן יותר של מדיום (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו- 1% עט/דלקת).
- להוסיף את הרכיבים לפי הסדר הבא שפופרת צנטרפוגה נקי mL 1.5: תאים בינונית, 10 x DMEM FBS, יונים מים (DI), קולגן, NaOH. מניחים את כל הרכיבים על קרח כדי להאט את gelation של הפתרון קולגן. להשתמש בטכניקות pipetting נאותה כדי למנוע היווצרות של בועות.
- לאחר הוספת של NaOH, מערבבים את הפתרון בקפידה עם pipet 1 מ"ל.
הערה: Gelation של הקולגן יתחיל נכון מיד לאחר התוספת של NaOH. ערבוב צריך להיעשות בזהירות ובמהירות. - ברגע הפתרון הוא מעורב טוב, להוסיף 500 µL של הפתרון מכל קידוח של צלחת 24-. טוב. מקם את הצלחת 24-ובכן בחממה 37 º C. הנח תא טריים תרבות בינוני באמבט מים 37 º C.
הערה: לוחות פלסטיק משמשים microcopy לחיות תאים ההגדלה נמוך שבו המרחק עבודה של העדשה הוא מעל 1 מ מ. זכוכית תחתון לוחות משמשים גבוהה-הגדלה מיקרוסקופית לחיות תאים עקב המרחק העבודה הקצר של גבוה עדשת הגדלה. - להוסיף 500 µL בינוני ומחוממת מראש (DMEM, גלוקוז גבוהות (4.5 g/L), נתרן פירובט, 10% FBS ו 1% עט/דלקת) לחלק העליון של הג'ל 30 דקות לאחר השלמת שלב 3.7.
4. חיים תא הדמיה של תאי חלוקה ב- 3D קולגן מטריצות (הגדלה נמוכה)
הערה: תמונות של התאים נאספים במרווחי 2 דקות בעזרת מצלמה בשילוב התקן (CCD) תשלום רכוב על מיקרוסקופ לעומת זאת שלב מצויד עם מטרה X 10, נשלט על-ידי תוכנות ליצירת תמונות.
- הפעל את יחידת התא חי רכוב על גבי העדשה אובייקטיבי. המתן עד מייצבת הטמפרטורה ב 37 ° C ריכוז CO2 ב-5%, הלחות עומדת על 75%.
- מכניסים את הצלחת. ובכן 24 של ג'ל יחידת התא חי על המיקרוסקופ. למצוא בתחתית הצלחת ולאחר מכן הזז את העדשה המטרה עד המיקרוסקופ מתמקדת כ-500 מיקרומטר מהחלק התחתון של הלוח.
הערה: תאים מטריצת קולגן כי הם יותר מדי התחתון של הלוח אינם מוטבעים לגמרי המטריצה תלת-ממד. הדמיה תאים שנמצאים מיקרומטר 500 הרחק בתחתית הצלחת יבטיח כי התאים אינם מושפעים אפקטי קצוות16,17,25. - הזז את הבמה כדי לחפש את התאים ולאחר לבחור מיקומים מרובים עבור הדמיה.
- להגדיר את הניסוי זמן לשגות במרווחים של 2-מין.
הערה: המספר המרבי של תפקידים שניתן לנקוט במהלך מרווח 2 דקות הוא מוגבל על ידי מהירות נע הבמה ממונע, ואת אורך זמן החשיפה לצילומים.
5. קולגן דפורמציה הרשת במהלך חלוקת התא (בהגדלה מיקרוסקופית)
- הפעל את יחידת התא חי רכוב על גבי העדשה אובייקטיבי. המתן עד מייצבת הטמפרטורה ב 37 ° C ריכוז CO2 ב-5%, הלחות עומדת על 75%.
- כדי להמחיש סיבי קולגן בתוך מוכתם קולגן 3D מטריצות, להגדיר מיקרוסקופ קונפוקלי ללכוד רק משתקף אור (488 ננומטר) הלייזר 488 ננומטר נעשה שימוש כדי להאיר את הדגימה. הלייזר משתמשת 60 X טבילה במי אובייקטיבי, NA = 1.2, WD = 200 מיקרומטר, ונשלט על-ידי הדמיה בתוכנה.
- מכניסים את הדגימה (בתאי הקולגן מטריצות) יחידת תא חי. למצוא בתחתית הצלחת ולאחר מכן הזז את העדשה המטרה עד המיקרוסקופ מתמקדת כ-100 מיקרומטר מהחלק התחתון של הלוח. הדמיה תאים שהם 100 מיקרומטר הרחק בתחתית הצלחת יבטיח כי התאים אינם מושפעים אפקטי קצוות.
הערה: כאן מטרה טבילה במי משמש במקום העדשה שמן-טבילה בגלל המרחק עבודה של העדשה שמן-טבילה הוא רק כ-100 מיקרומטר. השימוש של העדשה שמן-טבילה מהווה בעיה כמו עובי הזכוכית על החלק התחתון של הלוח הוא בדרך כלל כ-100 מיקרומטר. - הזז את הבמה כדי לחפש את התאים ולאחר לבחור מיקומים מרובים עבור הדמיה.
הערה: מיקרוסקופיה קונפוקלית שטיחות סעיפים לדוגמה, רק לוכד אותות מהמטוס מוקד. תאים חיים יכול להיות נע פנימה והחוצה להתמקד במהלך הניסוי זמן לשגות. כדי לאפשר את לכידת תמונות תא במשך פרקי זמן ארוכים, Z-מחסנית משמש כדי לאסוף תמונות רצופות פרוסות במרווחים של 5 מיקרומטר. סך של 5 פרוסות פורש מיקרומטר 25 הן עם תמונה. - להגדיר את הניסוי זמן לשגות במרווחים של 5 דקות.
הערה: 5 דקות משמש כאן בתור למרווח במקום 2 דקות בשימוש בסעיף 4 כי מספר מצבי סריקה, כולל פלורסצנטיות סריקה עבור ויזת עבודה H2B-mCherry, השתקפות סריקה לאיתור קולגן ו Z-מחסנית סריקה, מוחלים לכל תפקיד. השימוש של מספר מצבי סריקה מפחית את מהירות סריקה עמדה בהשוואה ההדמיה הגדלה נמוכה. - לכמת את דפורמציה של קולגן המטריצה באזור תא עקב הכוחות שמפעילים את התא באמצעות חלקיקים הדמיה velocimetry (PIV) עם רזולוציה פיקסל תת20. ביצוע ניתוח זה על תמונות דו-ממד מאפשר הפריט החזותי ברורה של שני האותות של ויזת עבודה H2B-mCherry, סיבי הקולגן. להחיל את אניסוטרופי יעברו סינון כדי להגביר את האות מתוך רשת קולגן20.
- על מנת למדוד את העקירה המקומי של אזור התמונה משנה עניין הממוקם ב (x,y) מ מסגרת k כדי להפליל k+1, לחלץ חלון האזורי של 15 × 15 פיקסלים שמרכזו בנקודה (x,y)-מסגרת k. ואז לזהות את הטוב ביותר התאמת מיקומים (x,y) * דרך המיקומים כוללים מקדם קרוס-המתאם מנורמל המרבי בתמונה לקבלו מסגרת k+1. הווקטור דפורמציה מחושבת (x,y) *-(x,y).
תוצאות
מטרת מאמר זה היא להציג שיטה מבוססת הדמיה כדי ללמוד תהליכי חלוקת תאים בתרבית של מטריצות תלת-ממד, לכמת את האינטראקציות בין התא לבין מטריצות 3D במהלך ואחרי חלוקת התא. כדי להקל על ההדמיה של מיטוזה תא, אנחנו שולבו ויזת עבודה H2B-mCherry מד א-MB-231 תאים באמצעות התמרה חושית lentiviral. ויזת עבודה H2B מצומדת עם חלבונים פלורסנט משמש כסמן mitotic להבחין mitotic תאים מתאי לאטמוספרה, וכדי להגדיר בשלבים שונים במהלך תא מיטוזה19,20,26. באמצעות שיטה זו, היינו יכולים לעקוב אחר תהליך מחלקה שלמה של תאים מד א-MB-231 stably לבטא ויזת עבודה H2B-mCherry ב- 3D קולגן מטריצות (איור 1 א'). שלבים mitotic התחיל עם התפרקות של קרום גרעיני (prophase; מסגרת 1, איור 1A); ארגון מחדש של הכרומוזומים (prometaphase: מסגרת 2); היישור של הכרומוזומים באמצע לגוף התא (מפה של; מסגרת 3); ההפרדה של הכרומוזומים ("אנאפאזה"; מסגרת 4); לארגונו מחדש של הכרומוזומים ואת גרעיני ממברנה ההפרדה של הגופות של שני תאי הבת (אשהה/ציטוקינזה, מסגרת 5).
קצב התפשטות של תאים במטריצה תלת-ממד הוא בדרך כלל נמוכים בהרבה מאשר מקביליהם על מצע 2D, ההופכת את הפיקוח על חלוקת התא פחות יעיל 3D19. כדי להגביר את היעילות של הלומדים 3D חלוקת התא, אנחנו מועסקים שיטת שילוב של תימידין, nocodazole ו- shake-off טכניקה כדי לסנכרן ולבחור מד א-MB-231 תאים שנמצאים בשלב mitotic. תאים מסונכרן הוטבעו ואז לתוך קולגן מטריצות. התהליך חלוקה של תאים מרובים נוטרו בזמן אמת באמצעות הדמיה לחיות תאים בהגדלה X 10. כ- 70% של התאים לחלק בתוך ה 2 הראשון לאחר היווצרות קולגן מטריצה (איור 2), ובכך מאפשר ניטור יעיל של מיטוזה תלת-ממד (איור 2).
כדי לפקח על האינטראקציה בין התאים שלהם מטריצות קולגן שמסביב, שילבנו בין מיקרוסקופ קונפוקלי השתקפות כדי התמונה סיבי קולגן, קרינה פלואורסצנטית מיקרוסקופ לשיקוף התאים. עדשה X 60 מאפשר לכידת תמונות באיכות גבוהה של סיבי קולגן. הדמיה באמצעות עדשת הגדלה גבוהה, אשר לוכדת פחות תאים בכל תצוגה של שדה, תפוקה נמוכה יותר לעומת השימוש נמוך-הגדלה 10 X או 20 X. סינכרון מוצלח של התאים משפר באופן משמעותי את היעילות והתפוקה של ניסוי כזה, שכן רוב התאים מסונכרן לחלק בתוך ה 2 הראשון לאחר היווצרות קולגן המטריצה. להרכב מטריקס במהלך ואחרי חלוקת התא הוא מטמיעים (נציג תמונות מוצגות באיור איור 1B), לכמת באמצעות תוכנה PIV מותאם אישית. אנו לכמת, לעומת מטריקס דפורמציה במהלך לאטמוספרה ושלב mitotic עבור תאים מסונכרנים לשלב mitotic. הבחנו כי מטריקס דפורמציה שונה מעט מאוד במהלך mitotic שלב (איור 3 א), ולא פחות מ להרכב נצפית בשלבים שלאחר mitotic (איור 3B). תוצאה זו מראה כי בתרבית של תאים יש קובץ מצורף מינימלי ואינטראקציות עם המטריצה שמסביב כאשר הם בשלב mitotic.
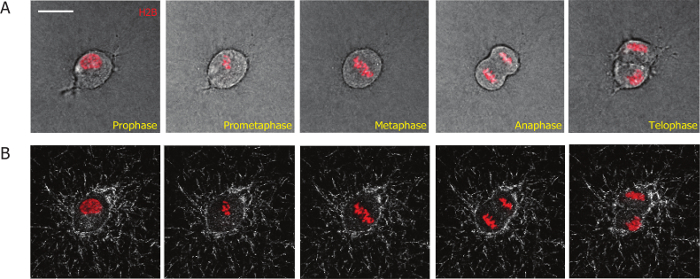
איור 1: נציג micrographs המתקבל וידאו הדמיה לחיות תאים גבוהה-הגדלה של מד א-MB-231 תא מוטבע בתוך מטריצה קולגן המבטאת ויזת עבודה H2B-mCherry stably. (א) שלבים שונים של ההתקדמות mitotic של התא מד א-MB-231 מוגדרים על-ידי ויזת עבודה H2B-mCherry כפי באדום. (B) סיבי הקולגן (לבן) במהלך תהליך mitotic הם דמיינו ידי מיקרוסקופ השתקפות קונאפוקלית תלויי-זמן. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: חלוקת התאים מסונכרנות ב- 3D קולגן מטריצות. התאים היו מסונכרנים לשלב G2/M, המוטבעות קולגן מטריצה. כ 70% של תאים מסונכרן לחלק בתוך ה 2 הראשון, ואילו הבקרה תאים ללא סינכרון לחלק באופן אקראי. קו שגיאה = SEM (שגיאת התקן של הממוצע). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
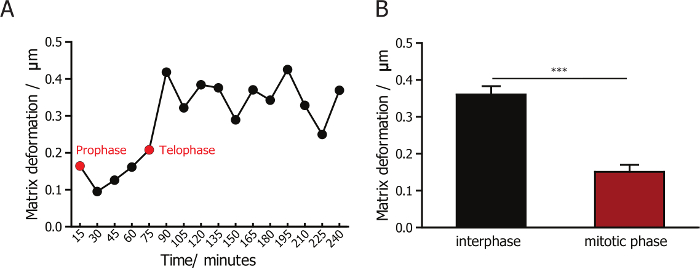
איור 3: כימות להרכב מטריקס עבור מד א-MB-231 תאים במהלך לאטמוספרה מיטוזה. (א) שינוי היקף דפורמציה מטריקס מטריקס-מוטבע התאים מד א-MB-231. החץ הירוק מציין prophase ומציין חץ אדום אשהה. כימות (B) של מטריקס דפורמציה של מד א-MB-231 תאים במהלך לאטמוספרה, שלב mitotic, המציינת כי מטריקס דפורמציה מינימלי במהלך חלוקת התא. קו שגיאה = SEM (שגיאת התקן של הממוצע). * p < 0.05. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
המחקר הקודם של חלוקת התא ב- 3D לא היה יעיל עקב מגבלות ניסיוני, האתגרים הטכניים18,19. השלבים הקריטיים ללימוד יעיל של חלוקת תאים בתרבית של-3D קולגן מטריצות הם: (1) שילוב של התווית על-ידי קרינה פלואורסצנטית סמני mitotic על התאים; (2) הסינכרון של חלוקת התא; (3) הפיקוח על חטיבת םיעוריא מטריצות תלת-ממד בעזרת טכניקת דימות לחיות תאים, זמן לפתור השתקפות קונאפוקלית מיקרוסקופ, וניתוח הדמיה כמותית.
תאים mitotic על מצעים 2D ניתן להבדיל בין התאים לאטמוספרה בהתבסס על המורפולוגיה שלהם, קרי mitotic תאים עגולים, בקושי לצרף המצע ואילו לאטמוספרה התאים התפזרו ולצרף בחוזקה המצע. ב- 3D מטריצות, עם זאת, המורפולוגיה תא אינה סמן אמין עבור תאים mitotic מאז כמה תאים בקושי התפרסו ולהישאר עגול מטריקס27,28. לכן, חשוב להכיר mitotic סמן התאים עבור המחקר של חלוקת התא ב- 3D מטריצות. אנחנו stably הביע ויזת עבודה H2B-mCherry בתאים מד א-MB-231, ששימש כסמן אמין עבור שלבים mitotic שונים, כולל prophase, prometaphase, מפה של, "אנאפאזה", אשהה/ציטוקינזה. בעבר השתמשנו בגישה זו כדי להבחין בין תאים mitotic מתאי לאטמוספרה ב- 3D מטריצות. בעזרת סמן זה, הצלחנו גם למדוד את האורך של השלב mitotic לקו סלולרי אחר, תאים HT1080, חלוקת על מצעים 2D ו 3D מטריצות19.
יש דרכים רבות כדי לסנכרן את התאים, כולל סרום הרעבה29, mitotic לנער-off30,31, כפול תימידין חסימת32, ו- nocodazole32. שילבנו בין הטיפול תימידין והטיפול nocodazole לסינכרון ביעילות תאים מד א-MB-231 לשלב G2/M. התאים חשופים תימידין נעצרים על המעבר G1/S ולאורך כל שלב S עקב עיכוב של סינתזת DNA על ידי תימידין. שחרורו של התאים מן החשיפה תימידין תן התקדמות התאים לשלב G2/M עבור תאים נעצרה בשלב G1/S, וכדי G1 עבור תאים נעצרה בשלב זה. כל התאים חשופים nocodazole נעצרים בשלב G2/M. התאים מעוגלת כלפי מעלה הזנת שלב mitotic היו אז מנוער-off מהצלחת, מקופל ישירות לתוך מטריצות קולגן. הראינו כי כ- 70% של התאים לחלק בתוך שעתיים אחרי הם משולבים מטריצות קולגן (איור 2). לחלופין, תאים יכול להיות מוטבעת קולגן מטריצות לפני הסינכרון, עם זאת, הרשת צולבים של קולגן המטריצה מציג מכשול פיסי ומפחית את שיעור למערכות ביולוגיות דיפוזיה ובהסעה33, 34. אכן, אנחנו ניסה לסנכרן בתאי הקולגן מטריצות באמצעות תימידין ו- nocodazole, אך נכשל להשיג סנכרון יעיל. תוצאה זו עשויה להיות דיפוזיה יעילה ובהסעה של התרופות באמצעות קולגן המטריצה.
השתקפות הוא מאפיין מהותי אופטי של biopolymers רבים, כולל קולגן. הטכניקה מיקרוסקופ קונפוקלי השתקפות מדמיין, quantitates את microtopography של נקבובי biomaterials מקריסטלים של פולימרים סינתטיים ו 3D קולגן מטריצות23,24,35,36 ,37. במעבדה שלנו, הקמנו טכניקות כדי לעקוב אחר השינויים ב קוטביות סיבי קולגן, כמו הריכוז של קולגן משתנה38. כאן, אנו מתארים את השיטה כדי לפקח על דפורמציה של סיבי קולגן המבוסס על צילומי הווידאו של תמונות קונאפוקלית רפלקטיביים לציון האינטראקציה תא-מטריקס. התוצאות נציג המובאת כאן מראים כי להרכב מטריקס עבור התאים מד א-MB-231 mitotic הוא קטן באופן משמעותי יותר תאים אלה לאטמוספרה, שמציעה שיש תאים בתרבית של קובץ מצורף מינימלי ואינטראקציות עם מטריקס שמסביב כאשר הם מזינים את שלב mitotic19.
בעבר, היינו מיקרוסקופ קונפוקלי השתקפות לפקח ולכמת תא-מטריצת אינטראקציה לפני, במהלך ואחרי של מיטוזה של תאים HT1080. אנחנו גם פיקוח להרכב מטריקס על ידי תאים HT1080 דפיקה למטה β1-אינטגרין במהלך שלב mitotic והן לאטמוספרה. Depleting β1-אינטגרין משמעותית מפחית להרכב מטריקס התא במהלך לאטמוספרה. עם זאת, אין שום הבדל ב דפורמציה מטריקס במהלך שלב mitotic של התאים נוקאאוט (KD) β1 עגול-אינטגרין, HT1080 פראי סוג התאים19.
גישה חלופית להמחיש סיבי קולגן היא להעסיק מצומדת פלורסצנטיות מסוג קולגן. בעבר השתמשנו בגישה זו התמונה רצועות של מטריצות קולגן שנוצר על ידי תאים19. גישה זו, עם זאת, דורשת תיוג של קולגן עם תיוג הפלורסנט כגון fluorescein isothiocyanate (FITC), אשר הוא זמן רב וגם פחות יעיל. מצד שני, מיקרוסקופ קונפוקלי השתקפות ניתן להחיל ישירות כדי קולגן שלא שונתה כדי לחסוך זמן ומשאבים, או לא לכלול את הנושאים הקשורים עם זריחה photobleaching. יתר על כן, שיטה זו אינה דורשת ערוץ פלורסנט, ולכן הוא תואם עם כל צבעי פלורסנט.
השיטה המובאת בעיתון הזה ניתן להחיל באופן פוטנציאלי לכל סוג של תאים בתרבית של חילוק במטריצה קולגן תלת-ממד. שילוב של דה מרקר ויזת עבודה H2B-mCherry לתוך תאים בתרבית של אחרים על-ידי התמרה חושית lentiviral יעברו בדיוק אותם הליכים כפי שמתואר הנייר, למרות סוגים שונים של תאים עשויים יש יעילות עבור התמרה חושית על ידי מגוון lentivirus 39. גם הצפיפות של התאים על התמרה חושית וגם את כייל של הנגיף יכול להיות אופטימיזציה עבור יעילות. אם לא ניתן להשיג יעילות גבוהה התמרה חושית, תאים יכול להיבחר על-ידי קרינה פלואורסצנטית תא בסיוע מיון (FACS). תימידין חסימה ו nocodazole חלות לסנכרן בהצלחה מספר סוגים אחרים של תאים בתרבית של, כמו הלה40. טלטול מכני-לא יכול לחול על כל סוגי תאים לאסוף, בקושי לצרף המצע במהלך שלב mitotic30,31. יתר על כן, ההדמיה של סיבי קולגן באמצעות מיקרוסקופ קונפוקלי השתקפות, כימות של מטריקס להרכב יכול להחיל ישירות על כל הסוגים האחרים של חלוקת תאים בתרבית.
השיטה המוצגת כאן היא גישה כללית ויעילה ללמוד בתרבית של חלוקת התא ואינטראקציות מטריצה תא סביבה תלת-ממד. הגישה מקלה על החללית שלנו לתוך הבסיס המולקולרי של הפיתוח של הרקמות ושל מחלות, potentiates את העיצוב של הרומן אבחון, גישות טיפוליות בעתיד.
Disclosures
המחברים מצהירים כי יש להם אינטרסים כלכליים אין מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי NIH מעניקה R01CA174388 ו- U54CA143868. המחברים רוצה להכיר את הפרס PURA מ אוניברסיטת ג'ונס הופקינס לתמיכה של חן ווי-טונג. חומר זה מתבסס על עבודה נתמכת על-ידי הלאומית למדע קרן בוגר מחקר לאחווה תחת גרנט מס 1232825.
Materials
| Name | Company | Catalog Number | Comments |
| Human embryonic kidney 293T | ATCC | ||
| MDA-MB-231 | Physical Sciences Oncology Center, NIH | ||
| DMEM | Corning | 10-013-CV | |
| DMEM powder | ThermoFisher Scientific | 12100-046 | |
| Fetal bovine serum | Hyclone | SH30910.03 | |
| Penicillin-Streptomycin 100X | Sigma-Aldrich | P0781 | |
| Fugene HD | Promega | E2311 | |
| Lipofectamine 2000 | Life technologies | 11668-07 | |
| Plasmid encoding H2B-mCherry in a lentiviral vector | Addgene | plasmid 21217 | |
| Thymidine | Sigma-Aldrich | T1895 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| Opti-MEM | Life Technologies | 31985-070 | |
| Sodium bicarbonate | GibcoBRL | 11810-025 | |
| HEPES | Sigma-Aldrich | 113375-100 | |
| Collagen | Corning | 354236 | |
| NaOH | J.T. Bake | 3722-01 | |
| Millex-HV syringe filter unit, 0.45-μm, PVDF, 33 mm | Millipore | SLHVM33RS | |
| Nikon TE2000E epifluorescence microscope | Nikon | TE2000E | |
| Cascade 1K CCD camera | Roper Scientific | ||
| NIS-Elements AR imaging software | Nikon | ||
| Nikon A1 confocal microscope | Nikon | A1 |
References
- Ly, D. H., Lockhart, D. J., Lerner, R. A., Schultz, P. G. Mitotic misregulation and human aging. Science. 287 (5462), 2486-2492 (2000).
- Gascoigne, K. E., Taylor, S. S. How do anti-mitotic drugs kill cancer cells?. J Cell Sci. 122 (Pt 15), 2579-2585 (2009).
- Brinkley, B. R. Managing the centrosome numbers game: from chaos to stability in cancer cell division. Trends Cell Biol. 11 (1), 18-21 (2001).
- Phillip, J. M., Aifuwa, I., Walston, J., Wirtz, D. The Mechanobiology of Aging. Annu Rev Biomed Eng. 17, 113-141 (2015).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Martin, M. D., et al. Effect of ablation or inhibition of stromal matrix metalloproteinase-9 on lung metastasis in a breast cancer model is dependent on genetic background. Cancer Res. 68 (15), 6251-6259 (2008).
- Knox, J. J., Hotte, S. J., Kollmannsberger, C., Winquist, E., Fisher, B., Eisenhauer, E. A. Phase II study of Triapine in patients with metastatic renal cell carcinoma: a trial of the National Cancer Institute of Canada Clinical Trials Group (NCIC IND.161). Invest New Drugs. 25 (5), 471-477 (2007).
- Komlodi-Pasztor, E., Sackett, D. L., Fojo, A. T. Inhibitors targeting mitosis: tales of how great drugs against a promising target were brought down by a flawed rationale. Clin Cancer Res. 18 (1), 51-63 (2012).
- Tong, W. G., et al. Phase I and pharmacologic study of SNS-032, a potent and selective Cdk2, 7, and 9 inhibitor, in patients with advanced chronic lymphocytic leukemia and multiple myeloma. J Clin Oncol. 28 (18), 3015-3022 (2010).
- Matulonis, U. A., et al. Phase II study of MLN8237 (alisertib), an investigational Aurora A kinase inhibitor, in patients with platinum-resistant or -refractory epithelial ovarian, fallopian tube, or primary peritoneal carcinoma. Gynecol Oncol. 127 (1), 63-69 (2012).
- Boss, D. S., et al. Clinical evaluation of AZD1152, an i.v. inhibitor of Aurora B kinase, in patients with solid malignant tumors. Ann Oncol. 22 (2), 431-437 (2011).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Giri, A., et al. The Arp2/3 complex mediates multigeneration dendritic protrusions for efficient 3-dimensional cancer cell migration. FASEB J. 27 (10), 4089-4099 (2013).
- Fraley, S. I., Feng, Y., Giri, A., Longmore, G. D., Wirtz, D. Dimensional and temporal controls of three-dimensional cell migration by zyxin and binding partners. Nat Commun. 3, 719 (2012).
- Fraley, S. I., et al. A distinctive role for focal adhesion proteins in three-dimensional cell motility. Nat Cell Biol. 12 (6), 598-604 (2010).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. J Cell Biol. 205 (2), 155-162 (2014).
- He, L., et al. Local 3D matrix confinement determines division axis through cell shape. Oncotarget. 7 (6), 6994-7011 (2016).
- Held, M., et al. CellCognition: time-resolved phenotype annotation in high-throughput live cell imaging. Nat Methods. 7 (9), 747-754 (2010).
- Fallica, B., Maffei, J. S., Makin, G., Zaman, M. Alteration of cellular behavior and response to PI3K pathway inhibition by culture in 3D collagen gels. PLoS One. 7 (10), e48024 (2012).
- Meli, L., Jordan, E. T., Clark, D. S., Linhardt, R. J., Dordick, J. S. Influence of a three-dimensional, microarray environment on human Cell culture in drug screening systems. Biomaterials. 33 (35), 9087-9096 (2012).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Protoc Cell Biol. 10, 1-20 (2010).
- Gunzer, M., Kampgen, E., Brocker, E. B., Zanker, K. S., Friedl, P. Migration of dendritic cells in 3D-collagen lattices. Visualisation of dynamic interactions with the substratum and the distribution of surface structures via a novel confocal reflection imaging technique. Adv Exp Med Biol. 417, 97-103 (1997).
- Geraldo, S., Simon, A., Vignjevic, D. M. Revealing the cytoskeletal organization of invasive cancer cells in 3D. J Vis Exp. (80), e50763 (2013).
- Lleres, D., James, J., Swift, S., Norman, D. G., Lamond, A. I. Quantitative analysis of chromatin compaction in living cells using FLIM-FRET. J Cell Biol. 187 (4), 481-496 (2009).
- Poincloux, R., et al. Contractility of the cell rear drives invasion of breast tumor cells in 3D Matrigel. Proc Natl Acad Sci U S A. 108 (5), 1943-1948 (2011).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods Mol Biol. 761, 75-83 (2011).
- Jackman, J., O'Connor, P. M. Methods for synchronizing cells at specific stages of the cell cycle. Curr Protoc Cell Biol. 8, (2001).
- Zwanenburg, T. S. Standardized shake-off to synchronize cultured CHO cells. Mutat Res. 120 (2-3), 151-159 (1983).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol Biol. 296, 157-166 (2005).
- Kihara, T., Ito, J., Miyake, J. Measurement of biomolecular diffusion in extracellular matrix condensed by fibroblasts using fluorescence correlation spectroscopy. PLoS One. 8 (11), e82382 (2013).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys J. 83 (3), 1650-1660 (2002).
- Harjanto, D., Maffei, J. S., Zaman, M. H. Quantitative analysis of the effect of cancer invasiveness and collagen concentration on 3D matrix remodeling. PLoS One. 6 (9), e24891 (2011).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin Cell Dev Biol. 20 (8), 931-941 (2009).
- Petroll, W. M. Differential interference contrast and confocal reflectance imaging of collagen organization in three-dimensional matrices. Scanning. 28 (6), 305-310 (2006).
- Fraley, S. I., et al. Three-dimensional matrix fiber alignment modulates cell migration and MT1-MMP utility by spatially and temporally directing protrusions. Sci Rep. 5, 14580 (2015).
- Ikeda, Y., Collins, M. K., Radcliffe, P. A., Mitrophanous, K. A., Takeuchi, Y. Gene transduction efficiency in cells of different species by HIV and EIAV vectors. Gene Ther. 9 (14), 932-938 (2002).
- Ma, H. T., Poon, R. Y. Synchronization of HeLa cells. Methods Mol Biol. 761, 151-161 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved