Method Article
Säugetier-Zellteilung in 3D Matrizen über Quantitative konfokale Reflexion Mikroskopie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll effizient studiert Säugetier-Zellteilung in 3D Kollagen Matrizen durch die Integration von Synchronisation der Zellteilung, Überwachung der Abteilung Veranstaltungen in 3D Matrizen mit live-Cell imaging Technik, zeitaufgelöste konfokale Reflexion Mikroskopie und quantitative bildgebende Analyse.
Zusammenfassung
Die Studie wie Säugetier-Zellteilung ist geregelt in einer 3D Umgebung bleibt trotz seiner physiologischen Relevanz und therapeutische Bedeutung weitgehend unerforscht. Mögliche Gründe für das Fehlen der Exploration sind die experimentellen Einschränkungen und technischen Herausforderungen, die das Studium der Zellteilung in 3D Culture ineffizient machen. Hier beschreiben wir eine Imaging-basierte Methode, um effizient Säugetier-Zellteilung und Zelle-Matrix-Interaktionen in 3D Kollagen Matrizen zu studieren. Zellen mit fluoreszierenden H2B beschriftet werden synchronisiert mit der Kombination von Thymidin blockieren und Nocodazole Behandlung mit anschließender eine mechanische Shake-off-Technik. Synchronisierte Zellen werden dann in ein 3D Kollagen-Matrix eingebettet. Zellteilung wird mit live-Cell-Mikroskopie überwacht. Die Verformung der Kollagenfasern während und nach der Zellteilung, die ein Indikator der Zellmatrix Interaktion ist, überwacht werden kann und mit quantitativen konfokale Reflexion Mikroskopie quantifiziert. Die Methode stellt eine effiziente und allgemeinen Ansatz zur Säugetier-Zellteilung und Zelle-Matrix Interaktionen in einer physiologisch relevanten 3D-Umgebung zu studieren. Dieser Ansatz bietet neue Einblicke in die molekularen Grundlagen der Entwicklung von Normalgewebe und Krankheiten nicht nur, sondern kann auch für die Gestaltung der neuartige diagnostische und therapeutische Ansätze.
Einleitung
Zelle Mitose ist ein kritisches Ereignis im zellularen Lebens, deren Regelung im Gewebe und Organ Entwicklung entscheidende Rolle spielt. Abnorme Mitose ist in natürlichen genetischen Variationen, menschliche Alterungsprozesse und das Fortschreiten von Krebs1,2,3,4,5verwickelt. Die erhöhte Rate von Proliferation von Tumorzellen im Vergleich zu normalen Zellen ist eines der Markenzeichen von Krebs, trotz der Tatsache, dass Zelle Verhaltensweisen sehr heterogenen unter verschiedenen Arten von Tumoren und auch unter den Patienten sind. Trotz vielversprechender präklinische Ergebnisse zeigten einige neu entwickelte antimitotic Medikamente nicht wirksam in klinischen Studien6,7,8,9,10 ,11. Die Relevanz der experimentellen und präklinischen Modellen muss sorgfältig geprüft werden. Viele Arten von normalen Säugetieren und Krebs Zellen unterteilen in dreidimensionale (3D) Matrizen, wie z. B. Fibroblasten und Fibrosarkom Zellen Kollagen-reiche 3D Bindegewebe und metastatischen Krebszellen in der 3D Stromazellen extrazelluläre Matrix (ECM). Allerdings sind die überwiegende Mehrheit der Säugetier-Zellteilung Experimente und Tests an Zellen auf zweidimensionale (2D) Substraten kultiviert durchgeführt worden. Eine veränderte 3D Matrix könnte besser rekapitulieren die Mikrostruktur, mechanischen Eigenschaften und biochemische Signale des 3D ECM sowohl normale und pathologische Gewebe12,13,14, 15,16,17.
Die Studie von wie Säugetier-Zellteilung reguliert in 3D Umgebungen bleibt weitgehend unerforscht, obwohl die physiologische Relevanz und therapeutische Bedeutung18,19. Mögliche Gründe sind die technischen Schwierigkeiten und experimentelle Herausforderungen im Zusammenhang mit dem Studium Zellteilung in 3D Matrizen. Mitose der Zelle bildet einen zeitliche Bruchteil in der ganzen Zellzyklus-20. Bisherigen Arbeit hat gezeigt, dass die Proliferationsrate von vielen Säugerzellen, wie menschliche Muttermilch Adenokarzinom MCF-7, menschlichen Osteosarkom U2OS und menschlichen Leber HepG2, ist viel niedriger in 3D Matrizen verglichen mit ihren Gegenstücken auf 2D Substrate21, 22. Darüber hinaus bewegen sich Zellen eingebettet in 3D Matrizen ein-und Fokus während live Cell Imaging. All diese Faktoren tragen zur extrem niedrige Effizienz Zellteilung Veranstaltungen in 3D Culture mit bildgebenden Verfahren zu erfassen.
Interaktionen zwischen den ECM und Zellen spielen wichtige Rolle bei der Regulierung der Zellteilungen. Hier beschreiben wir einen Ansatz zur Säugetier-Zellteilung in 3D Kollagen Matrizen effizient studieren. Die Methode beinhaltet die Einbeziehung der mitotischen Markierungen, um die Zellen, Synchronisation der Zellteilung sowie die Überwachung der Abteilung Veranstaltungen in 3D mit dem Leben-Zelle bildgebendes Verfahren, zeitaufgelöste konfokale Reflexion Mikroskopie, Matrizen und quantitative bildgebende Analyse. Fluoreszenz-markierten Histon Protein H2B als Marker zu differenzieren mitotischen und interphase Zellen zuerst in die Zellen eingebracht. Dann werden die Zellen synchronisiert mit der Kombination von Thymidin blockieren und Nocodazole Behandlung mit anschließender eine mechanische Shake-off-Technik. Synchronisierte Zellen werden dann direkt in 3D Kollagen Matrizen gekapselt. Zellteilung Ereignisse mehrerer Zellen werden effizient durch Low-Vergrößerung Zeitraffer live Cell Imaging überwacht. Die Verformung der Kollagenfasern, die ein Indikator der Zellmatrix Interaktion ist, wird mit der Reflexion der konfokalen Mikroskopie bei hoher Vergrößerung überwacht.
Wir haben früher diese Technik zu überwachen und zu quantifizieren Zellmatrix Interaktion vor, während und nach der Mitose zwei metastasiertem Krebs-Zelllinien, menschliche invasives Duktales Karzinom MDA-MB-231 und menschlichen Fibrosarkom HT1080 Zellen in 3D Kollagen Matrizen-19. Die hier vorgestellten Methoden ermöglichen einen effizienten und allgemeinen Ansatz um beide Säugetieren Zellteilung in einer 3D Umgebung und Zelle-Matrix Interaktionen zu untersuchen. Die MDA-MB-231-Zell-Linie dient als ein Beispiel in dem Papier. Dieses Protokoll bietet neue Einblicke in die molekularen Grundlagen der Entwicklung von Normalgewebe und Krankheiten, und könnte auch für die Gestaltung der neuartige diagnostische und therapeutische Ansätze ermöglichen.
Protokoll
Das Protokoll zur Verfügung gestellt erfolgt nach den Richtlinien von The Homewood institutionelle Review Board (HIRB).
(1) stabile Expression der H2B-mCherry als Marker für Zelle Mitose
-
Generation von Lentivirale Partikel aus menschlichen embryonalen Niere 293T (HEK 293T) Zellen
- Platte die HEK 293T Zellen in der Kulturschale 10 cm Zelle an der Dichte von 5 x 106 Zellen/Gericht im Zellkulturmedium (Dulbeccos geändert Eagle Medium (DMEM) mit hohen Glukose (4,5 g/L), Natrium Pyruvat, 10 % fetalen Bovine Serum (FBS) und 1 % Penicillin-Streptomycin (Pen/Strep)). 24 h bei 37 ° C und 5 % Kohlendioxid (CO2) inkubieren. Die gewünschte Konfluenz der Zellen am Tag der Transfektion ist etwa 70-80 %.
Hinweis: HEK 293T Zellen dienen hier Viruspartikel, zu produzieren, die später verwendet wird, um MDA-MB-231 Zellen transduzieren um eine Zell-Linie stabil auszudrücken H2B-mCherry zu generieren. Stellen Sie sicher, dass Zellen die Platte gleichmäßig verteilt sind. Ergänzung der Zellen weisen auf die Platte fallen, und sanft bewegt die Platte hin und her kann helfen, gleichmäßige Verteilung. Zellen können auch ausgesät werden, in Platten oder Flaschen von anderen Größen, die in der Auflistung der Viruspartikel verschiedenen Umfangs führen wird. - Transfizieren Sie HEK 293T Zellen mit einem Transfection Reagens mit drei Plasmide (Lentivirale Vektor, CMV ΔR 8.91 und pMDG-VSVG). Das Plasmid Codierung H2B-mCherry wird in einem Lentivirale Vektor mit Phosphoglycerate Kinase Promoter (PGK) geklont. CMV ΔR 8.91 enthält drei erforderlichen HIV Gene gag, Polund Rev. pMDG-VSVG enthält das VSV-G-Umschlag-gen.
Hinweis: Es gibt mehrere Transfektion Mittel zur Auswahl.- Lassen Sie das Fläschchen Transfection Reagens auf Raumtemperatur (RT) vor Gebrauch. Umkehren oder Wirbel das Fläschchen kurz.
- Mix 16 µg DNA, bestehend aus 6 µg Plasmid H2B-mCherry, 8 µg von CMV ΔR 8.91 und 2 µg der pMDG-VSVG, in 1 mL reduzierte Serum-Medien. 5 min bei RT inkubieren.
Hinweis: Die Menge und das Verhältnis der drei Vektoren ist vielfältig und für verschiedene Lentivirale Übertragung Vektoren optimiert. - Fügen Sie 48 µL (1:3-Verhältnis von DNA zu verwenden: Transfection Reagens) des Transfection Reagens in die oben genannte DNA-Lösung und dann mindestens 15 min bei RT inkubieren.
Hinweis: Das Verhältnis der DNA vs. Transfection Reagens ist vielfältig und optimiert für verschiedene Lentivirale Übertragung Vektoren. Stellen Sie sicher, dass die Transfektion Reagenz die Seite die 1,5 mL Zentrifugenröhrchen nicht berührt. - Fügen Sie die DNA-Lipid komplexe Lösung made in Schritt 1.1.2.3 tropfenweise auf die Zellen. Vorsichtig schwenken die Platte, um die gleichmäßige Verteilung des Komplexes in der Platte zu gewährleisten.
- Ca. 6 h nach Transfektion, aspirieren Sie das Medium und fügen Sie frische Zellkulturmedium (DMEM mit hohem Blutzucker (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep).
- Ernten Sie die überstehenden 24, 48 und 72 h nach Transfektion. Ersetzen Sie das Medium nach jeder Ernte (DMEM, 4,5 g/L Glukose, Natrium Pyruvat, mit 10 % FBS und 1 % Pen/Strep).
- Filtern Sie die Lentivirale Partikel durch einen 0,45 µm-Filter, die Zelltrümmer zu entfernen. Alternativ, spin-down der Überstand der Zellenrückstand trennen. Der Überstand Transduktion sofort einsetzbar oder kann bei-80 ° c gelagert werden
- Platte die HEK 293T Zellen in der Kulturschale 10 cm Zelle an der Dichte von 5 x 106 Zellen/Gericht im Zellkulturmedium (Dulbeccos geändert Eagle Medium (DMEM) mit hohen Glukose (4,5 g/L), Natrium Pyruvat, 10 % fetalen Bovine Serum (FBS) und 1 % Penicillin-Streptomycin (Pen/Strep)). 24 h bei 37 ° C und 5 % Kohlendioxid (CO2) inkubieren. Die gewünschte Konfluenz der Zellen am Tag der Transfektion ist etwa 70-80 %.
-
Generation von Zelle Linien stabil mit dem Ausdruck ihrer H2B-mCherry
Hinweis: Dieses Protokoll ist für MDA-MB-231 Zellen detailliert beschrieben. Vor der Verwendung im Experiment, menschliche Muttermilch Karzinomzellen MDA-MB-231 (Physical Sciences Oncology Center, NIH) kultiviert in DMEM mit hohem Blutzucker (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep.- Die MDA-MB-231-Zellen bei der Dichte von 1 x 10-5 -Zellen in der Kulturschale 35 mm Platte.
Hinweis: Die Dichte der Überzug für verschiedene Zelllinien sollte optimiert werden, und daher möglicherweise anders als die optimale Dichte für die MDA-MB-231-Zellen. - 24 h nach der galvanischen Zellen, fügen Sie 1 mL des Virus und 1 mL frisches Medium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep).
- Inkubieren Sie die Zellen, für einen Zeitraum von 6 h bis über Nacht.
Hinweis: Sowohl die Lautstärke des Virus und die Inkubationszeit für verschiedene Zelllinien optimiert werden müssen. Wenn die Zellen nicht gesund ein paar Stunden nach der Zugabe des Virus aussehen, z. B. 1 mL des Virus und 2 mL frisches Medium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep) für Schritt 1.2.2. Die Dauer der Inkubation in Schritt 1.2.3 kann auch reduziert werden. - Aspirieren Sie das Medium und 10 mL frisches Medium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep). Zwischen 24 bis 72 h bei 37 ° C und 5 % CO2inkubieren.
- Überprüfen Sie den Ausdruck der H2B-mCherry in Zellen mit einem Epifluoreszenz-Mikroskop.
Hinweis: Wenn die Transduktion Effizienz in den Zellen niedrig ist, könnte das Volumen des Virus im Schritt 2.2 und die Inkubationszeit im Schritt 2.3 erhöht werden.
- Die MDA-MB-231-Zellen bei der Dichte von 1 x 10-5 -Zellen in der Kulturschale 35 mm Platte.
(2) Synchronisation der Zellen mit dem stabil Ausdruck H2B-mCherry
- Platte die Zellen um 50 bis 60 % confluency, d. h. Platte 2 x 104 MDA-MB-231 Zellen in jede Vertiefung einer 24-Well-Platte.
- Inkubieren Sie die Kultur bei 37 ° C und 5 % CO2 für 24 h.
- Ersetzen Sie das Wachstumsmedium mit 0,5 mL Medium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep) mit 2 mM Thymidin und in den Inkubator für 24 h zu verlassen.
Hinweis: Zellen, Thymidin werden verhaftet, in der Phase des Zellwachstums (G1) / DNA-Synthese (S) Übergang und in der gesamten S-Phase durch die Hemmung der DNA-Synthese. Die Dauer der Inkubation sollte abwechslungsreich und optimiert für verschiedene Zelllinien. - Lassen Sie die Zellen von Thymidin-Exposition durch Waschen mit Phosphat gepufferte Kochsalzlösung (PBS) dreimal. Dann brüten Sie Zellen im normalen Zellkulturmedium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep) für 5 h.
Hinweis: Die Freigabe der Zellen von der Thymidin-Exposition kann die Zellen, um das Zellwachstum (G2) zu kommen / mitotischen (M)-Phase für Zellen zuvor verhaftet am G1/S-Phase und phase in die G1-Phase für Zellen zuvor verhaftet, in der S. Die Länge des Release-Zeit variiert und optimiert für verschiedene Zelllinien. - Blockieren Sie die Zellen mit 250 ng/mL Nocodazole für 12 h.
Hinweis: Alle Zellen ausgesetzt Nocodazole sind in der Phase G2/M verhaftet. Nocodazole ist zytotoxisch. Längerer Exposition gegenüber Nocodazole kann Apoptose führen. Passen Sie die Periode oder Konzentration der Exposition für verschiedenen Zelllinien, wenn Zelle Todesfälle beobachtet werden. Zellen, die erfolgreich synchronisiert werden, werden eine sphärische Morphologie aufweisen. - Schütteln Sie die Zellen für 45 s, 1 min mit einem Orbitalschüttler bei 150 bis 200 u/min.
Hinweis: Mitotische Zellen, die wenig festhalten an das Substrat haben, werden während des Prozesses abgeschüttelt werden. - Entfernen Sie das Medium, um Zellen zu extrahieren, indem das Medium in einem Zentrifugenröhrchen pipettieren und fügen es 0,5 mL frisches Medium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep) zu jedem Bohrloch der Platte.
- Wiederholen Sie die Schritte 2.6 und 2.7 dreimal.
- Zentrifugieren Sie die gesammelten Medium der mitotischen Zellen bei 800 X g für 3 min.
Hinweis: Dieser Schritt wird verwendet, um die Nocodazole von Handy Medium zu entfernen.
3. Einbeziehung der synchronisierten Zellen in das Kollagen Matrizen
Hinweis: Typ I Kollagen ist das am häufigsten vorkommende Protein im menschlichen Körper und in das ECM von Bindegewebe und ist so verbreitet wie eukaryotic Zelle untersuchen Funktionen werden durch eine 3D-Umgebung17,23,24 moduliert . Kollagen ist löslich in Essigsäure. Nach Neutralisation und die Kollagen-Lösung für 20-37 ° C Erwärmung, polymerisieren Kollagen Monomeren in einem Geflecht von Kollagen-Fibrillen.
- Bereiten Sie die 10 X DMEM Lösung durch ein Paket von DMEM Pulver, 3,7 g Natriumbicarbonat (Nahco33) und 1 g 4-(2-hydroxyethyl)-1-Piperazineethanesulfonic Säure (HEPES) in 50 mL destilliertem Wasser auflösen. Filtern Sie die Lösung, und dann bereiten Sie 1 M Natronlauge (NaOH) durch 2 g NaOH Pellets in 50 mL destilliertem Wasser auflösen. Filter und aliquoten Röhren die Lösung in 1,5 mL Zentrifuge.
Hinweis: In diesem Schritt sollte Normal DMEM Lösung nicht verwendet werden. Die Zugabe von bedeutenden Volumen der Kollagen-Lösung wird das Medium verdünnen. Daher ist die konzentrierte DMEM-Lösung bereit, um sicherzustellen, dass die Endkonzentration von DMEM in der Kollagenmatrix identisch mit den normalen DMEM. - Weiterhin mit den Zellen, die aus Schritt 2,9 gesammelt. Aspirieren Mittel- und wieder auszusetzen Zellen in etwa 0,25 - 0,5 mL frische Zellkulturmedium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep).
Hinweis: Um eine bestimmte Zelldichte in der Kollagenmatrix zu erreichen, kann nicht die anfängliche Dichte der Zellen in der Suspension zu niedrig sein. Somit hängt die Gesamtzahl der verfügbaren Zellen das Volumen des Mediums verwendet, um die Zellen wieder auszusetzen. - Platz 10 µL der neu suspendierten Zelle Lösung von Schritt 3.2 auf eine Hemocytometer und zählen die Dichte der Zellen in der Lösung.
-
Bestimmen Sie die Volumes für alle Komponenten, um die 3D Kollagen-Matrix benötigt. 500 µL 2 µg/µL Kollagen Gel dient hier als Beispiel.
- Berechnen Sie das Volumen der Zelle-Lösung erforderlich, um 40.000 Zellen/mL (oder 20.000 Zellen für die 500 µL Kollagen Gel). Diese Zahl in µL ist X. 50 µL 10 X DMEM benötigt werden. 50 µL der FBS wird benötigt.
- Berechnen Sie das Volumen des Kollagens, die ich auf Lager benötigt. Die Konzentration von Kollagen I ist um 4 µg/µL. Die Menge an Kollagen in µL benötigt ist Y.
- Berechnen Sie das Volumen der Natronlauge neutralisieren die Essigsäure in der Kollagen-Lösung müssen: Y µL Kollagen * 0,023 * 1000 = Z µL NaOH benötigt.
- Bestimmen Sie das Volumen der Füllstoff-Lösung: (500 µL Gesamt Gel - X µL Zellen - 50 µL 10 X DMEM - 50 µL der FBS - Y µL Kollagen - Z µL NaOH) = R µL
Hinweis: Die Füller-Lösung wird destilliert, Wasser. Wenn das berechnete Volumen der Füllstoff-Lösung eine negative Zahl ist, ist die ursprüngliche Zelldichte in der Zellsuspension zu niedrig. Die Zellen müssen drehte sich wieder und wieder in ein kleineres Volumen des Mediums suspendiert (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep).
- Hinzufügen einer sauberen 1,5 mL Zentrifugenröhrchen die Komponenten in folgender Reihenfolge: Zellen im Medium, 10 x DMEM, FBS, deionisiertes Wasser (DI), Kollagen, NaOH. Legen Sie alle Komponenten auf dem Eis zu verlangsamen die Gelierung der Kollagen-Lösung. Verwenden Sie richtiges pipettieren, um Blasenbildung zu vermeiden.
- Nach dem Hinzufügen der NaOH, mischen Sie die Lösung sorgfältig mit einer 1 mL pipettieren.
Hinweis: Gelierung des Kollagens wird unmittelbar nach der Zugabe von NaOH rechts starten. Mischen sollte sorgfältig und schnell erfolgen. - Sobald die Lösung gut vermischt ist, geben Sie 500 µL der Lösung in jedem 24-Well-Platte. Legen Sie die 24-Well-Platte im Inkubator 37 ° C. Legen Sie Frischzellen-Kulturmedium im 37 ° C Wasserbad.
Hinweis: Kunststoff Bodenplatten sind für Low-Vergrößerung Leben-Zelle Microcopy dient in der Arbeitsabstand der Linse über 1 mm. Glasboden verwendeten Platten für hohe Vergrößerung Leben-Zelle Mikroskopie aufgrund der kurzen Arbeitsabstand des hohen Vergrößerung Objektiv. - Hinzufügen von 500 µL vorgewärmten Medium (DMEM, hohe Glukose (4,5 g/L), Natrium Pyruvat, 10 % FBS und 1 % Pen/Strep) an die Spitze des Gels 30 min nach Abschluss von Schritt 3.7.
4. live Cell Imaging der Zellen aufteilen in die 3D Kollagen-Matrizen (geringer Vergrößerung)
Hinweis: Bilder von Zellen sind gesammelt in 2 min Abständen mit einer Ladung gekoppelten Gerät (CCD) Kamera auf ein Phase-Kontrast-Mikroskop, das mit einem 10 X-Objektiv ausgestattet ist und von imaging-Software gesteuert.
- Schalten Sie die live Zelle Einheit auf das Objektiv montiert. Warten Sie, bis die Temperatur bei 37 ° C stabilisiert, die Konzentration von CO2 bei 5 liegt % und die Luftfeuchtigkeit bei 75 liegt %.
- Genommen Sie 24-Well-Platte von Gelen in live Zelle Einheit am Mikroskop. Finden Sie die Unterseite der Platte zu und dann bewegen Sie das Objektiv zu, bis das Mikroskop konzentriert sich auf etwa 500 µm von der Unterseite der Platte.
Hinweis: Zellen in der Kollagenmatrix, die auch nah an der Unterseite der Platte nicht vollständig in 3D Matrix eingebettet sind. Zellen, die 500 µm weg von der Unterseite der Platte sind Imaging wird sichergestellt, dass die Zellen nicht durch Randeffekte16,17,25betroffen sind. - Verschieben Sie die Phase rund um die Zellen zu finden, und wählen Sie mehrere Positionen für die Bildgebung.
- Richten Sie die Zeitraffer-Experiment in 2-Minuten-Intervallen.
Hinweis: Die maximale Anzahl von Positionen, die in der 2 min Pause genommen werden kann ist begrenzt durch die Bewegungsgeschwindigkeit der motorisierten Bühne, und die Länge der Belichtungszeit für die Aufnahmen.
(5) Kollagen Netz Verformung während der Zellteilung (hoher Vergrößerung Microscopy)
- Schalten Sie die live Zelle Einheit auf das Objektiv montiert. Warten Sie, bis die Temperatur bei 37 ° C stabilisiert, die Konzentration von CO2 bei 5 liegt % und die Luftfeuchtigkeit bei 75 liegt %.
- Um Kollagenfasern in ungefärbten 3D Kollagen Matrizen zu visualisieren, konfigurieren Sie ein confocal Mikroskop um nur reflektiertes Licht (488 nm) von der 488-nm-Laser verwendet, um die Probe beleuchten zu erfassen. Der Laser verwendet, eine 60 X eintauchen in Wasser Ziel, NA = 1.2, WD = 200 µm, und wird von imaging-Software gesteuert.
- Die live Zelle Einheit die Probe (Zellen Kollagen Matrizen) umgesetzt. Finden Sie die Unterseite der Platte zu und dann bewegen Sie das Objektiv zu, bis das Mikroskop konzentriert sich auf etwa 100 µm von der Unterseite der Platte. Zellen, die 100 µm weg von der Unterseite der Platte sind Imaging wird sichergestellt, dass die Zellen nicht durch Randeffekte betroffen sind.
Hinweis: Hier ist ein Eintauchen in Wasser Ziel anstelle einer Öl-Immersion-Linse verwendet, da der Arbeitsabstand von der Öl-Immersion-Linse nur etwa 100 µm ist. Die Verwendung von Öl-Immersion-Objektiv stellt ein Problem dar, da die Dicke des Glases auf der Unterseite der Platte normalerweise etwa 100 µm ist. - Verschieben Sie die Phase rund um die Zellen zu finden, und wählen Sie mehrere Positionen für die Bildgebung.
Hinweis: Konfokale Mikroskopie optisch Abschnitte die Probe und erfasst nur Signale aus der Brennebene. Lebenden Zellen möglicherweise während des Time-Lapse-Experiment bewegten ein-und Fokus. Um die Erfassung der Zelle Bilder über lange Zeiträume hinweg zu ermöglichen, wird Z-Stack verwendet, um Bilder von aufeinander folgenden Scheiben 5 µm Abständen zu sammeln. Insgesamt 5 Scheiben über 25 µm werden abgebildet. - Richten Sie die Time-Lapse Experiment in 5 min Abständen.
Hinweis: 5 Minuten dient hier als das Intervall statt 2 min in Abschnitt 4 verwendet, da mehrere Scan-Modi, inklusive für H2B-mCherry, Reflexion Scannen für Kollagen und Z-Stapel Scannen, Scannen Fluoreszenz auf jeder Position angewendet werden. Die Verwendung von mehreren Scan-Modi reduziert die Geschwindigkeit des Scannens einer Position im Vergleich zu geringer Vergrößerung Bildgebung. - Die Verformung der Kollagen-Matrix in der Nähe einer Zelle durch die Kräfte, die durch die Zelle mit Particle imaging Velocimetry (PIV) mit Sub-Pixel Auflösung20zu quantifizieren. Diese Analyse auf 2D Bilder ermöglicht die klare Visualisierung der beiden Signale von den H2B-mCherry und die Kollagenfasern. Gelten Sie die anisotropen Tiefpass Filter um das Signal des Kollagen Netz20zu erhöhen.
- Um die lokale Verschiebung von einer Sub-Bild Region of Interest liegt bei (X,y) Messen von Frame k, k+ 1 Rahmen, extrahieren Sie eine regionale Fenster von 15 × 15 Pixel (X,y) am Rahmen kzentriert. Identifizieren Sie dann die passende Standorte (X,y) * durch die Orte, die eine maximale normalisierte Kreuzkorrelation Koeffizient in der Bild in Bild k+ 1 zu kennzeichnen. Die Verformung Vektor errechnet sich als (X,y) *-(X,y).
Ergebnisse
Das Ziel dieses Artikels ist eine Imaging-basierte Methode Säugetier-Zellteilung Prozesse in 3D Matrizen zu studieren und zu quantifizieren, die Wechselwirkungen zwischen der Zelle und die 3D extrazelluläre Matrix während und nach der Zellteilung zu präsentieren. Um die Darstellung der Mitose der Zelle zu erleichtern, haben wir in MDA-MB-231-Zellen mittels Lentivirale Transduktion H2B-mCherry aufgenommen. H2B konjugiert mit fluoreszierenden Proteinen dient als mitotischen Marker mitotische Zellen aus Interphase Zellen zu unterscheiden und zu verschiedene Stadien während Zelle Mitose19,20,26zu definieren. Mit dieser Methode konnten wir den gesamten Unternehmensbereich Prozess von MDA-MB-231 Zellen stabil auszudrücken H2B-mCherry in 3D Kollagen Matrizen (Abbildung 1A) zu überwachen. Mitotische Phasen begann mit der Auflösung der Kernhülle (Prophase Bild 1, Bild 1A); der Re-Organisation der Chromosomen (prometaphase: Bild 2); die Ausrichtung der Chromosomen in der Mitte der Zellkörper (Metaphase Frame 3); die Trennung der Chromosomen (Anaphase Frame 4); die Reorganisation der Chromosomen und Kernmembran und die Trennung der Körper von den zwei Tochterzellen (Telophase/Cytokinese, Bild 5).
Die Proliferationsrate der Zellen in einer 3D Matrix ist in der Regel viel niedriger als ihre Pendants auf einem 2D Substrat, die macht, die Kontrolle der Zellteilung in 3D weniger effizient19. Zur Steigerung der Effizienz des Studiums 3D Zellteilung haben wir eine Methode, die Kombination von Thymidin, Nocodazole und eine Shake-off-Technik, um zu synchronisieren, und wählen MDA-MB-231-Zellen, die in der mitotischen Phase sind beschäftigt. Synchronisierte Zellen wurden dann in Kollagen Matrizen eingebettet. Der Geschäftsbereich Prozess mehrerer Zellen wurde überwacht in Echtzeit mit live Cell Imaging bei 10-facher Vergrößerung. Etwa 70 % der Zellen unterteilt innerhalb der ersten 2 h nach der Bildung von Kollagen-Matrix (Abbildung 2), so dass für die effiziente Überwachung der Mitose in 3D (Abbildung 2).
Um die Interaktion zwischen Zellen und ihrer Umgebung Kollagen-Matrizen zu überwachen, kombinierten wir Reflexion konfokale Mikroskopie, Bild-Collagen-Fasern und Fluoreszenz-Mikroskopie, die Zellen abzubilden. A 60 X-Objektiv ermöglicht die Erfassung der Bilder in hoher Qualität der Kollagenfasern. Imaging mit einem hohen Vergrößerung Objektiv, die weniger Zellen in jedem Blickfeld erfasst, viel niedriger Durchsatz im Vergleich zur Verwendung von Low-Vergrößerung 10 X oder 20 X. Erfolgreiche Synchronisierung der Zellen erhöht die Effizienz und Durchsatz von solchen Versuch, da die meisten synchronisierten Zellen innerhalb der ersten 2 h nach der Bildung von Kollagen-Matrix unterteilt. Die Matrix-Deformation während und nach der Zellteilung ist visualisiert (Vertreter Schnappschüsse in Abbildung 1 b dargestellt sind) und quantifiziert, unter Verwendung einer benutzerdefinierten PIV-Software. Wir quantifiziert und im Vergleich Matrix Verformung während der Interphase und mitotischen Phase für Zellen in der mitotischen Phase synchronisiert. Wir beobachteten, dass Matrix Verformung nur wenig verändert in der mitotischen phase (Abbildung 3A) und weniger als die Verformung in Post-mitotischen Phasen (Abb. 3 b) eingehalten wird. Dieses Ergebnis zeigt, dass Säugerzellen haben minimale Bindung und Interaktion mit der umgebenden Matrix, während sie in der mitotischen Phase sind.
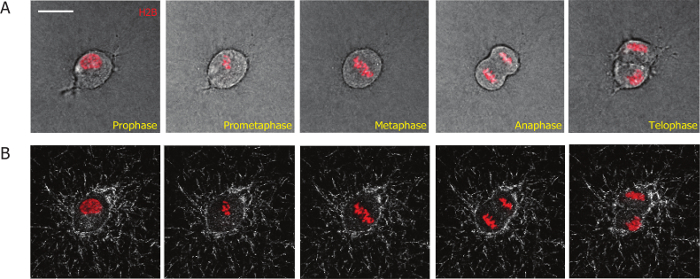
Abbildung 1: repräsentative Mikrographen erhalten aus einem hoher Vergrößerung live Cell imaging Video einer MDA-MB-231-Zelle eingebettet in eine Kollagen-Matrix, die stabil H2B-mCherry ausdrückt. (A) Phasen der mitotischen Progression der MDA-MB-231 Zelle zeichnen sich durch H2B-mCherry wie in rot gekennzeichnet. (B) die Kollagenfasern (weiß) während der mitotischen Prozess werden durch zeitabhängige konfokale Reflexion Mikroskopie visualisiert. Maßstabsleiste = 20 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Aufteilung der synchronisierten Zellen in 3D Kollagen Matrizen. Zellen wurden mit G2/M-Phase synchronisiert und in einer Kollagenmatrix eingebettet. Etwa 70 % der synchronisierten Zellen teilen innerhalb der ersten 2 h, während Kontrolle ohne Synchronisation Kluft nach dem Zufallsprinzip Zellen. Fehlerbalken = SEM (Standardfehler des Mittelwerts). Bitte klicken Sie hier für eine größere Version dieser Figur.
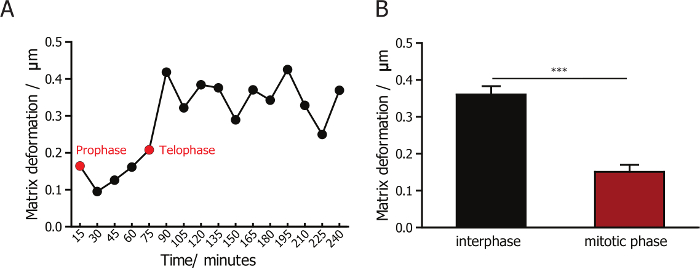
Abbildung 3: Quantifizierung der Matrix Verformung für MDA-MB-231 Zellen während der Interphase und Mitose. (A) die Änderung in der Größenordnung von Matrix Verformung für MDA-MB-231-Zellen Matrix eingebettet. Der grüne Pfeil zeigt Prophase und roter Pfeil Telophase. (B) Quantifizierung der Matrix Verformung für MDA-MB-231 Zellen während der Interphase und mitotischen Phase darauf hinweist, dass Matrix Verformung während der Zellteilung minimal ist. Fehlerbalken = SEM (Standardfehler des Mittelwerts). * p < 0,05. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Die vorherige Studie der Zellteilung in 3D war nicht effizient durch experimentelle Einschränkungen und technischen Herausforderungen18,19. Die entscheidenden Schritte für effiziente Untersuchung von Säugetieren Zellteilung in 3D Kollagen Matrizen sind: (1) die Aufnahme der Fluoreszenz-markierten mitotischen Marker zu den Zellen; (2) die Synchronisation der Zellteilung; (3) die Überwachung der Abteilung Veranstaltungen in 3D Matrizen mit live Cell imaging Technik, zeitaufgelöste konfokale Reflexion Mikroskopie und quantitative bildgebende Analyse.
Mitotische Zellen auf 2D Substraten unterschieden werden, von der Interphase Zellen anhand ihrer Morphologie, d.h. mitotische Zellen sind rund und kaum auf dem Untergrund zu befestigen, während Interphase Zellen verteilt und fest auf dem Untergrund befestigen. In 3D Matrizen der Zellmorphologie ist jedoch kein zuverlässiger Marker für mitotischen Zellen seit einigen Zellen kaum ausgebreitet und bleiben in der Matrix27,28Runden. Deshalb muss die Zellen für die Untersuchung der Zellteilung in 3D Matrizen eine mitotische Markierung vorzustellen. Wir drückten stabil H2B-mCherry im MDA-MB-231-Zellen, die als ein zuverlässiger Marker für verschiedene mitotischen Phasen Prophase, prometaphase, Metaphase, Anaphase und Telophase/Zytokinese diente. Zuvor werden wir diesen Ansatz mitotische Zellen aus Interphase Zellen in 3D Matrizen unterschieden. Mit Hilfe dieses Markers konnten wir auch messen Sie die Länge der mitotischen Phase für eine andere Zell-Linie, HT1080 Zellen aufteilen auf 2D und 3D Matrizen19.
Es gibt mehrere Möglichkeiten, Zellen, einschließlich Serum Hunger29, mitotischen Shake-30,31, doppelte Thymidin blockieren von32und Nocodazole32zu synchronisieren. Wir kombinieren die Thymidin-Behandlung und die Nocodazole Behandlung, MDA-MB-231-Zellen in der G2/M-Phase effizient zu synchronisieren. Zellen, Thymidin sind am G1/S Übergang und in der gesamten S-Phase durch die Hemmung der DNA-Synthese von Thymidin verhaftet. Die Freisetzung der Zellen aus dem Thymidin-Exposition lassen die Zellen Fortschritte G2/M-Phase für Zellen verhaftet am G1/S-Phase und G1 für Zellen in S Phase verhaftet. Alle Zellen, die Nocodazole ausgesetzt werden in der Phase G2/M verhaftet. Die gerundet bis Zellen in mitotischen Phase wurden dann geschüttelt-Weg von der Platte und direkt in die Kollagen-Matrizen gekapselt. Wir haben gezeigt, dass etwa 70 % der Zellen innerhalb von 2 Stunden teilen, nachdem sie in die Kollagen-Matrizen (Abbildung 2) integriert werden. Alternativ Zellen Kollagen Matrizen vor der Synchronisierung eingebettet werden konnte, jedoch das vernetzte die Kollagen-Matrix stellt eine physikalische Barriere und reduziert die Rate der biomolekularen Diffusion und Konvektion33, 34. in der Tat, wir versucht, Zellen in Kollagen Matrizen mit Thymidin und Nocodazole zu synchronisieren, aber versäumt, effiziente Synchronisation zu erhalten. Dieses Ergebnis könnte aufgrund der ineffizienten Diffusion und Konvektion der Medikamente durch die Kollagenmatrix sein.
Reflexion ist eine intrinsische optische Eigenschaft viele Biopolymere, einschließlich Kollagen. Reflexion der konfokalen Mikroskopie Technik visualisiert und quantitates Mikrotopographie poröse Biomaterialien hergestellt aus synthetischen Polymeren und 3D Kollagen Matrizen23,24,35,36 ,37. In unserem Labor haben wir Techniken, um Änderungen in der Kollagen Fasern Polarität zu überwachen, da die Konzentration von Kollagen38variiert etabliert. Hier beschreiben wir die Methode, um die Verformung der Kollagenfasern basierend auf die Zeitraffer-Video der reflektierenden konfokale Bilder zu bezeichnen, die Zellmatrix Interaktion zu überwachen. Die repräsentativen Ergebnisse zeigen, dass die Matrix-Deformation der mitotischen Zellen von MDA-MB-231 deutlich kleiner als die Zellen in Interphase, was darauf hindeutet ist, dass Säugerzellen minimale Anhaftung und Interaktionen mit der umgebenden Matrix beim Betreten der mitotischen Phase19.
Früher wir Reflexion der konfokalen Mikroskopie zu überwachen und zu quantifizieren Zellmatrix Interaktion vor, während und nach der Mitose HT1080 Zellen. Wir haben auch die Matrix Verformung durch β1-Integrin Knock-down HT1080 Zellen während der Interphase und mitotischen Phase überwacht. Abbauende β1-Integrin deutlich reduziert die Matrix Verformung durch die Zelle während der Interphase. Allerdings gibt es keinen Unterschied in der Matrix Verformung der mitotischen Phase der Runde β1-Integrin Zuschlag (KD) Zellen und HT1080 Wildtyp Zellen19.
Ein alternativer Ansatz zur Kollagenfasern zu visualisieren, Fluoreszenz-konjugiert zu beschäftigen ist Typ I Kollagen. Wir früher dieser Ansatz zur Bild-Titel in der Kollagen-Matrizen von Zellen19generiert. Dieser Ansatz erfordert jedoch die Kennzeichnung von Kollagen mit fluoreszierenden Farbstoff wie Fluorescein erfolgt (FITC), ist zeitaufwendig und weniger effizient. Auf der anderen Seite kann Reflexion der konfokalen Mikroskopie direkt angewendet werden, zu unveränderten Kollagen, sparen Zeit und Ressourcen und Probleme im Zusammenhang mit Fluoreszenz Immunofluoreszenz auszuschließen. Darüber hinaus ist diese Methode erfordert keinen einzelnen fluoreszierenden Kanal, und ist daher kompatibel mit allen Fluoreszenz-Farbstoffen.
In diesem Artikel vorgestellte Methode kann potenziell auf jede Art von Säugerzellen angewendet werden, die in einer 3D Kollagenmatrix zu trennen. Die Einbeziehung der H2B-mCherry-Marker in anderen Säugetieren-Zellen durch Lentivirale Transduktion werden genau die gleichen Verfahren folgen wie beschrieben in der Papier-, obwohl verschiedene Arten von Zellen Effizienzen für Transduktion von Lentivirus variiert haben kann 39. sowohl die Dichte der Zellen bei der Transduktion und der Titer des Virus könnte für Effizienz optimiert werden. Wenn hohe Transduktion Effizienz erzielt werden kann, konnte durch Fluoreszenz assistierten Zelle sortieren (FACS) Zellen ausgewählt werden. Thymidin blockieren und Nocodazole werden angewendet, um einige andere Arten von Säugetierzellen, wie HeLa40erfolgreich synchronisiert. Mechanische Shake-off konnte auf alle Zelltypen, die Runden und kaum auf das Substrat legen, während die mitotische Phase30,31angewendet werden. Darüber hinaus kann die Darstellung der Kollagenfasern mit Reflexion der konfokalen Mikroskopie und die Quantifizierung der Matrix Verformung direkt auf andere Arten der Teilung Säugerzellen angewendet werden.
Die hier vorgestellte Methode ist eine effiziente und allgemeine Konzept Säugetier-Zellteilung und Zelle-Matrix Interaktionen in einer 3D-Umgebung zu studieren. Der Ansatz unserer Sonde in die molekularen Grundlagen der Entwicklung von Normalgewebe und Krankheiten erleichtert und potenziert das Design des Romans diagnostische und therapeutische Ansätze in der Zukunft.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Diese Arbeit wurde vom NIH unterstützt R01CA174388 und U54CA143868 gewährt. Die Autoren möchte die PURA-Auszeichnung von der Johns Hopkins University für die Unterstützung von Chen Wei-Tong anerkennen. Dieses Material basiert auf Arbeit von der National Science Foundation Graduate Research Fellowship unter Grant Nr. 1232825 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Human embryonic kidney 293T | ATCC | ||
| MDA-MB-231 | Physical Sciences Oncology Center, NIH | ||
| DMEM | Corning | 10-013-CV | |
| DMEM powder | ThermoFisher Scientific | 12100-046 | |
| Fetal bovine serum | Hyclone | SH30910.03 | |
| Penicillin-Streptomycin 100X | Sigma-Aldrich | P0781 | |
| Fugene HD | Promega | E2311 | |
| Lipofectamine 2000 | Life technologies | 11668-07 | |
| Plasmid encoding H2B-mCherry in a lentiviral vector | Addgene | plasmid 21217 | |
| Thymidine | Sigma-Aldrich | T1895 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| Opti-MEM | Life Technologies | 31985-070 | |
| Sodium bicarbonate | GibcoBRL | 11810-025 | |
| HEPES | Sigma-Aldrich | 113375-100 | |
| Collagen | Corning | 354236 | |
| NaOH | J.T. Bake | 3722-01 | |
| Millex-HV syringe filter unit, 0.45-μm, PVDF, 33 mm | Millipore | SLHVM33RS | |
| Nikon TE2000E epifluorescence microscope | Nikon | TE2000E | |
| Cascade 1K CCD camera | Roper Scientific | ||
| NIS-Elements AR imaging software | Nikon | ||
| Nikon A1 confocal microscope | Nikon | A1 |
Referenzen
- Ly, D. H., Lockhart, D. J., Lerner, R. A., Schultz, P. G. Mitotic misregulation and human aging. Science. 287 (5462), 2486-2492 (2000).
- Gascoigne, K. E., Taylor, S. S. How do anti-mitotic drugs kill cancer cells? J Cell Sci. 122 (Pt 15), 2579-2585 (2009).
- Brinkley, B. R. Managing the centrosome numbers game: from chaos to stability in cancer cell division. Trends Cell Biol. 11 (1), 18-21 (2001).
- Phillip, J. M., Aifuwa, I., Walston, J., Wirtz, D. The Mechanobiology of Aging. Annu Rev Biomed Eng. 17, 113-141 (2015).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Martin, M. D., et al. Effect of ablation or inhibition of stromal matrix metalloproteinase-9 on lung metastasis in a breast cancer model is dependent on genetic background. Cancer Res. 68 (15), 6251-6259 (2008).
- Knox, J. J., Hotte, S. J., Kollmannsberger, C., Winquist, E., Fisher, B., Eisenhauer, E. A. Phase II study of Triapine in patients with metastatic renal cell carcinoma: a trial of the National Cancer Institute of Canada Clinical Trials Group (NCIC IND.161). Invest New Drugs. 25 (5), 471-477 (2007).
- Komlodi-Pasztor, E., Sackett, D. L., Fojo, A. T. Inhibitors targeting mitosis: tales of how great drugs against a promising target were brought down by a flawed rationale. Clin Cancer Res. 18 (1), 51-63 (2012).
- Tong, W. G., et al. Phase I and pharmacologic study of SNS-032, a potent and selective Cdk2, 7, and 9 inhibitor, in patients with advanced chronic lymphocytic leukemia and multiple myeloma. J Clin Oncol. 28 (18), 3015-3022 (2010).
- Matulonis, U. A., et al. Phase II study of MLN8237 (alisertib), an investigational Aurora A kinase inhibitor, in patients with platinum-resistant or -refractory epithelial ovarian, fallopian tube, or primary peritoneal carcinoma. Gynecol Oncol. 127 (1), 63-69 (2012).
- Boss, D. S., et al. Clinical evaluation of AZD1152, an i.v. inhibitor of Aurora B kinase, in patients with solid malignant tumors. Ann Oncol. 22 (2), 431-437 (2011).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Giri, A., et al. The Arp2/3 complex mediates multigeneration dendritic protrusions for efficient 3-dimensional cancer cell migration. FASEB J. 27 (10), 4089-4099 (2013).
- Fraley, S. I., Feng, Y., Giri, A., Longmore, G. D., Wirtz, D. Dimensional and temporal controls of three-dimensional cell migration by zyxin and binding partners. Nat Commun. 3, 719(2012).
- Fraley, S. I., et al. A distinctive role for focal adhesion proteins in three-dimensional cell motility. Nat Cell Biol. 12 (6), 598-604 (2010).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. J Cell Biol. 205 (2), 155-162 (2014).
- He, L., et al. Local 3D matrix confinement determines division axis through cell shape. Oncotarget. 7 (6), 6994-7011 (2016).
- Held, M., et al. CellCognition: time-resolved phenotype annotation in high-throughput live cell imaging. Nat Methods. 7 (9), 747-754 (2010).
- Fallica, B., Maffei, J. S., Makin, G., Zaman, M. Alteration of cellular behavior and response to PI3K pathway inhibition by culture in 3D collagen gels. PLoS One. 7 (10), e48024(2012).
- Meli, L., Jordan, E. T., Clark, D. S., Linhardt, R. J., Dordick, J. S. Influence of a three-dimensional, microarray environment on human Cell culture in drug screening systems. Biomaterials. 33 (35), 9087-9096 (2012).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Protoc Cell Biol. 10, 1-20 (2010).
- Gunzer, M., Kampgen, E., Brocker, E. B., Zanker, K. S., Friedl, P. Migration of dendritic cells in 3D-collagen lattices. Visualisation of dynamic interactions with the substratum and the distribution of surface structures via a novel confocal reflection imaging technique. Adv Exp Med Biol. 417, 97-103 (1997).
- Geraldo, S., Simon, A., Vignjevic, D. M. Revealing the cytoskeletal organization of invasive cancer cells in 3D. J Vis Exp. (80), e50763(2013).
- Lleres, D., James, J., Swift, S., Norman, D. G., Lamond, A. I. Quantitative analysis of chromatin compaction in living cells using FLIM-FRET. J Cell Biol. 187 (4), 481-496 (2009).
- Poincloux, R., et al. Contractility of the cell rear drives invasion of breast tumor cells in 3D Matrigel. Proc Natl Acad Sci U S A. 108 (5), 1943-1948 (2011).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods Mol Biol. 761, 75-83 (2011).
- Jackman, J., O'Connor, P. M. Methods for synchronizing cells at specific stages of the cell cycle. Curr Protoc Cell Biol. 8, (2001).
- Zwanenburg, T. S. Standardized shake-off to synchronize cultured CHO cells. Mutat Res. 120 (2-3), 151-159 (1983).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol Biol. 296, 157-166 (2005).
- Kihara, T., Ito, J., Miyake, J. Measurement of biomolecular diffusion in extracellular matrix condensed by fibroblasts using fluorescence correlation spectroscopy. PLoS One. 8 (11), e82382(2013).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys J. 83 (3), 1650-1660 (2002).
- Harjanto, D., Maffei, J. S., Zaman, M. H. Quantitative analysis of the effect of cancer invasiveness and collagen concentration on 3D matrix remodeling. PLoS One. 6 (9), e24891(2011).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin Cell Dev Biol. 20 (8), 931-941 (2009).
- Petroll, W. M. Differential interference contrast and confocal reflectance imaging of collagen organization in three-dimensional matrices. Scanning. 28 (6), 305-310 (2006).
- Fraley, S. I., et al. Three-dimensional matrix fiber alignment modulates cell migration and MT1-MMP utility by spatially and temporally directing protrusions. Sci Rep. 5, 14580(2015).
- Ikeda, Y., Collins, M. K., Radcliffe, P. A., Mitrophanous, K. A., Takeuchi, Y. Gene transduction efficiency in cells of different species by HIV and EIAV vectors. Gene Ther. 9 (14), 932-938 (2002).
- Ma, H. T., Poon, R. Y. Synchronization of HeLa cells. Methods Mol Biol. 761, 151-161 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.