Method Article
انقسام الخلية الثديية في مصفوفات ثلاثية الأبعاد عن طريق الفحص المجهري انعكاس [كنفوكل] الكمية
* These authors contributed equally
In This Article
Summary
هذا البروتوكول الدراسات كفاءة انقسام الخلايا الثديية في مصفوفات الكولاجين 3D من خلال دمج تزامن انقسام الخلية، رصد الأحداث شعبة في مصفوفات ثلاثية الأبعاد باستخدام تقنية التصوير خلية يعيش، حل وقت التأمل [كنفوكل] مجهرية والتحليل الكمي للتصوير.
Abstract
دراسة كيف الثدييات انقسام الخلية وينظم في 3D البيئة لا تزال غير مستكشفة إلى حد كبير على الرغم من أهميتها الفسيولوجية وأهمية علاجية. الأسباب المحتملة لعدم وجود الاستكشاف هي تجريبية القيود والتحديات التقنية التي تجعل دراسة انقسام الخلايا في ثقافة 3D غير فعالة. هنا، يمكننا وصف أسلوب المستندة إلى تصوير لدراسة كفاءة انقسام الخلايا الثديية وتفاعلات الخلية-مصفوفة في مصفوفات الكولاجين 3D. الخلايا المسماة الفلورسنت H2B متزامنة باستخدام مزيج العلاج حجب ونوكودازولي thymidine، متبوعاً بأسلوب يهز قبالة ميكانيكية. ثم يتم تضمين الخلايا متزامنة في مصفوفة 3D الكولاجين. ويتم رصد انقسام الخلية باستخدام الفحص المجهري خلية يعيش. تشوه ألياف الكولاجين أثناء وبعد انقسام الخلايا، ومؤشر على تفاعل الخلية-مصفوفة، يمكن رصدها وقياسها كمياً باستخدام الانعكاس [كنفوكل] كمية مجهرية. الأسلوب يقدم نهجاً تتسم بالكفاءة وعامة لدراسة الثدييات انقسام الخلية والتفاعلات الخلية-مصفوفة في بيئة ثلاثية الأبعاد ذات صلة فسيولوجيا. هذا النهج يوفر نظرة ثاقبة رواية الأساس الجزيئي لتنمية أنسجة طبيعية والأمراض، بل يسمح أيضا لتصميم نهج جديدة في التشخيص والعلاج.
Introduction
الانقسام الخلية هو حدث حاسم في الحياة الخلوية، واللائحة التي تلعب أدواراً حاسمة في تطوير الجهاز والأنسجة. الانقسام الشاذ المتورطة في الاختلافات الوراثية الطبيعية، وعمليات الشيخوخة البشرية وتطور السرطان1،2،3،،من45. زيادة معدل انتشار الخلايا السرطانية بالمقارنة مع الخلايا الطبيعية واحدة من السمات المميزة للسرطان، على الرغم من أن سلوك الخلية غير متجانسة تماما بين أنواع مختلفة من الأورام، وحتى بين المرضى. على الرغم من النتائج السريرية الواعدة، لم تظهر بعض العقاقير أنتيميتوتيك المطورة حديثا لتكون فعالة في التجارب السريرية6،،من78،9،10 ،11. وقد أهمية النماذج التجريبية والاكلينيكية التي سينظر فيها. تقسيم أنواع عديدة من خلايا الثدييات والسرطان العادي في المصفوفات (3D) ثلاثي الأبعاد، مثل الخلايا الليفية والخلايا فيبروساركوما في الأنسجة الضامة 3D-الأغنياء من الكولاجين وخلايا السرطان المنتشر في المصفوفة خارج الخلية stromal 3D (ECM). ومع ذلك، تم إجراء الغالبية العظمى من انقسام الخلية الثديية التجارب والاختبارات على الخلايا المزروعة في ثنائي الأبعاد (2D) ركائز. أفضل يمكن أن الخص مصفوفة 3D هندستها المجهرية، والخصائص الميكانيكية والإشارات البيوكيميائية من المحتوى ثلاثي الأبعاد لكل أنسجة طبيعية ومرضية12،،من1314، 1516،،17.
دراسة كيف الثدييات انقسام الخلية وينظم في 3D بيئات لا تزال غير مستكشفة إلى حد كبير على الرغم من أهميتها الفسيولوجية وال18،الأهمية العلاجية19. تتضمن الأسباب المحتملة بالصعوبات التقنية والتجريبية التحديات المرتبطة بدراسة انقسام الخلية في مصفوفات ثلاثية الأبعاد. يشكل الانقسام الخلية صغيراً الزمانية في20دورة الخلية بأكملها. العمل السابقة قد أظهرت أن معدل انتشار العديد من خلايا الثدييات، مثل غدية الثدي البشري MCF-7، أوستيوساركوما البشرية U2OS والكبد البشري HepG2، أقل بكثير في مصفوفات ثلاثية الأبعاد بالمقارنة مع نظرائهم في 2D ركائز21، 22. وعلاوة على ذلك، نقل الخلايا المضمنة في مصفوفات ثلاثية الأبعاد داخل وخارج التركيز أثناء تصوير خلية يعيش. وكل هذه العوامل تسهم في كفاءة منخفضة للغاية لالتقاط أحداث انقسام الخلايا في ثقافة ثلاثي الأبعاد باستخدام تقنيات التصوير.
التفاعلات بين إدارة المحتوى في المؤسسة والخلايا تلعب أدواراً حاسمة في تنظيم انقسامات الخلية. هنا، يمكننا وصف نهج لدراسة كفاءة انقسام الخلايا الثديية في مصفوفات الكولاجين 3D. يتضمن الأسلوب إدراج علامات الانقسامية للخلايا، وتزامن انقسام الخلية، فضلا عن رصد أحداث شعبة في مصفوفات ثلاثية الأبعاد باستخدام تقنية التصوير خلية يعيش، حل وقت التأمل [كنفوكل] مجهرية، و التحليل الكمي للتصوير. أولاً أدخلت البروتين المسمى fluorescence هيستون H2B الخلايا كعلامة لتمييز الانقسامية والطور البيني خلايا. ثم تتم مزامنة الخلايا باستخدام مزيج العلاج حجب ونوكودازولي thymidine، متبوعاً بأسلوب يهز قبالة ميكانيكية. ثم يتم تغليف الخلايا متزامنة مباشرة إلى مصفوفات الكولاجين 3D. وترصد أحداث انقسام الخلية من خلايا متعددة كفاءة استخدام التصوير خلية يعيش الوقت الفاصل بين تضخم منخفض. ويتم رصد تشوه ألياف الكولاجين، ومؤشر على تفاعل الخلية-مصفوفة، استخدام الانعكاس [كنفوكل] مجهرية في عالية التكبير.
وقد استخدمنا هذا الأسلوب سابقا لرصد وقياس التفاعل خلية المصفوفة قبل وأثناء وبعد الانقسام اثنين من خطوط خلايا السرطان المنتشر وسرطان الأقنية الغازية البشرية MDA-ميغابايت-231 والخلايا البشرية فيبروساركوما HT1080، في الكولاجين 3D 19من المصفوفات. الأساليب المقدمة هنا توفير نهج فعالة والعامة لدراسة كل انقسام الخلية الثدييات في التفاعلات بين البيئة وخلية-مصفوفة 3D. يتم استخدام خط الخلية MDA-ميغابايت-231 كمثال في جميع أنحاء الورقة. هذا البروتوكول يوفر نظرة ثاقبة رواية الأساس الجزيئي لتنمية أنسجة طبيعية والأمراض، ويمكن أن تسمح أيضا بتصميم نهج جديدة في التشخيص والعلاج.
Protocol
وينص البروتوكول المبادئ التوجيهية Homewood المؤسسية استعراض المجلس (حرب).
1-استقرار التعبير عن مشري H2B كعلامة للانقسام الخلية
-
جيل جسيمات لينتيفيرال من الكلي الجنينية البشرية 293T (HEK 293T) الخلايا
- لوحة الخلايا HEK 293T على طبق ثقافة خلية 10 سم في كثافة 5 × 106 خلايا/طبق في خلية الثقافة المتوسطة (دولبيكو للمتوسطة (دميم) تحتوي على ارتفاع الجلوكوز "تعديل النسر" (4.5 غرام/لتر)، بيروفات صوديوم، 10% مصل بقرى الجنين (FBS)، و 1% البنسلين-ستربتوميسين (القلم/بكتيريا)). احتضانها ح 24 في غاز ثاني أكسيد الكربون (CO2) 37 درجة مئوية و 5 في المائة. كونفلوينسي المطلوب من الخلايا في يوم تعداء هو حوالي 70-80%.
ملاحظة: يتم استخدام الخلايا 293T HEK هنا لإنتاج الجزيئات الفيروسية، التي سوف تستخدم في وقت لاحق ترانسدوسي MDA-ميغابايت-231 الخلايا بغية توليد خط خلية ستابلي معربا عن مشري H2B. تأكد من أن الخلايا وتوزع بالتساوي في جميع أنحاء اللوحة. إضافة خلايا إسقاط الحكيمة اللوحة، وتتحرك بلطف لوحة ذهابا وإيابا يمكن أن تساعد في توزيع حتى. يمكن أيضا أن يكون المصنف الخلايا في لوحات أو قوارير من أحجام أخرى، مما سيؤدي إلى جمع كميات مختلفة من الجسيمات الفيروسية. - ترانسفيكت HEK 293T الخلايا باستخدام كاشف تعداء مع البلازميدات الثلاثة (متجه لينتيفيرال و CMV ΔR 8.91 pMDG-فسفج). هو استنساخ بلازميد ترميز مشري H2B في ناقل لينتيفيرال مع فوسفوجليسيراتي كيناز المروج (PGK). CMV ΔR 8.91 يحتوي على ثلاثة المطلوبة فيروس نقص المناعة البشرية الجينات و اسكت، و بول، و القس. pMDG-فسفج يحتوي على الجين ز منظمة المغلف.
ملاحظة: هناك عدة عوامل تعداء للاختيار من بينها.- السماح القنينة من تعداء كاشف تصل إلى درجة حرارة الغرفة (RT) قبل الاستخدام. عكس أو دوامة القنينة بإيجاز.
- ميكس 16 ميكروغرام للحمض النووي، الذي يتكون من 6 ميكروغرام من بلازميد مشري H2B و 8 ميكروغرام من CMV ΔR 8.91 2 ميكروغرام من pMDG-فسفج، في 1 مل من المصل انخفاض وسائل الإعلام. تبني على RT لمدة 5 دقائق.
ملاحظة: مقدار ونسبة من ثلاث ناقلات متنوعة والأمثل لناقلات نقل لينتيفيرال مختلفة. - إضافة 48 ميليلتر (استخدام نسبة 1:3 من الحمض النووي: كاشف تعداء) من الكاشف تعداء في الحل الحمض النووي السابق، واحتضان ثم على RT لمدة 15 دقيقة على الأقل.
ملاحظة: تختلف نسبة الحمض النووي مقابل كاشف تعداء والأمثل لناقلات نقل لينتيفيرال مختلفة. تأكد من أن الكاشف تعداء عدم الاتصال إلى جانب أنبوب الطرد المركزي 1.5 مل. - إضافة الحمض الدهني الحل المعقدة الواردة في الخطوة 1.1.2.3 دروبويسي إلى الخلايا. بلطف دوامة لوحة لضمان التوزيع حتى مجمع في اللوحة.
- نضح المتوسط حوالي 6 ح بعد تعداء، وإضافة خلية جديدة الثقافة المتوسطة (دميم مع ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم، % FBS 10 و 1% القلم/بكتيريا).
- حصاد 24 طافية و 48 تعداء بعد ح 72. استبدال المتوسطة بعد كل موسم الحصاد (دميم، الجلوكوز 4.5 غرام/لتر، بيروفات صوديوم، مع 10% FBS، و 1% القلم/بكتيريا).
- تصفية الجزيئات لينتيفيرال من خلال عامل تصفية 0.45 ميكرون لإزالة الحطام الخلوية. وبدلاً من ذلك، تدور أسفل المادة طافية فصل الخلية تحت الأنقاض. المادة طافية يمكن أن تستخدم لتوصيل الحق بعيداً، أو يمكن تخزينها في-80 درجة مئوية.
- لوحة الخلايا HEK 293T على طبق ثقافة خلية 10 سم في كثافة 5 × 106 خلايا/طبق في خلية الثقافة المتوسطة (دولبيكو للمتوسطة (دميم) تحتوي على ارتفاع الجلوكوز "تعديل النسر" (4.5 غرام/لتر)، بيروفات صوديوم، 10% مصل بقرى الجنين (FBS)، و 1% البنسلين-ستربتوميسين (القلم/بكتيريا)). احتضانها ح 24 في غاز ثاني أكسيد الكربون (CO2) 37 درجة مئوية و 5 في المائة. كونفلوينسي المطلوب من الخلايا في يوم تعداء هو حوالي 70-80%.
-
خطوط جيل خلية مشري H2B ستابلي إذ تعرب عن
ملاحظة: هذا البروتوكول هو وصف مفصل لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا. قبل استخدامها في التجربة، تستزرع خلايا سرطان الثدي البشرية MDA-ميغابايت-231 (مركز الأورام العلوم الفيزيائية، والمعاهد الوطنية للصحة) في دميم التي تحتوي على جلوكوز مرتفعة (4.5 غرام/لتر)، بيروفات صوديوم، % FBS 10 و 1% القلم/بكتيريا.- لوحة MDA-ميغابايت-231 الخلايا في كثافة 1 × 105 خلايا في صحن ثقافة 35 ملم.
ملاحظة: كثافة الطلاء لخطوط خلايا مختلفة من ينبغي أن يكون الأمثل، وذلك قد يكون مختلفاً عن الكثافة المثلى لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا. - 24 ساعة بعد طلاء الخلايا، وإضافة 1 مل من الفيروسات و 1 مل من متوسطة جديدة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم و 10% FBS و 1% القلم/بكتيريا).
- احتضان الخلايا لفترة زمنية من 6 (ح) بين عشية وضحاها.
ملاحظة: كلا حجم الفيروس وضرورة احتضان الوقت الأمثل لخطوط خلايا مختلفة. على سبيل المثال، إذا كانت الخلايا لا تبدو صحية بضع ساعات بعد إضافة الفيروس، استخدم 1 مل من الفيروسات و 2 مل من متوسطة جديدة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم و 10% FBS و 1% القلم/بكتيريا) لخطوة 1.2.2. ويمكن أيضا تخفيض طول فترة الحضانة في خطوة 1.2.3. - نضح المتوسطة وإضافة 10 مل متوسطة جديدة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم، 10% FBS و 1% القلم/بكتيريا). احتضانها لبين 24 إلى 72 ح في شركة 37 درجة مئوية و 5%2.
- تحقق من التعبير عن مشري H2B في الخلايا باستخدام مجهر ابيفلوريسسينسي.
ملاحظة: في حالة انخفاض كفاءة توصيل في الخلايا، يمكن زيادة حجم الفيروس في الخطوة 2، 2 وفترة الحضانة في الخطوة 2، 3.
- لوحة MDA-ميغابايت-231 الخلايا في كثافة 1 × 105 خلايا في صحن ثقافة 35 ملم.
2-تزامن الخلايا ستابلي معربا عن H2B مشري
- لوحة الخلايا في 50 إلى 60% كونفلوينسي، أي لوحة 2 × 104 نجمة داود الحمراء-ميغابايت-231 الخلايا في كل من لوحة 24-جيدا جيدا.
- احتضان الثقافة في 37 درجة مئوية و 5% CO2 ل 24 ساعة.
- استبدال المتوسطة النمو مع 0.5 مل متوسطة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم و 10% FBS و 1% القلم/بكتيريا) تتضمن thymidine 2 مم وتترك في الحاضنة ح 24.
ملاحظة: يتم القبض الخلايا المعرضة ل thymidine في مرحلة نمو الخلايا (G1)/الحمض النووي التوليف (S) مرحلة انتقالية وطوال مرحلة ثانية بسبب تثبيط توليف الحمض النووي. يجب أن تختلف طول فترة حضانة المرض والأمثل لخطوط خلايا مختلفة. - تحرير الخلايا من التعرض thymidine بغسلها مع الفوسفات مخزنة المالحة (PBS) ثلاث مرات. ثم احتضان خلايا في الخلية العادية الثقافة المتوسطة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم، 10% FBS و 1% القلم/بكتيريا) ح 5.
ملاحظة: يتيح الإفراج عن الخلايا من التعرض thymidine الخلايا للتقدم إلى نمو الخلايا (G2)/المرحلة (م) الانقسامية للخلايا سابقا اعتقل في المرحلة G1/S، وفي المرحلة G1 للخلايا التي سبق القبض عليهم في ليالي المرحلة. ينبغي أن تختلف طول وقت الإصدار والأمثل لخطوط خلايا مختلفة. - كتلة الخلايا مع 250 نانوغرام/مل من نوكودازولي ح 12.
ملاحظة: كافة الخلايا التي تتعرض نوكودازولي اعتقل في مرحلة G2/M. نوكودازولي السامة للخلايا. يمكن أن يسبب التعرض المطول نوكودازولي المبرمج. ضبط الفترة أو تركيز من التعرض لخطوط خلايا مختلفة إذا لوحظت موت الخلية. سوف يحمل الخلايا التي يتم مزامنتها بنجاح مورفولوجيا كروية. - اهتزاز الخلايا ل 45 ثانية إلى 1 دقيقة باستخدام شاكر مداري 150 إلى 200 لفة في الدقيقة.
ملاحظة: سوف تخلصت الخلايا الانقسامية التي لديها القليل من الانضمام إلى الركيزة، أثناء هذه العملية. - إزالة المتوسطة لاستخراج الخلايا، التي بيبيتينج المتوسط في أنبوب الطرد مركزي، ثم قم بإضافة 0.5 مل متوسطة جديدة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم و 10% FBS و 1% القلم/بكتيريا) لكل بئر من اللوحة.
- كرر الخطوات من 2.6 و 2.7 ثلاث مرات.
- الطرد المركزي متوسطة المجمعة التي تحتوي على الخلايا الانقسامية في 800 x ز لمدة 3 دقائق.
ملاحظة: يتم استخدام هذه الخطوة لإزالة نوكودازولي من المتوسطة الخلية.
3-إدماج متزامنة الخلايا إلى الكولاجين أنا المصفوفات
ملاحظة: النوع الأول من الكولاجين هو البروتين الأكثر وفرة في جسم الإنسان، وفي إدارة المحتوى في المؤسسة من الأنسجة الضامة، وهكذا يستخدم على نطاق واسع للتحقيق في الخلية حقيقية النواة كيف يتم التضمين وظائف ببيئة 3D17،23،24 . الكولاجين قابل للذوبان في حمض الخليك. وبعد تحييد والاحترار الحل الكولاجين إلى 20-37 درجة مئوية، بلمرة مونومرات الكولاجين في meshwork ييفات الكولاجين.
- إعداد الحل x DMEM 10 بحل علبة مسحوق دميم، ز 3.7 من بيكربونات الصوديوم (ناكو3) و 1 ز 4 حمض-(2-hydroxyethyl)-1-بيبيرازينيثانيسولفونيك (حبيس) في 50 مل ماء المقطر. تصفية الحل، ثم قم بإعداد م 1 من هيدروكسيد الصوديوم (هيدروكسيد الصوديوم) بإذابة 2 غ حبيبات هيدروكسيد الصوديوم في 50 مل ماء المقطر. تصفية وقاسمه الحل إلى 1.5 مل أنابيب الطرد المركزي.
ملاحظة: لا ينبغي أن تكون استخدام الحل دميم العادي في هذه الخطوة. سيخفف إضافة كميات كبيرة من الكولاجين الحل الوسط. ولذلك الحل دميم تتركز على استعداد لضمان أن التركيز النهائي دميم في مصفوفة الكولاجين نفس دميم العادية. - مواصلة العمل مع الخلايا التي يتم جمعها من الخطوة 2.9. نضح المتوسطة، وإعادة تعليق الخلايا في حوالي 0.25-0.5 مل من خلية جديدة الثقافة المتوسطة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم و 10% FBS و 1% القلم/بكتيريا).
ملاحظة: للوصول إلى كثافة خلية محددة في مصفوفة الكولاجين، لا يمكن الكثافة الأولية من الخلايا في التعليق منخفض جداً. وبالتالي، سيعتمد حجم الوسيلة المستخدمة لإعادة تعليق الخلايا على العدد الإجمالي للخلايا المتوفرة. - المكان 10 ميليلتر من الحل إعادة تعليق خلية من الخطوة 3، 2 على هيموسيتوميتير وحساب كثافة الخلايا الموجودة في الحل.
-
تحديد وحدات التخزين المطلوبة لكافة المكونات لجعل مصفوفة 3D الكولاجين. 500 ميليلتر من 2 ميكروغرام/ميليلتر الكولاجين هلام يستخدم هنا كمثال.
- حساب حجم الخلية الحل اللازم للحصول على خلايا/مل 40,000 (أو خلايا 20,000 عن 500 ميليلتر من جل الكولاجين). يمثل هذا العدد في ميليلتر عاشرا 50 ميليلتر من 10 x سيلزم دميم. وسيلزم 50 ميليلتر من FBS.
- حساب حجم الكولاجين أنا الأسهم المطلوبة. أن تركيز الكولاجين حوالي 4 ميكروغرام/ميليلتر. كمية الكولاجين اللازمة في ميليلتر هو Y.
- حساب حجم هيدروكسيد الصوديوم بحاجة إلى تحييد حمض الخليك في الحل الكولاجين: الكولاجين ميليلتر Y * 0.023 * 1000 = Z ميليلتر هيدروكسيد الصوديوم اللازمة.
- تحديد حجم الحل حشو: (500 ميليلتر 50 مجموع جل-الخلايا X µL-ميليلتر 10 × دميم-50 ميليلتر من FBS-الكولاجين ميليلتر Y-Z ميليلتر هيدروكسيد الصوديوم) = ميليلتر R
ملاحظة: هو الحل حشو المقطر المياه. إذا كان حجم المحسوبة للحل حشو رقم سالب، كثافة الخلية الأصلي في تعليق خلية منخفض جداً. الخلايا بحاجة إلى نسج أسفل مرة أخرى وإعادة تعليق في حجم أصغر من المتوسط (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم و 10% FBS و 1% القلم/بكتيريا).
- إضافة المكونات بالترتيب التالي إلى أنبوب الطرد مركزي نظيفة 1.5 مل: الخلايا في المتوسط، 10 × دميم، FBS، والمياه (دي)، الكولاجين، هيدروكسيد الصوديوم. ضع كل المكونات على الجليد لإبطاء جيليشن الحل الكولاجين. استخدام تقنيات بيبيتينج السليم لمنع تكوين فقاعات.
- بعد إضافة هيدروكسيد الصوديوم، مزيج الحل بعناية مع بيبيت 1 مل.
ملاحظة: جيليشن الكولاجين سيبدأ الحق فورا بعد إضافة هيدروكسيد الصوديوم. خلط وينبغي أن يتم بعناية وبسرعة. - بمجرد الحل مختلطة، وهو أيضا إضافة 500 ميليلتر من الحل لكل بئر من لوحة 24-جيدا. ضع لوحة 24-جيدا في الحاضنة 37 درجة مئوية. ضع مستنبت الخلية الطازجة في حمام الماء 37 درجة مئوية.
ملاحظة: تستخدم ألواح البلاستيك أسفل للتكبير المنخفض خلية يعيش ميكروكوبي الذي عامل المسافة من العدسة أعلاه الزجاج السفلي 1 مم. وتستخدم لوحات عالية التكبير المجهري خلية يعيش نظراً لبعد المسافة عمل قصيرة للسامية عدسة التكبير. - إضافة 500 ميليلتر من قبل حرارة متوسطة (دميم، ارتفاع الجلوكوز (4.5 غرام/لتر)، بيروفات صوديوم، 10% FBS و 1% القلم/بكتيريا) إلى الجزء العلوي من جل 30 دقيقة بعد الانتهاء من الخطوة 3، 7.
4-يعيش التصوير خلية من الخلايا تقسيم في مصفوفات الكولاجين 3D (تضخم منخفض)
ملاحظة: يتم جمع صور خلايا على فترات 2 دقيقة باستخدام كاميرا جهاز إلى جانب (CCD) تهمة التي شنت على مجهر تباين المرحلة التي هي مجهزة هدفا X 10 ويسيطر عليها برامج التصوير.
- قم بتشغيل وحدة الخلية الحية التي شنت على رأس العدسة الهدف. الانتظار حتى تستقر درجة الحرارة عند 37 درجة مئوية، وتركيز CO2 5% والرطوبة 75%.
- وضع لوحة 24-جيدا من المواد الهلامية في وحدة الخلية الحية في المجهر. العثور على الجزء السفلي من اللوحة، ثم قم بنقل العدسة الهدف حتى المجهر يركز على حوالي 500 ميكرومتر من الجزء السفلي من اللوحة.
ملاحظة: الخلايا في المصفوفة الكولاجين التي قريبة جداً من الجزء السفلي من اللوحة لا تندرج تماما في مصفوفة ثلاثية الأبعاد. تصوير الخلايا التي هي 500 ميكرومتر بعيداً عن الجزء السفلي من اللوحة سيضمن أن الخلايا لا تتأثر بتأثيرات الحافة16،،من1725. - الانتقال من مرحلة للبحث عن الخلايا، وتحديد مواقع متعددة للتصوير.
- قم بإعداد الوقت الفاصل بين التجربة على فترات 2-مين.
ملاحظة: الحد الأقصى لعدد الوظائف التي يمكن اتخاذها خلال فترة 2 دقيقة محدودة بسرعة التحرك المرحلة المزودة بمحركات، وطول فترة التعرض لالتقاط الصور.
5-الكولاجين شبكة التشوه أثناء انقسام الخلية (عالية التكبير المجهري)
- قم بتشغيل وحدة الخلية الحية التي شنت على رأس العدسة الهدف. الانتظار حتى تستقر درجة الحرارة عند 37 درجة مئوية، وتركيز CO2 5% والرطوبة 75%.
- تصور ألياف الكولاجين في مصفوفات أونستينيد الكولاجين 3D، تكوين مجهر [كنفوكل] لالتقاط فقط الضوء المنعكس (488-شمال البحر الأبيض المتوسط) من 488 نانومتر الليزر المستخدمة لإلقاء الضوء على العينة. الليزر يستخدم 60 × الهدف غمر المياه، نا 1.2، WD = = 200 ميكرون، ويتم التحكم بواسطة برامج التصوير.
- وضع العينة (الخلايا في مصفوفات الكولاجين) في وحدة الخلية الحية. العثور على الجزء السفلي من اللوحة، ثم قم بنقل العدسة الهدف حتى المجهر يركز على حوالي 100 ميكرون من الجزء السفلي من اللوحة. تصوير الخلايا التي هي 100 ميكرومتر بعيداً عن الجزء السفلي من اللوحة سيضمن أن الخلايا لا تتأثر بتأثيرات الحافة.
ملاحظة: هنا هدفا غمر مياه يتم استخدام بدلاً من عدسة غمر نفط نظراً المسافة العمل العدسة الغمر النفط فقط حوالي 100 ميكرومتر. استخدام عدسة الغمر النفط يشكل مشكلة حسب سمك الزجاج في الجزء السفلي من اللوحة هو عادة حوالي 100 ميكرومتر. - الانتقال من مرحلة للبحث عن الخلايا، وتحديد مواقع متعددة للتصوير.
ملاحظة: الفحص المجهري [كنفوكل] الفرعين بصريا العينة ويلتقط إشارات من المستوى البؤري فقط. قد تكون الخلايا الحية تتحرك داخل وخارج التركيز خلال التجربة بمرور الزمن. لتمكين التقاط الصور خلية على مدى فترات طويلة من الزمن، يستخدم Z-المكدس لجمع الصور من الشرائح المتتالية في 5 ميكرومتر فترات. يتم تصويرها مجموعة شرائح 5 تمتد 25 ميكرومتر. - قم بإعداد الوقت الفاصل بين التجربة على فترات مدة 5 دقائق.
ملاحظة: يتم استخدام 5 دقائق هنا كالفاصل الزمني بدلاً من 2 دقيقة تستخدم في القسم 4 لأن وسائط متعددة من المسح الضوئي، بما في ذلك الأسفار المسح H2B-متشيري وانعكاس المسح الضوئي للكولاجين، ومسح Z-المكدس، يتم تطبيقها على كل موقف. استخدام أساليب المسح متعددة يقلل من سرعة المسح الضوئي موقفا عند تصوير تضخم منخفض بالمقارنة. - قياس تشوه المصفوفة الكولاجين محيط خلية نظراً لأن القوات التي تمارسها تلك الخلية باستخدام الجسيمات التصوير فيلوسيميتري (PIV) مع الفرعي بكسل القرار20. إجراء هذا التحليل في 2D الصور يسمح لتصور واضح لكل الإشارات H2B-مشري وألياف الكولاجين. تطبيق تمرير منخفض متباين التصفية لتعزيز الإشارات من شبكة الكولاجين20.
- بغية قياس تشريد المحلية لمنطقة الصورة الفرعية من الفائدة الموجودة في (x,y) من ك الإطار الإطار ك+ 1، واستخراج نافذة إقليمية من 15 × 15 بكسل يتم توسيطها في (x,y) في الإطار ك. ثم تحديد أفضل مطابقة مواقع (x,y) * من خلال المواقع التي تتميز بمعامل الارتباط عبر تطبيع الحد أقصى في الصورة التي تم الحصول عليها في إطار k+ 1. ناقل تشوه يحسب ك (x,y) *-(x,y).
النتائج
والهدف من هذه المادة تقديم أسلوب المستندة إلى تصوير لدراسة عمليات انقسام الخلايا الثديية في مصفوفات ثلاثية الأبعاد، وقياس التفاعلات بين الخلية والمصفوفة خارج الخلية 3D أثناء وبعد انقسام الخلية. لتسهيل تصوير الانقسام الخلية، ادخلنا مشري H2B في جمعية نجمة داود الحمراء-ميغابايت-231 الخلايا باستخدام توصيل لينتيفيرال. H2B مترافق مع البروتينات الفلورية كعلامة الانقسامية لتمييز الخلايا الانقسامية من خلايا الطور البيني، وتحديد مراحل مختلفة خلال الخلية الانقسام19،،من2026. باستخدام هذا الأسلوب، كنا قادرين على رصد عملية تقسيم كامل لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا ستابلي معربا عن مشري H2B في مصفوفات الكولاجين ثلاثي الأبعاد (الشكل 1A). بدأت المراحل الانقسامية مع انحلال الغشاء النووي (الطور الأول؛ الإطار 1، الشكل 1A)؛ إعادة تنظيم الكروموسومات (بروميتافاسي: الإطار 2)؛ محاذاة الكروموسومات في منتصف الخلية الجسم (الطورية الإطار 3)؛ فصل الكروموزومات (طور الصعود؛ الإطار 4)؛ إعادة تنظيم الكروموسومات والغشاء النووي، والفصل بين الهيئات للخليتين ابنه (الطور النهائي/سيتوكينيسيس، الإطار 5).
معدل انتشار الخلايا في مصفوفة 3D عادة أقل بكثير من نظرائهم في 2D الركازة، مما يجعل الرصد لانقسام الخلية في أقل كفاءة 3D19. لزيادة كفاءة دراسة انقسام الخلية 3D، استخدمنا أسلوب الجمع بين thymidine، نوكودازولي، وأسلوب يهز إيقاف مزامنة وحدد MDA-ميغابايت-231 الخلايا التي في مرحلة الانقسامية. ثم تم تضمينها الخلايا متزامنة إلى مصفوفات الكولاجين. رصد عملية تقسيم خلايا متعددة في الوقت الحقيقي باستخدام التصوير خلية يعيش في 10 X التكبير. تقسيم حوالي 70% الخلايا ضمن ح 2 الأولى بعد تشكيل الكولاجين مصفوفة (الشكل 2)، مما يسمح للرصد الفعال للانقسام في 3D (الشكل 2).
لرصد التفاعل بين الخلايا ومصفوفات الكولاجين المحيطة بهم، نحن مجتمعة انعكاس [كنفوكل] الفحص المجهري لألياف الكولاجين الصورة، والأسفار الفحص المجهري الصورة الخلايا. عدسة X 60 يسمح لالتقاط صور عالية الجودة لألياف الكولاجين. التصوير باستخدام عدسة عالية التكبير، الذي يلتقط خلايا أقل في كل مجال الرؤية، هو الإنتاجية أقل كثيرا مقارنة باستخدام التكبير المنخفض في 10 X أو 20 س. مزامنة ناجحة للخلايا يعزز إلى حد كبير في الكفاءة والإنتاجية لهذه التجربة، منذ تقسيم معظم الخلايا متزامنة داخل ح 2 الأولى بعد تشكيل مصفوفة الكولاجين. مصفوفة تشوه أثناء وبعد انقسام الخلية هو تصور (الممثل لقطات تظهر في الشكل 1B) وقياسها كمياً باستخدام برمجيات PIV مخصصة. ونحن كمياً ومقارنة مصفوفة تشوه أثناء مرحلة الانقسامية للخلايا متزامنة إلى مرحلة الانقسامية والطور البيني. لاحظنا أن تشوه مصفوفة تغيرت قليلاً جداً خلال الانقسامية المرحلة (الشكل 3 أ)، وهو أقل من التشوه لوحظ في مراحل ما بعد الانقسامية (الشكل 3B). هذه النتيجة تبين أن خلايا الثدييات مرفق الحد الأدنى والتفاعلات مع المصفوفة المحيطة بها بينما هم في مرحلة الانقسامية.
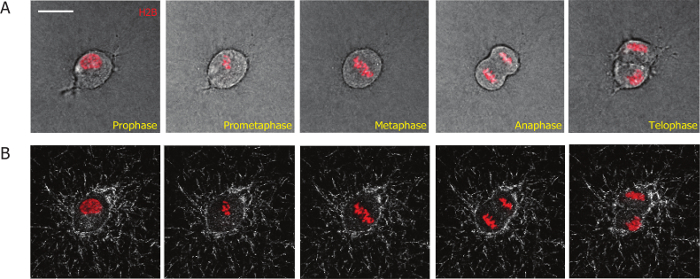
رقم 1: ميكروجرافس التمثيلية التي تم الحصول عليها من فيديو عالية التكبير تصوير خلية يعيش خلية تابعة لجمعية نجمة داود الحمراء-ميغابايت-231 مضمن في مصفوفة الكولاجين ستابلي يعبر عن مشري H2B. (أ) المراحل المختلفة لتطور الخلية MDA-ميغابايت-231 الانقسامية يتم تعريف بواسطة H2B مشري كما وصفت باللون الأحمر. (ب) يتم تصور ألياف الكولاجين (أبيض) أثناء عملية الانقسامية بالفحص المجهري انعكاس [كنفوكل] تعتمد على الوقت. شريط المقياس = 20 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: تقسيم الخلايا متزامنة في مصفوفات الكولاجين 3D- مزامنة إلى مرحلة G2/M الخلايا وجزءاً لا يتجزأ من مصفوفة الكولاجين. تقسيم حوالي 70% خلايا متزامنة داخل ح 2 الأولى، بينما تحكم الخلايا دون التزامن الفجوة عشوائياً. شريط الخطأ = (الخطأ المعياري للوسط) ووزارة شؤون المرأة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
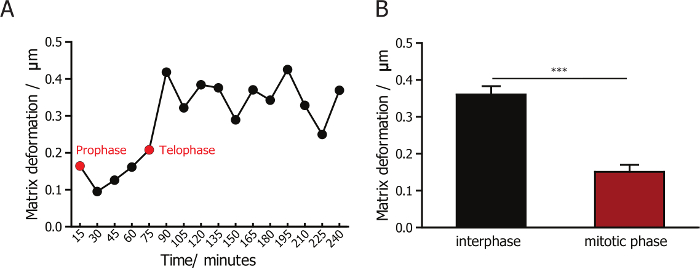
الشكل 3: القياس الكمي لتشوه مصفوفة لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا أثناء الطور البيني والانقسام. (أ) التغير في حجم التشوه مصفوفة لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا جزءا لا يتجزأ من المصفوفة. يشير السهم الأخضر إلى الطور الأول والسهم الأحمر يشير إلى الطور النهائي. (ب) التحديد الكمي لتشوه مصفوفة لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا أثناء مرحلة الانقسامية، والطور البيني مشيراً إلى أن تشوه مصفوفة الحد الأدنى أثناء انقسام الخلية. شريط الخطأ = (الخطأ المعياري للوسط) ووزارة شؤون المرأة. * ف < 0.05. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
الدراسة السابقة لانقسام الخلية في 3D لم تكن فعالة بسبب القيود التجريبية والتحديات التقنية18،19. الخطوات الحاسمة لدراسة كفاءة الانقسام الخلوي الثدييات في مصفوفات الكولاجين 3D: (1) إدماج الأسفار المسماة علامات الانقسامية للخلايا؛ (2) تزامن انقسام الخلية؛ و (3) رصد أحداث شعبة في مصفوفات ثلاثية الأبعاد باستخدام تقنية التصوير خلية يعيش وانعكاس [كنفوكل] حل وقت الفحص المجهري، والتحليل الكمي للتصوير.
يمكن تمييز الخلايا الانقسامية في 2D ركائز من خلايا الطور البيني استناداً على مورفولوجيا، أي الخلايا الانقسامية هي جولة وإرفاق بالكاد إلى الركيزة بينما خلايا الطور البيني انتشرت ونعلق بشدة على الركازة. في مصفوفات ثلاثية الأبعاد، بيد أن مورفولوجية الخلية ليست علامة موثوقة للخلايا الانقسامية منذ بعض الخلايا بالكاد انتشرت وتبقى جولة في27،المصفوفة28. ولذلك، من الضروري لإدخال علامة الانقسامية للخلايا لدراسة انقسام الخلية في مصفوفات ثلاثية الأبعاد. وأعربنا ستابلي مشري H2B في جمعية نجمة داود الحمراء-ميغابايت-231 الخلايا، وكانت بمثابة علامة موثوق بها لمختلف المراحل الانقسامية، بما في ذلك الطور الأول، بروميتافاسي، الطورية، طور الصعود، والطور النهائي/سيتوكينيسيس. كنا سابقا هذا النهج لتمييز الخلايا الانقسامية من خلايا الطور البيني في مصفوفات ثلاثية الأبعاد. مع المساعدة من هذه العلامة، تمكنا أيضا من قياس طول مرحلة الانقسامية لخط خلية آخر، HT1080 الخلايا، تقسيم في 2D ركائز ومصفوفات 3D19.
هناك طرق متعددة لمزامنة الخلايا، بما في ذلك المصل المجاعة29،31من الانقسامية يهز قبالة30،، thymidine مزدوجة حجب32، ونوكودازولي32. نحن جنبا إلى جنب العلاج thymidine ومعاملة نوكودازولي لمزامنة كفاءة MDA-ميغابايت-231 الخلايا إلى مرحلة G2/M. الخلايا المعرضة ل thymidine يتم القبض في الانتقال G1/S، وطوال مرحلة ثانية بسبب تثبيط تركيب الدنا thymidine. واسمحوا الإفراج عن الخلايا من التعرض thymidine الخلايا التقدم إلى المرحلة G2/M للخلايا التي اعتقلت في المرحلة G1/S، وإلى G1 للخلايا التي اعتقلت في مرحلة ثانية. كافة الخلايا المعرضة نوكودازولي اعتقل في مرحلة G2/M. الخلايا تقريب حتى دخول المرحلة الانقسامية ثم اهتزت حالاً من اللوحة وتغليف مباشرة إلى مصفوفات الكولاجين. ونحن أظهر أن حوالي 70% الخلايا تقسيم ضمن ح 2 بعد إدماجها في مصفوفات الكولاجين (الشكل 2). بدلاً من ذلك، الخلايا يمكن أن تكون جزءا لا يتجزأ من مصفوفات الكولاجين قبل المزامنة، ولكن شبكة cross-linked المصفوفة الكولاجين يعرض حاجز مادي ويقلل من معدل الجزيئية البيولوجية نشر والحراري33، 34. في الواقع، نحن مزامنة الخلايا في مصفوفات الكولاجين باستخدام thymidine ونوكودازولي، لكن باءت محاولته للحصول على مزامنة كفاءة. قد تكون هذه النتيجة بسبب عدم كفاءة نشر والحراري للأدوية من خلال مصفوفة الكولاجين.
الانعكاس خاصية بصرية ذاتية من العديد من البوليمرات الحيوية، بما في ذلك الكولاجين. تقنية مجهرية انعكاس [كنفوكل] يتصور وكوانتيتاتيس ميكروتوبوجرافي الحيوية المليئة بالثغرات التي أعدت من البوليمرات الاصطناعية والكولاجين 3D مصفوفات23،24،35،36 ،37. قد أنشأنا في المختبر، ولدينا تقنيات رصد التغييرات في قطبية ألياف الكولاجين كما يختلف تركيز الكولاجين38. هنا، نحن تصف طريقة لرصد تشوه استناداً إلى شريط الفيديو الوقت الفاصل بين الصور [كنفوكل] عاكس للدلالة على تفاعل الخلية-مصفوفة ألياف الكولاجين. وتظهر النتائج ممثلة المقدمة هنا أن تشوه مصفوفة لجمعية نجمة داود الحمراء-ميغابايت-231 الخلايا الانقسامية أصغر بكثير من تلك الخلايا في الطور البيني، مما يوحي بأن خلايا الثدييات مرفق الحد الأدنى والتفاعلات مع مصفوفة المحيطة بها عند دخولها مرحلة الانقسامية19.
سابقا، استخدمنا التأمل [كنفوكل] الفحص المجهري لرصد وقياس التفاعل خلية المصفوفة قبل وأثناء وبعد الانقسام للخلايا HT1080. ونحن أيضا برصد تشوه مصفوفة β1-إنتغرين تدق لأسفل HT1080 الخلايا أثناء الطور البيني والمرحلة الانقسامية. المستنفدة β1-إنتغرين إلى حد كبير يقلل من تشوه مصفوفة بالخلية أثناء الطور البيني. ومع ذلك، ليس هناك فرق في مصفوفة تشوه أثناء مرحلة الانقسامية الخلايا ضربة قاضية (دينار كويتي) جولة β1-إنتغرين و خلايا نوع البرية HT108019.
نهج بديل لتصور ألياف الكولاجين توظيف مترافق fluorescence النوع الأول من الكولاجين. كنا سابقا هذا النهج إلى مسارات الصورة في مصفوفات الكولاجين التي تم إنشاؤها بواسطة الخلايا19. ومع ذلك، يتطلب هذا النهج، العلامات الكولاجين بصبغة الفلورسنت مثل fluorescein isothiocyanate (فيتك)، التي مضيعة للوقت وأقل كفاءة. من ناحية أخرى، انعكاس [كنفوكل] مجهرية يمكن تطبيقها مباشرة على الكولاجين غير معدلة توفير الوقت والموارد، واستبعاد القضايا المرتبطة فوتوبليتشينج الأسفار. وعلاوة على ذلك، هذا الأسلوب لا تتطلب قناة فلورسنت فردية، والتالي متوافق مع جميع الأصباغ الفلورية.
يمكن تطبيق الطريقة المعروضة في هذه الورقة يحتمل أن تكون لأي نوع من خلايا الثدييات التي تفرق في مصفوفة 3D الكولاجين. إدراج علامة مشري H2B في خلايا الثدييات الأخرى بتوصيل لينتيفيرال ستتبع نفس الإجراءات بالضبط كما هو موضح في الورقة، على الرغم من أن أنواع مختلفة من الخلايا وقد اختلفت الكفاءة لتوصيل قبل لينتيفيروس 39-كلا من كثافة الخلايا عند توصيل وعيار الفيروس يمكن أن يكون الأمثل للكفاءة. وإذا تعذر تحقيق توصيل عالية الكفاءة، يمكن اختيار الخلايا خلية مساعدة fluorescence الفرز (نظام مراقبة الأصول الميدانية). يتم تطبيق حظر thymidine ونوكودازولي لمزامنة بنجاح عدة أنواع أخرى من خلايا الثدييات، مثل هيلا40. الاهتزاز الميكانيكي قبالة يمكن تطبيقها على أي نوع من أنواع الخلايا حتى الجولة وإرفاقه بالكاد الركيزة خلال30،المرحلة الانقسامية31. وعلاوة على ذلك، تصوير ألياف الكولاجين باستخدام الانعكاس [كنفوكل] الفحص المجهري، والتحديد الكمي لتشوه مصفوفة يمكن تطبيقها مباشرة على جميع الأنواع الأخرى من تقسيم خلايا الثدييات.
الطريقة المعروضة هنا نهج الكفاءة وعامة لدراسة الثدييات انقسام الخلية والتفاعلات الخلية-مصفوفة في بيئة ثلاثية الأبعاد. النهج الذي ييسر لنا التحقيق في الأساس الجزيئي لتنمية أنسجة طبيعية والأمراض، ويقوي التي تعالج تصميم رواية التشخيص والنهج العلاجية في المستقبل.
Disclosures
الكتاب يعلن أن لديهم لا تضارب المصالح المالية.
Acknowledgements
هذا العمل كان يدعمها في المعاهد الوطنية للصحة ويمنح R01CA174388 و U54CA143868. الكتاب تود أن تقر منح بورا من جامعة جون هوبكنز للدعم لتشن وي-تونغ. ويستند إلى العمل المدعوم من "زمالة البحوث الدراسات العليا مؤسسة العلوم الوطنية" تحت رقم المنحة 1232825 هذه المواد.
Materials
| Name | Company | Catalog Number | Comments |
| Human embryonic kidney 293T | ATCC | ||
| MDA-MB-231 | Physical Sciences Oncology Center, NIH | ||
| DMEM | Corning | 10-013-CV | |
| DMEM powder | ThermoFisher Scientific | 12100-046 | |
| Fetal bovine serum | Hyclone | SH30910.03 | |
| Penicillin-Streptomycin 100X | Sigma-Aldrich | P0781 | |
| Fugene HD | Promega | E2311 | |
| Lipofectamine 2000 | Life technologies | 11668-07 | |
| Plasmid encoding H2B-mCherry in a lentiviral vector | Addgene | plasmid 21217 | |
| Thymidine | Sigma-Aldrich | T1895 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| Opti-MEM | Life Technologies | 31985-070 | |
| Sodium bicarbonate | GibcoBRL | 11810-025 | |
| HEPES | Sigma-Aldrich | 113375-100 | |
| Collagen | Corning | 354236 | |
| NaOH | J.T. Bake | 3722-01 | |
| Millex-HV syringe filter unit, 0.45-μm, PVDF, 33 mm | Millipore | SLHVM33RS | |
| Nikon TE2000E epifluorescence microscope | Nikon | TE2000E | |
| Cascade 1K CCD camera | Roper Scientific | ||
| NIS-Elements AR imaging software | Nikon | ||
| Nikon A1 confocal microscope | Nikon | A1 |
References
- Ly, D. H., Lockhart, D. J., Lerner, R. A., Schultz, P. G. Mitotic misregulation and human aging. Science. 287 (5462), 2486-2492 (2000).
- Gascoigne, K. E., Taylor, S. S. How do anti-mitotic drugs kill cancer cells? J Cell Sci. 122 (Pt 15), 2579-2585 (2009).
- Brinkley, B. R. Managing the centrosome numbers game: from chaos to stability in cancer cell division. Trends Cell Biol. 11 (1), 18-21 (2001).
- Phillip, J. M., Aifuwa, I., Walston, J., Wirtz, D. The Mechanobiology of Aging. Annu Rev Biomed Eng. 17, 113-141 (2015).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Martin, M. D., et al. Effect of ablation or inhibition of stromal matrix metalloproteinase-9 on lung metastasis in a breast cancer model is dependent on genetic background. Cancer Res. 68 (15), 6251-6259 (2008).
- Knox, J. J., Hotte, S. J., Kollmannsberger, C., Winquist, E., Fisher, B., Eisenhauer, E. A. Phase II study of Triapine in patients with metastatic renal cell carcinoma: a trial of the National Cancer Institute of Canada Clinical Trials Group (NCIC IND.161). Invest New Drugs. 25 (5), 471-477 (2007).
- Komlodi-Pasztor, E., Sackett, D. L., Fojo, A. T. Inhibitors targeting mitosis: tales of how great drugs against a promising target were brought down by a flawed rationale. Clin Cancer Res. 18 (1), 51-63 (2012).
- Tong, W. G., et al. Phase I and pharmacologic study of SNS-032, a potent and selective Cdk2, 7, and 9 inhibitor, in patients with advanced chronic lymphocytic leukemia and multiple myeloma. J Clin Oncol. 28 (18), 3015-3022 (2010).
- Matulonis, U. A., et al. Phase II study of MLN8237 (alisertib), an investigational Aurora A kinase inhibitor, in patients with platinum-resistant or -refractory epithelial ovarian, fallopian tube, or primary peritoneal carcinoma. Gynecol Oncol. 127 (1), 63-69 (2012).
- Boss, D. S., et al. Clinical evaluation of AZD1152, an i.v. inhibitor of Aurora B kinase, in patients with solid malignant tumors. Ann Oncol. 22 (2), 431-437 (2011).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol. 7 (3), 211-224 (2006).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Lu, P., Weaver, V. M., Werb, Z. The extracellular matrix: a dynamic niche in cancer progression. J Cell Biol. 196 (4), 395-406 (2012).
- Giri, A., et al. The Arp2/3 complex mediates multigeneration dendritic protrusions for efficient 3-dimensional cancer cell migration. FASEB J. 27 (10), 4089-4099 (2013).
- Fraley, S. I., Feng, Y., Giri, A., Longmore, G. D., Wirtz, D. Dimensional and temporal controls of three-dimensional cell migration by zyxin and binding partners. Nat Commun. 3, 719(2012).
- Fraley, S. I., et al. A distinctive role for focal adhesion proteins in three-dimensional cell motility. Nat Cell Biol. 12 (6), 598-604 (2010).
- Lesman, A., Notbohm, J., Tirrell, D. A., Ravichandran, G. Contractile forces regulate cell division in three-dimensional environments. J Cell Biol. 205 (2), 155-162 (2014).
- He, L., et al. Local 3D matrix confinement determines division axis through cell shape. Oncotarget. 7 (6), 6994-7011 (2016).
- Held, M., et al. CellCognition: time-resolved phenotype annotation in high-throughput live cell imaging. Nat Methods. 7 (9), 747-754 (2010).
- Fallica, B., Maffei, J. S., Makin, G., Zaman, M. Alteration of cellular behavior and response to PI3K pathway inhibition by culture in 3D collagen gels. PLoS One. 7 (10), e48024(2012).
- Meli, L., Jordan, E. T., Clark, D. S., Linhardt, R. J., Dordick, J. S. Influence of a three-dimensional, microarray environment on human Cell culture in drug screening systems. Biomaterials. 33 (35), 9087-9096 (2012).
- Artym, V. V., Matsumoto, K. Imaging cells in three-dimensional collagen matrix. Curr Protoc Cell Biol. 10, 1-20 (2010).
- Gunzer, M., Kampgen, E., Brocker, E. B., Zanker, K. S., Friedl, P. Migration of dendritic cells in 3D-collagen lattices. Visualisation of dynamic interactions with the substratum and the distribution of surface structures via a novel confocal reflection imaging technique. Adv Exp Med Biol. 417, 97-103 (1997).
- Geraldo, S., Simon, A., Vignjevic, D. M. Revealing the cytoskeletal organization of invasive cancer cells in 3D. J Vis Exp. (80), e50763(2013).
- Lleres, D., James, J., Swift, S., Norman, D. G., Lamond, A. I. Quantitative analysis of chromatin compaction in living cells using FLIM-FRET. J Cell Biol. 187 (4), 481-496 (2009).
- Poincloux, R., et al. Contractility of the cell rear drives invasion of breast tumor cells in 3D Matrigel. Proc Natl Acad Sci U S A. 108 (5), 1943-1948 (2011).
- Carey, S. P., Kraning-Rush, C. M., Williams, R. M., Reinhart-King, C. A. Biophysical control of invasive tumor cell behavior by extracellular matrix microarchitecture. Biomaterials. 33 (16), 4157-4165 (2012).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods Mol Biol. 761, 75-83 (2011).
- Jackman, J., O'Connor, P. M. Methods for synchronizing cells at specific stages of the cell cycle. Curr Protoc Cell Biol. 8, (2001).
- Zwanenburg, T. S. Standardized shake-off to synchronize cultured CHO cells. Mutat Res. 120 (2-3), 151-159 (1983).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol Biol. 296, 157-166 (2005).
- Kihara, T., Ito, J., Miyake, J. Measurement of biomolecular diffusion in extracellular matrix condensed by fibroblasts using fluorescence correlation spectroscopy. PLoS One. 8 (11), e82382(2013).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys J. 83 (3), 1650-1660 (2002).
- Harjanto, D., Maffei, J. S., Zaman, M. H. Quantitative analysis of the effect of cancer invasiveness and collagen concentration on 3D matrix remodeling. PLoS One. 6 (9), e24891(2011).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin Cell Dev Biol. 20 (8), 931-941 (2009).
- Petroll, W. M. Differential interference contrast and confocal reflectance imaging of collagen organization in three-dimensional matrices. Scanning. 28 (6), 305-310 (2006).
- Fraley, S. I., et al. Three-dimensional matrix fiber alignment modulates cell migration and MT1-MMP utility by spatially and temporally directing protrusions. Sci Rep. 5, 14580(2015).
- Ikeda, Y., Collins, M. K., Radcliffe, P. A., Mitrophanous, K. A., Takeuchi, Y. Gene transduction efficiency in cells of different species by HIV and EIAV vectors. Gene Ther. 9 (14), 932-938 (2002).
- Ma, H. T., Poon, R. Y. Synchronization of HeLa cells. Methods Mol Biol. 761, 151-161 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved