Sostituzione nucleofila
Panoramica
Fonte: Vy M. Dong e Daniel Kim, Dipartimento di Chimica, Università della California, Irvine, CA
Le reazioni di sostituzione nucleofila sono tra gli argomenti più fondamentali trattati in chimica organica. Una reazione di sostituzione nucleofila è quella in cui un nucleofilo (base di Lewis ricca di elettroni) sostituisce un gruppo di partenza da un atomo di carbonio.
SN1 (S = Sostituzione, N = Nucleofila, 1 = cinetica del primo ordine)
SN2 (S = Sostituzione, N = Nucleofila, 2 = cinetica del secondo ordine)
Questo video aiuterà a visualizzare le sottili differenze tra una reazione SN1 e SN2 e quali fattori aiutano ad accelerare ogni tipo di reazione di sostituzione nucleofila. La prima sezione si concentrerà sulle reazioni che aiuteranno a comprendere e conoscere meglio le reazioni di sostituzione nucleofila. La seconda sezione si concentrerà su un esempio reale di una reazione di sostituzione.
Principi
In una reazione di sostituzione nucleofila, un nucleofilo sostituisce un gruppo di partenza su un atomo di carbonio. Una sostituzione nucleofila in un solo passaggio è un esempio del meccanismo SN2. Questa reazione è una reazione concertata in cui i legami che si rompono e si formano si verificano allo stesso tempo. Una cosa da tenere a mente è che gli orbitali molecolari coinvolti nella reazione indicano che l'attacco nucleofilo deve arrivare a 180° dal gruppo in partenza. Pertanto, alcuni soprannominano la reazione SN2 "attacco back-side". Questo attacco back-side inverte la stereochimica sul carbonio reagente. Questo è un esempio di reazione stereospecifica in cui la stereochimica all'inizio della reazione determina l'esito della stereochimica dopo la reazione.

Una sostituzione nucleofila in due fasi è un esempio del meccanismo SN1. Nella prima fase, il gruppo di partenza lascia e forma un intermedio chiamato carbocatione. Nella seconda fase, il nucleofilo attacca il carbocatione. Poiché il carbocatione è achiral (non chirale), qualsiasi stereochimica all'inizio della reazione viene persa. Il prodotto è ancora chirale, ma ora è una miscela uniforme di entrambi gli enantiomeri che è chiamata miscela racemica. Le reazioni SN1 non sono stereospecifiche.
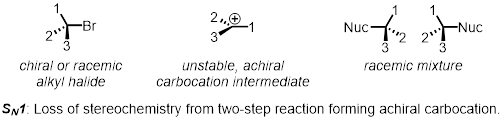
In due parti, esamineremo i fattori che influenzano i tassi relativi delle reazioni SN1 e SN2.
Nella prima parte, studieremo la reazione SN1 usando 11 reazioni in provetta. Tutte le reazioni hanno lo stesso schema di reazione generale:
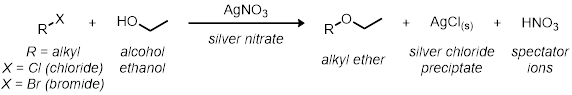
Tutti i tassi delle reazioni sono relativi l'uno all'altro. La velocità di reazione sarà determinata dall'indicatore visivo nella reazione. Poiché il cloruro d'argento precipita fuori dalla soluzione, il momento in cui la reazione passa da chiara a torbosa fornisce un'indicazione visiva della relativa velocità di reazione.
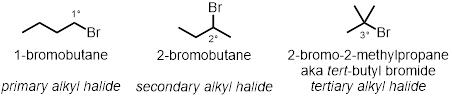
In tre delle reazioni in provetta, verrà testato il modo in cui la struttura ad alogenuri alchilici svolge un ruolo nella velocità delle reazioni. Saranno testati tre diversi cloruri alchilici nelle stesse condizioni:
In due delle reazioni in provetta, verranno testati gli effetti della polarità del solvente sulla reazione. Verranno testati due diversi solventi:
| Provetta | Solvente | Tipo di solvente |
| 1 | 100% etanolo | Protico polare |
| 2 | 5% di etanolo: 95% di acetone | Principalmente aprotico polare |
In due delle reazioni in provetta, verranno testati gli effetti del gruppo di uscita. Saranno utilizzati due diversi alogenuri alchilici:

Infine, quattro delle provette saranno utilizzate per misurare la legge della velocità delle reazioni. La velocità della reazione sarà misurata con concentrazioni variabili di soluzione di ioduro di sodio e soluzioni di 1-bromobutano.
| Provetta |
cloruro terz-butilico concentrazione |
Nitrato d'argento concentrazione |
Tempo fino alle precipitazioni |
| 1 | 0,1 M | 0,1 M | |
| 2 | 0,2 M | 0,1 M | |
| 3 | 0,1 M | 0,1 M | |
| 4 | 0,1 M | 0,05 M |
Nella seconda parte, studieremo la reazione SN2 utilizzando 11 reazioni in provetta. Tutte le reazioni hanno lo stesso schema di reazione generale:
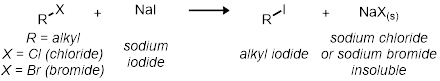
Tutti i tassi delle reazioni sono relativi l'uno all'altro. La velocità di reazione sarà determinata dall'indicatore visivo del cloruro di sodio o del bromuro di sodio che precipita fuori dalla soluzione. Questo sarà indicato quando la reazione passa da chiara a torbia.
In tre delle reazioni in provetta, verrà testato il modo in cui la struttura ad alogenuri alchilici svolge un ruolo nella velocità delle reazioni. Questo confronterà gli effetti sterici del carbonio legato al bromo. Saranno testati tre diversi cloruri alchilici nelle stesse condizioni:

In due delle reazioni in provetta, saranno testati gli effetti sterici secondari dell'alogenuro alchilico. Questi sono effetti sterici sulla molecola escluso il carbonio legato al bromuro. Saranno testati due diversi bromuri alchilici primari, nelle stesse condizioni:

In due delle reazioni in provetta, verranno testati gli effetti del gruppo di uscita. Saranno utilizzati due diversi alogenuri alchilici:

Infine, quattro provette saranno utilizzate per misurare la legge della velocità delle reazioni. La velocità della reazione sarà misurata con concentrazioni variabili di soluzione di ioduro di sodio e soluzioni di 1-bromobutano.
| Provetta |
Ioduro di sodio Concentrazione |
1-Bromobutano Concentrazione |
Tempo fino alle precipitazioni |
| 1 | 15% | 1,0 m | |
| 2 | 15% | 2,0 m | |
| 3 | 15% | 1,0 m | |
| 4 | 7.5% | 1,0 m |
Procedura
Parte 1: Studio delle reazioni di SN1
Struttura ad alogenuri alchilici:
- Misurare 2 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo assoluto in ciascuna delle tre provette.
- Aggiungere 2 gocce di 1-bromobutano nella prima provetta. Aggiungere 2 gocce di 2-bromobutano nella seconda provetta.
- Aggiungere 2 gocce di 2-bromo-2-metilpropano nella terza provetta finale.
- Tappo e agitare ogni provetta.
- Nota il momento in cui compaiono i primi segni di nuvolosità o precipitato.
Uscita dagli effetti di gruppo:
- Misurare 2 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo assoluto in ciascuna delle due provette.
- Aggiungere 2 gocce di 2-bromo-2-metilpropano nella prima provetta e 2 gocce di 2-cloro-2-metilpropano nella seconda provetta.
- Tappo e agitare ogni provetta.
- Nota il momento in cui compaiono i primi segni di nuvolosità o precipitato.
Effetti di polarità del solvente:
- Misurare 2 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo assoluto nella prima provetta e misurare 2 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo al 5%/acetone al 95% nella seconda provetta.
- Aggiungere 2 gocce di 2-bromo-2-metilpropano in entrambe le provette.
- Tappo e agitare ogni provetta.
- Nota il momento in cui compaiono i primi segni di nuvolosità o precipitato.
Determinazione della legge del tasso SN1:
- Misurare 0,5 mL di una soluzione di 0,1 M di 2-cloro-2-metilpropano in etanolo nella prima provetta.
- Misurare 0,5 mL di una soluzione da 0,2 M di 2-cloro-2-metilpropano in etanolo nella seconda provetta.
- Aggiungere 1,0 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo assoluto in entrambe le provette.
- Misurare attentamente il tempo necessario per osservare nuvolosità o precipitazioni.
- Misurare 1,0 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo nella terza provetta.
- Nella quarta provetta, misurare 0,5 mL di una soluzione da 0,1 M di nitrato d'argento in etanolo e aggiungere altri 0,5 ml di etanolo.
- In entrambe le provette, aggiungere 1,0 ml di 0,1 M 2-cloro-2-metilpropano in etanolo e misurare attentamente il tempo necessario per osservare la nuvolosità o le precipitazioni.
Parte 2: Studio delle reazioni SN2
Struttura ad alogenuri alchilici:
- Misurare 2 ml di ioduro di sodio al 15% in acetone in ciascuna delle tre provette.
- Aggiungere 2 gocce di 1-bromobutano nella prima provetta.
- Aggiungere 2 gocce di 2-bromobutano nella seconda provetta.
- Infine, aggiungere 2 gocce di 2-bromo-2-metilpropano nella terza provetta finale.
- Tappo e agitare ogni provetta.
- Nota il momento in cui compaiono i primi segni di nuvolosità o precipitato.
Effetti sterici:
- Misurare 1 mL di ioduro di sodio al 15% in soluzione di acetone in ciascuna delle due provette.
- Aggiungere 2 gocce di 1-bromobutano nella prima provetta e aggiungere 2 gocce di neopentil bromuro nella seconda provetta.
- Tappo e agitare ogni provetta.
- Nota il momento in cui compaiono i primi segni di nuvolosità o precipitato.
Uscita dagli effetti di gruppo:
- Misurare 1 mL di ioduro di sodio al 15% in soluzione di acetone in ciascuna delle due provette.
- Aggiungere 2 gocce di 1-bromobutano nella prima provetta e aggiungere 2 gocce di 1-clorobutano nella seconda provetta.
- Tappo e agitare ogni provetta.
- Nota il momento in cui compaiono i primi segni di nuvolosità o precipitato.
Determinazione della legge del tasso SN2:
- Misurare 1,0 ml di ioduro di sodio al 15% in soluzione di acetone in due provette.
- Aggiungere 0,1 mL di 1,0 M di soluzione di 1-bromobutano in acetone nella prima provetta.
- Misura attentamente il tempo necessario per osservare il primo segno di nuvolosità.
- Nella seconda provetta, aggiungere 0,1 mL di una soluzione da 2,0 M di 1-bromobutano in acetone.
- Misura attentamente il tempo necessario per osservare il primo segno di nuvolosità.
- Misurare 1,0 mL di 1,0 M 1-bromobutano in acetone nella terza e quarta provetta.
- Aggiungere 0,1 mL di ioduro di sodio al 7,5 % in soluzione di acetone nella terza provetta.
- Misura attentamente il tempo necessario per osservare il primo segno di nuvolosità.
- Nella quarta provetta, aggiungere 0,1 mL di ioduro di sodio al 15% in soluzione di acetone e misurare attentamente il tempo necessario per osservare il primo segno di torbidità.
Risultati
Parte 1: Studio dellereazioni di SN1
Struttura ad alogenuri alchilici:

Uscita dagli effetti di gruppo:

Effetti di polarità del solvente:

Determinazione dellalegge del tasso SN1:
| Provetta |
Nitrato d'argento Concentrazione |
1-Bromobutano Concentrazione |
Tempo fino alle precipitazioni |
| 1 | 0,1 M | 0,1 M | 20 anni |
| 2 | 0,1 M | 0,2 M | 10 s |
| 3 | 0,1 M | 0,1 M | 20 anni |
| 4 | 0,05 M | 0,1 M | 20 anni |

Parte 2: Studio dellereazioni SN2
Struttura ad alogenuri alchilici:
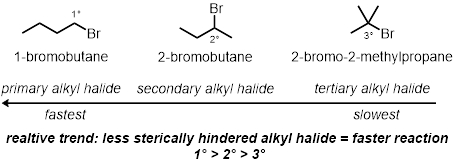
Effetti sterici:
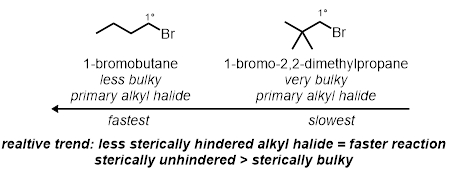
Uscita dagli effetti di gruppo:

Determinazione dellalegge del tasso SN2:
| Provetta |
Ioduro di sodio Concentrazione |
1-Bromobutano Concentrazione |
Tempo fino alle precipitazioni |
| 1 | 15% | 1,0 m | 20 anni |
| 2 | 15% | 2,0 m | 10 s |
| 3 | 15% | 1,0 m | 20 anni |
| 4 | 7.5% | 1,0 m | 40 anni |

Applicazione e Riepilogo
Questi esperimenti sono progettati per mostrare rapidamente le tendenze nelle reazioni di sostituzione nucleofila. Testare sperimentalmente queste tendenze aiuta a comprendere meglio le sottili differenze tra una reazione SN1 e SN2. I chimici hanno imparato a sviluppare e ottimizzare le condizioni di reazione. Tutto nasce dalla prima comprensione della reazione: cosa accelera o rallenta una reazione e come possiamo trarne vantaggio? La scelta del miglior solvente, temperatura o concentrazione di reagenti può influire notevolmente sulla velocità di fine di una reazione. Nel corso del tempo, i chimici non si sono preoccupati solo della velocità, ma anche della selettività e delle rese. Le reazioni di sostituzione nucleofila sono una reazione importante da imparare come può essere trovata in tutta la letteratura sintetica.
Questa dimostrazione può essere utilizzata come risorsa per reazioni di sostituzione nucleofila; tuttavia, è uno schema approssimativo su come studiare qualsiasi reazione organica. Come cambiare le condizioni di reazione (cambiando una variabile alla volta) e osservando i loro effetti è la base dell'uso del metodo scientifico. Questo può essere applicato ad altri tipi di reazioni oltre alle reazioni di sostituzione, ad esempio, altre reazioni di sostituzione come reazioni di sostituzione aromatica e reazioni di sostituzione acilica.
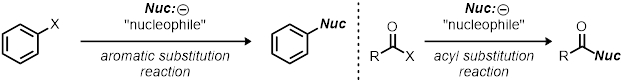
Le reazioni sono ottimizzate per le loro rese, selettività e velocità (efficienza). Il modo in cui il chimico modifica i parametri di reazione, come catalizzatore, temperatura, solvente e capacità del gruppo di partenza, può influire in gran parte sulla reazione. Conoscere la cinetica di una reazione può fornire preziose informazioni sulla reazione, e di solito questo è l'inizio per capire il meccanismo di una reazione.
Vai a...
Video da questa raccolta:

Now Playing
Sostituzione nucleofila
Organic Chemistry II
99.5K Visualizzazioni

Pulizia della vetreria
Organic Chemistry II
123.5K Visualizzazioni

Agenti riducenti
Organic Chemistry II
43.1K Visualizzazioni

Reazione di Grignard
Organic Chemistry II
149.0K Visualizzazioni

Titolazione di n-butillitio
Organic Chemistry II
47.7K Visualizzazioni

Dispositivo di Dean Stark
Organic Chemistry II
100.2K Visualizzazioni

Ozonolisi degli alcheni
Organic Chemistry II
67.0K Visualizzazioni

Organocatalisi
Organic Chemistry II
16.6K Visualizzazioni

Reazione di accoppiamento catalizzata da palladio
Organic Chemistry II
34.3K Visualizzazioni

Sintesi in fase solida
Organic Chemistry II
41.0K Visualizzazioni

Idrogenazione
Organic Chemistry II
49.6K Visualizzazioni

Polimerizzazione
Organic Chemistry II
93.9K Visualizzazioni

Punto di fusione
Organic Chemistry II
149.8K Visualizzazioni

Spettroscopia infrarossa
Organic Chemistry II
214.6K Visualizzazioni

Polarimetro
Organic Chemistry II
99.9K Visualizzazioni