Substituição nucleofílica
Visão Geral
Fonte: Vy M. Dong e Daniel Kim, Departamento de Química da Universidade da Califórnia, Irvine, CA
As reações de substituição nucleofílica estão entre os temas mais fundamentais abordados na química orgânica. Uma reação de substituição nucleofílica é aquela em que um nucleófilo (base lewis rica em elétrons) substitui um grupo de saída de um átomo de carbono.
SN1 (S = Substituição, N = Nucleofílico, 1 = cinética de primeira ordem)
SN2 (S = Substituição, N = Nucleofílico, 2 = cinética de segunda ordem)
Este vídeo ajudará a visualizar as diferenças sutis entre uma reação SN1 e SN2 e quais fatores ajudam a acelerar cada tipo de reação de substituição nucleofílica. A primeira seção se concentrará em reações que ajudarão a entender melhor e aprender sobre reações de substituição nucleofílica. A segunda seção se concentrará em um exemplo real de uma reação de substituição.
Princípios
Em uma reação de substituição nucleofílica, um nucleófilo substitui um grupo de saída em um átomo de carbono. Uma substituição nucleofílica de uma etapa é um exemplo do mecanismo SN2. Esta reação é uma reação concertada onde os laços quebrando e formando estão ocorrendo ao mesmo tempo. Uma coisa a ter em mente é que os orbitais moleculares envolvidos na reação indicam que o ataque nucleofílico deve vir a 180 ° do grupo de saída. Portanto, alguns apelidam a reação SN2 do "ataque back-side". Este ataque back-side inverte a estereoquímica no carbono reagindo. Este é um exemplo de uma reação estereospecífica onde a estereoquímica no início da reação dita o resultado da estereoquímica após a reação.

Uma substituição nucleofílica de duas etapas é um exemplo do mecanismo SN1. Na primeira etapa, o grupo de saída sai e forma um intermediário chamado carbocation. Na segunda etapa, o nucleófilo ataca a carbocação. Como a carbocação é achiral (não quiral), qualquer estereótipo no início da reação é perdida. O produto ainda é quiral, mas agora é uma mistura uniforme de ambos os enantiomers que é chamado de mistura racial. As reações SN1 não são estereospecíficas.
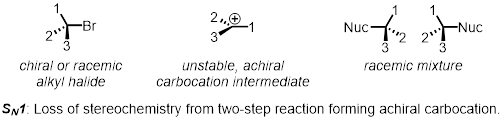
Em duas partes, examinaremos os fatores que afetam as taxas relativas das reações SN1 e SN2.
Na primeira parte, estudaremos a reação SN1 usando 11 reações de tubo de ensaio. Todas as reações têm o mesmo esquema de reação geral:
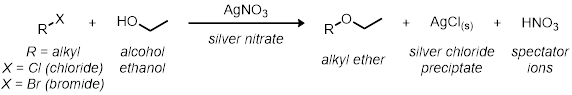
Todas as taxas das reações são relativas umas às outras. A taxa de reação será determinada pelo indicador visual na reação. Como o cloreto de prata precipita-se fora de solução, o momento em que a reação vai de claro a nublado dá uma indicação visual da velocidade relativa da reação.
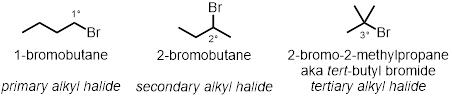
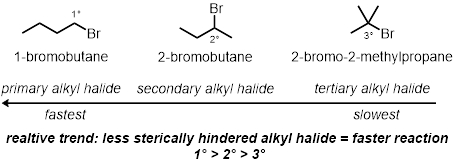
Em três das reações do tubo de ensaio, como a estrutura de halido alquila desempenha um papel na taxa das reações será testada. Três cloretos de alquila diferentes sob as mesmas condições serão testados:
Em duas das reações do tubo de ensaio, os efeitos de polaridade solvente na reação serão testados. Dois solventes diferentes serão testados:
| Tubo de ensaio | Solvente | Tipo de Solvente |
| 1 | 100% etanol | Prost polar |
| 2 | 5% de etanol:95% acetona | Principalmente apíptico polar |
Em duas das reações do tubo de ensaio, os efeitos do grupo de saída serão testados. Dois halidos alquilos diferentes serão usados:

Finalmente, quatro dos tubos de ensaio serão usados para medir a lei de taxas das reações. A taxa de reação será medida com concentrações variadas de solução de iodeto de sódio e soluções de 1-bromobutano.
| Tubo de ensaio |
cloreto tert-butil concentração |
Nitrato de prata concentração |
Tempo até precipitação |
| 1 | 0,1 M | 0,1 M | |
| 2 | 0,2 M | 0,1 M | |
| 3 | 0,1 M | 0,1 M | |
| 4 | 0,1 M | 0,05 M |
Na segunda parte, estudaremos a reação SN2 usando 11 reações de tubo de ensaio. Todas as reações têm o mesmo esquema de reação geral:
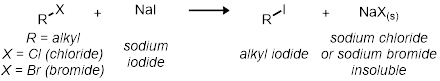
Todas as taxas das reações são relativas umas às outras. A taxa de reação será determinada pelo indicador visual de cloreto de sódio ou brometo de sódio precipitando-se fora de solução. Isso será indicado quando a reação for de claro a nublado.
Em três das reações do tubo de ensaio, como a estrutura de halido alquila desempenha um papel na taxa das reações será testada. Isso vai comparar os efeitos estéricos do carbono que está ligado ao bromo. Três cloretos de alquila diferentes sob as mesmas condições serão testados:

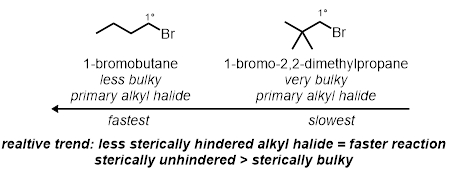
Em duas das reações do tubo de ensaio, os efeitos estéricos secundários do halido alquilo serão testados. Estes são efeitos estericos na molécula, não incluindo o carbono ligado ao brometo. Dois brometos alquil primários diferentes, sob as mesmas condições, serão testados:

Em duas das reações do tubo de ensaio, os efeitos do grupo de saída serão testados. Dois halidos alquilos diferentes serão usados:

Finalmente, quatro tubos de ensaio serão usados para medir a lei de taxas das reações. A taxa de reação será medida com concentrações variadas de solução de iodeto de sódio e soluções de 1-bromobutano.
| Tubo de ensaio |
Iodeto de sódio Concentração |
1-Bromobutano Concentração |
Tempo até precipitação |
| 1 | 15% | 1,0 M | |
| 2 | 15% | 2.0 M | |
| 3 | 15% | 1,0 M | |
| 4 | 7.5% | 1,0 M |
Procedimento
Parte 1: Estudar reações SN1
Estrutura Alkyl Halide:
- Meça 2 mL de uma solução de 0,1 M de nitrato de prata em etanol absoluto em cada um dos três tubos de ensaio.
- Adicione 2 gotas de 1-bromobutano no primeiro tubo de ensaio. Adicione 2 gotas de 2-bromobutano no segundo tubo de ensaio.
- Adicione 2 gotas de 2-bromo-2-metilpropano no último, terceiro tubo de ensaio.
- Rolha e agite cada tubo de ensaio.
- Observe o momento em que os primeiros sinais de nebulosidade ou precipitação aparecem.
Deixando efeitos de grupo:
- Meça 2 mL de uma solução de 0,1 M de nitrato de prata em etanol absoluto em cada um dos dois tubos de ensaio.
- Adicione 2 gotas de 2-bromo-2-metilpropano no primeiro tubo de ensaio e 2 gotas de 2-cloro-2-metilpropano no segundo tubo de ensaio.
- Rolha e agite cada tubo de ensaio.
- Observe o momento em que os primeiros sinais de nebulosidade ou precipitação aparecem.
Efeitos de polaridade solvente:
- Meça 2 mL de uma solução de 0,1 M de nitrato de prata no etanol absoluto no primeiro tubo de ensaio e meça 2 mL de uma solução de 0,1 M de nitrato de prata em 5% etanol/95% acetona no segundo tubo de ensaio.
- Adicione 2 gotas de 2-bromo-2-metilpropano em ambos os tubos de ensaio.
- Rolha e agite cada tubo de ensaio.
- Observe o momento em que os primeiros sinais de nebulosidade ou precipitação aparecem.
Determinando a Lei de Taxas SN1:
- Meça 0,5 mL de uma solução de 0,1 M de 2-cloro-2-metilpropano no etanol no primeiro tubo de ensaio.
- Meça 0,5 mL de uma solução de 0,2 M de 2-cloro-2-metilpropano no etanol no segundo tubo de ensaio.
- Adicione 1,0 mL de uma solução de 0,1 M de nitrato de prata em etanol absoluto em ambos os tubos de ensaio.
- Meça cuidadosamente o tempo necessário para observar nebulosidade ou precipitação.
- Meça 1,0 mL de uma solução de 0,1 M de nitrato de prata no etanol no terceiro tubo de ensaio.
- No quarto tubo de ensaio, meça 0,5 mL de uma solução de 0,1 M de nitrato de prata no etanol e adicione mais 0,5 mL de etanol.
- Em ambos os tubos de ensaio, adicione 1,0 mL de 0,1 M 2-cloro-2-metilpropano no etanol e meça cuidadosamente o tempo necessário para observar a nebulosidade ou precipitação.
Parte 2: Estudando reações SN2
Estrutura Alkyl Halide:
- Meça 2 mL de iodeto de sódio de 15% em acetona em cada um dos três tubos de ensaio.
- Adicione 2 gotas de 1-bromobutano no primeiro tubo de ensaio.
- Adicione 2 gotas de 2-bromobutano no segundo tubo de ensaio.
- Por fim, adicione 2 gotas de 2-bromo-2-metilpropano no último terceiro tubo de ensaio.
- Rolha e agite cada tubo de ensaio.
- Observe o momento em que os primeiros sinais de nebulosidade ou precipitação aparecem.
Efeitoséricos:
- Meça 1 mL de iodeto de sódio de 15% na solução de acetona em cada um dos dois tubos de ensaio.
- Adicione 2 gotas de 1-bromobutano no primeiro tubo de ensaio e adicione 2 gotas de brometo de neopentil no segundo tubo de ensaio.
- Rolha e agite cada tubo de ensaio.
- Observe o momento em que os primeiros sinais de nebulosidade ou precipitação aparecem.
Deixando efeitos de grupo:
- Meça 1 mL de iodeto de sódio de 15% na solução de acetona em cada um dos dois tubos de ensaio.
- Adicione 2 gotas de 1-bromobutano no primeiro tubo de ensaio e adicione 2 gotas de 1 clorobutano no segundo tubo de ensaio.
- Rolha e agite cada tubo de ensaio.
- Observe o momento em que os primeiros sinais de nebulosidade ou precipitação aparecem.
Determinando a Lei de Taxas SN2:
- Meça 1,0 mL de iodeto de sódio de 15% na solução de acetona em dois tubos de ensaio.
- Adicione 0,1 mL de solução de 1,0 M de 1-bromobutano em acetona no primeiro tubo de ensaio.
- Meça cuidadosamente o tempo necessário para observar o primeiro sinal de nebulosidade.
- No segundo tubo de ensaio, adicione 0,1 mL de uma solução de 2,0 M de 1-bromobutano em acetona.
- Meça cuidadosamente o tempo necessário para observar o primeiro sinal de nebulosidade.
- Meça 1,0 mL de 1,0 M 1-bromobutano em acetona no terceiro e quarto tubos de ensaio.
- Adicione 0,1 mL de um iodeto de sódio de 7,5 % na solução de acetona no terceiro tubo de ensaio.
- Meça cuidadosamente o tempo necessário para observar o primeiro sinal de nebulosidade.
- No quarto tubo de ensaio, adicione 0,1 mL de um iodeto de sódio de 15% na solução de acetona e meça cuidadosamente o tempo necessário para observar o primeiro sinal de nebulosidade.
Resultados
Parte 1: Estudar reações SN1
Estrutura Alkyl Halide:

Deixando efeitos de grupo:

Efeitos de polaridade solvente:

Determinando aLei de Taxas SN1:
| Tubo de ensaio |
Nitrato de prata Concentração |
1-Bromobutano Concentração |
Tempo até precipitação |
| 1 | 0,1 M | 0,1 M | 20 s |
| 2 | 0,1 M | 0,2 M | 10 s |
| 3 | 0,1 M | 0,1 M | 20 s |
| 4 | 0,05 M | 0,1 M | 20 s |

Parte 2: Estudando reações SN2
Estrutura Alkyl Halide:
Efeitoséricos:
Deixando efeitos de grupo:

Determinando aLei de Taxas SN2:
| Tubo de ensaio |
Iodeto de sódio Concentração |
1-Bromobutano Concentração |
Tempo até precipitação |
| 1 | 15% | 1,0 M | 20 s |
| 2 | 15% | 2.0 M | 10 s |
| 3 | 15% | 1,0 M | 20 s |
| 4 | 7.5% | 1,0 M | 40 s |

Aplicação e Resumo
Esses experimentos são projetados para mostrar rapidamente tendências nas reações de substituição nucleofílicas. Testar experimentalmente essas tendências ajuda a entender melhor as diferenças sutis entre uma reação SN1 e SN2. Os químicos aprenderam a desenvolver e otimizar as condições de reação. Tudo decorre primeiro de entender a reação: o que acelera ou retarda uma reação e como podemos tirar proveito disso? Escolher o melhor solvente, temperatura ou concentração de reagentes pode afetar muito a rapidez com que uma reação terminará. Com o tempo, os químicos não se preocuparam apenas com a velocidade, mas também com seletividade e rendimentos. As reações de substituição nucleofílicas são uma reação importante para aprender, pois podem ser encontradas ao longo da literatura sintética.
Esta demonstração pode ser usada como recurso para reações de substituição nucleofílica; no entanto, é um esboço áspero sobre como estudar qualquer reação orgânica. Como mudar as condições de reação (mudar uma variável de cada vez) e observar seus afetos é a base do uso do método científico. Isso pode ser aplicado a outros tipos de reações além de reações de substituição, por exemplo, outras reações de substituição, como reações de substituição aromática e reações de substituição aciótica.
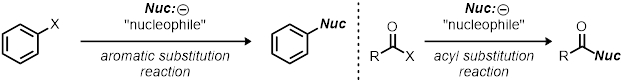
As reações são otimizadas para seus rendimentos, seletividade e velocidade (eficiência). Como o químico altera os parâmetros de reação - como catalisador, temperatura, solvente e capacidade de deixar o grupo - pode impactar em grande parte a reação. Conhecer a cinética de uma reação pode dar informações valiosas sobre a reação, e geralmente este é o começo para entender o mecanismo de uma reação.
Pular para...
Vídeos desta coleção:

Now Playing
Substituição nucleofílica
Organic Chemistry II
99.5K Visualizações

Limpeza de Vidraria
Organic Chemistry II
123.5K Visualizações

Agentes redutores
Organic Chemistry II
43.0K Visualizações

Reação de Grignard
Organic Chemistry II
149.0K Visualizações

Titulação de n-butil-lítio
Organic Chemistry II
47.7K Visualizações

Trap Dean-Stark para destilação
Organic Chemistry II
100.2K Visualizações

Ozonólise de Alquenos
Organic Chemistry II
67.0K Visualizações

Organocatálise
Organic Chemistry II
16.6K Visualizações

Acoplamento Cruzado Catalisado por Paládio
Organic Chemistry II
34.3K Visualizações

Síntese de Fase Sólida
Organic Chemistry II
41.0K Visualizações

Hidrogenação
Organic Chemistry II
49.6K Visualizações

Polimerização
Organic Chemistry II
93.8K Visualizações

Ponto de fusão
Organic Chemistry II
149.8K Visualizações

Espectroscopia infravermelha
Organic Chemistry II
214.6K Visualizações

Polarímetro
Organic Chemistry II
99.9K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados