Substitution nucléophile
Vue d'ensemble
Source : Vy M. Dong et Daniel Kim, Department of Chemistry, University of California, Irvine, CA
Réactions de substitutions nucléophiles sont parmi les plus fondamentaux sujets abordés en chimie organique. Une réaction de substitution nucléophile est un où un nucléophile (riches en électrons Lewis base) remplace un groupe partant d’un atome de carbone.
SN1 (S = Substitution, N = Nucleophilic, 1 = cinétique du premier ordre)
SN2 (S = Substitution, N = Nucleophilic, 2 = cinétique du second ordre)
Cette vidéo permettra de visualiser les différences subtiles entre un SN1 et SN2 réaction et quels facteurs contribuent à accélérer à chaque type de réaction de substitution nucléophile. La première section se concentrera sur les réactions qui aideront à mieux comprendre et connaître les réactions de substitutions nucléophiles. La deuxième section se concentrera sur un exemple réel d’une réaction de substitution.
Principles
Dans une réaction de substitution nucléophile, un nucléophile remplace un groupe partant sur un atome de carbone. Une substitution nucléophile en une seule étape est un exemple de la SN2 mécanisme. Cette réaction est une réaction concertée où les liens briser et formant sont produisent en même temps. Une chose à garder à l’esprit est que les orbitales moléculaires impliqués dans la réaction indiquent que l’attaque nucléophile doit provenir à 180 ° nucléofuge. Par conséquent, certains surnom le SN2 réaction « envers l’attaque ». Cette attaque dos inverse la stéréochimie sur le carbone qui réagissent. Il s’agit d’un exemple d’une réaction stéréospécifique où la stéréochimie au début de la réaction dicte le résultat de la stéréochimie après la réaction.

Une substitution nucléophile en deux étapes est un exemple de la SN1 mécanisme. Dans la première étape, le nucléofuge laisse et forme un intermédiaire appelé un carbocation. Dans la deuxième étape, le nucléophile attaque le carbocation. Étant donné que le carbocation est achiral (pas chirale), une stéréochimie au début de la réaction est perdue. Le produit est toujours chiral, mais est maintenant un même mélange des deux énantiomères qui s’appelle un mélange racémique. SN1 réactions ne sont pas stéréospécifique.
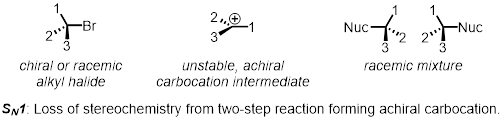
En deux parties, nous allons examiner les facteurs qui affectent les vitesses relatives des SN1 SN2 réactions.
Dans la première partie, nous étudierons le SN1 réaction utilisant 11 réactions de tube à essai. Toutes les réactions ont le même schéma de réaction générale :
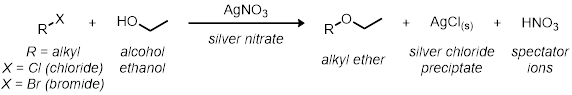
Toutes les vitesses des réactions sont par rapport à l’autre. La vitesse de réaction sera déterminée par l’indicateur visuel dans la réaction. Étant donné que le chlorure d’argent se précipite hors de la solution, au moment où la réaction va de clair à nuageux donne une indication visuelle de la réaction relative vitesse.
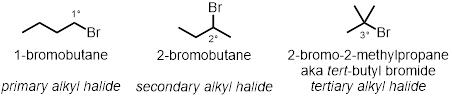
Dans trois des réactions tube à essai, comment la structure de halogénure d’alkyle joue un rôle dans le taux des réactions est testé. Trois chlorures d’alkyle différents dans les mêmes conditions seront testés :
Dans deux des réactions tube à essai, les effets de la polarité du solvant sur la réaction seront testés. Deux solvants différents seront testés :
| Tube à essai | Solvant | Type de solvant |
| 1 | 100 % d’éthanol | Protique polaire |
| 2 | 5 % d’éthanol : 95 % acétone | Pour la plupart polaires aprotiques |
Dans deux des réactions tube à essai, les effets de groupe nucléofuge seront testés. Deux halogénures d’alkyle différents seront utilisés :

Enfin, quatre d'entre les tubes à essai servira à mesurer la Loi de vitesse des réactions. On mesurera la vitesse de la réaction avec des concentrations variables de solution d’iodure de sodium et solutions 1-bromobutane.
| Tube à essai | chlorure de tert-butyle concentration de |
Nitrate d’argent concentration de |
Temps jusqu'à précipitation |
| 1 | 0,1 M | 0,1 M | |
| 2 | 0,2 M | 0,1 M | |
| 3 | 0,1 M | 0,1 M | |
| 4 | 0,1 M | 0,05 M |
Dans la deuxième partie, nous étudierons le SN2 réaction utilisant 11 réactions de tube à essai. Toutes les réactions ont le même schéma de réaction générale :
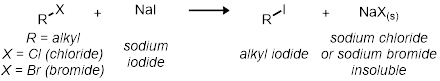
Toutes les vitesses des réactions sont par rapport à l’autre. La vitesse de réaction sera déterminée par l’indicateur visuel de précipiter hors de la solution de bromure de sodium ou de chlorure de sodium. Cela vous est indiqué lorsque la réaction passe de clair à nuageux.
Dans trois des réactions tube à essai, comment la structure de halogénure d’alkyle joue un rôle dans le taux des réactions est testé. Il comparera les effets stériques du carbone auquel est lié le brome. Trois chlorures d’alkyle différents dans les mêmes conditions seront testés :

Dans deux des réactions tube à essai, les effets stériques secondaires de l’halogénure d’alkyle seront testés. Voici les effets stériques sur la molécule non compris le carbone lié au bromure. Deux bromures d’alkyle primaires différentes, dans les mêmes conditions, seront testés :

Dans deux des réactions tube à essai, les effets de groupe nucléofuge seront testés. Deux halogénures d’alkyle différents seront utilisés :

Enfin, quatre tubes à essai servira à mesurer la Loi de vitesse des réactions.On mesurera la vitesse de la réaction avec des concentrations variables de solution d’iodure de sodium et solutions 1-bromobutane.
| Tube à essai | Iodure de sodium Concentration de |
1-Bromobutane Concentration de |
Temps jusqu'à précipitation |
| 1 | 15 % | 1. 0 M | |
| 2 | 15 % | 0 2. M | |
| 3 | 15 % | 1. 0 M | |
| 4 | 7,5 % | 1. 0 M |
Procédure
Partie 1 : Étude SN1 réactions
Alkyle halogénure Structure :
- Mesurer 2 mL d’une solution 0,1 M de nitrate d’argent dans l’éthanol absolu dans chacun des trois tubes de test.
- Ajouter 2 gouttes de 1-bromobutane dans le premier tube à essai. Ajouter 2 gouttes de 2-bromobutane dans le deuxième tube à essai.
- Ajouter 2 gouttes de 2-bromo-2-Méthylpropane dans la finale et troisième tube à essai.
- Boucher et agiter chaque tube à essai.
- Notez l’heure à laquelle les premiers signes de trouble ou précipité apparaît.
Laissant les effets de groupe :
- Mesurer 2 mL d’une solution 0,1 M de nitrate d’argent dans l’éthanol absolu dans chacun des deux tubes de test.
- Ajouter 2 gouttes de 2-bromo-2-Méthylpropane dans le premier tube à essai et 2 gouttes de 2-chloro-2-Méthylpropane dans le deuxième tube à essai.
- Boucher et agiter chaque tube à essai.
- Notez l’heure à laquelle les premiers signes de trouble ou précipité apparaît.
Effets de la polarité du solvant :
- Mesure 2 mL d’une solution 0,1 M de nitrate d’argent dans l’éthanol absolu dans le premier tube à essai et mesure 2 mL d’une solution 0,1 M de nitrate d’argent dans l’acétone ethanol/95% 5 % dans le second tube à essai.
- Ajouter 2 gouttes de 2-bromo-2-Méthylpropane dans deux tubes à essai.
- Boucher et agiter chaque tube à essai.
- Notez l’heure à laquelle les premiers signes de trouble ou précipité apparaît.
Détermination de la Loi de vitesse 1 deNS :
- Mesure 0,5 mL d’une solution 0,1 M de 2-chloro-2-Méthylpropane dans de l’éthanol dans le premier tube à essai.
- Mesurer 0,5 mL d’une solution de 0,2 M du 2-chloro-2-Méthylpropane dans de l’éthanol dans le deuxième tube à essai.
- Ajouter 1,0 mL d’une solution 0,1 M de nitrate d’argent dans l’éthanol absolu dans les deux tubes à essai.
- Mesurer précisément le temps que nécessaire pour observer la nébulosité et la précipitation.
- Mesurer 1,0 mL d’une solution 0,1 M de nitrate d’argent dans l’éthanol dans le troisième tube à essai.
- Dans le quatrième tube à essai, mesurer 0,5 mL d’une solution 0,1 M de nitrate d’argent dans l’éthanol et ajouter 0,5 mL d’éthanol supplémentaire.
- Dans les deux tubes à essai, ajouter 1,0 mL de 0.1 M 2-chloro-2-Méthylpropane dans l’éthanol et mesurer précisément le temps que nécessaire pour observer la nébulosité et la précipitation.
Partie 2 : Étude SN2 réactions
Alkyle halogénure Structure :
- Mesurer 2 mL d’iodure de sodium 15 % dans de l’acétone dans chacun des trois tubes de test.
- Ajouter 2 gouttes de 1-bromobutane dans le premier tube à essai.
- Ajouter 2 gouttes de 2-bromobutane dans le deuxième tube à essai.
- Enfin, ajouter 2 gouttes de 2-bromo-2-Méthylpropane dans la finale et troisième tube à essai.
- Boucher et agiter chaque tube à essai.
- Notez l’heure à laquelle les premiers signes de trouble ou précipité apparaît.
Effets stériques :
- Mesurer 1 mL d’iodure de sodium 15 % dans une solution d’acétone dans chacun des deux tubes de test.
- Ajouter 2 gouttes de 1-bromobutane dans le premier tube à essais et ajouter 2 gouttes de néopentyle bromure dans le deuxième tube à essai.
- Boucher et agiter chaque tube à essai.
- Notez l’heure à laquelle les premiers signes de trouble ou précipité apparaît.
Laissant les effets de groupe :
- Mesurer 1 mL d’iodure de sodium 15 % dans une solution d’acétone dans chacun des deux tubes de test.
- Ajouter 2 gouttes de 1-bromobutane dans le premier tube à essais et ajouter 2 gouttes de 1-chlorobutane dans le deuxième tube à essai.
- Boucher et agiter chaque tube à essai.
- Notez l’heure à laquelle les premiers signes de trouble ou précipité apparaît.
Détermination de la SN2 taux de droit :
- Mesurer 1,0 mL d’iodure de sodium 15 % dans une solution d’acétone dans deux tubes à essai.
- Ajouter 0,1 mL de solution de 1,0 M de 1-bromobutane dans l’acétone dans le premier tube à essai.
- Mesurer précisément le temps que nécessaire pour observer les premiers signes de la nébulosité.
- Dans le deuxième tube à essai, ajouter 0,1 mL d’une solution de 2,0 M de 1-bromobutane dans l’acétone.
- Mesurer précisément le temps que nécessaire pour observer les premiers signes de la nébulosité.
- Mesurer 1,0 mL de 1,0 M 1-bromobutane dans l’acétone dans les troisième et quatrième des éprouvettes.
- Ajouter 0,1 mL un 7,5 % d’iodure de sodium en solution d’acétone dans le troisième tube à essai.
- Mesurer précisément le temps que nécessaire pour observer les premiers signes de la nébulosité.
- Dans le quatrième tube à essai, ajouter 0,1 mL un 15 % d’iodure de sodium en solution d’acétone et de mesurer précisément le temps que nécessaire pour observer les premiers signes de la nébulosité.
Résultats
Partie 1 : étude S N 1 réactions
Alkyle halogénure Structure :

Laissant les effets de groupe :

Effets de la polarité du solvant :

Détermination de la S N Loi de 1 Vitesse :
| Tube à essai | Nitrate d’argent Concentration de |
1-Bromobutane Concentration de |
Temps jusqu'à précipitation |
| 1 | 0,1 M | 0,1 M | 20 s |
| 2 | 0,1 M | 0,2 M | 10 s |
| 3 | 0,1 M | 0,1 M | 20 s |
| 4 | 0,05 M | 0,1 M | 20 s |

Partie 2 : étude de S N 2 réactions
Alkyle halogénure Structure :
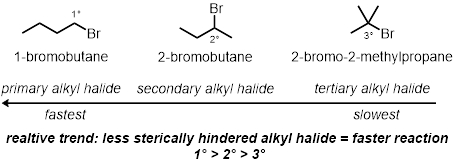
Effets stériques :
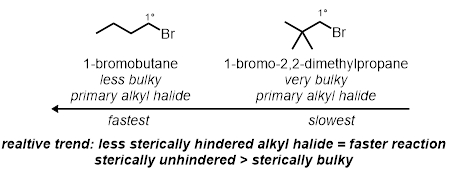
Laissant les effets de groupe :

Détermination de la S N 2 taux droit :
| Tube à essai | Iodure de sodium Concentration de |
1-Bromobutane Concentration de |
Temps jusqu'à précipitation |
| 1 | 15 % | 1. 0 M | 20 s |
| 2 | 15 % | 0 2. M | 10 s |
| 3 | 15 % | 1. 0 M | 20 s |
| 4 | 7,5 % | 1. 0 M | 40 s |

Applications et Résumé
Ces expériences visent à montrer rapidement les tendances dans les réactions de substitutions nucléophiles. Tester expérimentalement ces tendances permet de mieux comprendre les différences subtiles entre un SN1 et SN2 réaction. Chimistes ont appris à développer et optimiser les conditions de la réaction. Tout cela découle de la première compréhension de la réaction : ce qui accélère ou ralentit une réaction et comment nous pouvons en profiter ? Choisir que le meilleur solvant, la température ou la concentration des réactifs peut grandement affecter la rapidité une réaction se terminera. Au fil du temps, chimistes ont été non seulement concernés avec la vitesse, mais avec la sélectivité et de rendements ainsi. Réactions de substitutions nucléophiles sont une réaction importante d’apprendre comme on le trouve dans toute la littérature synthétique.
Cette démonstration peut être utilisée comme une ressource pour les réactions de substitutions nucléophiles ; Cependant, c’est une description approximative sur la façon d’étudier toute réaction de chimie organique. Comment faire pour changer les conditions de réaction (changeant une variable à la fois) et en observant leurs affects est la base de l’utilisation de la méthode scientifique. Ceci peut être appliqué à d’autres types de réactions en dehors des réactions de substitution, par exemple, autres réactions de substitution tels que les réactions de substitutions aromatiques et les réactions de substitutions d’acyle.
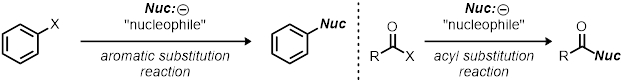
Les réactions sont optimisées pour leurs rendements, la sélectivité et la vitesse (efficacité). Comment le chimiste modifie la paramètres tels que le catalyseur de réaction, température, solvant et laissant-groupe capacité-peut largement influer la réaction. Sachant la cinétique d’une réaction peut prêter des informations précieuses sur la réaction, et généralement c’est le début pour comprendre le mécanisme d’une réaction.
Passer à...
Vidéos de cette collection:

Now Playing
Substitution nucléophile
Organic Chemistry II
99.5K Vues

Nettoyage de la verrerie
Organic Chemistry II
123.5K Vues

Agents reducteurs
Organic Chemistry II
43.0K Vues

Réaction de Grignard
Organic Chemistry II
149.0K Vues

Titrage du n-butyllithium
Organic Chemistry II
47.7K Vues

Appareil de Dean-Stark
Organic Chemistry II
100.2K Vues

Ozonolyse des alcènes
Organic Chemistry II
67.0K Vues

Organocatalyse
Organic Chemistry II
16.6K Vues

Réaction de couplage catalysé au palladium
Organic Chemistry II
34.3K Vues

Synthèse en phase solide
Organic Chemistry II
41.0K Vues

Hydrogénation
Organic Chemistry II
49.6K Vues

Polymérisation
Organic Chemistry II
93.8K Vues

Point de fusion
Organic Chemistry II
149.8K Vues

Spectroscopie infrarouge
Organic Chemistry II
214.6K Vues

Polarimètre
Organic Chemistry II
99.9K Vues