Nucelophile Substitution
Überblick
Quelle: Vy M. Dong und Daniel Kim, Department of Chemistry, University of California, Irvine, CA
Nucleophilen Substitution Reaktionen gehören zu den grundlegendsten Themen in der organischen Chemie. Nucleophilen Substitution Reaktion gehört, wo ein nucleophil (elektronenreichen Lewis-base) eine verlassen Gruppe aus einem Kohlenstoffatom ersetzt.
SN1 (S = Substitution, N = Nucleophilic, 1 = Kinetik erster Ordnung)
SN2 (S = Substitution, N = Nucleophilic, 2 = zweiter Ordnung Kinetik)
Dieses Video wird dazu beitragen, die feinen Unterschiede zwischen einem SN1 und SN2 visualisieren Reaktion und welche Faktoren dazu beitragen, jede Art von nucleophilen Substitution Reaktion zu beschleunigen. Der erste Abschnitt konzentriert sich auf Reaktionen, das hilft, besser zu verstehen und erfahren Sie mehr über nucleophilen Substitution Reaktionen. Der zweite Teil konzentriert sich auf ein reales Beispiel einer Ersatz-Reaktion.
Grundsätze
In einer nucleophilen Substitution Reaktion ersetzt ein nucleophil verlassen Gruppe auf einem Kohlenstoffatom. Eine einstufige nucleophilen Substitution ist ein Beispiel für die S-N2 Mechanismus. Diese Reaktion ist eine konzertierte Reaktion, wo sind die Bande brechen und bilden gleichzeitig auftreten. Eine Sache im Auge zu behalten ist, dass an der Reaktion beteiligte Molekülorbitale zufolge der nukleophilen Angriff verlassen Gruppe um 180° stammen muss. Daher einige Spitznamen SN2 Reaktion "Rückseite Attack". Dieser Angriff Rückseite kehrt der Stereochemie auf die reagierenden Kohlenstoff. Dies ist ein Beispiel einer stereospezifischen Reaktion, wo die Stereochemie zu Beginn der Reaktion bestimmt das Ergebnis der Stereochemie nach der Reaktion.

Eine zweistufige nucleophilen Substitution ist ein Beispiel für die S-N1 Mechanismus. In einem ersten Schritt die verlassen Gruppe verlässt und bildet ein Zwischenprodukt namens eine elektrophile. Im zweiten Schritt greift das nucleophil die elektrophile. Da die elektrophile achiral ist (nicht chiral), Stereochemie am Anfang der Reaktion geht verloren. Das Produkt ist nach wie vor chiral, aber jetzt ist eine sogar Mischung der beiden Enantiomere racemischem Mischung genannt. SN1 Reaktionen sind nicht stereospezifischen.
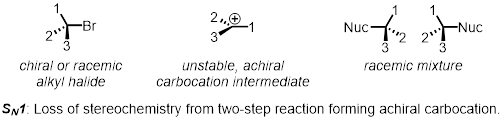
In zwei Teile, untersuchen wir die Faktoren, die Einfluss auf die relativen Preise der SN1 und SN2 Reaktionen.
In Teil eins, wir studieren das SN1 Reaktion unter Verwendung der 11 Reagenzglas Reaktionen. Alle Reaktionen haben die gleichen allgemeinen Reaktionsschema:
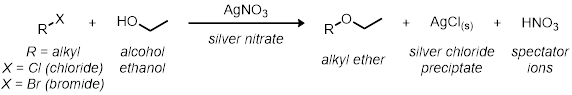
Alle Preise der Reaktionen sind relativ zueinander. Die Reaktionsgeschwindigkeit wird durch die visuelle Anzeige bei der Reaktion bestimmt werden. Da Silberchlorid aus der Lösung ausfällt, den Moment geht die Reaktion von klar, trübe gibt eine visuelle Anzeige der relativen Reaktion beschleunigen.
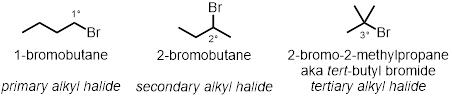
In drei der Reagenzglas Reaktionen werden wie die Alkyl-Halogenid-Struktur spielt eine Rolle in der Rate der Reaktionen getestet. Drei verschiedene Alkyl-Chloride unter den gleichen Bedingungen werden getestet werden:
In zwei der Reagenzglas Reaktionen werden die Lösungsmittel Polarität Auswirkungen auf die Reaktion getestet werden. Zwei verschiedene Lösungsmittel werden getestet:
| Reagenzglas | Lösungsmittel | Art des Lösungsmittels |
| 1 | 100 % ethanol | Polar protische |
| 2 | 5 % Ethanol: 95 % Aceton | Vor allem polaren aprotischen |
In zwei der Reagenzglas Reaktionen werden verlassen Gruppe Effekte getestet werden. Zwei verschiedene Alkyl Halogenide werden verwendet:

Schließlich wird vier die Reagenzgläser verwendet werden, um das Tarif-Gesetz der Reaktionen zu messen. Die Rate der Reaktion wird mit unterschiedlichen Konzentrationen von Natrium-Iodid-Lösung und 1-Bromobutane-Lösungen gemessen werden.
| Reagenzglas | Tert-Butyl Chlorid Konzentration |
Silbernitrat Konzentration |
Zeit bis zur Fällung |
| 1 | 0,1 M | 0,1 M | |
| 2 | 0,3 l | 0,1 M | |
| 3 | 0,1 M | 0,1 M | |
| 4 | 0,1 M | 0,05 M |
In Teil zwei, wir studieren das SN2 Reaktion unter Verwendung der 11 Reagenzglas Reaktionen. Alle Reaktionen haben die gleichen allgemeinen Reaktionsschema:
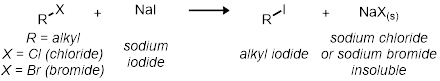
Alle Preise der Reaktionen sind relativ zueinander. Die Reaktionsgeschwindigkeit wird durch die visuelle Anzeige von Natriumchlorid oder Natriumbromid Ausfällen aus der Lösung bestimmt werden. Dies wird bei der Reaktion von klar bis wolkig geht angegeben werden.
In drei der Reagenzglas Reaktionen werden wie die Alkyl-Halogenid-Struktur spielt eine Rolle in der Rate der Reaktionen getestet. Dies wird die sterische Effekte des Kohlenstoffs vergleichen, die an die Brom gebunden ist. Drei verschiedene Alkyl-Chloride unter den gleichen Bedingungen werden getestet werden:

In zwei der Reagenzglas Reaktionen werden die sekundäre sterische Effekte von Alkyl-Halogenid getestet werden. Dies sind sterische Effekte auf das Molekül nicht einschließlich des Kohlenstoffs gebunden, Bromid. Zwei verschiedene primäre Alkyl Bromide, unter den gleichen Bedingungen werden getestet werden:

In zwei der Reagenzglas Reaktionen werden verlassen Gruppe Effekte getestet werden. Zwei verschiedene Alkyl Halogenide werden verwendet:

Schließlich wird vier Reagenzgläser verwendet werden, um das Tarif-Gesetz der Reaktionen zu messen.Die Rate der Reaktion wird mit unterschiedlichen Konzentrationen von Natrium-Iodid-Lösung und 1-Bromobutane-Lösungen gemessen werden.
| Reagenzglas | Natriumiodid Konzentration |
1-Bromobutane Konzentration |
Zeit bis zur Fällung |
| 1 | 15 % | 1.0 M | |
| 2 | 15 % | 2.0 M | |
| 3 | 15 % | 1.0 M | |
| 4 | 7,5 % | 1.0 M |
Verfahren
Teil 1: Studium SN1 Reaktionen
Alkyl-Halogenid-Struktur:
- Messen Sie 2 mL einer 0,1 M Lösung von Silbernitrat in absoluten Ethanol in jeder der drei Reagenzgläser.
- Geben Sie 2 Tropfen 1-Bromobutane in das erste Reagenzglas. Geben Sie 2 Tropfen 2-Bromobutane in das zweite Reagenzglas.
- Fügen Sie 2 Tropfen 2-Bromo-2-Methylpropane ins Finale, dritte Reagenzglas.
- Stopper und schütteln Sie jedes Reagenzglas.
- Notieren Sie die Zeit, an der die ersten Anzeichen einer Trübung oder Niederschlag wird angezeigt.
Verlassen die Gruppe Effekte:
- Messen Sie 2 mL einer 0,1 M Lösung von Silbernitrat in absoluten Ethanol in jeder der beiden Reagenzgläser.
- Geben Sie 2 Tropfen 2-Bromo-2-Methylpropane in das erste Reagenzglas und 2 Tropfen 2-Chloro-2-Methylpropane in das zweite Reagenzglas.
- Stopper und schütteln Sie jedes Reagenzglas.
- Notieren Sie die Zeit, an der die ersten Anzeichen einer Trübung oder Niederschlag wird angezeigt.
Solvent Polarität Effekte:
- Maßnahme 2 mL einer 0,1 M Lösung von Silbernitrat in absoluten Ethanol in das erste Reagenzglas und Maßnahme 2 mL einer 0,1 M Lösung von Silbernitrat in 5 % ethanol/95% Aceton in das zweite Reagenzglas.
- Geben Sie 2 Tropfen 2-Bromo-2-Methylpropane in beide Reagenzgläser.
- Stopper und schütteln Sie jedes Reagenzglas.
- Notieren Sie die Zeit, an der die ersten Anzeichen einer Trübung oder Niederschlag wird angezeigt.
Bestimmung des SN1 Rate rechts:
- 0,5 mL einer 0,1 M Lösung von 2-Chlor-2-Methylpropane in Ethanol in das erste Reagenzglas zu messen.
- 0,5 mL einer 0,2 M Lösung von 2-Chlor-2-Methylpropane in Ethanol in das zweite Reagenzglas zu messen.
- Fügen Sie 1,0 mL einer 0,1 M Lösung von Silbernitrat in absoluten Ethanol in beide Reagenzgläser.
- Messen Sie sorgfältig die Zeitdauer, um Trübung oder Niederschlag zu beobachten.
- 1,0 mL einer 0,1 M Lösung von Silbernitrat in Ethanol in das dritte Reagenzglas zu messen.
- Messen Sie in der vierten Reagenzglas 0,5 mL einer 0,1 M Lösung von Silbernitrat in Ethanol zu und fügen Sie eine zusätzliche 0,5 mL Ethanol.
- Fügen Sie in beide Reagenzgläser 1,0 mL 0,1 M 2-Chloro-2-Methylpropane in Ethanol hinzu und Messen Sie sorgfältig die Zeitdauer, um Trübung oder Niederschlag zu beobachten.
Teil 2: Studium SN2 Reaktionen
Alkyl-Halogenid-Struktur:
- Messen Sie 2 mL 15 % Natriumiodid in Aceton in jeder der drei Reagenzgläser.
- Geben Sie 2 Tropfen 1-Bromobutane in das erste Reagenzglas.
- Geben Sie 2 Tropfen 2-Bromobutane in das zweite Reagenzglas.
- Zu guter Letzt fügen Sie 2 Tropfen 2-Bromo-2-Methylpropane ins Finale, dritte Reagenzglas.
- Stopper und schütteln Sie jedes Reagenzglas.
- Notieren Sie die Zeit, an der die ersten Anzeichen einer Trübung oder Niederschlag wird angezeigt.
Sterische Effekte:
- 1 mL 15 % Natriumiodid in Aceton-Lösung in jeder der beiden Reagenzgläser zu messen.
- 2 Tropfen 1-Bromobutane in das erste Reagenzglas und Tropfen Sie 2 Neopentyl Bromid in das zweite Reagenzglas.
- Stopper und schütteln Sie jedes Reagenzglas.
- Notieren Sie die Zeit, an der die ersten Anzeichen einer Trübung oder Niederschlag wird angezeigt.
Verlassen die Gruppe Effekte:
- 1 mL 15 % Natriumiodid in Aceton-Lösung in jeder der beiden Reagenzgläser zu messen.
- 2 Tropfen 1-Bromobutane in das erste Reagenzglas und Tropfen Sie 2 1-Chlorobutane in das zweite Reagenzglas.
- Stopper und schütteln Sie jedes Reagenzglas.
- Notieren Sie die Zeit, an der die ersten Anzeichen einer Trübung oder Niederschlag wird angezeigt.
Bestimmung der SNbewerten 2 Gesetz:
- Messen Sie 1,0 mL 15 % Natriumiodid in Aceton-Lösung in zwei Reagenzgläser.
- 0,1 mL 1,0 M Lösung von 1-Bromobutane in das erste Reagenzglas in Aceton hinzugeben.
- Messen Sie sorgfältig die Zeit, die es braucht, um die ersten Anzeichen von Trübung zu beobachten.
- Fügen Sie in das zweite Reagenzglas 0,1 mL einer 2,0 M Lösung von 1-Bromobutane in Aceton.
- Messen Sie sorgfältig die Zeit, die es braucht, um die ersten Anzeichen von Trübung zu beobachten.
- Messen Sie 1,0 mL 1,0 M 1-Bromobutane in Aceton in der dritten und vierten Reagenzgläser.
- 0,1 mL eine 7,5 % Natriumiodid in Aceton-Lösung in das dritte Reagenzglas hinzugeben.
- Messen Sie sorgfältig die Zeit, die es braucht, um die ersten Anzeichen von Trübung zu beobachten.
- Fügen Sie in der vierten Reagenzglas 0,1 mL einer 15 % Natriumiodid in Aceton-Lösung hinzu und Messen Sie sorgfältig die Zeit, die es braucht, um die ersten Anzeichen von Trübung zu beobachten.
Ergebnisse
Teil 1: Studium S N 1 Reaktionen
Alkyl-Halogenid-Struktur:

Verlassen die Gruppe Effekte:

Solvent Polarität Effekte:

Bestimmung der S N 1 Rate Gesetz:
| Reagenzglas | Silbernitrat Konzentration |
1-Bromobutane Konzentration |
Zeit bis zur Fällung |
| 1 | 0,1 M | 0,1 M | 20 s |
| 2 | 0,1 M | 0,2 M | 10 s |
| 3 | 0,1 M | 0,1 M | 20 s |
| 4 | 0,05 M | 0,1 M | 20 s |

Teil 2: Studium S N 2 Reaktionen
Alkyl-Halogenid-Struktur:
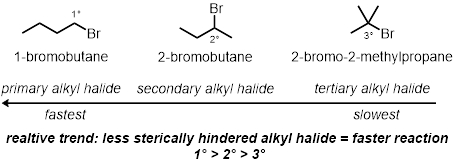
Sterische Effekte:
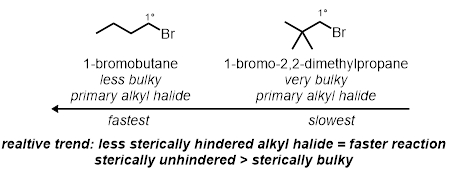
Verlassen die Gruppe Effekte:

Bestimmung der S N 2 bewerten Gesetz:
| Reagenzglas | Natriumiodid Konzentration |
1-Bromobutane Konzentration |
Zeit bis zur Fällung |
| 1 | 15 % | 1.0 M | 20 s |
| 2 | 15 % | 2.0 M | 10 s |
| 3 | 15 % | 1.0 M | 20 s |
| 4 | 7,5 % | 1.0 M | 40 s |

Anwendung und Zusammenfassung
Diese Experimente sollen schnell Trends in nucleophilen Substitution Reaktionen zeigen. Experimentell testen diese Trends hilft, um besser zu verstehen, die feinen Unterschiede zwischen einem SN1 und SN2 Reaktion. Chemiker haben gelernt, zu entwickeln und Reaktionsbedingungen zu optimieren. Alles stammt aus dem ersten Verständnis der Reaktions: Was beschleunigt oder verlangsamt eine Reaktion und wie können wir nutzen davon? Die Wahl der besten Lösungsmittel, Temperatur oder Konzentration von Reagenzien erheblich beeinflussen kann, wie schnelle eine Reaktion endet. Im Laufe der Zeit haben Chemiker nicht nur Geschwindigkeit, sondern mit Selektivität und Erträge sowie besorgt. Nucleophilen Substitution Reaktionen sind eine wichtige Reaktion, lernen, wie es im ganzen synthetische Literatur gefunden werden kann.
Diese Demonstration kann als eine Ressource für nucleophilen Substitution Reaktionen verwendet werden; Es ist jedoch eine grobe Skizze wie man organische Reaktionen zu studieren. So wechseln Sie Reaktionsbedingungen (wechselnde eine Variable gleichzeitig) und deren Auswirkungen zu beobachten ist die Grundlage der wissenschaftlichen Methode zu verwenden. Dies kann auf andere Arten von Reaktionen neben Ersatz Reaktionen, zum Beispiel andere Ersatz Reaktionen wie aromatische Substitution Reaktionen und Acyl Substitution angewendet werden.
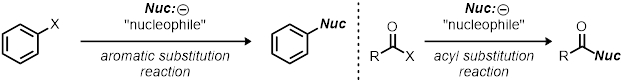
Reaktionen sind optimiert für ihre Erträge, Selektivität und Geschwindigkeit (Effizienz). Wie der Chemiker die Parameter, wie z. B. Katalysator Reaktion ändert, beeinflussen Temperatur, Lösungsmittel und Fähigkeit verlassen-Gruppe kann weitgehend die Reaktion. Zu wissen, die Kinetik der Reaktion kann wertvolle Informationen über die Reaktion verleihen, und dies ist in der Regel am Anfang zum Verständnis des Mechanismus einer Reaktion.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Nucelophile Substitution
Organic Chemistry II
99.5K Ansichten

Reinigung der Glaswaren
Organic Chemistry II
123.5K Ansichten

Reduktionsmittel
Organic Chemistry II
43.1K Ansichten

Grignard-Reaktion
Organic Chemistry II
149.0K Ansichten

n- Butyllithium Titration
Organic Chemistry II
47.7K Ansichten

Dean-Stark-Falle
Organic Chemistry II
100.2K Ansichten

Ozonolyse von Alkenen
Organic Chemistry II
67.0K Ansichten

Organokatalyse
Organic Chemistry II
16.6K Ansichten

Palladiumkatalysierte Kreuzkupplungsreaktionen
Organic Chemistry II
34.3K Ansichten

Festphasen-Synthese
Organic Chemistry II
41.0K Ansichten

Hydrierung
Organic Chemistry II
49.6K Ansichten

Polymerisation
Organic Chemistry II
93.9K Ansichten

Schmelzpunkt
Organic Chemistry II
149.8K Ansichten

Infrarot-Spektroskopie
Organic Chemistry II
214.6K Ansichten

Polarimeter
Organic Chemistry II
99.9K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten