Sustitución nucleófila
Visión general
Fuente: Vy M. Dong y Daniel Kim, Departamento de química, Universidad de California, Irvine, CA
Reacciones de Sustitución nucleófila son entre los temas más fundamentales en química orgánica. Una reacción de Sustitución nucleófila es uno donde un nucleófilo (rico en electrones base de Lewis) sustituye un grupo saliendo de un átomo de carbono.
SN1 (S = sustitución, N = Nucleophilic, 1 = cinética de primer orden)
SN2 (S = sustitución, N = Nucleophilic, 2 = cinética de segundo orden)
Este video le ayudará a visualizar las diferencias sutiles entre una SN1 y SN2 la reacción y qué factores ayudan a la velocidad de cada tipo de reacción de sustitución nucleofílica. La primera sección se centrará en las reacciones que ayudarán a mejor entender y aprender sobre las reacciones de sustitución nucleofílica. La segunda sección se centrará en un ejemplo real de una reacción de sustitución.
Principios
En una reacción de sustitución nucleofílica, un nucleófilo sustituye a un grupo que en un átomo de carbono. Una Sustitución nucleófila de un solo paso es un ejemplo de la SN2 mecanismo. Esta reacción es una reacción concertada donde están ocurriendo los bonos rompiendo y formando al mismo tiempo. Una cosa a tener en cuenta es que los orbitales moleculares implicados en la reacción indican que el ataque nucleofílico debe provenir en 180 ° el grupo dejando. Por lo tanto, algunos nickname SN2 reacción el "ataque de la parte trasera". Este ataque de parte trasera invierte la estereoquímica de la reacción de carbono. Este es un ejemplo de una reacción estereoespecífica donde la estereoquímica en el inicio de la reacción determina los resultados de la estereoquímica después de la reacción.

Una Sustitución nucleófila de dos etapas es un ejemplo de la SN1 mecanismo. En el primer paso, el grupo dejando las hojas y forma un intermediario llamado un Carbocatión. En el segundo paso el nucleófilo ataca al Carbocatión. Ya que el Carbocatión es achiral (no quiral), cualquier estereoquímica al principio de la reacción se pierde. El producto es todavía quiral, pero ahora es una mezcla uniforme de ambos enantiómeros que se llama una mezcla racémica. SN1 reacciones no están estereoespecífica.
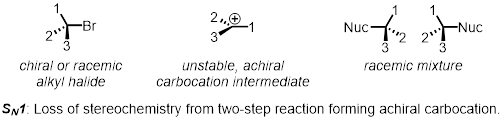
En dos partes, examinaremos los factores que afectan las tasas relativas de la SN1 y SN2 reacciones.
En la primera parte, estudiaremos la SN1 reacción usando 11 reacciones de tubo de ensayo. Todas las reacciones tienen el mismo esquema de reacción general:
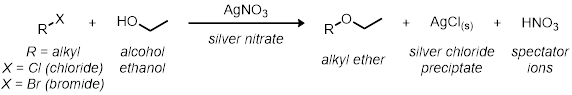
Todas las tarifas de las reacciones son relativos entre sí. La velocidad de reacción se determinará por el indicador visual en la reacción. Puesto que los precipitados de cloruro de plata de la solución, el momento de la reacción va de claro a turbio da una indicación visual de la reacción relativa velocidad.
En tres de las reacciones de tubo de ensayo, cómo la estructura del halogenuro de alquilo juega un papel en la tasa de las reacciones se probará. Se probarán tres cloruros de alquilo diferente bajo las mismas condiciones:
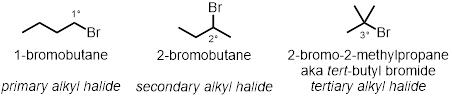
En dos de las reacciones de la probeta, se probarán los efectos de la polaridad del disolvente en la reacción. Se probarán dos disolventes diferentes:
| Tubo de ensayo | Solvente | Tipo de solvente |
| 1 | etanol al 100% | Polar protiques |
| 2 | 5% etanol: 95% acetona | Sobre todo Polar aprótico |
En dos de las reacciones de la probeta, se probarán los efectos dejando de grupo. Se utilizarán dos halogenuros de alquilo diferente:

Por último, cuatro de las probetas se utilizará para medir la ley de velocidad de las reacciones. Se medirá la velocidad de la reacción con diferentes concentraciones de solución de yoduro de sodio y soluciones 1-bromobutano.
| Tubo de ensayo | cloruro de terc-butilo concentración |
Nitrato de plata concentración |
Tiempo hasta precipitación |
| 1 | 0.1 M | 0.1 M | |
| 2 | 0.2 M | 0.1 M | |
| 3 | 0.1 M | 0.1 M | |
| 4 | 0.1 M | 0.05 M |
En la segunda parte, estudiaremos la SN2 la reacción usando 11 reacciones de tubo de ensayo. Todas las reacciones tienen el mismo esquema de reacción general:
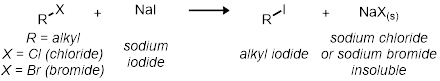
Todas las tarifas de las reacciones son relativos entre sí. La velocidad de reacción se determinará por el indicador visual de cloruro de sodio o bromuro de sodio precipitar de la solución. Esto se indicará cuando la reacción va de claro a turbio.
En tres de las reacciones de tubo de ensayo, cómo la estructura del halogenuro de alquilo juega un papel en la tasa de las reacciones se probará. Esto compara el estérico del carbono que está enlazado al bromo. Se probarán tres cloruros de alquilo diferente bajo las mismas condiciones:

En dos de las reacciones de la probeta, se probará la secundaria estérico de los halogenuros de alquilo. Estos son efectos estérico en la molécula no incluyendo el carbono enlazado a bromuro. Se probarán dos bromuros de alquilo primarios distintos, bajo las mismas condiciones:

En dos de las reacciones de la probeta, se probarán los efectos dejando de grupo. Se utilizarán dos halogenuros de alquilo diferente:

Por último, se utilizará cuatro tubos de ensayo para medir la ley de velocidad de las reacciones.Se medirá la velocidad de la reacción con diferentes concentraciones de solución de yoduro de sodio y soluciones 1-bromobutano.
| Tubo de ensayo | Yoduro de sodio Concentración |
1-bromobutano Concentración |
Tiempo hasta precipitación |
| 1 | 15% | 1.0 M | |
| 2 | 15% | 2.0 M | |
| 3 | 15% | 1.0 M | |
| 4 | 7.5% | 1.0 M |
Procedimiento
Parte 1: Estudio de la SN1 reacciones
Estructura de halogenuros de Alquilo:
- Medir 2 mL de una solución de 0.1 M de nitrato de plata en etanol absoluto en cada uno de los tres tubos de ensayo.
- Añadir 2 gotas de 1-bromobutano en el primer tubo de ensayo. Añadir 2 gotas de 2-bromobutano en el segundo tubo de ensayo.
- Añadir 2 gotas de 2-bromo-2-metilpropano en la final, tercer tubo de ensayo.
- Tapón y agite cada tubo de ensayo.
- Tenga en cuenta el momento en el que aparecen los primeros signos de turbidez o precipitado.
Dejando el efectos de Grupo:
- Medir 2 mL de una solución de 0.1 M de nitrato de plata en etanol absoluto en cada uno de los dos tubos de ensayo.
- Añadir 2 gotas de 2-bromo-2-metilpropano en el primer tubo de ensayo y 2 gotas de 2-cloro-2-metilpropano, en el segundo tubo de ensayo.
- Tapón y agite cada tubo de ensayo.
- Tenga en cuenta el momento en el que aparecen los primeros signos de turbidez o precipitado.
Efectos de la polaridad del solvente:
- Medir 2 mL de una solución de 0.1 M de nitrato de plata en etanol absoluto en el primer tubo de ensayo y medida 2 mL de una solución de 0.1 M de nitrato de plata en acetona ethanol/95% 5% en el segundo tubo de ensayo.
- Añadir 2 gotas de 2-bromo-2-metilpropano en ambos tubos de ensayo.
- Tapón y agite cada tubo de ensayo.
- Tenga en cuenta el momento en el que aparecen los primeros signos de turbidez o precipitado.
Determinación de la ley de velocidad de 1 SN:
- Medir 0.5 mL de una solución de 0.1 M de 2-cloro-2-metilpropano en etanol en el primer tubo de ensayo.
- Medir 0.5 mL de una solución de 0.2 M de 2-cloro-2-metilpropano en etanol en el segundo tubo de ensayo.
- Añadir 1,0 mL de solución de 0,1 M de nitrato de plata en etanol absoluto en ambos tubos de ensayo.
- Mida con cuidado el tiempo que toma para observar turbidez o precipitación.
- Medir 1.0 mL de una solución de 0.1 M de nitrato de plata en etanol en el tercer tubo de ensayo.
- En el cuarto tubo de ensayo, medir 0.5 mL de una solución de 0.1 M de nitrato de plata en etanol y añadir un adicional 0,5 mL de etanol.
- En ambos tubos de ensayo, añadir 1,0 mL de 0.1 M 2-chloro-2-metilpropano en etanol y medir cuidadosamente el tiempo que toma para observar turbidez o precipitación.
Parte 2: Estudio de SN2 reacciones
Estructura de halogenuros de Alquilo:
- Medir 2 mL de yoduro de sodio 15% en acetona en cada uno de los tres tubos de ensayo.
- Añadir 2 gotas de 1-bromobutano en el primer tubo de ensayo.
- Añadir 2 gotas de 2-bromobutano en el segundo tubo de ensayo.
- Finalmente, agregar 2 gotas de 2-bromo-2-metilpropano en la final, tercer tubo de ensayo.
- Tapón y agite cada tubo de ensayo.
- Tenga en cuenta el momento en el que aparecen los primeros signos de turbidez o precipitado.
Estérico:
- Medir 1 mL de yoduro de sodio 15% en solución de acetona en cada uno de los dos tubos de ensayo.
- 2 gotas de 1-bromobutano en el primer tubo de ensayo y añadir 2 gotas de Neopentilglicol bromuro en el segundo tubo de ensayo.
- Tapón y agite cada tubo de ensayo.
- Tenga en cuenta el momento en el que aparecen los primeros signos de turbidez o precipitado.
Dejando el efectos de Grupo:
- Medir 1 mL de yoduro de sodio 15% en solución de acetona en cada uno de los dos tubos de ensayo.
- En el primer tubo de ensayo 2 gotas de 1-bromobutano y añadir 2 gotas de 1-chlorobutane en el segundo tubo de ensayo.
- Tapón y agite cada tubo de ensayo.
- Tenga en cuenta el momento en el que aparecen los primeros signos de turbidez o precipitado.
Determinar la SN2 Índice derecho:
- Medir 1.0 mL de yoduro de sodio 15% en solución de acetona en dos tubos de ensayo.
- Añadir 0,1 mL de solución de 1,0 M de 1-bromobutano en acetona en el primer tubo de ensayo.
- Mida con cuidado el tiempo que lleva a observar los primeros signos de turbidez.
- En el segundo tubo de ensayo, Añadir 0,1 mL de una solución de 2,0 M de 1-bromobutano en acetona.
- Mida con cuidado el tiempo que lleva a observar los primeros signos de turbidez.
- Medir 1.0 mL de 1,0 M 1-bromobutano en acetona en los tubos de ensayo de terceros y cuarto.
- Añadir 0,1 mL de un yoduro de sodio 7.5% en solución de acetona en el tercer tubo de ensayo.
- Mida con cuidado el tiempo que lleva a observar los primeros signos de turbidez.
- En el cuarto tubo de ensayo, Añadir 0,1 mL de un 15% el yoduro de sodio en solución de acetona y mida con cuidado el tiempo que lleva a observar los primeros signos de turbidez.
Resultados
Parte 1: estudio S N 1 reacciones
Estructura de halogenuros de Alquilo:

Dejando el efectos de Grupo:

Efectos de la polaridad del solvente:

Determinar la S N Ley de 1 velocidad:
| Tubo de ensayo | Nitrato de plata Concentración |
1-bromobutano Concentración |
Tiempo hasta precipitación |
| 1 | 0.1 M | 0.1 M | 20 s |
| 2 | 0.1 M | 0.2 M | 10 s |
| 3 | 0.1 M | 0.1 M | 20 s |
| 4 | 0.05 M | 0.1 M | 20 s |

Parte 2: estudio S N 2 reacciones
Estructura de halogenuros de Alquilo:
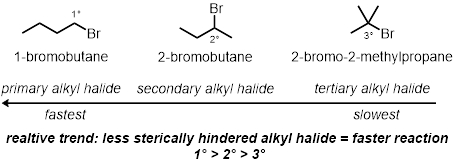
Estérico:
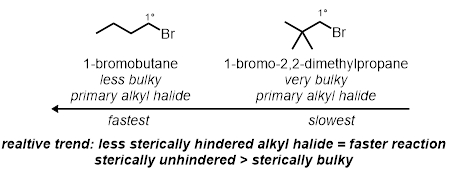
Dejando el efectos de Grupo:

Determinar la S N 2 tasa ley:
| Tubo de ensayo | Yoduro de sodio Concentración |
1-bromobutano Concentración |
Tiempo hasta precipitación |
| 1 | 15% | 1.0 M | 20 s |
| 2 | 15% | 2.0 M | 10 s |
| 3 | 15% | 1.0 M | 20 s |
| 4 | 7.5% | 1.0 M | 40 s |

Aplicación y resumen
Estos experimentos están diseñados para mostrar rápidamente tendencias en reacciones de sustitución nucleofílica. Prueba experimentalmente estas tendencias ayuda a comprender mejor las diferencias sutiles entre una SN1 y SN2 la reacción. Químicos han aprendido a desarrollar y optimizar las condiciones de reacción. ¿Todo proviene de la primera comprensión de la reacción: lo que acelera o frena una reacción y cómo podemos tomar ventaja de ello? Elegir que el mejor solvente, temperatura o concentración de los reactivos puede afectar en gran medida rapidez una reacción terminará. Con el tiempo, químicos han estado no solamente preocupados con velocidad, pero con selectividad y rendimiento así. Reacciones de Sustitución nucleófila son una reacción importante para aprender como se puede encontrar en literatura sintético.
Esta demostración se puede utilizar como un recurso para las reacciones de sustitución nucleofílica; sin embargo, es un contorno áspero de cómo estudiar cualquier reacción orgánica. Cómo cambiar las condiciones de reacción (cambiando una variable a la vez) y la observación de sus efectos es la base de la utilización del método científico. Esto puede aplicarse a otros tipos de reacciones además de reacciones de la substitución, por ejemplo, otras reacciones de la substitución como reacciones de sustitución aromática y reacciones de la substitución de acil.
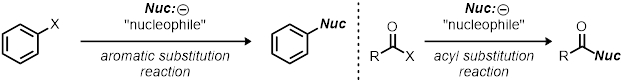
Reacciones están optimizadas para su rendimiento, selectividad y velocidad (eficiencia). Cómo el químico cambia la reacción parámetros, tales como catalizador, temperatura, solvente y grupo dejando capacidad-puede en gran medida afectan la reacción. Conocer la cinética de una reacción puede dar información valiosa acerca de la reacción, y generalmente este es el comienzo para comprender el mecanismo de una reacción.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Sustitución nucleófila
Organic Chemistry II
99.6K Vistas

Limpieza de cristalería
Organic Chemistry II
123.7K Vistas

Agentes de reducción
Organic Chemistry II
43.1K Vistas

Reacción de Grignard
Organic Chemistry II
149.1K Vistas

Titulación de n-butilitio
Organic Chemistry II
47.9K Vistas

Aparato de Dean-Stark
Organic Chemistry II
100.4K Vistas

Ozonólisis de alquenos
Organic Chemistry II
67.0K Vistas

Organocatálisis
Organic Chemistry II
16.8K Vistas

Acoplamiento cruzado catalizado por paladio
Organic Chemistry II
34.5K Vistas

Síntesis en fase sólida
Organic Chemistry II
41.1K Vistas

Hidrogenación
Organic Chemistry II
49.6K Vistas

Polimerización
Organic Chemistry II
94.3K Vistas

Punto de fusión
Organic Chemistry II
149.9K Vistas

Espectroscopia infrarroja
Organic Chemistry II
215.2K Vistas

Polarímetro
Organic Chemistry II
100.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados