Method Article
Ottica pH quantificazione di intracellulare in Drosophila melanogaster anatomista Epithelia con pH indicatore fluorescente geneticamente codificato
In questo articolo
Riepilogo
Trasporto ionico cellulare spesso può essere valutata attraverso il monitoraggio pH intracellulare (pHho). Geneticamente codificato indicatori di pH (GEpHIs) forniscono ottico quantificazione del pH intracellulare in cellule intatte. Questo protocollo dettaglia la quantificazione del pH intracellulare attraverso cellulare ex vivo live-immagini di tubuli malpighiani di Drosophila melanogaster con Bud, un pseudo-raziometrici geneticamente codificato indicatore di pH.
Abstract
Trasporto ionico epiteliale è vitale per omeostasi ionica sistemica così come manutenzione dei gradienti elettrochimici cellulari essenziali. PH intracellulare (pHio) è influenzato da molti trasportatori di ioni e quindi monitoraggio pHmi è uno strumento utile per la valutazione dell'attività di trasportatore. Moderno geneticamente codificato-indicatori di pH (GEpHIs) forniscono ottico quantificazione del pH in cellule intatte su scala cellulare e subcellulare. Questo protocollo descrive la quantificazione in tempo reale del pH cellulareho regolamento in tubuli malpighiani (MTs) di Drosophila melanogaster attraverso ex vivo live-immagini di Bud, una pseudo-raziometrici GEpHI con un pKun adatto per tenere traccia di variazioni di pH nel citosol. Estratto Mosca adulta MTs sono composte da sezioni morfologicamente e funzionalmente distinte del epithelia strato unicellulare e può servire come un modello accessibile e geneticamente trattabile per indagine di trasporto epiteliale. GEpHIs offrono parecchi vantaggi sopra le tinture fluorescenti convenzionali pH sensibili ed elettrodi iono-selettivi. GEpHIs possibile etichettare popolazioni distinte delle cellule, purché gli elementi appropriati promotore sono disponibili. Questa marcatura è particolarmente utile nelle ex vivo, in vivoe in situ preparati, che sono intrinsecamente eterogenei. GEpHIs consentono anche la quantificazione del pHi nei tessuti intatti nel tempo senza necessità di esternalizzazione di trattamento o tessuto di tintura ripetute. Lo svantaggio principale del GEpHIs corrente è la tendenza ad aggregare nelle inclusioni citosoliche in risposta al danno tissutale e costruire la sovra-espressione. Queste carenze, loro soluzioni e vantaggi che essi GEpHIs vengono illustrati nel presente protocollo attraverso la valutazione del trasporto di protoni (H+) basolateral nelle cellule principali e stellari funzionalmente distinte di estratti fly MTs. Le tecniche e l'analisi descritta sono facilmente adattabile ad un'ampia varietà di preparazioni di vertebrati e invertebrati, e la raffinatezza del dosaggio può essere scalata da laboratori intricato determinazione del flusso ionico attraverso specifici trasportatori didattici.
Introduzione
L'obiettivo del presente protocollo è quello di descrivere la quantificazione del pH intracellulare (pHi) utilizzando un geneticamente codificato-indicatore di pH (GEpHI) e dimostrare come questo metodo può essere utilizzato per valutare basolaterale trasporto di H+ in un insetto di modello (D. melanogaster) struttura renale, l'anatomista (MT). MTs servire come gli organi escretori del moscerino della frutta e sono simili ai mammiferi nefrone in diversi aspetti chiave1. MTs sono disposti come 2 paia di tubuli (anteriori e posteriori) nel torace e l'addome della Mosca. Il tubo epiteliale unicellulare di ogni MT è composto di cellule principali metabolicamente attive con la clausola distinct apicale (luminal) e basolaterale (emocele) polarità come pure intercalate cellule stellate. MTs anteriore sono composti da 3 morfologicamente, funzionalmente, ed inerente allo sviluppo distinti segmenti, in particolare l'iniziale dilatati segmento e segmento di transizione secretiva segmento principale, che si unisce all' uretere2. A livello cellulare trasporto trans-epiteliale ionico nel lumen è compiuto da una membrana plasmatica apicale del V-ATPasi3 e uno scambiatore di alcali-metallo/H+ , nonché un basolateral Na+-K+-ATPasi4, verso l'interno-raddrizzatore K+ canali5, Na+-driven Cl−/HCO3− scambiatore (NDAE1)6e Na+-K+-2 Cl− cotransporter (NKCC; Ncc69),7, mentre le cellule stellate mediano Cl– e acqua di trasporto8,9. Questo sistema fisiologico complesso ma accessibile offre eccellenti opportunità per indagine dei meccanismi di trasporto di ioni endogeni quando combinato con i diversi set di strumenti genetici e comportamentali di Drosophila.
La spiegazione razionale per questo protocollo era di descrivere un sistema geneticamente malleabile per studiare il trasporto ionico epiteliale con un potenziale di integrazione da cella a comportamento e l'esportazione di strumenti ad altri sistemi di modello. Espressione di Bud10, un GEpHI derivato da una fusione di verde pH sensibili Super-eclittica pHluorin11,12 (SEpH) e rosso mCherry pH-insensibile13, in MTs permette quantificazione di trasporto H+ in celluli MT attraverso la tecnica di calibrazione /nigericin alta K+14. Come molti trasportatori di ioni spostano equivalenti di H+ , quantificazione del pH intracellulare funge da rappresentazione funzionale del movimento di ioni attraverso una varietà di trasportatori. Il sistema di modello di Drosophila MT offre anche potenti strumenti genetici in tessuto-specifico transgene15 ed espressione di RNA interferenza (RNAi)16 , che può essere combinato con imaging cellulare e intero-organo saggi17 , 18 , 19 della funzione del tubulo per creare un robusto set di strumenti con integrazione verticale da molecole di comportamento. Questo è in contrasto con molti altri protocolli per la valutazione biologia epiteliale, come storicamente tali misure hanno contato su intricati e scoraggiante micro-dissezione, sofisticato elettrodi iono-selettivi20,21, e costosi pH sensibili coloranti22 con richieste di caricamento restrittive e scarsa specificità cellulare nei tessuti eterogenei. GEpHIs sono stati utilizzati estesamente misurare pHsono in una varietà di tipi di cella23. Primi lavori sfruttati la pH-sensibilità intrinseca di verde fluorescente Protein (GFP) per monitorare il pH in cellule epiteliali coltivate24 , ma negli ultimi due decenni hanno visto GEpHIs utilizzato in neuroni25, glia26, funghi27 , e pianta cellule28. La combinazione del potenziale per il targeting cellulari di costrutti genetici attraverso il sistema di espressione GAL4/UAS15 e l'accessibilità al fisiologico della drosofila MT rendono questo una preparazione ideale per indagini di pHho regolamento e trasporto ionico epiteliale.
regolazione del pH è stato studiato per decenni ed è vitale alla vita. La preparazione di MT offre un modello affidabile per insegnare la fisiologia della regolazione del pHho ma anche eseguire sofisticate indagini di pHi regolamento ex vivo e in vivo. Questo protocollo descrive la quantificazione del movimento H+ attraverso la membrana basolaterale delle cellule epiteliali di Drosophila MT utilizzando il NH4caricamento tecnica21acido di impulso di Cl, ma come l'indicatore di pH è geneticamente codificato, questi metodi e loro quadro teorico può essere applicati a qualsiasi preparazione suscettibili di transgenesi e live-imaging.
Protocollo
Tutti i punti in questo protocollo conformi alle linee guida uso animale Mayo Clinic (Rochester, MN).
1. allevamento di volare
- Vola di rilancio e insieme traverse secondo standard allevamento29.
Nota: Espressione di reporter fluorescente dal sistema GAL4/UAS è proporzionale alla temperatura e quindi allevamento temperatura può essere regolata per modificare il livello di espressione. Mentre i livelli di espressione alta conducono spesso ad un migliore rapporto segnale-rumore questa circostanza inoltre è associata con aumentati citosolici e organellari aggregati quando usando GFP per fusione proteina fluorescente rosso (RFP) costruisce come Bud10, 30,31. Se l'aggregazione è inevitabile, la quantificazione è ancora possibile eseguendo punto calibrazioni in ogni esperimento e normalizzare i dati tale che un rapporto di fluorescenza di 1.0 corrisponde al pHho 7.0 (vedere il punto 7.4 Nota sulla calibrazione qui sotto). - Insieme traverse di omozigoti Carosso-GAL432 maschi omozigoti UAS-Bud10 femmine vergini e omozigotica c724-GAL42 maschi per le femmine omozigoti Vergine di UAS-Bud per consentire la formazione immagine del pH in cellule principali e le cellule stellate della MT, rispettivamente. Posto 6 UAS-Bud femmine con 3 maschi GAL4 nei flaconi di freschi di cibo e lasciare ad accoppiarsi a 28 ° C.
Nota: Le larve devono essere evidenti all'interno 4D e adulti inizierà a eclose intorno giorno 10. - Raccogliere femminile mosche su eclosion e mettere da parte per età per 10 d a 28 ° C.
Nota: I tempi di sperimentazione possono essere regolato per corrispondere a qualsiasi analisi comportamentale restrittive (ad esempio il Ramsay secrezione dosaggio17,19) che saranno correlate a imaging pH intracellulare dal vivo. Mosche maschi possono essere utilizzati ma tubuli dalle femmine sono spesso più grandi e più robusto.
2. preparazione dei vetrini di poli-L-lisina.
- Disegnare un bordo di 40 x 20 mm con una penna PAP idrofobica intorno alla parte superiore di diapositive standard 75 x 25 mm e mettere da parte ad per asciugare per 15 min a RT. uso grandi coprioggetti se le diapositive non sono compatibili con ottica di imaging.
- Trasferire 2 mL di soluzione madre di poli-L-lisina (PLL) 0,01% in ogni diapositiva e mettere da parte per 1 h a TA.
- Rimuovere l'eccesso PLL con una pipetta. Salvare la soluzione in un flaconcino di 50 mL conica per un utilizzo futuro. Conservare a 4 ° C.
- Aspirare eventuali residui di soluzione con una linea del vuoto. Eseguire la linea del vuoto sopra la superficie intera diapositiva per garantire che nessuna soluzione rimanga sugli scivoli.
- Impostare le diapositive da parte per altre 1 h prima del RT uso. Archiviare le diapositive asciutto a temperatura ambiente per 1 mese in un libro di diapositiva standard.
3. preparazione della dissezione del piatto e bacchette di vetro
- Aggiungere 0,5 mL di agente indurente elastomero a 4,5 mL di elastomero base in polistirolo un 35 x 10 mm di Petri a RT per produrre una profondità di 5 mm. Mix con una pipetta monouso. Consentire l'elastomero curare O/N a TA.
Nota: Elastomero deve essere limpida e priva di bolle. Schiarimento di bolle può essere facilitato mantenendo lastre in elastomeri in un barattolo vuoto per 10-15 min dopo la colata. - Tenere una bacchetta di vetro del diametro di 5 mm tra le mani e sciogliere il centro dell'asta sopra un bruciatore di Bunsen illuminato mentre tirando le estremità a pezzi. Come il vetro si scioglie tirare più rapidamente di produrre una sottile (0,1 mm) e albero conico (Figura 1).
Nota: Un angolo di 45 ° alla tibia è spesso utile nella gestione dei tubuli. Ciò può essere ottenuto abbassando una mano come la tibia è tirata (Vedi Figura 1). - Rottura dell'albero sottile nel mezzo, con il lato smussato di una lama di rasoio taglio singolo in acciaio al carbonio. Ispezionare l'estremità sottile dell'asta in un ambito di dissezione per garantire che l'interruzione è pulito.

Figura 1: Fabbricazione di bacchette di vetro per la movimentazione di tubuli malpighiani.
A - E. Processo di riscaldamento e tirando una bacchetta di vetro per produrre una conicità e angolo adatto per la movimentazione MTS. frecce indicano la direzione e l'entità della forza da applicare. F. fotografia di uno strumento di vetro opportunamente fabbricato. Barra della scala = 10 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
4. preparazione di soluzioni e sistema di perfusione
Nota: Aspersione sistemi differiscono dal produttore. Questo protocollo è basato intorno un serbatoio aperto 8 canali gravità con un regolatore di flusso in ingresso e un deflusso di vuoto-driven, ma il metodo di montaggio che MTS come descritto qui può essere adattato per funzionare con qualsiasi sistema di perfusione.
-
Preparare le seguenti soluzioni:
- Di aliquotare Schneider mezzo (40 mL in fiale conica 50 mL) e conservare a 4 ° C.
- Preparare soluzioni (cioè insetto Phosphate-Buffered Saline (iPBS) e iPBS con NH4Cl) presso RT come necessario secondo la tabella 1). Soluzioni caldi a RT prima dell'uso il giorno dell'esperimento.
Nota: iPBS e iPBS con 40 mM NH4Cl può essere preparato in grandi volumi (1 L o più) e conservato a 4 ° C. - Preparare 8 soluzioni di calibrazione in volumi di 500 mL a pH = 5.0, 6.0, 6.5, 7.0, 7.3, 7.6, 8.0 e 9.0, come indicato nella tabella 1 e conservare a 4 ° C. Regolare il pH di ogni soluzione mediante titolazione con N-metil-D-glucamine (NMDG) e HCl.
- Il giorno di esperimenti, caldo aliquote di 5 mL delle soluzioni di taratura a RT e aggiungere soluzione stock Nigericina (20 mM di solfossido dimetilico (DMSO)) per produrre una concentrazione finale di 10 µM.
Attenzione: Maneggiare Nigericina con i guanti. Trattare tutte le apparecchiature che viene a contatto con la Nigericina come USA e getta. Nigericina rimane sul vetro e plastica e comprometterà biologico preparazioni se attrezzature sono stata riutilizzata.
-
Sistema di perfusione:
- Preparare il sistema di perfusione compilando tutti i serbatoi con ddH2O (Figura 2). Aprire i canali uno alla volta per consentire prossimale per il regolatore di portata per riempire tutte le linee.
Nota: Potrebbe essere necessario deselezionare aria nelle linee aprendo il canale in fase di stallo e utilizzando un pistone per unità di flusso dal serbatoio. - 2 canali aperti e consentire ddH2O di scarico. Una volta che i serbatoi sono quasi vuoti, riempire il serbatoio primo con iPBS e il secondo serbatoio con NH4iPBS Cl-pulsato. Impostare la portata al massimo con il regolatore di portata e lasciare che ogni soluzione di fluire per 1 min riempire le linee distale, quindi arrestare il flusso (Figura 2).
- Posizione 2 set di morsetti "helping hands" di saldatura sul palco microscopio imaging. Mettere un morsetto su ciascun lato della piattaforma imaging.
- Riscaldare con attenzione i distale 0,5 pollici di un pezzo di vetro capillare (diametro 1,5 mm, diametro esterno 0,86 mm, lunghezza 100 mm) sopra un bruciatore di Bunsen. Creare una curva a 45 ° consentendo l'estremità distale di piegare dalla forza di gravità e rimozione del vetro dalla fiamma una volta raggiunto l'angolo desiderato. Ripetere questo processo con un secondo pezzo di vetro capillare.
- Inserire i capillari di vetro curvato nella linea di flusso e deflusso vuoto-collegato rispettivamente e montarli in "helping hands" per allinearli con la tappa di formazione immagine del microscopio (Figura 3).
- Preparare il sistema di perfusione compilando tutti i serbatoi con ddH2O (Figura 2). Aprire i canali uno alla volta per consentire prossimale per il regolatore di portata per riempire tutte le linee.

Figura 2: Sistema di perfusione e configurazione di Imaging.
Componenti necessari per la valutazione fisiologica della funzione di trasporto MT basolaterale tramite simultanea vivono scambio di soluzione di imaging e rapido di fluorescenza. Linee di gas indicati sono facoltativi e consentono l'espansione di esperimenti per la valutazione del trasporto HCO3– . Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Schema di flusso dell'apparato di perfusione per NH4Cl Pulse esperimenti.
Le frecce rappresentano percorso di flusso e valvola punti di commutazione. Soluzione si trasferisce dal serbatoio a esemplare di flusso a gravità ed è attirata dalla camera di esemplare la beuta rifiuta di aspirazione di vuoto. Clicca qui per visualizzare una versione più grande di questa figura.
5. dissezione dei tubuli malpighiani anteriore adulto della drosofila .
- Raccogliere il piatto di dissezione e tirato una diapositiva rivestite con PLL dalla sezione 2, un divisore di aspersione-pozzo adesivo, grasso per vuoto, bacchetta di vetro dalla sezione 3, una striscia di 4 x 2" di film di sigillo, 2 paia di #5 fine, forcipe, le aliquote di 40 mL di medium RT iPBS e ghiacciata di Schneider.
- Spalmare grasso vuoto sul nastro sigillante e premere il divisore di aspersione-pozzo adesivo sul nastro per rivestire il fondo con grasso. Staccare l'adesivo divisore di aspersione-pozzo e posizionarlo grasso-side-down sulla cima di una diapositiva rivestita di PLL. Rimuovere il separatore di aspersione-pozzo per lasciare individuali di campione pozzi tracciate nel grasso idrorepellente.
- Posto 200 µ l di RT iPBS in grasso-accerchiato bene sulla diapositiva rivestita PLL e spostare il vetrino sotto lo stereoscopio.
- Posto UAS-Bud/carosso-GAL4 mosche in una Mosca vuota fiala e li anestetizzare il ghiaccio per 10 min.
Nota: Questo metodo di anestesia, a differenza di CO2, assicura che le mosche non disidratare. - Versare mezzo ghiacciato di Schneider nel piatto per dissezione e utilizzare una pinzetta per trasferire una singola Mosca femmina anestetizzata nel piatto sotto uno stereoscopio per dissezione.
- Afferrare al volo il torace con un set di pinze e utilizzare l'altro per afferrare delicatamente la parte posteriore dell'addome. Aprite la parte posteriore al volo utilizzando le pinze in breve, movimenti intenzionali. Una volta visibile del hindgut, afferrare l'estremità distale e libera l'intestino e MTs dal tracheoles sottostante tirando il hindgut lontano dal corpo attraverso rimorchiatori ripetitivi, brevi.
Nota: Il MTs anteriore e posteriore sarà visibile dove si incontra la giunzione del midgut e del hindgut attraverso l'uretere. La prima coppia di MTs a essere libero arbitrio probabile essere tubuli posteriore come circondano il hindgut. Questi possono essere ignorati (Figura 4A). - Pizzico fuori il MTs anteriore all'uretere con una pinzetta, una volta che la seconda serie di MTs è gratuita dell'addome. Consente di separare il MTs anteriore dall'intestino e chiudere l'uretere.
- Prelevamento gratuito MTs anteriore con la bacchetta di vetro tirato facendo scorrere l'asta sotto l'uretere tale che i tubuli si iscrivono su entrambi i lati. Consente di estrarre la soluzione MTs verso l'alto.
- Girare la bacchetta di vetro in modo che la MTs e dell'uretere sono aderiti alla parte inferiore dell'asta e abbassare l'uretere verso il basso nella diapositiva. Appone l'uretere e sigillare le estremità distali del MTs premendo l'uretere giù su vetrino (Figura 4B). Non manipolare il MTs più del necessario. La MTs dovrebbe essere galleggiavano nella soluzione con l'uretere ancorato alla diapositiva.
- Utilizzare la fine fine della bacchetta di vetro delicatamente spazzare ogni tubulo su tutta la superficie di scorrimento. Brace l'asta contro la diapositiva per evitare di schiacciare il tubulo e far scorrere l'asta sopra la parte superiore del tubulo, movimento distale prossimale, per attaccare l'intera lunghezza di ogni tubulo alla superficie della diapositiva rivestite con PLL (Figura 4).
- Posto il divisore di aspersione-pozzo adesivo indietro sulla diapositiva per formare un piccolo fluido-riempita oltre il tubulo montato.
- Posizionare il campione sul tavolino del microscopio. Posizionare l'afflusso e deflusso capillari sopra l'ingresso e l'apertura di uscita della perfusione ben, rispettivamente.
Nota: Se non si desidera una camera aperta di aspersione, il divisore ben può essere lasciato. In questo caso i capillari di afflusso e deflusso possono essere allineati ai lati opposti di un imaging bene.
6. validazione del protocollo e del tubulo Health Imaging
Nota: Il presente protocollo viene eseguito su un microscopio invertito grandangolari epifluorescente con GFP (SEpH) e set di filtri RFP (mCherry) (eccitazione nm 470/40 (ex), 515 nm longpass emissione (em), 500 nm dicroici e 546/10 nm ex, 590 nm longpass em, 565 nm dicroici), un 10 X / 0.45 aria obiettivo, una telecamera monocromatica per la cattura di immagine live e software di imaging. Il protocollo può essere adattato per qualsiasi montante o microscopio invertito con filtro automatico di commutazione tra software GFP e RFP ottica e immagine acquisizione, sebbene possano variare parametri binning, intensità della luce e tempi di esposizione ottimale. In tutte le analisi, l'intensità della fluorescenza deve essere analizzato come intensità di pixel medi della regione di interesse (ROI), dopo sottrazione di sfondo in ogni canale utilizzando un ROI con non contiene alcuna fluorescenza adiacente al segnale ROI.
- Accendere il microscopio, una sorgente luminosa e un sistema di imaging.
- Open software di imaging associato.
- Guardare attraverso l'oculare e regolare manualmente la messa a fuoco fino a quando il lume della MT è chiaramente visibile sotto la luce trasmessa.
- Fare clic sulla scheda "Acquisizione" nel software di analisi di immagine e selezionare "2 x 2" nel menu pull-down "Binning" nella sezione "Modalità di acquisizione".
- Inserire un filtro di densità neutra 5% nel percorso della luce per illuminazione luce di ridurre e minimizzare photobleaching.
- Il canale GFP (SEpH) nel menu "Canali", scegliere "Live" per osservare il segnale fluorescente tramite la fotocamera.
- Regolare il dispositivo di scorrimento per impostare il tempo di esposizione, tale che i valori dei pixel più luminosi nell'istogramma intensità sono circa il 40% del valore massimo di "Tempo", quindi fare clic su "Stop" per interrompere l'illuminazione.
- Ripetere i passaggi 6.6-6.7 nella RFP (mCherry) canale e confermano la presenza del segmento iniziale dilatata della MT anteriore e l'assenza di mCherry citosolico aggrega (indicativo di danno tissutale o sovraespressione) (Figura 4).
Nota: Il segmento dilatato dovrebbe essere chiaramente evidente, come è il segmento più prossimale del tubulo e il diametro del lume interno di questo segmento è superiore a quella del segmento adiacente transitorio di ~ 20 µm. 2 x 2 pixel binning è spesso sufficiente ma può essere aumentata per ridurre ulteriormente l'intensità di illuminazione richiesto. Tempi tipici di esposizione sono tra 150 e 800 ms/canale. Utilizzare come poca luce possibile per ridurre al minimo photobleaching. Ridurre al minimo photobleaching è essenziale per l'uso di indicatori di dual-fluorophore come Bud come i due fluorofori possono candeggina in modo indipendente, invalidando pertanto alcuna operazione di taratura del rapporto. - Abilitare un protocollo di imaging time-lapse cliccando la casella di controllo "Time Series".
- Regolare la "durata" nel menu a discesa nella sezione "Time Series" per 10 min e il dispositivo di scorrimento di "Intervallo" a 0 per impostare il tempo di acquisizione totale con un tasso di acquisizione massima dell'immagine. Una frequenza di acquisizione totale di 0,2 Hz è spesso sufficiente.
- Controllare entrambe le caselle RFP (mCherry) nella sezione "Canali" e GFP (SEpH).
- Aprire la riga di iPBS del sistema aspersione attivando il posizionatore appropriato e avviare il protocollo di formazione immagine facendo clic su "Start esperimento." Dopo 1 min, passare al NH4Cl soluzione di impulso per 20 s aprendo l'apposita valvola e chiudendo la linea iPBS, quindi tornare alla iPBS NH4Cl linea di chiudere e riaprire la valvola iPBS. Consentire il protocollo completo di imaging completare prima di arrestare il sistema di perfusione.
Nota: Time-lapse analisi dovrebbero rivelare un segnale stabile mCherry e un segnale di SEpH che aumenta in presenza di NH4Cl, disseta al dilavamento e recupera gradualmente. - Eseguire una calibrazione a 2 punti.
- Rimuovere il divisore ben da peeling lontano la diapositiva sottostante e rimuovere i capillari di aspersione ed i morsetti dall'imaging bene.
- Applicare l'imaging bene con una pipetta 200 µ l 200 µ l calibrazione iPBS (pH 7.4, 10 µM Nigericina). Rimuovere la soluzione da imaging bene con la pipetta, quindi sostituire con un altro 200 µ l di soluzione di taratura. Ripetere questa operazione 4 volte per garantire lo scambio di soluzione completa.
- Incubare la preparazione in soluzione di calibrazione per 30 min prima di formazione immagine. Ripetere il protocollo imaging utilizzando gli stessi parametri determinati in passaggi 6.6-6.11, con la modifica di solo 1 min di image capture.
Nota: Il sistema di perfusione e capillari non sono necessari in questo passaggio e non devono essere allegati all'imaging bene per evitare di esporre i vasi capillari a Nigericina. - Aggiungere 200 µ l calibrazione iPBS (pH 9.0, 10 µM Nigericina) per l'imaging bene con una pipetta 200 µ l. Rimuovere la soluzione da imaging bene con la pipetta, quindi sostituire con un altro 200 µ l di soluzione di taratura. Ripetere questa operazione 4 volte per garantire lo scambio di soluzione completa.
- Incubare la preparazione della seconda soluzione di calibrazione per 10 min prima di formazione immagine. Ripetere il protocollo imaging come passaggio 6.13.3.
- Esaminare lo stack di immagine catturata nel software di analisi di immagine per confermare che nessun pixel a o canale sono saturi cliccando "Significa ROI" e lo scorrimento anche se lo stack di immagine con il cursore di "Frame" osservando che nessun valori segnalati nell'istogramma intensità raggiungere il massimo valore rilevabile. Se qualsiasi frame contengono pixel che raggiungono la massima intensità rilevabile, ridurre l'intensità di tempo o illuminazione di esposizione e la sezione di ripetizione 6.
Nota: Una volta stabilita non modificare parametri di imaging tra esperimenti o calibrazione senza punto tarature devono essere utilizzati in ogni preparazione (Vedi punto 8.3).
- Analizzare lo stack di immagine per tracciare l'intensità di fluorescenza e rapporto di fluorescenza (SEpH/mCherry) come funzione del tempo.
- Fare clic su "Significa ROI" e selezionare lo strumento forma libera. Tenere premuto il tasto sinistro del mouse per tracciare un ~ 50 µm di lunghezza di MT. Fare clic con il pulsante destro per finire di disegnare il ROI, quindi ripetere in un'area adiacente alla MT per definire uno sfondo ROI (Figura 5A).
- Fare clic su "Media intensità" sotto "Misure." Creare una tabella di valori di intensità facendo clic su "Esporta > tabella dati > creazione."
- Fare clic sull'icona della ruota dentata di configurazione e de-selezionare tutti i parametri ad eccezione di "Time" e "Significa intensità". Pulsante destro del mouse la scheda per la tabella di dati appena creato, selezionare "Salva con nome" ed esportare i dati come file CSV.
Nota: Simile può anche essere misurati utilizzando software libero come ImageJ. - Aprire una tabella di foglio di calcolo e importare la tabella di dati selezionando la scheda "Dati" seguita da "Da testo".
- Utilizzare le funzioni del foglio di calcolo per sottrarre intensitá del Background di SEpH dall'intensità del segnale di SEpH in ogni momento. Ripetere questo processo per il segnale di mCherry.
- Tracciare ogni intensità di canale in funzione del tempo selezionando le colonne contenenti il tempo e dati di intensità sfondo-corretti e quindi facendo clic su "Inserisci > Scatter (grafici) > dispersione con linee dritte" (figura 5B).
- Utilizzare le funzioni di foglio di calcolo per calcolare il rapporto di fluorescenza di SEpH/mCherry in ogni momento.
- Trama di un rapporto di fluorescenza in funzione del tempo selezionando le colonne contenenti i dati di tempo e rapporto e quindi facendo clic su "Inserisci > Scatter (grafici) > dispersione con linee dritte" (Figura 5).
7. pieno calibrazione di Bud in tubuli malpighiani Ex Vivo.
- Sezionare e montare un set fresco di MTs anteriore come descritto nella sezione 5.
- Come descritto nel passaggio 6.13.2 di scambio iPBS per calibrazione iPBS (pH 7.4, Nigericina 10 µM). Incubare per 30 min.
- Individuare il MTs e raccogliere le coppie di immagini di SEpH/mCherry come descritto ai punti 6.1-6.11. Sostituire la soluzione con un altro stock di calibrazione iPBS come descritto nel passaggio 6.13.4, attendere 10 minuti e ancora l'immagine. Ripetere questo processo fino a quando il rapporto di SEpH/mCherry è stato ripreso in tutte le soluzioni. Ottenere pH 9,0 immagini ultimo appena l'esemplare raramente riprende dal pH elevato.
- Stampa rapporto di fluorescenza di SEpH su mCherry da tarature in otto esemplari in funzione del pH impostoio come descritto nel passaggio 6.14.9. Adattare i dati di calibrazione con una curva di Boltzmann per ottenere la funzione di calibrazione completa secondo l'equazione 1 (Figura 5). Se i dati non sono coerenti, trama set di calibrazione da ogni campione normalizzato tale che un rapporto di fluorescenza di 1.0 corrisponde al pHi 7.0 e rianalizzare (Figura 5E).
Nota: Se il processo di quest'ultimo è necessario singoli esperimenti saranno necessario proprio punto interno calibrazioni33 (vedi procedura di quantificazione qui sotto (punto 8.3)). -
Equazione 1

Dove R = rapporto di SEpH/mCherry e un1,2, xoe dx è curva raccordo parametri che rappresenta il rapporto minimo di fluorescenza, fluorescenza massima ratio, pKune larghezza della funzione rispettivamente. xo = apparente pKuna di Bud, che può variare da 7.1 a 7.4 a seconda del tipo di cella e condizioni di taratura esatta.
8. quantificazione dell'acido Basolateral estrusione dal Epithelia anatomista Ex Vivo .
- Le cellule stellate esprimendo la Bud immagine e principal Bud-esprimendo cellule simultaneamente.
- Sezionare anteriore MTs da una Mosca UAS-Bud/carosso-GAL4 come descritto nella sezione 5, ma non trasferire MTs da mezzo di Schneider dissezione per l'imaging bene.
- Sezionare anteriore MTs da una Mosca UAS-Bud/c724-GAL4 nello stesso piatto per dissezione utilizzando la procedura descritta nella sezione 5.
- Trasferire il 2 set di MTs nell'imaging stesso così come descritto nei passaggi 5.8-5.11.
Nota: Quando spazzare le braccia del MTs giù per la diapositiva, posizionare il MTs di UAS-Bud/c724-GAL4 e i tubuli UAS-Bud/carosso-GAL4 vicino a vicenda così Bud-esprimendo le cellule principali e stellari possono essere visualizzate nel campo stesso ( Figura 6A).
- Applicare il NH4Cl prepulse come descritto nel passaggio 6.12.
Nota: Se coerenza taratura (Figura 4B) non poteva essere raggiunti, eseguire una calibrazione a punto impostando pHi a 7.0 alla fine di ogni esperimento con calibrazione iPBS (pH 7.0, 10 µM Nigericina, incubazione di 30 min) dopo l'adesivo divisore di aspersione-pozzo e l'apparecchiatura di perfusione sono stati rimossi. - Calibrare le tracce da cellule stellate e principale dei diversi segmenti di MT (usando il rapporto assoluto o normalizzato a seconda dei casi) con 2 equazione e analizzare la fase di recupero dopo NH4Cl ritiro applicando funzioni di decadimento esponenziale utilizzando software di analisi statistica e notando la costante di decadimento (τ) (Figura 6B).
Equazione 2
Dove R = rapporto di SEpH/mCherry e un1,2, xoe dx è curva raccordo parametri determinati dalla taratura al punto 7.4 (equazione 1).- Calcolare il tasso di acido estrusione (JH +, Vedi equazione 3) in funzione del pH per tener conto delle variazioni nel pHio e caricamento tra preparazioni34acido di riposo. Utilizzare le funzioni esponenziali derivate nel passaggio 8.3 per calcolare la derivata del pH per quanto riguarda il tempo in ogni intervallo di tempo.
Equazione 3
- Calcolare la capacità intrinseca di tampone (βi; Equazione 4) del citosol al pHho fin dall'inizio di ogni intervallo nel passaggio 8.3.1 basata sulla letteratura precedente (Vedi equazione 4).
Nota: In Drosophila, la più approfondita caratterizzazione del β proviene da larvale del nervo motore terminali35 e questi dati possono essere presupposti per tenere per le celle di MT in assenza di altri dati disponibili.
Equazione 4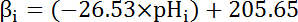
- Calcolare il prodotto di βT (dal punto 8.3.2)e dpHho/dt (dal punto 8.3.1) per determinare JH + (equazione 3).
Nota: Nelle soluzioni di dimensioni nominali privo di bicarbonato come quelli descritti nel presente protocollo, capacità tampone bicarbonato-derivato (βb) è considerato ~ 0 mM. Totale tampone (βT) è la somma del βio eβbe quindi βio = βT in assenza di HCO3–Co236. - Trama JH + in funzione del pH all'inizio di ogni intervallo di tempo, come illustrato nel passaggio 6.14.9.
- Applicare le funzioni di decadimento esponenziale alla porzione di tutti i set di dati che si sovrappongono in pHho utilizzando software di analisi statistica. Confronta i tassi di variazione delle funzioni risultante per confrontare i tassi di acido estrusione tra cellule e segmenti di MT (Figura 6).
Nota: La funzione più appropriata utilizzata per adattamento della curva non può essere sempre un singolo esponenziale. Altre funzioni possono essere sostituiti se migliorano la qualità della misura. - Acido di calcolare in funzione del pH per tener conto delle variazioni in forma e dimensioni della cella di flusso (Vedi equazione 5).
Equazione 5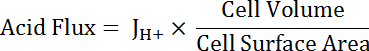
Nota: Dimensioni della cella possono essere misurate direttamente in immagini o approssimate. Cellule principali possono essere rappresentate come metà di un tubo cavo con le seguenti dimensioni: diametro interno 24 µm; diametro esterno 48 µm; altezza 50 µm. transitorio cellule stellate sono variabili, ma possono essere rappresentate approssimativamente come cilindri con altezze di 50 µm e diametri di 10 µm. Si veda il paragrafo finale di Rappresentante risultati qui sotto. - Applicare le funzioni di decadimento esponenziale alla porzione di tutti i set di dati che si sovrappongono al pHho utilizzando software di analisi statistica. Confronta i tassi di variazione delle funzioni risultante da confrontare acidi flussi tra le cellule e segmenti di MT (Figura 6).
- Calcolare il tasso di acido estrusione (JH +, Vedi equazione 3) in funzione del pH per tener conto delle variazioni nel pHio e caricamento tra preparazioni34acido di riposo. Utilizzare le funzioni esponenziali derivate nel passaggio 8.3 per calcolare la derivata del pH per quanto riguarda il tempo in ogni intervallo di tempo.
Risultati
Tessuti sani e un'adeguata identificazione del MTs anteriore sono vitali per il successo del presente protocollo. Durante la dissezione, dovrebbe prestare attenzione a non direttamente tocco il MTs e maniglia unica loro dall'uretere come la MTs di presa direttamente porterà alla rottura (Figura 4A– B). Quando MTs sono spazzate piatta sulla diapositiva, i tubuli devono essere toccati il meno possibile e movimento in eccesso evitato come questo danneggia lo strato epiteliale di singola cellula (Figura 4). Adeguatamente sezionato MTs anteriore mostrerà la distribuzione uniforme della fluorescenza sia rosso che verde attraverso il cytosol delle cellule epiteliali e segmenti tubulo morfologicamente distinte. Tubuli danneggiati tramite aspersione improprio o cattiva gestione visualizzerà l'aggregazione di fluorescenza rossa con non aggregati verde accoppiati, e identificato erroneamente posteriore MTs mostrerà morfologia uniforme dall'estremità prossimale cieco nell'uretere distale (Figura 4) .
Deve essere confermata la funzione adeguata di Bud valutazione fisiologica però così come morfologia. Il metodo più vantaggioso di confermare il corretto rilevamento del pH è di applicare un NH4Cl impulso. In queste condizioni il SEpH verde segnale dovrebbe segnalare le variazioni di pH previsto (un aumento del pH durante l'impulso come NH3 entra nella cellula, un declino graduale durante l'impulso come NH4+ entra attraverso i trasportatori K+ e canali e una rapida acidificazione e graduale recupero su NH4Cl ritiro21, mentre il segnale rosso mCherry deve rimanere costante (Figura 5A– B). La grandezza dei cambiamenti nel segnale SEpH varierà con protocollo e tipo di cella, ma il segnale di mCherry dovrebbe essere stabile in tutti i casi. Cambiamenti nel segnale mCherry durante gli esperimenti individuali indicano artefatti di movimento o progressiva generazione di aggregati di sensore a causa di danno delle cellule. Quest'ultimo impedirà la quantificazione del pHsono e dovrà essere evitato. Dopo aver completato il NH4Cl impulso è importante eseguire una calibrazione a 2 punti (calibrazione iPBS, pH 7,4 e 9.0, 10 µM Nigericina) per confermare un riposo pHio vicino a 7,4 e garantire che i parametri di imaging correnti non portino a saturazione di rilevazione della fluorescenza quando fluorescenza è ingrandita a pH 9.0 (Figura 5). Se pH a riposo è significativamente inferiore a 7.4, il protocollo deve essere ripetuto con MTs sano; e in caso di saturazione a pH 9.0, il protocollo deve essere ripetuto con tempi di esposizione o intensità luce inferiori. Una volta adeguati parametri di imaging sono determinati, devono non essere modificate tra esperimenti o calibrazioni se i rapporti di fluorescenza assoluta sono da utilizzarsi. Mentre la natura di pseudo-raziometrici di Bud può fornire un metodo di correzione di movimento nelle preparazioni soggette a movimento o a cambiamenti di diametro delle cellule, la quantificazione assoluta del pH richiede completa sistematica correlazione di Bud SEpH / mCherry rapporto al pHho attraverso la tecnica di K+ Nigericina/alto. La calibrazione di Bud in preparazioni sani dovrebbe produrre curve di calibrazione coerente con un'apparente pKun 7.1-7.4 a seconda delle condizioni di tipo e calibrazione del cellulare (Figura 5). Per le preparazioni in cui mCherry aggregazione è inevitabile, normalizzazione dei valori del rapporto tale che un rapporto di fluorescenza di 1.0 corrisponde al pHho 7.0 dovrebbe dare risultati simili (Figura 5E). Se vengono utilizzate punto calibrazioni e curve normalizzate, parametri di imaging può essere ottimizzata per ogni preparazione.
Calibrazione pHho tracce possono essere utilizzate per confrontare il meccanismo regolatore pH tra tipi cellulari. Il sistema di espressione GAL4/UAS in Drosophila può essere utilizzato per esprimere Bud in cellule principali e le cellule stellate della MT anteriore (Figura 6A). regolazione del pH può essere valutato dalle cellule acido-caricamento con NH4Cl impulsi e quantificare il tasso di recupero di pHio . Questo può essere realizzato inserendo funzioni esponenziali per la fase di recupero in diverse condizioni sperimentali per estrarre la costante di decadimento (τ) cellule con più rapido deflusso H+ visualizzarà una ripresa più rapida (e quindi più bassi valori di τ). Sulla base di questa analisi, le cellule stellate della MT sembrano estrusione acido più robusto rispetto alle cellule principali (Figura 6B). Questa analisi si terrà come il riposo pHio, misura di carico acido e capacità tampone sono simili tra i gruppi sperimentali. Tuttavia, quando queste condizioni non sono soddisfatte, è necessario tenere conto per l'osservazione che l'intrinseca capacità tampone del citosol (βi) di molte cellule è esso stesso dipendente dal pH35,37,38 e così il tasso di pHho cambiamento a diversi pHi non può essere direttamente confrontabili. In tali casi, curve esponenziali adattano alla seguente fase di estrusione acido un NH4Cl impulso e stime precedentemente determinate di intrinseca capacità tampone (βi) utilizzabile per tracciare il tasso di acido estrusione (JH +) come una funzione del pHio e determinare compensata tasso di estrusione acido (equazioni 3 & 4). Una volta che le differenze in acido caricamento e riposo pHmi sono contabilizzate, è evidente estrusione acido nelle cellule principali del segmento transitorio superare quello delle cellule stellari (Figura 6). Mentre avvincente, questa analisi non considera che misurato pHho è una funzione del volume, mentre acido estrusione attraverso la membrana plasmatica è una funzione della superficie della membrana. Dividendo JH + per la superficie in rapporto al volume della cella di interesse produrrà valori in moli di acidi equivalenti per unità di superficie per unità di tempo (equazione 5), consentendo la correzione per le differenze nella morfologia e dimensioni della cella. Circa due cellule principali comprendono la circonferenza della MT nei segmenti transitori e così singole cellule possono essere modellate come la metà di un tubo (diametro esterno 48 µm, diametro interno 24 µm; altezza 50 µm). Le cellule stellate sono più piccole e tendono ad essere a forma di barra nel segmento transitorio di MT2. Esatta quantificazione della superficie e volume è difficile ma anche conservatore approssimazioni di forma di transizione delle cellule stellate (cilindro con un'altezza di 50 µm e un diametro di 10 µm) indicano una superficie in rapporto al volume almeno 2 x quello delle cellule principali. Tenendo conto di questo rivela che il disossidante acido cellula stellate è significativamente di sotto di quello delle cellule principali transitorie e in realtà si avvicina a quello delle cellule principali del segmento iniziale (Figura 6).

Figura 4: Dissezione dei tubuli malpighiani anteriore adulto della drosofila .
A. rappresentazione schematica dell'anteriore rimozione MT con 2 paia di una pinzetta in mezzo di Schneider refrigerati. "R. tubulo" = anteriore MT. "P. del tubulo" = posteriore MT. B. Processo di recupero e di montaggio estratti MTs utilizzando canne di vetro sottile. C. processo di aderire l'intera lunghezza di estratti di MTs a una diapositiva per la valutazione fisiologica e imaging. D. rappresentante widefield immagini del SEpH (470/510 nm ex / em) e mCherry (556/630 nm ex / em) componenti di UAS-Bud guidato da Carosso-GAL4 raffigurante sano anteriore MTs, MTs anteriore danneggiati dall'insufficiente perfusione, e Nota MTS. erroneamente identificato posteriore che anteriore sano MTs visualizzare un chiaro dilatato cieco segmento iniziale, un ristretto segmento di transizione con relativamente aumentata espressione di UAS-Bud quando guidato da Carosso-GAL4e una portata principale distale segmento. Danneggiato MTs display evidenti aggregati di fluorescenza mCherry senza fluorescenza SEpH corrispondente. Posteriore MTs sono uniformi in diametro con nessun morfologicamente distinti segmenti. Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Validazione e calibrazione di Bud in tubuli malpighiani.
A. rappresentante widefield immagini del SEpH (470/510 nm ex / em) e mCherry (556/630 nm ex / em) componenti di UAS-Bud guidato da Carosso-GAL4 raffigurante MTS. anteriore sano "ROI" marchi segnale regione di interesse. "BG" segni sfondo regione di interesse che successivamente è stato sottratto il segnale ROI nello stesso canale. Barra della scala = 50 µm. B. Cambiamenti di fluorescenza relativa nei segnali SEpH e mCherry di Bud in risposta a un 20 s 40mm NH4Cl impulso. Si noti che il segnale di mCherry è stabile, mentre il segnale di SEpH Visualizza un aumento caratteristico durante l'impulso (indicativo di alcalinizzazione, cioè aumentato pHio) e una forte diminuzione su washout (indicativo di acidificazione, cioè è diminuito pHho). C. rapporto di fluorescenza di Bud (SEpH/mCherry) calcolato dai dati in B con dati aggiuntivi dopo incubazione di 30 min in calibrazione iPBS (10 µM Nigericina, 130 mM K+, pH 7,4 e 9.0). D. curva di taratura costruita dal rapporto assoluto Bud (SEpH / mCherry) come una funzione del pHho imposto durante l'esposizione a calibrazione iPBS tamponato a uno degli otto valori di pH. Cerchi grigi sono i singoli valori modulo 8 preparati. Quadrati neri e i bar sono media ± SD. curva è misura di Boltzmann. E. dati stessi come D normalizzati tali quel rapporto di fluorescenza a pH 7.0 è 1.0. Curva viene modificata la curva sigmoidale (Vedi punto 7.4, equazione 1). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Quantificazione dell'acido espulsione in Epithelia anatomista.
A. immagine Widefield di SEpH fluorescenza (da Bud) in cellule principali della MT anteriore (sinistra, guidato da Carosso-GAL4 driver) e le cellule stellate della MT anteriore (destra, guidato da c724-GAL4). Notare che le cellule stellate sono a forma di barra nel segmento iniziale, variabile nel segmento transitorio e visualizzare proiezioni cellulari distinte nel segmento principale. Barra della scala = 100 µm. B. Calibrato le variazioni del pH in risposta a un 20 s 40mm NH4Cl impulso nelle regioni di interesse denotato in (cellule principali del segmento di transizione, cellule principali del segmento iniziale e le cellule stellate del segmento transitorio). Le curve tratteggiate indicano singoli si inserisce esponenziale applicato per la fase di recupero acido seguendo NH4Cl ritiro da cui sono derivati dichiarato decadimento costante (τ) valori. C. velocità di estrusione acido (JH +) tracciata come una funzione pHi derivati dall'esponenziale si adatta visto in B. Vedere il punto 8.3.1 per JH + calcolo (equazione 3). Le curve tratteggiate sono esponenziale si adatta applicato a ogni trama di dati all'interno dell'area di sovrapposizione pHho denotato la casella grigia. D. flusso acido tracciata come una funzione pHi derivati dall'esponenziale si adatta visto in B e 5 di equazione. Le curve tratteggiate sono esponenziale si adatta applicato a ogni trama di dati all'interno dell'area di sovrapposizione pHho denotato la casella grigia. Clicca qui per visualizzare una versione più grande di questa figura.
| iPBS | NH4Cl Pulse iPBS | Calibrazione iPBS | |
| NaCl | 121,5 | 81,5 | 0 |
| NH4Cl | 0 | 40 | 0 |
| KCl | 20 | 20 | 130 |
| Glucosio | 20 | 20 | 20 |
| Buffer | HEPES; 8.6 | HEPES; 8.6 | MES, HEPES o rubinetti; 8.6 |
| NaHCO3 | 10,24 | 10,24 | 0 |
| NaH2PO4 (1 H2O) | 4.5 | 4.5 | 0 |
| NMDG | 0 | 0 | 30,5 |
| pH | 6.8 | 6.8 | Varia |
| Osmolarità | 350 ± 5 | 350 ± 5 | 350 ± 5 |
Tabella 1: Soluzioni sperimentali di volare.
iPBS soluzioni vengono preparate a temperatura e pH viene impostato mediante titolazione con HCl e NaOH. Soluzione di calibrazione è titolata con HCl e NMDG. Buffer della soluzione di taratura è varia basata su pH desiderato [2-(N-morfolino) ethanesulfonic acido (MES) per pH = 4.0-6.0; 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acido (HEPES) per pH = 6.5-7.5; N-[tris (idrossimetil) metil] -3-aminopropanesulfonic acido (rubinetti) per pH = 8.0-9.0]. Tutti i valori in mM, ad eccezione di pH (senza unità) e l'osmolalità (mmol/kg). Stock Nigericina in DMSO è aggiunto alle soluzioni di calibrazione a una concentrazione finale di 10 µM appena prima dell'uso.
| GEpHI | Eccitazione (nm) | Emissione (nm) | pKun | Note |
| Superecliptic pHluorin (SEpH)11 | 395, 488 | 530 | 7.2 | Vasta gamma lineare, grande piega (50x) aumento della fluorescenza pH sensibili in gamma lineare |
| PT GFP42 | 390, 475 | 540 | 7.3 | Convalidato per l'uso nelle cellule vegetali |
| Superecliptic pHluorin - mCherry fusione31 | 488, 556 | 530, 620 | 7.2 | Aggregati di spaiato mCherry produce in alcune cellule |
| ClopHensor40 | 488, 545 | 525, 590 | 6.8 | pH e Cl– sensore. Aggiornato il ClopHensorN30 varient Mostra meno aggregazione in neuroni |
| Bud10 | 488, 556 | 530, 620 | 7.2 | Aggiornato SEpH-mCherry fusione con linker da ClopHensor |
| mNectarine44 | 558 | 578 | 6.9 | Spesso è necessaria una correzione per photobleaching |
| pHluorin245 | 395, 475 | 509 | 6.9 | Variante di raziometrici pHluorin12 |
| pHred47 | 440, 585 | 610 | 7,8 | Aggiornato varient di lungo-Stokes shift mKeima49, compatibile con immagini da 2-fotone FLIM NIR |
| pHuji43 | 566 | 598 | 7.7 | Varient di mApple; sensibilità di pH previsto in alcune cellule inferiori al |
| pHtomato46 | 550 | 580 | 7,8 | Convalidato per tenere traccia di endocitosi vescicolare, cytocolic scarsa sensibilità di pH |
| pHoran443 | 547 | 561 | 7.5 | Migliorata sensibili al pH della proteina fluorescente arancia |
| SypHer-248 | 427, 504 | 525 | 8.1 | Variante più luminoso del raziometrici SypHer51, originariamente per misurazioni mitocondriale |
Tabella 2: Elenco delle pubblicato GEpHIs citosolico
Maxima di eccitazione, emissione maxima e apparenteKun valori di p sono approssimative e possono variare a seconda del sistema di espressione, tecnica di imaging e metodo di calibrazione. FLIM = durata di fluorescenza imaging microscopia. NIR = vicino infrarosso.
Discussione
Il successo di quantificazione del pHsono in Drosophila MTs dipende interamente sulla salute degli estratti MTs e la qualità del montaggio e la dissezione (Figura A – C). Così, la gestione attenta del tessuto come descritto è imperativa. Diapositive appena rivestiti in PLL sostanzialmente aiuti MT di montaggio, come essi tendono ad essere molto più adesivo di diapositive che precedentemente sono stati esposti alla soluzione. Montaggio attenzione sarà di aiuto anche nell'identificazione di segmenti distinti MT (Figura D). MTs sano facilitare la taratura di Bud e valutazione funzionale riducendo l'aggregazione mCherry e producendo molto più coerente quantificazione dell'acido estrusione, rispettivamente. In alcuni casi, evitando mCherry aggregazione non è possibile poiché le condizioni sperimentali intrinsecamente possono danneggiare epiteli MT o produrre significativi sovra-espressione del reporter fluorescente. In questi casi, una calibrazione di pseudo-raziometrici normalizzato tale rapporto di fluorescenza 1.0 corrisponde al pHho 7.0, e punto calibrazioni permetterà di quantificazione (Figura E). Deve prestare attenzione quando eseguire tarature di punto per evitare di esporre gli elementi permanenti dei sistemi di imaging e perfusione Nigericina come lo ionoforo aderirà a vetro e plastica. Non è possibile per le circostanze in cui una manipolazione sperimentale induce danno cellulare durante un esperimento, anche pseudo-raziometrici calibrazione cioè questo danno causerà un progressivo apparente aumento di fluorescenza mCherry in tutto l'esperimento. In questi casi successivi, il segnale di fluorescenza di SEpH può essere utilizzato con una curva di calibrazione normalizzato e punto tarature, con l'avvertenza che l'imaging non è più corretto per artefatti di movimento e turni di focali.
GEpHIs trasportare parecchie limitazioni generali rispetto alla quantificazione del pH con le tinture fluorescenti. Ritenzione di tintura può essere utilizzato come un indicatore della membrana delle cellule e integrità salute39, ma nessun dosaggio equivalente è disponibile per l'utilizzo di GEpHIs. Come tale, la salute di preparazione deve essere monitorata attraverso mezzi indipendenti se danno delle cellule è preveduta per confondere i risultati. GEpHIs potenzialmente consentire a formazione immagine dalle preparazioni minimamente disturbato in vivo ma l'integrità del tessuto intrinsecamente limita manipolazioni sperimentali e possa fare punto calibrazioni impossibile. Un'altra limitazione specifica insita nell'utilizzo di Bud e altri indicatori di pH citosolico fluoroforo dual (ad esempio ClopHensor40) deriva dalla tendenza dei due fluorofori per alterare la loro fluorescenza indipendentemente da uno a altro e il pHi . RFP aggregazione manufatti sono la manifestazione più significativa di questa limitazione, ma la quantificazione può essere compromessa anche da photobleaching di fluorofori uno o entrambi. Così, protocolli di imaging molto essere regolata per ridurre al minimo photobleaching, che può portare a tempi di esposizione lunghi e tassi di acquisizione < 0.2 Hz. lunghi tempi di esposizione non riuscirà a segnalare pH rapidami sposta. SEpH fluorescenza mostra correlazione lineare a pHho da pH 6,8-7,8 nella maggior parte delle preparazioni, ma la precisione di queste misure dipende dalla precisione della tecnica K+ Nigericina/alto. Nigericina agisce come un ionoforo/h K++ e calibrazione corretta si basa su equilibrare extracellulare [K+] con intracellulare [K+]. Le stime di intracellulare [K+] non sono disponibili o facilmente reperibili per tutti i sistemi sperimentali. Precisione di quantificazione di pHsono solo sarà affidabile come stime di intracellulare [K+], anche se i tassi di cambio relativo al pHho sarà coerenti. Data questa limitazione e la relazione inversa logaritmica del pH intracellulare [H+], è sempre preferibile ai dati del report come tassi di variazione pHio, tasso di estrusione acido (JH +, Figura 6), o acido flusso (Figura 6) piuttosto che variazioni assolute al pHio. Analisi dei dati come flusso acido ha il beneficio aggiunto di correzione per le differenze di superficie sono in rapporto al volume tra tipi cellulari.
Diversi aspetti devono essere apprezzati quando interpretazione dati dall'adulto volano preparazione MT descritti nel presente protocollo. La distinzione morfologica di iniziali, transitorio e segmenti principali è probabilmente una semplificazione della vera diversità di domini funzionali e genetiche presenti in MTs2. Inoltre, mentre questo protocollo è progettato per rilevare la funzione dei trasportatori acido basolaterale è possibile che il trasporto apicale può influenzare misure di pHi pure. Gli ureteri di tenuta quando la MTs (passo 5,9) di montaggio assicura quello scambio di soluzione principalmente si verifica sulla superficie basolaterale ma movimento apicale e para-cellulare degli ioni ancora può influenzare pHi come basolaterale trasporto in definitiva altera il lato citoplasmico del lumen/citosolico gradienti ionici. Separazione assoluta di apicale e basolaterale funzione può essere eseguita in modo indipendente che irrora il luminal e basolaterale superfici di MT, ma tali metodi sono sostanzialmente più tecnicamente impegnativo dato che richiedono l'inserimento di una canula micropipetta41 .
GEpHIs presentano molti vantaggi rispetto ai metodi convenzionali di misurazione pH, e questi punti di forza sono amplificati quando combinato con la malleabilità genetica e basso costo della preparazione della drosofila MT. Quantificazione del pH storicamente ha fatto affidamento su coloranti fluorescenti quali (2',7'-Bis-(2-Carboxyethyl)-5-(and-6)-Carboxyfluorescein (BCECF)22 o valutazione elettrofisiologica complicati tramite elettrodi iono-selettivi20 ,21. Come Bud è geneticamente codificato, può essere espressa in specifiche popolazioni cellulari di promotori specifici (come dimostrato qui in cellule principali e le cellule stellate della MT, Figura 6) e più suscettibile di utilizzare in qualsiasi tessuto soggette a transgenesi, transfezione, o un'infezione virale-mediata. Coloranti sono limitati dal costo delle singole preparazioni e i protocolli di applicazione potenzialmente complicata che non trasmettono nessuna specificità delle cellule nei tessuti eterogenei. Elettrodi iono-selettivi richiedono attrezzature specializzate per la lavorazione e misurazione, mentre Bud richiede solo widefield epifluorescente microscopia con convenzionale GFP e RFP filtrare i set. Uso di coloranti ed elettrodi richiede fisico così come accesso ottico al tessuto di interesse mentre GEpHIs può essere monitorato in tessuti appena estratti e nel corso del tempo in vivo. L'opportunità per l'imaging dal vivo nelle preparazioni intatti è di particolare interesse quando valutare la fisiologia cellulare diho del pH come nessun altra tecnologia permette la quantificazione del pH in presenza di buffer endogeno meccanismi.
La preparazione di MT adulta di Drosophila presenta molte caratteristiche interessanti per chi è interessato nel trasporto di regolamento e dello ione di pH cellulare. Allevamento di Drosophila è poco costoso e strumenti quali costrutti di biosensore geneticamente codificato e inserti di espressione di RNAi sono prontamente disponibili da una varietà di centri d'archivio (Bloomington Drosophila Stock Center presso l'Indiana University; Vienna centro di ricerca di Drosophila ). Drosophila MTs sono composti da un singolo strato di cellule epiteliali polarizzate, che li rende ideali per le indagini di trasporto ionico transepiteliale. Basolaterale trasporto può essere facilmente analizzato (come dimostrato qui) ma la valutazione completa di apicale e basolaterale ione movimento è possibile con una micropipetta incannulazione41. Inoltre, la funzione dell'organo saggi come il Ramsay secrezione dosaggio17 e la deposizione di luminal di ossalato di calcio18 sono ben caratterizzati e consentire la correlazione della fisiologia cellulare epiteliale a modelli di secrezione fluida e nefrolitiasi, rispettivamente. Mentre queste funzionalità offrono opportunità per analisi robusta, la low-cost e ampia disponibilità di microscopia epifluorescente rende il modello di Drosophila MT ideale per dimostrazioni di fisiologia cellulare e intero-organo in laboratori didattici.
Padronanza di questi metodi consente quantificazione di regolazione del pHho basolaterale H+ flux in adulto Drosophila MTs, un accessibile ma robusto modello dello ione transepiteliale di trasporto. Uso di GEpHIs come Bud può essere facilmente adattato per valutarei regolazione del pH in altri tipi cellulari invertebrati marini, coltivate le cellule di mammiferi e preparati in vivo . Lo sviluppo di nuove GEpHIs probabilmente seguirà quella di indicatori geneticamente codificato del calcio, con le nuove generazioni che coprono lo spettro visibile e affrontare le attuali limitazioni come aggregazione artefatti30,42, 43 , 44 , 45 , 46 , 47 , 48 , 49. GEpHIs già sono stati ampiamente utilizzati per segnalare la matrice mitocondriale pH50,51, e strategie di targeting subcellulare esistono per localizzare biosensori al reticolo endoplasmatico52, nucleo 53, vescicole sinaptiche12,43e la citoplasmico54 e superfici esterne della membrana plasmatica cellulare55 (per un elenco dei reagenti pubblicati, vedere tabella 2 ). Come tali strumenti diventano disponibili sarà permesso integrazione verticale di regolazione pH sub-cellulare con altri aspetti della fisiologia cellulare, ad esempio Ca2 + gestione e segnalazione intracellulare e la funzione dell'organo intero attraverso una varietà di vertebrati e preparazioni di invertebrati marini.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato da NIH DK092408 e DK100227 al fabbricante AJR è stata sostenuta da T32-DK007013. Gli autori desiderano ringraziare Dr. Julian A.T. Dow per la carosso-GAL4 e c724-GAL4 scorte di Drosophila . Ringraziamo anche Jacob B. Anderson per assistenza mantenendo sperimentale croci volare.
Materiali
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
Riferimenti
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151 (2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68 (2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. . Fly pushing: the theory and practice of Drosophila genetics. , (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202 (2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897 (2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7 (2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon