Method Article
Óptica pH cuantificación de intracelular en epitelios de túbulos de Malpighi de Drosophila melanogaster con fluorescentes genéticamente codificado pH indicador
En este artículo
Resumen
Transporte iónico celular a menudo puede evaluarse mediante el control de pH intracelular (pH). Genéticamente codificada pH-indicadores (GEpHIs) ofrecen cuantificación óptica de pH intracelular en las células intactas. Este protocolo detalla la cuantificación de pH intracelular a través de celular ex vivo vivo-proyección de imagen de los túbulos de Malpighi de la Drosophila melanogaster con pHerry, un pseudo-radiométrica genéticamente codificada en indicador de pH.
Resumen
Transporte iónico epitelial es fundamental para la homeostasis de iones sistémica así como el mantenimiento de gradientes electroquímicos celulares esenciales. PH intracelular (pH) está influenciado por muchos transportadores de iones y así control de pH es una herramienta útil para evaluar la actividad de transportista. Moderno codificado genéticamente pH-indicadores (GEpHIs) ofrecen cuantificación óptica de pH en las células intactas a escala celular y subcelular. Este protocolo describe la cuantificación en tiempo real del pH celular Reglamento en túbulos de Malpighi (MTs) de Drosophila melanogaster por ex vivo vivo-proyección de imagen de pHerry, un pseudo-radiométrica GEpHI con un pKun adecuadas para el seguimiento de los cambios de pH en el citosol. Mosca adulta extraída MTs se componen de secciones morfológicamente y funcionalmente distintas de epitelios capa unicelular y pueden servir como un modelo accesible y genéticamente manejable para la investigación del transporte epitelial. GEpHIs ofrece varias ventajas sobre los convencionales tintes fluorescentes sensibles a pH y electrodos ion-selectivos. GEpHIs puede etiquetar poblaciones celulares distintas siempre elementos promotor apropiado están disponibles. Este etiquetado es particularmente útil en ex vivo, en vivoy en situ preparados, que son inherentemente heterogéneos. GEpHIs también permiten la cuantificación de pHi en tejidos intactos en el tiempo sin necesidad de externalización de tratamiento o tejido tinte repetidas. El principal inconveniente de GEpHIs actual es la tendencia a agregar en inclusiones citosólicas en respuesta al daño tisular y construir sobre expresión. Estas deficiencias, sus soluciones y las ventajas inherentes de GEpHIs se demuestran en el presente Protocolo mediante la evaluación del transporte de protones (H+) basolateral en células principales y radiadas funcionalmente distintas de mosca extraído MTs. Las técnicas y análisis descritos son fácilmente adaptables a una amplia variedad de vertebrados e invertebrados preparados y la sofisticación del análisis puede ampliarse desde laboratorios a intrincados determinación del flujo de iones a través de transportadores específicos de enseñanza.
Introducción
El objetivo de este protocolo es describir cuantificación de pH intracelular (pHi) utilizando un genéticamente codificado-indicador de pH (GEpHI) y demostrar cómo este método puede utilizarse para evaluar transporte basolateral H+ un insecto modelo (D. melanogaster) estructura renal, los túbulos de Malpighi (TM). MTs sirven como los órganos excretores de la mosca de la fruta y son funcionalmente similares a la nefrona mamífera en varios aspectos clave1. MTs se arreglan como 2 pares de túbulos (anteriores y posteriores) en el tórax y el abdomen de la mosca. El sola célula epitelial tubo de cada MT está compuesto por metabólicamente activas principales células con distinta apicales (luminal) y basolateral (hemocoel) polaridad así como células radiadas intercaladas. Anteriores MTs se componen de 3 morfológico, funcional, y con distintos segmentos, en particular la inicial dilatada segmento, segmento de transición y secretor principal segmento, que une el uréter2. En la escala celular transporte trans epitelial ion en el lumen se logra por una membrana plasmática apical V-ATPasa3 y un intercambiador+ de álcali-metal/H así como un basolateral Na+-K+-4de la ATPasa, hacia adentro-rectificador K+ canales5, Na+-conducido Cl−/HCO3− intercambiador (NDAE1)6y Na+-K+-2 Cl− cotransporter (NKCC; Ncc69)7, mientras que células radiadas median Cl– y agua transporte8,9. Este sistema fisiológico complejo pero accesible ofrece excelentes oportunidades para la investigación de mecanismos de transporte iónico endógeno cuando se combinan con los diversos conjuntos de herramientas genéticas y de comportamiento de Drosophila.
La justificación de este protocolo fue describir un sistema genéticamente maleable para el estudio de transporte iónico epitelial con potencial para la integración de la célula de a conducta y exportación de herramientas para otros sistemas modelo. Expresión de pHerry10, un GEpHI derivada de una fusión de verde pH-sensible Super eclíptica pHluorin11,12 (SEpH) y rojo mCherry insensible pH13, MTs permite la cuantificación del transporte de H+ en MT las células a través de la alta K+/nigericin calibración técnica14. Medida que muchos transportadores de iones equivalentes de H+ , cuantificación de pH intracelular sirve como una representación funcional de movimiento de iones a través de una variedad de transportadores. El sistema de modelo de Drosophila MT también ofrece potentes herramientas genéticas en tejidos específicos del transgén15 y RNA de interferencia (ARNi)16 expresión, puede combinarse con la proyección de imagen de celular y todo órgano ensayos17 , 18 , 19 de la función del túbulo para crear un sólido conjunto de herramientas con integración vertical de las moléculas al comportamiento. Esto contrasta con muchos otros protocolos para evaluar biología epitelial, como históricamente tales medidas han confiado en el intrincado y difícil electrodos ion-selectivos micro disección, sofisticado20,21, y caro pH-sensible tintes22 con requisitos de carga restrictiva y pobre especificidad celular en tejidos heterogéneos. GEpHIs se han utilizado para medir el pH en una gran variedad de tipos de célula23extensivamente. Trabajo temprano explota la inherente sensibilidad al pH de la proteína fluorescente verde (GFP) para controlar el pH en células epiteliales cultivadas24 pero las dos últimas décadas han visto utilizado en neuronas25, glia26, hongos27 GEpHIs , y28de las células de la planta. La combinación de las posibilidades de orientación celular de construcciones genéticas a través de la expresión de GAL4/UAS sistema15 y la accesibilidad fisiológica de la Drosophila MT hacen de esta una preparación ideal para las investigaciones de pHi regulación y transporte iónico epitelial.
regulación de pH ha sido estudiado durante décadas y es vital para la vida. La preparación de MT ofrece un modelo robusto para enseñar fisiología de la regulación de pH pero también realizar sofisticadas investigaciones de pHi regulación ex vivo e in vivo. Este protocolo describe la cuantificación del movimiento de la H+ a través de la membrana basolateral de las células epiteliales de la Drosophila MT con NH4Cl ácido de pulso carga técnica21, pero como el indicador de pH es genéticamente codificada, estos métodos y su marco teórico se pueden aplicar a cualquier preparación favorable a la transgénesis y las imágenes en vivo.
Protocolo
Todos los pasos de este protocolo cumplen con las directrices de uso de animales de la Mayo Clinic (Rochester, MN).
1. cría de la mosca
- Levante vuela y conjunto de cruces según estándar cría29.
Nota: La expresión del reportero fluorescente por el sistema de GAL4/UAS es proporcional a la temperatura y así cría de temperatura se puede ajustar para alterar el nivel de expresión. Mientras que niveles altos de expresión a menudo conducen a una mejor relación señal a ruido esta condición también está asociada con aumento citosólicas y organellar agregados cuando usando GFP a la fusión de la proteína fluorescente roja (RFP) construye como pHerry10, 30,31. Si la agregación es inevitable, la cuantificación es posible mediante la realización de calibraciones en cada experimento y normalización de datos tal que punto un cociente de la fluorescencia de 1.0 corresponde al pH 7.0 (ver paso 7.4 Nota sobre calibración más abajo). - Establecer cruces de homocigótica capaR-GAL432 machos homocigóticos pHerry UAS10 hembras vírgenes y homocigótica c724-GAL42 machos a homocigótica UAS pHerry hembras vírgenes para permitir la proyección de imagen de pH en las células principales y células radiadas de la MT, respectivamente. Lugar 6 UAS-pHerry hembras con 3 machos de GAL4 en frascos frescos del alimento y dejar mate a 28 ° C.
Nota: Las larvas deben ser evidentes dentro d 4 y adultos comenzará a eclose alrededor del día 10. - Recoger las moscas hembra en eclosión y apartar a la edad de 10 días a 28 ° C.
Nota: El tiempo de experimentación se puede ajustar para que coincidan con cualquier análisis comportamiento restrictivos (como Ramsay secreción ensayo17,19) que se correlaciona a la imagen del pH intracelular en. Pueden utilizar moscas macho pero los túbulos de las hembras son a menudo más grande y más robusto.
2. preparación de portaobjetos de poli-l-lisina.
- Dibujar un borde de 40 x 20 mm con una pluma PAP hidrofóbica alrededor de la parte superior de diapositivas estándar 75 x 25 mm y dejar de lado que se seque durante 15 min a cubreobjetos grande RT. uso si las diapositivas no son compatibles con la proyección de imagen óptica.
- Transferir 2 mL de solución 0.01% Poly-L-lisina (PLL) en cada diapositiva y deja reposar durante 1 h a TA.
- Retire el exceso PLL con una pipeta. Guardar la solución en un frasco cónico de 50 mL para uso futuro. Almacenar a 4 ° C.
- Aspirar cualquier resto de solución con una línea de vacío. Ejecutar la línea de vacío sobre la superficie del portaobjetos todo para garantizar que no hay solución en las diapositivas.
- Configurar las diapositivas para 1 h adicional en antes RT. Almacenar las diapositivas seco a temperatura ambiente hasta por 1 mes en un libro de diapositiva estándar.
3. preparación de plato y varillas de vidrio de disección
- Añadir 0,5 mL de agente de curado de elastómero a 4,5 mL de elastómero base en un poliestireno de 35 x 10 mm plato de Petri a temperatura ambiente para producir una profundidad de 5 mm. mezclar con una pipeta desechable. Permiten elastómero curar O/N a TA.
Nota: Elastómero debe ser clara y libre de burbujas. Claro de burbujas puede facilitarse manteniendo las placas de elastómero en un tarro vacío de 10-15 min después de verter. - Sostener una varilla de vidrio de 5 mm de diámetro entre las manos y derrita el centro de la varilla en un mechero de Bunsen encendido mientras tira de los extremos separados. Como el vidrio se funde Tire más rápidamente para producir un fino (0.1 mm) y eje cónico (figura 1).
Nota: Un ángulo de 45 ° en la caña es a menudo útil en el manejo de los túbulos. Esto se logra bajando una mano como se tira la caña (ver figura 1). - Romper el eje de la fino en el centro con el lado embotado de una cuchilla de un solo filo acero al carbono. Inspeccione el extremo fino de la varilla en un ámbito de disección para asegurar que la rotura es limpia.

Figura 1: Fabricación de varillas de vidrio para el manejo de los túbulos de Malpighi.
A - E. Proceso de calentamiento y tirando de una varilla de vidrio para producir una forma cónica y del ángulo conveniente para manejar mts. flechas denotan dirección y magnitud de la fuerza a aplicar. F. fotografía de un instrumento de vidrio fabricado adecuadamente. Barra de escala = 10 mm. haga clic aquí para ver una versión más grande de esta figura.
4. preparación de soluciones y sistema de perfusión
Nota: Sistemas de perfusión difieren según el fabricante. Este protocolo se basa en un depósito abierto 8 canales de gravedad con un regulador de velocidad de flujo de entrada y una salida basada en el vacío, pero el método de montaje MTs como se describe aquí pueden ser adaptados para trabajar con cualquier sistema de perfusión.
-
Preparar las siguientes soluciones:
- Medio (40 mL en frascos cónicos de 50 mL) alícuota Schneider y almacenar a 4 ° C.
- Preparar soluciones (es decir, insectos Phosphate-Buffered salina (EICP) y EICP con NH4Cl) a temperatura ambiente cuando sea necesario según tabla 1). Soluciones calientes RT antes del uso en el día del experimento.
Nota: EICP EICP con 40 mM de NH4Cl puede ser preparados en grandes volúmenes (1 L o más) y almacenados a 4 ° C. - Preparar 8 soluciones de calibración en volúmenes de 500 mL a pH = 5.0, 6.0, 6.5, 7.0, 7.3, 7.6, 8.0 y 9.0, como se indica en la tabla 1 y almacenar a 4 ° C. Ajustar el pH de cada solución por titulación con N-metil-D-glucamine (NMDG) y ácido clorhídrico.
- En el día de los experimentos, caliente alícuotas de 5 mL de soluciones de calibración a RT y agregar solución de nigericin stock (20 mM en dimetil sulfóxido (DMSO)) para producir una concentración final de 10 μm.
PRECAUCIÓN: Manipule nigericin con guantes. Tratar a todo el equipo que entra en contacto con nigericin como desechables. Nigericin sigue siendo en vidrio y plástico y pondrá en peligro biológico Preparaciones si equipo se reutiliza.
-
Sistema de perfusión:
- Cebe el sistema de perfusión por llenar los depósitos con ddH2O (figura 2). Abra los canales uno a la vez permitir que todas las líneas proximal para el regulador de velocidad de flujo para llenar.
Nota: Puede ser necesario limpiar el aire de las líneas abriendo el canal estancado y utilizando un émbolo al flujo de la unidad de la reserva. - 2 canales abiertos y permiten ddH2O al desagüe. Una vez que los embalses están casi vacíos, se llenan el primer depósito EICP y el segundo depósito con NH4Cl-pulsada EICP. Establecer el caudal máximo con el regulador de velocidad de flujo hacer durante 1 minuto llenar las líneas distales de cada solución y detener el flujo (figura 2).
- Posición 2 juegos de pinzas "ayudando a las manos" de soldadura en la platina del microscopio de proyección de imagen. Coloque una abrazadera a cada lado de la plataforma de proyección de imagen.
- Calentar cuidadosamente el distales 0.5 pulgadas de un pedazo de vidrio capilar (diámetro interno de 1.5 mm, diámetro externo 0.86 mm, longitud 100 mm) sobre un mechero de Bunsen. Crear una curva de 45 ° por lo que el extremo distal a la curva por gravedad y quitar el cristal del fuego una vez que se obtiene el ángulo deseado. Repita este proceso con una segunda pieza de vidrio capilares.
- Inserte los tubos capilares de vidrio doblado en la línea de flujo y la línea de vacío conectado de la salida, respectivamente y montarlos en las "manos" para alinear con la etapa de proyección de imagen del microscopio (figura 3).
- Cebe el sistema de perfusión por llenar los depósitos con ddH2O (figura 2). Abra los canales uno a la vez permitir que todas las líneas proximal para el regulador de velocidad de flujo para llenar.

Figura 2: Sistema de perfusión y configuración de la imagen.
Componentes necesarios para la evaluación fisiológica de la función de transporte basolateral de MT a través de simultánea en vivo cambio de fluorescencia proyección de imagen y rápida solución. Líneas de gas se muestra son opcionales y permiten la expansión de experimentos para la evaluación del transporte HCO3– . Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Esquema del flujo de perfusión aparatos de NH4Cl pulso experimentos.
Flechas representan la trayectoria del flujo y válvula de conmutación puntos. La solución pasa de depósito a muestra por flujo de gravedad y se extrae de la cámara de muestra al matraz de residuos por la succión del vacío. Haga clic aquí para ver una versión más grande de esta figura.
5. disección de los túbulos de Malpighi Anterior adulto Drosophila .
- Recoger el plato de disección y sacó la varilla de vidrio de sección 3, un portaobjetos recubierto de PLL de la sección 2, un divisor de perfusión-bien adhesivo, grasa para vacío, una tira de 4 x 2" de la película, 2 pares de #5 finas pinzas y alícuotas de 40 mL de medio y RT EICP helada Schneider.
- Difundir la grasa para vacío en el precinto y pulse el divisor de perfusión-bien adhesivo en cinta para cubrir el fondo con grasa. Despegue el adhesivo divisor de perfusión-bien y colocar grasa hacia abajo sobre un portaobjetos recubierto de PLL. Retire el divisor de perfusión-bien para dejar a muestra individual de pozos en grasa hidrofóbica.
- Lugar 200 μL del EICP RT en el cercado de grasa bien en el portaobjetos recubierto de PLL y córralo bajo el estereoscopio.
- Lugar UAS-pHerry/capaR-GAL4 moscas en un vuelo vacío del frasco y anestesiar en hielo durante 10 minutos.
Nota: Este método de la anestesia, a diferencia de CO2, asegura que las moscas no deshidratan. - Vierta medio helada de Schneider en la disección y pinzas finas para transferir una sola mosca hembra anestesia en el plato bajo un estereoscopio de disección.
- Mantener la marcha por el tórax con un conjunto de pinzas y el otro para agarre suavemente la parte posterior del abdomen. Abra la parte posterior de la mosca usando las pinzas, movimientos deliberados. Una vez visible el hindgut, agarre el extremo distal y sin la tripa y MTs tracheoles subyacentes tirando el hindgut lejos del cuerpo a través de remolcadores repetitivos, breve.
Nota: Los metros anteriores y posteriores serán visibles donde se encuentran el cruce del midgut y hindgut a través del uréter. El primer par de MTs a libre voluntad probable ser los túbulos posteriores rodean al intestino grueso. Estos pueden ser ignorados (Figura 4A). - Una pizca de las anteriores MTs en el uréter con pinzas finas una vez que el segundo conjunto de MTs está libre del abdomen. Esto separa el anterior MTs en el intestino y cerrar el uréter.
- Recoger las libres MTs anteriores con la varilla de vidrio tirado deslizando la varilla bajo el uréter tal que los túbulos a los lados. Levante el MTs recto fuera de la solución.
- Gire la varilla de vidrio que la MTs y el uréter se adhieren a la parte inferior de la varilla y bajan el uréter derecho en la diapositiva. Afijo el uréter y selle los extremos distales de las MTs presionando el uréter sobre el portaobjetos de cristal (Figura 4B). No manipule el MTs más que necesario. El MTs deben estar flotando en la solución con el uréter a la diapositiva.
- Utilice el extremo fino de la varilla de vidrio para barrer suavemente cada túbulo a través de la superficie del portaobjetos. Apoyo de la barra contra el portaobjetos para evitar aplastar el túbulo y deslice la varilla por encima de los túbulos, movimiento distal a la proximal, para unir toda la longitud de cada túbulo a la superficie del tobogán cubierto de PLL (figura 4).
- Coloque el adhesivo divisor de perfusión-bien en la diapositiva para formar un pequeño llenado de líquido más el túbulo montado.
- Coloque al espécimen en la platina del microscopio. Coloque la entrada y salida capilares sobre la entrada y la abertura de salida de la perfusión bien, respectivamente.
Nota: El divisor bien puede dejarse si se desea una cámara abierta de la perfusión. En este caso los capilares de entrada y salida se pueden alinear a lados opuestos de una imagen bien.
6. validación de la proyección del túbulo salud y Protocolo de
Nota: Este protocolo se realiza en un microscopio epifluorescente invertida de gran campo con GFP (SEpH) y filtro RFP (mCherry) (470/40 nm excitación (ex), emisión de longpass de 515 nm (em), 500 nm nm dicroico y 546/10 ex, 590 em de longpass nm, 565 nm dicroico), 10 X / 0.45 de aire objetivo, una cámara monocromática para captura de imágenes en vivo y proyección de imagen de software. El protocolo puede ser adaptado para cualquier posición vertical o microscopio invertido con filtro automático de conmutación entre GFP y RFP óptica e imagen software de adquisición, aunque variarán parámetros binning, intensidad de la luz y tiempos de exposición óptima. En todos los análisis, la intensidad de fluorescencia debe analizarse como intensidad de pixel media en la región de interés (ROI), después de la sustracción de fondo en cada canal mediante un ROI con no contiene ninguna fluorescencia junto a la señal de retorno de la inversión.
- Encender el microscopio, fuente de luz y sistema de proyección de imagen.
- Software abierto de imagen asociado.
- Mire por el ocular y ajustar el foco manualmente hasta que la luz de la MT es claramente visible bajo luz transmitida.
- Haga clic en la pestaña de "Adquisición" de software de análisis de imagen y seleccione "2 x 2" en el menú desplegable "Binning" en la sección "Modo de adquisición".
- Inserte un filtro de densidad neutra de 5% en la trayectoria de la luz para reducir la luz de la iluminación y minimizar el fotoblanqueo.
- El canal GFP (SEpH) en el menú "Canales", haga clic en "Live" para observar la señal fluorescente a través de la cámara.
- Ajuste el control deslizante de "Tiempo" para ajustar el tiempo de exposición tal que los más brillantes valores de píxel en el histograma de intensidad aproximadamente el 40% del valor máximo, luego haz clic en "Stop" para detener la iluminación.
- Repita los pasos 6.6-6.7 en la RFP (mCherry) canal y confirman la presencia del segmento inicial dilatada de la anterior TA y la ausencia de mCherry citosólica agregados (indicativa de daño tisular o sobreexpresión) (figura 4).
Nota: El segmento dilatado debe ser claramente evidente como lo es el segmento más proximal del túbulo y el diámetro de la luz interior de este segmento es ~ 20 μm mayor que la de adyacente del segmento transicional. 2 x 2 binning pixel es a menudo suficiente pero se puede aumentar para reducir la intensidad de iluminación requerida. Tiempos de exposición típicos son entre 150 y 800 ms/canal. Utilizar como poca luz como sea posible para minimizar el fotoblanqueo. Minimizar el fotoblanqueo es vital para el uso de indicadores de doble-fluoróforo como pHerry como los dos fluoróforos pueden blanquear independientemente, invalidando así cualquier calibración de relación. - Habilitar un protocolo Time-lapse de imágenes haciendo clic en la casilla de verificación "Series de tiempo".
- Ajustar la "duración" en el menú desplegable en la sección de "Series de tiempo" a 10 min y el deslizador de "Intervalo" a 0 para configurar el tiempo de captura total con una tasa de adquisición de imagen máxima. A menudo basta con una tasa de adquisición total de 0,2 Hz.
- Compruebe los cuadros de RFP (mCherry) en la sección "Canales" y GFP (SEpH).
- Abrir la línea EICP del sistema de perfusión, activando el controlador de la válvula adecuada y empezar el protocolo de imagen haciendo clic en "Start experimento." Después de 1 minuto, interruptor de NH4Cl solución de pulso de 20 s abriendo la válvula correspondiente y cerrando la línea EICP, volver a EICP por NH4Cl línea de cierre y reapertura de la válvula del EICP. Permitir el protocolo completo de imágenes completar antes de parar el sistema de perfusión.
Nota: Time-lapse análisis deberían revelar una señal mCherry estable y una señal de la SEpH que aumenta en presencia de NH4Cl, sacia al lavado y poco a poco se recupera. - Realizar una calibración de 2 puntos.
- Retire el divisor bien pelando lejos la diapositiva subyacente y eliminar los capilares de la perfusión y las abrazaderas de la proyección de imagen bien.
- Aplique 200 μL EICP de calibración (pH 7,4, 10 nigericin μm) para la proyección de imagen con una pipeta de 200 μl. Retire la solución de la proyección de imagen con la pipeta, luego cambie por otro 200 μL de solución de calibración. Repetir este proceso 4 veces para asegurar la solución completa de exchange.
- Incubar la preparación en solución de calibración para 30 minutos antes de la proyección de imagen. Repita el protocolo de imagen utilizando los mismos parámetros determinados en los pasos 6.6-6.11, con la modificación de solamente 1 minuto de la imagen de captura.
Nota: El sistema de perfusión y los capilares no son necesarios en esta etapa y no debe estar conectados a la proyección de imagen bien para evitar exponer a los capilares a nigericin. - Añadir 200 μL EICP de calibración (pH 9.0, 10 nigericin μm) a la proyección de imagen con una pipeta de 200 μl. Retire la solución de la proyección de imagen con la pipeta, luego cambie por otro 200 μL de solución de calibración. Repetir este proceso 4 veces para asegurar la solución completa de exchange.
- Incubar la preparación en la segunda solución de calibración para 10 minutos antes de la proyección de imagen. Repita el protocolo de imagen como en el paso 6.13.3.
- Revise la pila de la imagen capturada en el software de análisis de imagen para confirmar que no hay píxeles de cada canal están saturados por clic "Significa ROI" y el desplazamiento aunque la pila de la imagen con el slider de "Marco" mientras observa que no hay valores reportados en el histograma de intensidad alcanzar el máximo valor detectable. Si cualquier Marcos contienen pixeles que alcanzan la máxima intensidad detectable, reducir la intensidad de tiempo o iluminación de la exposición y repetición sección 6.
Nota: Una vez establecido no cambia parámetros de proyección de imagen entre experimentos o calibración a menos que punto calibraciones deben ser utilizadas en cada preparación (ver paso 8.3).
- Analizar la pila imagen para trazar la intensidad fluorescente y cociente de la fluorescencia (SEpH/mCherry) como una función del tiempo.
- Haga clic en "Significa ROI" y seleccione la herramienta forma libre. Mantenga el botón izquierdo del ratón para trazar una ~ 50 μm de longitud de MT Haga clic para terminar de dibujar el ROI, luego repetir en un área adyacente a la MT para definir un fondo ROI (figura 5A).
- Haga clic en la opción de "Media intensidad" bajo "Medidas". Crear una tabla de valores de intensidad haciendo clic en "Exportar > tabla de datos > crear."
- Haga clic en el icono de rueda dentada de configuración y anular la selección de todos los parámetros excepto el "Tiempo" y "Significa intensidad." Haga clic en la ficha de la tabla de datos recién creada, seleccione "Guardar como" y exportar los datos como un archivo .csv.
Nota: Medidas similares también es posible usar software libre como el ImageJ. - Abrir una tabla de hoja de cálculo y la tabla de datos de importación seleccionando la pestaña de "Datos" seguida de "De texto".
- Utilizar funciones en la hoja de cálculo para disminuir la intensidad de fondo SEpH de la intensidad de la señal de la SEpH en cada momento. Repita este proceso para la señal mCherry.
- Parcela de cada intensidad de canal como una función de tiempo seleccionando las columnas que contiene el tiempo y corregir de fondo datos de intensidad y luego clic en "Insertar > dispersión (diagramas) > dispersión con líneas rectas" (figura 5B).
- Utilizar funciones de hoja de cálculo para calcular el cociente de la fluorescencia de SEpH/mCherry en cada momento.
- Trama de fluorescencia relación como una función de tiempo seleccionando las columnas que contienen los datos de tiempo y ratio y luego clic en "Insertar > dispersión (diagramas) > dispersión con líneas rectas" (figura 5).
7. completa calibración de pHerry en túbulos de Malpighi Ex Vivo.
- Disecar y montar una nueva serie de MTs anteriores como se describe en la sección 5.
- Intercambio EICP para calibración EICP (pH 7,4, nigericin del μm 10) como se describe en el paso 6.13.2. Incubar durante 30 minutos.
- Localice el MTs y recoger pares de imágenes de SEpH/mCherry como se describe en pasos 6.1-6.11. Reemplazar la solución con otro stock de calibración EICP como se describe en el paso 6.13.4, espera 10 minutos y otra vez la imagen. Repita este proceso hasta que el cociente de la SEpH/mCherry ha sido reflejado en todas las soluciones. Obtener pH 9,0 imágenes durar mientras el espécimen rara vez se recupera de pH alto.
- Parcela cociente de la fluorescencia de la SEpH a mCherry de calibraciones en las ocho muestras en función del pH impuesto como se describe en el paso 6.14.9. Ajustar los datos de calibración con una curva de Boltzmann para obtener la función de calibración completo según la ecuación 1 (figura 5). Si los datos son inconsistentes, trazar sistemas de calibración de cada ejemplar normalizado que un cociente de la fluorescencia de 1.0 corresponde a pHi 7.0 y volver a analizar (figura 5E).
Nota: Si este último proceso es necesario experimentos individuales tendrá sus propias calibraciones de punto interno33 (ver cuantificación procedimiento siguiente (paso 8.3)). -
Ecuación 1

Donde R = relación de SEpH/mCherry y un1,2, xoy dx es curva de parámetros de conexión que representa la proporción mínima de la fluorescencia, fluorescencia máxima proporción, pKunay anchura de la función respectivamente. xo = aparente pKuna de pHerry, que puede variar entre 7.1 y 7.4 dependiendo del tipo de la célula y las condiciones de la calibración exacta.
8. cuantificación de ácido Basolateral extrusión de epitelios de túbulos de Malpighi Ex Vivo .
- Imagen expresando pHerry células radiadas y principal pHerry expresando las células simultáneamente.
- Disección anteriores MTs de una mosca UAS-pHerry/capaR-GAL4 como se describe en la sección 5, pero no transfieren MTs de medio de Schneider de la disección a la proyección de imagen bien.
- Disección anteriores MTs de una mosca UAS-pHerry/c724-GAL4 en el mismo plato de disección utilizando el procedimiento descrito en la sección 5.
- Transferencia de los 2 conjuntos de MTs en el mismo la proyección de imagen así como se describe en pasos 5.8-5.11.
Nota: Cuando barrido de los brazos de las MTs hasta la diapositiva, coloque los metros que la UAS-pHerry/c724-GAL4 y cerca de los túbulos UAS-pHerry/capaR-GAL4 mutuamente las células principales y radiadas pHerry-expresando así que se pueden visualizar en el mismo campo ( Figura 6A).
- Aplicar el NH4Cl prepulso como se describe en el paso 6.12.
Nota: Si no podría lograrse calibración consistente (Figura 4B), realice una calibración de punto ajustando pHi a 7.0 al final de cada experimento con EICP de calibración (pH 7.0, 10 μm nigericin, incubación de 30 min) después del adhesivo divisor de perfusión-bien y el equipo de perfusión se han quitado. - Calibrar rastros de células radiadas y principal de diversos segmentos de MT (con el cociente normalizado o absoluto según el caso) con la ecuación 2 y analizar la fase de recuperación después de NH4Cl retiro aplicando funciones del decaimiento exponencial con software de análisis estadístico y teniendo en cuenta la constante de decaimiento (τ) (Figura 6B).
Ecuación 2
Donde R = relación de SEpH/mCherry y un1,2, xoy dx es curva de parámetros de conexión determinados por calibración en el paso 7.4 (ecuación 1).- Calcular tasa de extrusión ácido (JH +, ver ecuación 3) en función del pH para tener en cuenta las variaciones en pH y ácido carga entre preparaciones34de reclinación. Utilizar las funciones exponenciales en paso 8.3 para calcular la derivada de pH en cuanto a tiempo en cada intervalo de tiempo.
Ecuación 3
- Calcular la capacidad tampón intrínseca (βi; Ecuación 4) el citosol en el pH desde el inicio de cada intervalo en el paso 8.3.1 basado en literatura anterior (véase ecuación 4).
Nota: En Drosophila, la caracterización más completa de β viene del nervio motor larvas terminales35 y estos datos se pueden suponer que se mantenga para las celdas de MT en ausencia de otros datos disponibles.
Ecuación 4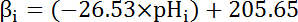
- Calcular el producto de βT (de paso 8.3.2)y dpH/dt (del paso 8.3.1) para determinar JH + (ecuación 3).
Nota: En soluciones nominalmente libres de bicarbonato como los descritos en este protocolo, derivados del bicarbonato búfer capacidad (βb) se asume que es ~ 0 mM. Almacenamiento en búfer capacidad (βT) total es la suma de β yβby βi = βT en ausencia de HCO3–/CO236. - Parcela JH + en función del pH al principio de cada intervalo de tiempo como se indica en el paso 6.14.9.
- Las funciones del decaimiento exponencial se aplica a la porción de todos los conjuntos que se superponen en el pH utilizando el software de análisis estadístico. Comparar las tasas de cambio de las funciones resultantes de comparar las tasas de ácido protuberancia entre las células y MT segmentos (figura 6).
Nota: La función más apropiada utilizada para ajuste de curvas puede no siempre ser un solo exponencial. Otras funciones pueden ser sustituidas si mejoran la bondad de ajuste. - Calcular ácido (ver ecuación 5) del flujo en función del pH para tener en cuenta las variaciones en forma y tamaño de la célula.
Ecuación 5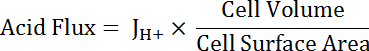
Nota: Dimensiones de la célula pueden ser medidos directamente en imágenes o aproximados. Las células principales se pueden representar como mitades de un tubo hueco con las siguientes dimensiones: diámetro interno 24 μm; diámetro exterior 48 μm; altura 50 μm. transición células radiadas son variables, pero pueden representarse aproximadamente como cilindros con alturas de 50 μm y el diámetro de 10 μm. Véase el párrafo final del Representante resultados a continuación. - Funciones del decaimiento exponencial se aplica a la porción de los conjuntos de datos que se superponen en el pH utilizando el software de análisis estadístico. Comparar las tasas de cambio de las funciones que resulta comparar flujos de ácidos entre las células y MT segmentos (figura 6).
- Calcular tasa de extrusión ácido (JH +, ver ecuación 3) en función del pH para tener en cuenta las variaciones en pH y ácido carga entre preparaciones34de reclinación. Utilizar las funciones exponenciales en paso 8.3 para calcular la derivada de pH en cuanto a tiempo en cada intervalo de tiempo.
Resultados
Tejidos sanos y correcta identificación de los MTs anteriores son vitales para el éxito de este protocolo. Durante la disección, debe tenerse cuidado que no toque el MTs y a manija única por el uréter como agarre el MTs directamente conducirá a la rotura (Figura 4A– B). Cuando se barren MTs plana sobre la diapositiva, los túbulos se deben tocar lo menos posible y exceso movimiento evitado ya que esto puede dañar la capa epitelial unicelulares (figura 4). Bien disecado MTs anteriores mostrará distribución uniforme de la fluorescencia verde y roja por el citosol de las células epiteliales y los segmentos del túbulo morfológicamente distintos. Túbulos dañados por perfusión inadecuada o mal manejo mostrará agregación de fluorescencia roja con los no apareados agregados verdes y mal identificados MTs posteriores mostrará morfología uniforme desde el extremo ciego proximal al uréter distal (figura 4) .
Se debe confirmar el funcionamiento correcto de pHerry evaluación aunque fisiológica así como morfología. El método más conveniente confirmar la detección de pH adecuado es aplicar un NH4Cl pulso. En estas condiciones la SEpH verde señal debe informar los cambios de pH esperado (un aumento del pH durante el pulso como NH3 entra en la célula, una disminución gradual durante el pulso como NH4+ entra por transportadores de K+ y canales y una acidificación rápida y recuperación gradual a NH4Cl retiro21, mientras que la señal roja mCherry debe permanecer constante (figura 5A– B). La magnitud de los cambios en la señal de la SEpH se varían de acuerdo con el protocolo y tipo de la célula, pero la señal mCherry debe ser estable en todos los casos. Los cambios en la señal mCherry durante los experimentos individuales indican artefactos de movimiento o generación progresiva de agregados de sensor debido a daño de la célula. Esto último evitará que cuantificación de pH y debe evitarse. Al completar el NH4Cl pulso es importante realizar una calibración de 2 puntos (calibración EICP, pH 7.4 y 9.0, 10 μm nigericin) para confirmar un descanso pH cerca de 7.4 y asegurar que los parámetros de imagen actuales no llevan a la saturación de detección de fluorescencia cuando se maximiza la fluorescencia a pH 9.0 (figura 5). Si pH es significativamente menor de 7.4, el protocolo debe repetirse con MTs saludables; y si la saturación se produce a pH 9.0, el protocolo debe repetirse con menor tiempo de exposición o la intensidad de luz. Una vez que se determinan parámetros de proyección de imagen adecuados, se debe no cambiar entre experimentos o calibraciones si se utilizan los ratios de fluorescencia absoluta. Mientras que la naturaleza de pseudo-radiométrica de pHerry puede proporcionar un método de corrección de movimiento en preparaciones proclives al movimiento o cambios en el diámetro de la célula, la cuantificación absoluta de pH requiere correlación sistemática completa de pHerry SEpH / mCherry relación pH a través de la técnica de K+ de alta nigericin. La calibración de pHerry en preparaciones saludables debe producir curvas de calibración consistente con una aparente pKuna de 7.1-7.4 dependiendo de las condiciones de tipo y la calibración de la célula (figura 5). Para las preparaciones en que mCherry agregación es inevitable, normalización de los valores del cociente que un cociente de la fluorescencia de 1.0 corresponde al pH 7.0 deben producir resultados similares (figura 5E). Si se utilizan punto calibraciones y las curvas normalizadas, parámetros de la proyección de imagen puede ser optimizada para cada preparación.
Rastros de pH calibrado pueden utilizarse para comparar el mecanismo regulador pH entre tipos de células. El sistema de la expresión de GAL4/UAS en Drosophila se puede utilizar para expresar pHerry en las células principales y células radiadas de la anterior TA (figura 6A). regulación de pH puede ser evaluada por las células ácido-carga con pulsos de NH4Cl y cuantificación de la tasa de recuperación de pH . Esto puede lograrse ajustando funciones exponenciales para la fase de recuperación en diferentes condiciones experimentales para obtener la constante de decaimiento (τ) como células con más rápido eflujo de H+ mostrará una recuperación más rápida (y por lo tanto menores valores de τ). Basado en este análisis, células radiadas de la TA parecen tener más sólida protuberancia ácida que las células principales (Figura 6B). Este análisis llevará a cabo siempre y cuando el reposo pH, grado de carga ácida y capacidad de almacenamiento en búfer son similares entre los grupos experimentales. Sin embargo, cuando no se cumplen estas condiciones, es necesario tener en cuenta la observación que la capacidad tampón intrínseca del citosol (βi) de muchas células es sí mismo dependiente del pH35,37,38 y así el índice de pH cambio en el pH diferentei no sean directamente comparable. En tales casos, las curvas exponenciales ajuste a la siguiente fase de extrusión ácido un NH4Cl pulso y estimaciones previamente de la capacidad tampón intrínseca (βi) pueden utilizarse para representar la tasa de extrusión ácido (JH +) como una función de pH y determinar tasa compensada de extrusión ácido (ecuaciones 3 y 4). Una vez que las diferencias en carga y reposo pH el ácido se contabilizan ya que es evidente extrusión ácido en las células principales del segmento transición superar de células radiadas (figura 6). Al mismo tiempo conmovedora, este análisis no responde a que pH es una función de volumen mientras que el ácido a través de la membrana plasmática es una función de la superficie de la membrana. División JH + por el área superficial al cociente del volumen de la célula de interés dará valores en moles de ácido equivalente por unidad de área superficial por unidad de tiempo (ecuación 5), permitiendo la corrección de las diferencias en la morfología y tamaño de la célula. Aproximadamente dos células principales abarcan la circunferencia de la MT en los segmentos de transición y así las células se pueden modelar como la mitad de un tubo (diámetro interno 24 μm; diámetro exterior 48 μm; altura 50 μm). Las células radiadas son más pequeñas y suelen ser en forma de barra en el segmento de transición de la MT2. Cuantificación exacta de área superficial y volumen es difícil pero aún conservadoras aproximaciones de forma transitorio de la célula radiada (cilindro con una altura de 50 μm y 10 μm de diámetro) indican un área superficial al cociente del volumen al menos 2 x de las células principales. Teniendo esto en cuenta revela que el flujo ácido de la célula radiada es significativamente inferior a la de las células principales de transición y de hecho aproxima de las células principales del segmento inicial (figura 6).

Figura 4: Disección de los túbulos de Malpighi Anterior adulto Drosophila .
A. representación esquemática de la anterior eliminación de MT con 2 pares de Pinzas finas en medio del frío de Schneider. "A. túbulo" = Anterior MT. "P. túbulo" = posterior MT. B. Proceso de recuperación y montaje extraído MTs con varillas de vidrio delgado. C. proceso de adhesión de toda la longitud de extrae MTs a una diapositiva para la evaluación de la proyección de imagen y fisiológica. D. imágenes de campo amplio del representante de la SEpH (470/510 nm ex / em) y mCherry (556/630 nm ex / em) componentes de pHerry UAS impulsado por capaR-GAL4 representando saludable anterior MTs, MTs anteriores dañado por perfusión insuficiente, y mal identificado posterior mts. Nota que sano MTs anteriores mostrar un segmento inicial ciego dilatado claro, un segmento de transición estrecho con expresión relativamente creciente de pHerry UAS cuando impulsado por capaR-GAL4y principal distal segmento. Daños MTs pantalla sensibles agregados de fluorescencia mCherry con ninguna fluorescencia correspondiente de la SEpH. Posteriores MTs son uniformes en diámetro con no segmentos morfológicamente distintos. Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Validación y calibración de pHerry en túbulos de Malpighi.
A. imágenes de campo amplio del representante de la SEpH (470/510 nm ex / em) y mCherry (556/630 nm ex / em) componentes de pHerry UAS impulsado por capaR-GAL4 con MTS anterior sano "ROI" marcas señal de región de interés. "BG" marcas fondo la región de interés que posteriormente fue restada de la señal de retorno de la inversión en el mismo canal. Barra de escala = 50 μm. B. Cambios de fluorescencia relativa en SEpH y mCherry señales de pHerry en respuesta a 20 s 40 mM NH4Cl pulso. Tenga en cuenta que la señal mCherry es estable mientras que la señal de la SEpH muestra un aumento característico durante el pulso (indicativo de alcalinización, es decir, mayor pH) y una fuerte disminución sobre lavado (indicativo de la acidificación, es decir, disminución de pH). C. cociente de la fluorescencia de pHerry (SEpH/mCherry) calcula a partir de datos de B datos adicionales después de la incubación de 30 min en calibración EICP (10 μm nigericin, 130 mM K+, pH 7.4 y 9.0). D. curva de calibración construida de pHerry absoluta relación (SEpH / mCherry) como una función de pH impuso durante la exposición EICP de calibración intermedia a uno de los ocho valores de pH. Círculos grises son preparados de forma 8 valores individuales. Barras y cuadrados negros son media ±SD. Boltzmann es curva. E. datos mismo como D normalizaron tal eso cociente de la fluorescencia a pH 7.0 es 1.0. La curva se modifica sigmoidal curva de ajuste (ver paso 7.4, ecuación 1). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Cuantificación de ácido extrusión en epitelios de túbulos de Malpighi.
A. imagen de campo amplio de fluorescencia de SEpH (de pHerry) en las células principales de la TA anterior (a la izquierda, conducido por conductor de capaR-GAL4 ) y células radiadas de la MT anterior (a la derecha, conducido por c724-GAL4). Tenga en cuenta que células radiadas son en forma de barra en el segmento inicial, variable en el segmento de transición y mostrar distintas proyecciones celulares en el segmento principal. Barra de escala = 100 μm. B. Calibrado cambios de pH en respuesta a 20 s 40 mM NH4Cl pulso en las regiones de interés que se indica en (células principales del segmento de transición, las células principales del segmento inicial y células radiadas de la segmento de transición). Las curvas punteadas denotan ajustes exponenciales solo aplicación a la fase de recuperación de ácidos después de NH4Cl retiro de donde se derivan indicado decaimiento constante (τ) valores. C. tasa de extrusión ácido (JH +) trazada como una función pHi derivada de la exponencial cabe ver en B. Consulte el paso 8.3.1 JH + cálculo (ecuación 3). Las curvas discontinuas son ajustes exponenciales aplicados a cada trama de datos dentro de la zona de pH denota el cuadro gris que se superponen. D. flujo ácido trazada como una función pHi derivada de la exponencial cabe ver en la B y la ecuación 5. Las curvas discontinuas son ajustes exponenciales aplicados a cada trama de datos dentro de la zona de pH denota el cuadro gris que se superponen. Haga clic aquí para ver una versión más grande de esta figura.
| EICP | NH4Cl pulso EICP | EICP calibración | |
| NaCl | 121.5 | 81.5 | 0 |
| NH4Cl | 0 | 40 | 0 |
| KCl | 20 | 20 | 130 |
| Glucosa | 20 | 20 | 20 |
| Tampón de | HEPES; 8.6 | HEPES; 8.6 | MES, HEPES o llaves; 8.6 |
| NaHCO3 | 10.24 | 10.24 | 0 |
| NaH2PO4 (1 H2O) | 4.5 | 4.5 | 0 |
| NMDG | 0 | 0 | 30.5 |
| pH | 6.8 | 6.8 | Varía |
| Osmolaridad | 350 ± 5 | 350 ± 5 | 350 ± 5 |
Tabla 1: Soluciones mosca Experimental.
EICP soluciones están preparadas a temperatura ambiente y pH se establece por titulación con HCl y NaOH. Solución de calibración se titula con HCl y NMDG. Buffer de solución de calibración es muy variada basándose en pH deseado [2-(N-morfolino) (n-2-hidroxietilpiperazina-N'-2-ácido ácido (MES) de pH = 4.0-6.0; 4-(2-hydroxyethyl)-1--1-ácido ácido (HEPES) para pH = 6.5-7.5; N-[tris (hidroximetil) metil] -3-ácido aminopropanesulfonic (TAPS) para pH = 8.0-9.0]. Todos los valores en mM, excepto pH (sin unidad) y la osmolalidad (mmol/kg). Nigericin stock en DMSO se añade a las soluciones de calibración a una concentración final de 10 μm antes de uso.
| GEpHI | Excitación (nm) | Emisión (nm) | pKun | Notas |
| Superecliptic pHluorin (SEpH)11 | 395, 488 | 530 | 7.2 | Amplio rango lineal, doblez grande (50 x) aumento en fluorescencia sensible al pH en rango lineal |
| Pinta GFP42 | 390, 475 | 540 | 7.3 | Validado para su uso en las células vegetales |
| Superecliptic pHluorin - mCherry fusión31 | 488, 556 | 530, 620 | 7.2 | Agregados de mCherry impar produce en algunas células |
| ClopHensor40 | 488, 545 | 525, 590 | 6.8 | pH y Cl– sensor. Actualizado ClopHensorN30 varient muestra menos agregación en las neuronas |
| pHerry10 | 488, 556 | 530, 620 | 7.2 | Fusión de SEpH mCherry actualizada con vinculador de ClopHensor |
| mNectarine44 | 558 | 578 | 6.9 | Corrección por photobleaching es a menudo necesario |
| pHluorin245 | 395, 475 | 509 | 6.9 | Variante de radiométrica pHluorin12 |
| pHred47 | 440, 585 | 610 | 7.8 | Actualizado varient de largo-Stokes shift mKeima49, compatible con la proyección de imagen de 2 fotones FLIM NIR |
| pHuji43 | 566 | 598 | 7.7 | Varient de arce; menor sensibilidad de pH esperado en algunas células |
| pHtomato46 | 550 | 580 | 7.8 | Validados para realizar el seguimiento vesicular endocitosis, cytocolic pobre sensibilidad de pH |
| pHoran443 | 547 | 561 | 7.5 | Mayor pH-sensible proteína fluorescente naranja |
| SypHer-248 | 427, 504 | 525 | 8.1 | Variante más brillante de radiométrica SypHer51, originalmente para mediciones mitocondriales |
Tabla 2: Lista de publicados GEpHIs citosólica
Máximos de excitación, máximos de emisión y aparenteKun valor de p es aproximadas y puede variar dependiendo del sistema de la expresión, técnica y método de calibración. FLIM = vida de la fluorescencia microscopía de imágenes. NIR = infrarrojo cercano.
Discusión
El éxito de cuantificación de pH en Drosophila MTs depende totalmente de la salud de MTs extraídos y la calidad del montaje y la disección (Figura A – C). Así, la manipulación cuidadosa del tejido como descrito es indispensable. Diapositivas recién revestidos en PLL substancialmente ayuda MT de montaje ya que tienden a ser mucho más pegamento que las diapositivas que han sido expuestos previamente a solución. Montaje cuidadoso también ayuda en la identificación de los distintos segmentos de MT (Figura D). MTs saludables facilitan la calibración de pHerry y evaluación funcional reduciendo la agregación mCherry y rendimiento cuantificación mucho más consistente de la protuberancia ácida, respectivamente. En algunos casos, evitando la agregación mCherry no es posible las condiciones experimentales inherentemente pueden dañar el epitelio de MT o producir significativa expresión del reportero fluorescente. En estos casos, una calibración radiométrica pseudo normalizados tal que cociente de la fluorescencia 1.0 corresponde al pH 7.0, y calibraciones punto permitirá cuantificación (Figura E). Debe tenerse cuidado al realizar calibraciones de punto para evitar exponer los elementos permanentes de los sistemas de proyección de imagen y de la perfusión a nigericin como el ionóforo se adhiere al vidrio y plástico. Calibración radiométrica de pseudo aún no es posible para las circunstancias en las que una manipulación experimental induce daño celular durante un experimento, es decir, este daño provocará una progresiva evidente aumento en fluorescencia mCherry durante todo el experimento. En estos casos más adelante, la señal de fluorescencia de la SEpH se puede utilizar con una curva de calibración normalizado y punto de calibración, con la salvedad de que la proyección de imagen no corrige por artefactos de movimiento y cambios de focal.
GEpHIs llevar varias limitaciones generales en comparación con la cuantificación de pH con tintes fluorescentes. Retención de colorante puede ser utilizado como un indicador de membrana de salud integridad y célula39, pero ningún ensayo equivalente está disponible para el uso de GEpHIs. Como tal, la salud preparación debe controlarse a través de medios independientes, si el daño celular se predice que para confundir resultados. GEpHIs potencialmente permitir la proyección de imagen de preparaciones mínimamente perturbados en vivo pero integridad de tejido inherentemente limita las manipulaciones experimentales y puede hacer punto calibraciones imposibles. Otra limitación específica inherente en el uso de pHerry y otros indicadores del pH citosólico fluoróforo dual (como el ClopHensor40) deriva de la tendencia de los dos fluoróforos a alterar su fluorescencia independientemente de uno otro y pHi . Artefactos de agregación RFP son la manifestación más significativa de esta limitación, pero la cuantificación puede ser comprometida también por photobleaching de uno o ambos fluoróforos. Así, la proyección de imagen protocolos tanto ajustarse para minimizar el fotoblanqueo, que puede conducir a tiempos de exposición largos y las tasas de adquisición < 0,2 Hz. largos tiempos de exposición no informe rápido pH cambia de puesto. SEpH fluorescencia pH muestra correlación lineal de pH 6.8-7.8 en la mayoría de las preparaciones, pero la exactitud de tales medidas depende de la exactitud de la técnica de K+ de alta nigericin. Nigericin actúa como un ionóforo/h K++ y adecuada calibración se basa en equilibrar extracelular [K+] intracelular [k+]. Las estimaciones de intracelular [K+] no están disponibles o fácilmente obtenible para todos los sistemas experimentales. Precisión de pH la cuantificación sólo será tan fiable como las estimaciones de intracelular [K+], aunque las tasas de cambio relativo en el pH será constante. Ante esta limitación y la relación logarítmica inversa de pH intracelular [H+], es siempre preferible datos como tasas de cambio en el pH, tasa de extrusión ácido (JH +, figura 6), o flujo ácido (figura 6) en lugar de absolutas cambios en el pH. Análisis de los datos como fundente ácido tiene la ventaja de corregir las diferencias en la superficie son relación entre tipos de células.
Varias advertencias deben apreciarse al interpretar datos del adulto volar preparación de MT que se describe en este protocolo. La distinción morfológica de los segmentos principal e inicial, transición, es probable que una simplificación de la verdadera diversidad de dominios funcionales y genéticos presentes en los MTs2. Además, mientras que este protocolo está diseñado para detectar la función de transportadores ácido basolateral es posible que transporte apical puede influir en las mediciones dei pH así. Sellado de los uréteres al montaje MTs (paso 5.9) asegura que intercambio de solución sobre todo ocurre en la superficie basolateral pero movimiento para celular y apical de los iones puede todavía influyen pHi transporte basolateral, en definitiva, altera la lado citoplasmático de lumen/citosólica gradientes de iones. Separación absoluta de la apical y basolateral función puede lograrse independientemente perfundiendo el luminal y basolateral superficies de la MT, pero tales métodos substancialmente más técnicamente exigen como el requieren la canulación de la micropipeta41 .
GEpHIs presentan muchas ventajas sobre los métodos convencionales de medición de pH y estas fortalezas se amplifican cuando combinada con la maleabilidad genética y bajo costo de la preparación de Drosophila MT. Cuantificación de pH ha confiado históricamente a tintes fluorescentes como (2',7'-Bis-(2-Carboxyethyl)-5-(and-6)-Carboxyfluorescein (BCECF)22 o complicada evaluación electrofisiológica mediante electrodos ion selectivo20 ,21. Como pHerry está codificada genéticamente, se puede expresar en poblaciones celulares específicas por promotores específicos (como se muestra aquí en las células principales y células radiadas de la MT, figura 6) y es susceptible de utilizar en cualquier tejido sujeto a la transgénesis, transfección o infección viral mediada. Los tintes están limitados por costos de preparaciones individuales y protocolos de aplicación potencialmente complicada que no transmitan ninguna especificidad celular en tejidos heterogéneos. Electrodos ion-selectivos requieren equipo especializado para la fabricación y medición, mientras que pHerry requiere solamente widefield epifluorescente microscopia con convencional GFP y RFP filtran de conjuntos. Uso de colorantes y electrodos requieren física así como de acceso óptico para el tejido de interés, mientras que GEpHIs puede ser monitoreado en los tejidos recién extraídos y sobre el tiempo en vivo. La oportunidad para la proyección de imagen vivo en preparaciones intactas es de particular interés cuando la evaluación de la fisiología celular de pH regulación como ninguna otra tecnología permite cuantificación de pH en presencia de buffering endógena mecanismos.
La preparación de MT adulto Drosophila presenta muchas características atractivas para los interesados en pH celular regulación y ion transporte. Cría de Drosophila es barato y herramientas tales como construcciones de biosensor genéticamente codificado y ARNi expresión insertos están disponibles de una variedad de centros de acción (Bloomington Drosophila Stock Center de Indiana University; Viena Drosophila centro de investigación). Drosophila MTs se componen de una sola capa de células epiteliales polarizadas, lo que es ideal para la investigación del transporte de iónico transepitelial. Transporte basolateral puede fácilmente ensayar (como se muestra aquí) pero la evaluación completa del apical y basolateral movimiento de iones es posible con una micropipeta canulación41. Además, la función del órgano ensayos como Ramsay secreción ensayo17 y la deposición de oxalato de calcio luminal18 están bien caracterizados y permitan la correlación de la fisiología celular epitelial a los modelos de la secreción de fluidos y nefrolitiasis, respectivamente. Mientras que estas características proporcionan oportunidades para el análisis, el bajo costo y amplia disponibilidad de microscopía epifluorescente hace el modelo Drosophila MT ideal para demostraciones de fisiología celular y de todo órgano en los laboratorios de enseñanza.
Dominio de estos métodos permite la cuantificación de la regulación de pH H+ flujo en adulto Drosophila MTs, un accesible y robusto modelo de transepithelial ion transporte basolateral. Uso de GEpHIs como pHerry puede ser fácilmente adaptado para evaluar Reglamento de pHi en otros tipos de células invertebrados, cultiva las células mamíferas y preparaciones en vivo . Desarrollo de nuevos GEpHIs de indicadores de calcio codificado genéticamente, seguirá probablemente con nuevas generaciones que abarcan el espectro visible y abordar las limitaciones actuales como agregación artefactos30,42, 43 , 44 , 45 , 46 , 47 , 48 , 49. GEpHIs ya se han utilizado extensivamente para Informe matriz mitocondrial pH50,51, y existen estrategias objetivos subcelulares para localizar biosensores en el retículo endoplásmico52, núcleo 53, vesículas sinápticas12,43y el citoplásmico54 y las superficies externas de la membrana plasmática celular55 (ver tabla 2 para una lista de reactivos publicados). Como tal herramientas disponibles permitan integración vertical de la regulación del pH celular con otros aspectos de la fisiología celular, tales como Ca2 + manejo y señalización intracelular y la función del órgano entero a través de una variedad de vertebrados e invertebrados.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por los NIH DK092408 y DK100227 a MFR. AJR fue apoyado por DK007013 T32. Los autores desean agradecer al Dr. Julian A.T. Dow el CapaR-GAL4 y c724-GAL4 poblaciones de Drosophila . También agradecemos a Jacob B. Anderson por ayuda mantener cruces mosca experimentales.
Materiales
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
Referencias
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151 (2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68 (2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. . Fly pushing: the theory and practice of Drosophila genetics. , (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202 (2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897 (2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7 (2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados