SEM-Bildgebung biologischer Proben
Quelle: Peiman Shahbeigi-Roodposhti und Sina Shahbazmohamadi, Biomedical Engineering Department, University of Connecticut, Storrs, Connecticut
Ein Rasterelektronenmikroskop (SEM) ist ein Instrument, das einen Elektronenstrahl verwendet, um leitfreie Abbilder zu bilden und leitfähige Materialien in einem Vakuum zu charakterisieren. Analog dazu ist ein Elektronenstrahl zum SEM als Licht für das optische Mikroskop. Der Unterschied besteht darin, dass das Elektronenmikroskop Bilder mit viel höherer Auflösung und Vergrößerung liefert. Die besten optischen Mikroskope haben in der Regel eine Auflösung von bis zu 200 nm, während SEMs in der Regel eine Auflösung von 0,5 nm beanspruchen. Dies ist darauf zurückzuführen, dass optische Mikroskope durch die Beugung von Wellen begrenzt sind, eine Funktion der Wellenlänge, die für sichtbares Licht etwa 500 nm beträgt. Umgekehrt verwendet das SEM einen energetisierten Elektronenstrahl, der als Wellenlänge von 1 nm. Diese Eigenschaft macht sie zu sehr zuverlässigen Werkzeugen für die Untersuchung von Nano- und Mikrostrukturen. Elektronenmikroskope ermöglichen auch das Studium biologischer Proben mit zu kleinen Merkmalsgrößen für die optische Mikroskopie.
Diese Demonstration bietet eine Einführung in die Probenvorbereitung und die erste Bildaufnahme biologischer Proben mit einem Rasterelektronenmikroskop. In diesem Fall wird ein Kollagen-Hydroxyapatit (HA) Zellgerüst untersucht. Die Vakuumumgebung des SEM und die induzierte Aufladung des Elektronenstrahls auf nichtleitende Proben (z. B. organische Materie) schaffen Herausforderungen, die bei der Vorbereitung angegangen werden. Die Vor- und Nachteile verschiedener bildgebender Verfahren, die sich auf Auflösung, Schärfentiefe und Probentyp beziehen, werden ebenfalls erörtert. Der Zweck dieser Demo besteht darin, dem Teilnehmer mehr Informationen über SEM zu geben, um festzustellen, ob dieses Mikroskopiemodul für eine Art biologischer Probe am besten geeignet ist.
Wenn ein hochenergetischer Elektronenstrahl (typischerweise 5-30 keV) auf eine Probe trifft, wird eine Reihe von Signalen aus der Probe emittiert. Diese Wechselwirkungen können verwendet werden, um Topographie, Kristallographie, elektrisches Potential und lokale Magnetfelder zu studieren. Die Elektronen durchlaufen zwei Arten der Streuung: elastisch und unelastisch. Unelastische Streuung verursacht die Emission von Sekundärelektronen. Diese niederenergetischen Elektronen (ca. 50 eV) sind die äußeren Schalenelektronen der Probenatome, die gerade genug Energie sammeln, um die Oberfläche des Atoms zu verlassen. Die Streuung von Sekundärelektronen liefert topografische Informationen, da der Energiestand der Elektronen, die das Probenatom verlassen, nicht hoch genug ist, um durch die Probe zu reisen. Daher werden vom Detektor nur Oberflächendaten erfasst.
Elastische Streuung hingegen wird nicht durch aus den Probenatomen entfernte Elektronen verursacht. Es ist der Hauptstrahl von Elektronen nach Interaktion mit dem Kern, wie in Abbildung 1 dargestellt. Diese Elektronen ändern nicht ihre Energie oder Geschwindigkeit, aber sie ändern ihre Richtung basierend auf ihrer Interaktion mit dem Kern. Die Detektion dieser Elektronen liefert kompositorische Informationen, und ihr unterschiedlicher Kontrast bei der Interaktion mit Atomen unterschiedlicher Atomgewichte ermöglicht es dem Anwender, Unterschiede in der Probenzusammensetzung zu unterscheiden. In biologischen Proben kann dies verwendet werden, um eingebettete oder befestigte Nanopartikel und Nanostrukturen mit schwereren atomaren Gewichten wie Gold oder Eisen zu untersuchen.
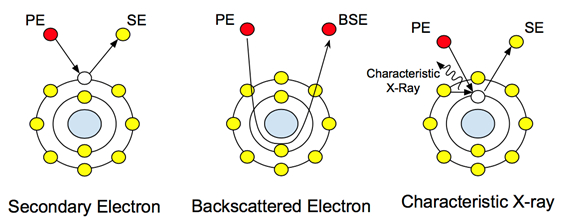
Abbildung 1: Atomare Wechselwirkungen mit den Hauptelektronen (PE) und wie sie die verschiedenen Signale erzeugen.
Die Probenvorbereitung ist ein wichtiges Verfahren, insbesondere für biologische Proben. Um hochauflösende SEM-Bilder zu erhalten, müssen Elektronen die Probe erreichen. Dann müssen die Signale, die das Ergebnis der Interaktion zwischen den Elektronen und der Probe sind, die Detektoren erreichen. Das bedeutet, dass das Gerät unter einem Hochvakuum arbeiten muss, um eine Elektronenstreuung zu verhindern, bevor der Strahl die Probe erreicht und die Signale die Detektoren erreichen. Dieses Vakuum ist hochempfindlich und kann Partikel aus der Probe ziehen, was bedeutet, dass es wichtig ist, sicherzustellen, dass die Probe trocken und frei von Partikeln ist.
Eine weitere Überlegung bei der Probenvorbereitung ist die Art des Elektronenstrahls. Da der Strahl aus hochgeladenen Teilchen besteht, wenn eine nichtleitende Probe mit hochgeladenen Teilchen aus dem Elektronenstrahl bombardiert wird, gibt es eine Ansammlung von Ladungen auf der Oberfläche, die die Ablenkung des Elektronenstrahls beeinflussen und eine große Erhöhung der Strahlstreuung. Durch Beschichten der Probe mit einer leitfähigen Schicht vor der Bildgebung können diese Ladeartefakte im Bild vermieden werden.
Die hier beschriebenen Methoden gelten für die meisten nichtleitenden Materialien. Eine Beschichtung ist notwendig, um Ladeartefakte zu mildern. Das Kollagen-HA-Zellgerüst wurde durch folgende Syntheseschritte hergestellt: Ko-Ausfällung von Kollagen mit HA in das Verbundgel, Güllebildung und Gefrierguss, Vernetzung des Gerüstes und Endtrocknung. Diese Endtrocknung wird über 5 Tage in einem Vakuumtrockner abgeschlossen und trocknet die Probe für die SEM-Analyse ausreichend, ohne die strukturellen Eigenschaften der Gerüste zu beeinträchtigen. Bei der Abbildung von Zellenbesteht das Hauptanliegen bei der Vorbereitung der Probe jedoch darin, die Zellstruktur zu erhalten. Chemische und harzbasierte Fixierungsmethoden werden häufig verwendet, um Zellen zu beobachten und gleichzeitig die Struktur von Zellen zu erhalten, wie z. B. Glutaraldehydfixierung und Epoxid- und Acrylharze. Typischerweise wird Glutaraldehyd als Fixierung verwendet, die Verklinkungen im Zytoplasma von Zellen erzeugt, aber auch einen Rückgang des pH-Werts verursacht. Daher ist eine Pufferung erforderlich, wenn Proben mit Glutaraldehyd vorbereitet werden. Die Zugabe dieser Techniken ermöglicht es der Struktur der Zelle, ihre Struktur am ehesten zu ähneln, als sie noch lebte [3].

Abbildung 2: Gold-Palladium-Sputterlacker mit der Probenkammer (Silbergefäß oben) und Vakuum(links) und Strom (rechts) Messgeräte. Bei diesem Modell wird ein Strom von 2 mA mit einem Kammervakuum von 0,1 Torr verwendet, das mit einem Argon-Leckventil konstant gehalten wird.
1. Probenvorbereitung
- Tragen Sie Handschuhe und treffen Sie Vorsichtsmaßnahmen, um eine Kontamination bei der Handhabung der Probe zu vermeiden.
- Stellen Sie sicher, dass die Probe auf dem Schlitten getrocknet ist und keine Verunreinigung der Probe vorliegt. Dies liegt daran, dass SEM die Oberflächencharakterisierung misst, und diese Defekte können das Signal stark behindern.
- Wenn die Probe auf einem Standard-Glasschlitten geladen wird, verringern Sie die Größe der Probe, indem Sie den Schlitten mit einem Diamant-Gekipptglasschneider in einer geraden Linie punkten und sanft auf die bewertete Linie vom Körper wegdrücken, bis das Glas bricht.
- Je nach Probe wählen Sie eine Beschichtung, die nicht die gleiche Elementarzusammensetzung aufweist (sie würde das von EDS empfangene Signal behindern). Für diese Demonstration wird eine Gold-Palladium-Beschichtung verwendet.
- Verwenden Sie den Sputter-Coater wie angegeben. Lassen Sie die Maschine die Probe für ca. 40 s für eine dünne Beschichtung mit ausreichender Abdeckung sputtern.
- Montieren Sie die Probe mit leitfähigem doppelseitigem Carbonband auf einen SEM-Stub. Dieses Band sollte auch von der Bühne bis zum oberen Rand des Dias platziert werden, das gesputtert wurde, um die Probe zu erden, wenn es auf einem nicht leitenden Dia montiert ist. Eine dünne Schicht leitfähiger Silberfarbe könnte auch verwendet werden, um die Leitfähigkeit der Probe auf die Bühne zu erhöhen.
- Montieren Sie den Stummel auf die Bühne und ziehen Sie die Schraube an der Seite fest.
2. Imaging-Verfahren
- Laden Sie die Bühne in die Kammer. Schließen und versiegeln Sie die Tür. Klicken Sie dann auf die Taste "Transfer", um den Durchgang von der Ladekammer zum Vakuum zu öffnen.
- Sobald der Transferknopf nicht mehr blinkt und die Innentür geöffnet ist, kann die Probe durch Einschrauben der Metallstäbe in die Vakuumkammer bewegt und die Probe in die Kammer geschoben werden.
- Lösen Sie die Stange, ziehen Sie die Stange zurück und befestigen Sie sie vollständig in der Ladekammer, und drücken Sie "Speichern", um die Ladekammer von der Vakuumkammer zu schließen. Das Beispiel wird nun geladen, und der Rest des Prozesses findet von der Computerarbeitsstation aus statt.
- Verschieben Sie die Bühne mit dem Controller und öffnen Sie das Bedienfeld , bis es sich in Ihrem Sichtfeld befindet.
- Verschieben Sie die Probe vertikal, bis der Arbeitsabstand 5-10 mm beträgt. Wenn Sie die Bühne in Z-Richtung bewegen, schalten Sie die Kammerkamera ein, um sicherzustellen, dass Ihre Probe nicht in die Nähe der Elektronenkanone kommt.
- Schalten Sie den Extrahochspannungsstrahl (EHT) ein. Beachten Sie, dass Sie die Spalte möglicherweise auch öffnen müssen, wenn sie eine Weile ausgeschaltet war.
- Wählen Sie das SE2-Signal aus den Detektoroptionen aus.
- Verwenden Sie eine kV-Einstellung von ca. 5 kV für die erstmalige Bildgebung, und erhöhen Sie dann auf 20-30 kV für mehr Signal mit dem Back-Scatter-Modus. Wenn die Probe nicht beschichtet wurde, halten Sie den keV niedrig, um zu viele Ladeartefakte im Bild zu verhindern und Probenschäden zu verhindern.
- Wenn kein klares Bild vorhanden ist, drehen Sie den Fokus, die Helligkeit und die Kontrastknöpfe, bis eine Struktur sichtbar ist. Dies wird eine Referenz für die Verfeinerung sein.
- Drehen Sie den Fokusknopf auf den Grobmodus, bis ein Bild sichtbar ist. Wechseln Sie dann zu Fein, um den besten Fokus zu finden.
- Verwenden Sie die Bühnennavigation (nicht in Z-Richtung) und die Vergrößerung, um einen Bereich zum Speichern eines Bildes zu finden.
- Verringern Sie die Scangeschwindigkeit und drehen Sie die Online-Mittelung, um ein besseres Bild zum Speichern zu erhalten.
- Speichern Sie das Bild, indem Sie mit der rechten Maustaste klicken und an einem Dateispeicherort speichern.
- Fügen Sie den BSD ein, und verschieben Sie die Bühne wieder in eine Z-Position, an der das Sample fokussiert ist.
- Wiederholen Sie die Schritte 8-11, während Sie nach Kontrastbereichen suchen, die auf eine höhere Ordnungszahl hinweisen.
- Entfernen Sie den BSD, wenn Sie fertig sind.
- Wenn Sie bereit sind, das Beispiel zu entfernen, drücken Sie den Button "Austausch".
- Bewegen Sie die Probe zurück in die Ladekammer und drücken Sie "Store" dann "vent".
Die SEM-Bilder in den Abbildungen 3 und 4 zeigen, dass die abgebildete Struktur mit Mikroskalium-Features sehr dreidimensional ist. Die Bildqualität wird durch den Fokus und die Dicke der Sputterbeschichtung beeinflusst.

Abbildung 3: Die folgenden Abbildungen veranschaulichen, wie sich der Beispielfokus auf die Bildqualität auswirken kann. Im Bild rechts steht das gesamte Sichtfeld im Fokus, während es nicht im Fokus der Linken steht. Das Spielen mit Parametern wie dem Fokus kann ein viel besseres Bild liefern.
Abbildung 4: Bilder der Kollagen-Hydroxyapatit-Probe.
Hier demonstrierten wir die Schärfentiefe, das Sichtfeld und die maximale Auflösung und Vergrößerung eines Elektronenmikroskops und wie diese Eigenschaften zur Anzeige biologischer Proben genutzt werden können. Diese Demonstration wurde entwickelt, um den Zuschauern zu helfen, zu entscheiden, welches Mikroskopisierungsmodul für eine bestimmte Anwendung das beste ist. Wie gezeigt, hat SEM eine sehr hohe Konzentrationstiefe, eine viel höhere Auflösung und größere Vergrößerungen. Sie ist jedoch nicht für alle Stichprobentypen geeignet.
Diese Demonstration führte die Prinzipien der Elektronenmikroskopie ein und zeigte mehrere ihrer Anwendungen in Forschungslabors. Elektronenmikroskope werden zur Inspektion, Charakterisierung und Qualitätskontrolle eingesetzt. Sie werden beispielsweise zur Visualisierung von ICs, Leiterplatten, Rissausbreitung und nanoelektromechanischen Systemen verwendet. Auch im Bereich der Biologie spielen diese Instrumente eine Schlüsselrolle. Es gibt sogar Elektronenmikroskope, die speziell für die Aufnahme nasser biologischer Proben entwickelt wurden. Diese biologischen Proben reichen von Geweben bis hin zu Knochen, Zellen und Mikroorganismen. Der Einsatz zusätzlicher Detektoren kann noch mehr Analysen ermöglichen, wie z. B. eine präzise Oberflächenanalyse.
Materialliste
| Namen | Unternehmen | Katalognummer | Kommentare |
| Ausrüstung | |||
| Biosample | |||
| Carbon oder Gold-Coater | |||
| Querbalken-SEM | Zeiss | ||
| Kollagen-Hydroxyappetite Zellgerüste | Entwickelt von Wei Laboratory an der University of Connecticut |
- Oatley, C. W., W. C. Nixon, and R. F. W. Pease. "Scanning electron microscopy." Advances in Electronics and Electron Physics 21 (1966): 181-247.
- Goldstein, Joseph, et al. Scanning electron microscopy and X-ray microanalysis: a text for biologists, materials scientists, and geologists. Springer Science & Business Media, 2012.
- Carol Heckman, et al. Preparation of cultural cells for scanning electron microscope. Nature Protocols Network, 2007, doi:10.1038/nprot.2007.504
pringen zu...
Videos aus dieser Sammlung:

Now Playing
SEM-Bildgebung biologischer Proben
Biomedical Engineering
23.5K Ansichten

Bildgebung biologischer Proben mit optischer und konfokaler Mikroskopie
Biomedical Engineering
35.7K Ansichten

Biodistribution von Nano-Wirkstoffträgern: Anwendungen von SEM
Biomedical Engineering
9.3K Ansichten

Hochfrequenz-Ultraschall-Bildgebung der Bauchaorta
Biomedical Engineering
14.4K Ansichten

Abbildung der Dehnungsbelastung eines Bauchaortenaneurysmas
Biomedical Engineering
4.6K Ansichten

Photoakustische Tomographie zur Darstellung von Blut und Lipiden in der infrarenalen Aorta
Biomedical Engineering
5.7K Ansichten

Kardiale Magnetresonanztomographie
Biomedical Engineering
14.7K Ansichten

Numerische Strömungsmechaniksimulationen des Blutflusses in einem zerebralen Aneurysma
Biomedical Engineering
11.7K Ansichten

Nahinfrarot-Fluoreszenz-Bildgebung von Abdominalaortenaneurysmen
Biomedical Engineering
8.2K Ansichten

Nichtinvasive Blutdruckmesstechniken
Biomedical Engineering
11.9K Ansichten

Erfassung und Analyse eines EKG-Signals (Elektrokardiographie)
Biomedical Engineering
104.8K Ansichten

Zugfestigkeit resorbierbarer Biomaterialien
Biomedical Engineering
7.5K Ansichten

Mikro-CT-Bildgebung von Maus-Rückenmark
Biomedical Engineering
8.0K Ansichten

Visualisierung der Kniegelenksdegeneration nach nicht-invasiver Kreuzbandverletzung bei Ratten
Biomedical Engineering
8.2K Ansichten

Kombinierte SPECT- und CT-Bildgebung zur Visualisierung der Herzfunktionalität
Biomedical Engineering
11.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten