Nahinfrarot-Fluoreszenz-Bildgebung von Abdominalaortenaneurysmen
Quelle: Arvin H. Soepriatna1, Kelsey A. Bullens2, und Craig J. Goergen1
1 Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
2 Institut für Biochemie, Purdue University, West Lafayette, Indiana
Die Nahinfrarotfluoreszenz-Bildgebung (NIRF) ist eine aufregende optische Technik, bei der fluoreszierende Sonden komplexe biomolekulare Baugruppen in Geweben visualisiert werden. NIRF-Bildgebung hat gegenüber herkömmlichen bildgebenden Verfahren zur nichtinvasiven Bildgebung von Krankheiten viele Vorteile. Im Gegensatz zur Einzelphotonen-Emissions-Computertomographie (SPECT) und Positronen-Emissionstomographie (PET) ist die NIRF-Bildgebung schnell, mit hohem Durchsatz und beinhaltet keine ionisierende Strahlung. Darüber hinaus bieten die jüngsten Entwicklungen in der Entwicklung zielspezifischer und aktivierbarer Fluoreszenzsonden NIRF eine hohe Spezifität und Empfindlichkeit und machen es zu einer attraktiven Modalität bei der Untersuchung von Krebs und Herz-Kreislauf-Erkrankungen. Das vorgestellte Verfahren soll die Prinzipien der NIRF-Bildgebung aufzeigen und zeigen, wie in vivo- und ex vivo-Experimente an Kleintieren durchgeführt werden, um eine Vielzahl von Krankheiten zu untersuchen. Das hier gezeigte spezifische Beispiel verwendet eine aktivierbare fluoreszierende Sonde für Matrix-Metalloproteinase-2 (MMP2), um seine Aufnahme in zwei verschiedenen Nagetiermodellen von Abdominalaortenaneurysmen (AAAs) zu untersuchen.
Wie der Name schon sagt, nutzt die NIRF-Bildgebung Licht im ersten Nahinfrarotfenster, das von 650 nm bis 900 nm reicht, um Photonen in gewebe zu liefern. Die Energie, E, eines Photons ist durch Gleichung 1 gekennzeichnet, wobei h die Planck-Konstante ist, c die Lichtgeschwindigkeit in einem Vakuum und die Wellenlänge des Lichts.
 =
=  (Gleichung 1)
(Gleichung 1)
Zielspezifische fluoreszierende Moleküle, sogenannte Fluorophore, werden in der Regel durch Gentechnik oder durch Schwanzveneninjektion vor der Bildgebung in das Tier eingeführt. Diese Fluorophore absorbieren Photonenenergie, die die Energie der Moleküle aus dem Bodenzustand, S0,in den instabilen, angeregten Zustand S1' erhebt. Aufgrund der Instabilität desS 1'-Zustands entspannen sich die Moleküle auf das niedrigste Schwingungsenergieniveau innerhalb dieses Zustands und geben Energie in Form von Wärme frei. Die Fluorophore, jetzt im entspannten, aufgeregten Zustand S1, kehren dann in den Bodenzustand S0zurück und emittieren Licht bei einer bestimmten Wellenlänge. Das emittierte Licht, das aufgrund der Energieableitung in Form von Wärme eine längere Wellenlänge hat, wird dann mit einem Fluoreszenz-Bildgebungssystem erfasst und aufgezeichnet. Die grundlegende Verschiebung zwischen Absorptions- und Emissionsspektren wird als Stokes-Verschiebung bezeichnet und ist wichtig, da sie es ermöglicht, zwischen Anregung und Emissionslicht zu unterscheiden.
Das folgende Verfahren enthält detaillierte Schritte, die erforderlich sind, um in vivo- und ex vivo NIRF-Bilder von Kleintieren zu sammeln:
1. Experimentelle Einrichtung
- Verbinden Sie eine Lichtwellenleiter mit dem Fluoreszenz-Bildgebungssystem über eine Lichtleiter.
- Wählen Sie den entsprechenden Anregungsfilter für das Experiment aus. Der Anregungsfilter bestimmt die Wellenlänge des Lichts, das an die Probe geliefert werden soll, und sollte so gewählt werden, dass es dem Anregungsspektrum des in die Probe eingeführten Fluorophors entspricht.
- Wählen Sie den entsprechenden Emissionsfilter aus. Der Emissionsfilter blockiert unerwünschte Spektralkomponenten, die der Autofluoreszenz zugeschrieben werden können, und sollte so gewählt werden, dass sie dem Emissionsspektrum des Fluorophors entspricht.
2. Probenvorbereitung
-
In Vivo
- Anästhetisieren Sie das Tier in einer Induktionskammer mit Isofluran in einer Konzentration von 3-4% auf dem Durchflussmesserzifferblatt.
- Übertragen Sie das Tier auf einen Nasenkegel, der auf dem Bildgebungsstadium fixiert ist, und halten Sie Isofluran in einer Konzentration von 1-2%. Eine Wärmequelle ist nicht notwendig, da die Tiere in der Regel nur für einen kurzen Zeitraum abgebildet werden (> 5 min), und ihre Körpertemperatur nicht wesentlich abnimmt.
- Befestigen Sie die Pfoten des Tieres, um Bewegungsartefakte zu minimieren. Entfernen Sie das Haar aus dem Bereich des Interesses, indem Sie eine Enthaarungscreme auftragen.
- Enthaarungscreme auf den kleinsten Bedarf auftragen. Nach 30 s mit einem Gazepad abwischen. Wischen Sie den Bereich ein zweites Mal mit einem Ethylalkohol befeuchteten Gazepad, um die Enthaarungscreme vollständig zu entfernen.
- Ophthalmologische Salbe auf die Augen auftragen, um das Trocknen der Hornhaut zu verhindern.
- Injizieren Sie die aktivierbare fluoreszierende molekulare Sonde in das Tier. Für diese spezifische Anwendung wurden MMP2-aktivierbare Sonden intravenös in die Schwanzvene injiziert. An diesem Punkt kann die Maus abgebildet werden. Fahren Sie mit dem "Image Acquistion" dieses Protokolls fort, um fortzufahren. Überwachen Sie das Tier während des kurzen Eingriffs auf regelmäßige atmungsaktive s.
-
Ex Vivo
- Nach der Injektion der Fluoreszenzsonde, euthanisieren Sie das Tier auf humane Weise nach den AVMA-Richtlinien von 2013 für die Euthaniasie von Tieren. Die Überdosierung von Kohlendioxid(CO2) ist eine gängige Praxis für die Einschläferne von Kleintieren.
- Chirurgische extrahieren Sie das Gewebe oder Organ von Interesse und sorgfältig entfernen überschüssiges Fettgewebe mit Zange.
- Spülen Sie das Gewebe in Phosphat gepufferte Saline, um Restblut zu entfernen und legen Sie die Probe direkt auf der bildgebenden Bühne.
3. Bildaufnahme
- Öffnen Sie die molekulare Bildgebungssoftware und schalten Sie sowohl die Lichtquelle als auch das Fluoreszenz-Bildgebungssystem ein.
- Öffnen Sie das Erfassungsfenster, und geben Sie die Art der Exposition an, die für die Studie geeignet ist. Zu den verfügbaren Belichtungen gehören: Standardbelichtung zur Aufnahme eines einzelnen Bildes, Time Lapse Exposure zur Erfassung einer Reihe von Bildern über ein festes Zeitintervall und Progressive Belichtung zur Erfassung einer kontinuierlichen Abfolge von Belichtungen zu unterschiedlichen Belichtungszeiten.
- Wählen Sie UV-Transillumination als Beleuchtungsquelle.
- Passen Sie mithilfe des in der Vorschau angezeigten Bildes als Referenz den Fokus der Linse, das Sichtfeld und die Blende in der Aufnahmesystemkammer an, um die abgetastete Bildqualität zu optimieren. Passen Sie die Belichtungszeit und -position der Probe an.
- Schließen Sie das Vorschaufenster, und stellen Sie sicher, dass alle Parameter im Erfassungsfenster mit den Kamera- und Filtereinstellungen übereinstimmen.
- Klicken Sie auf 'Expose', um das Bild zu erfassen und zu speichern.
- Standard-Software für molekulare Bildgebung bietet in der Regel eine Vielzahl von Analyse-, Mess- und Bildkorrekturwerkzeugen, um Fluoreszenzsignale für die Bildanalyse zu quantifizieren.
- Entfernen Sie am Ende der Bildgebungssitzung die Probe/das Tier, schalten Sie das System aus, und reinigen Sie die Bildgebungsphase, um Schäden am System zu minimieren.
Repräsentative in vivo- und ex vivo NIRF-Bilder von Nagetieren mit abdominalen Aortenaneurysmen (AAAs) sind in den Abbildungen 1-2 dargestellt. Eine aktivierbare Fluoreszenzsonde wurde systemisch über die Schwanzvene injiziert, um die Matrix-Metalloproteinase-2-Aktivität (MMP2) zu visualisieren. MMP2 ist ein elastolytisches Enzym, das am Abbau der extrazellulären Matrix beteiligt ist, die eine wichtige Rolle bei der Initiierung und Progression von AAA spielt. Alle Bilder wurden mit einem 625 nm Anregungsfilter, einem 700 nm Emissionsfilter und 60 Sekunden Belichtungszeit aufgenommen.
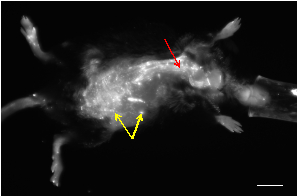
Abbildung 1: Ein repräsentatives in vivo NIRF-Bild einer Apolipoprotein-E-Mangelmaus, die nach infusion von Angiotensin-II eine AAA entwickelte. Die meisten der kleinen Flecken, die ein hohes Signal zeigen, stammen aus hautautofluoreszenz (gelbe Pfeile). Die Vaskulatur kann als röhrenförmige Strukturen mit hohen Fluoreszenzsignalen (roter Pfeil) visualisiert werden. Scalebar: 1 cm.
Abbildung 2 zeigt einen Anstieg der MMP2-Aktivität in der aneurysmalen Region der Bauchaorta, wie die beobachtete Zunahme der Signalintensität im Vergleich zu gesunden Regionen der Bauchaorta zeigt. Dieses Ergebnis stimmt mit den Ergebnissen in der Literatur überein, die erhöhte MMP2-Werte innerhalb von AAAs anzeigen. Überschüssige Fluoreszenzsonden wurden gefiltert und in den Nieren angesammelt, was zu hellen Fluoreszenzsignalen führte.

Abbildung 2: NIRF-Bilder von AAAs aus zwei verschiedenen Tiermodellen: (A) eine suprarenale AAA in Angiotensin II-infundierter Apolipoprotein-E-Mangelmaus und (B) eine infrarote AAA bei Ratte, die mit Schweinepankrease infundiert ist. Gelbe Pfeile zeigen auf die AAAs. Skalenbalken: 3 mm.
Die NIRF-Bildgebung stützt sich auf fluoreszierende Sonden, um biomolekulare Baugruppen in Geweben zu quantifizieren und zu visualisieren. Absorbierte Photonenenergie aus Nahinfrarotlicht regt fluoreszierende Moleküle zu einem höheren Energiezustand an, und das emittierte Licht mit einer längeren charakteristischen Wellenlänge wird durch ein Fluoreszenz-Bildgebungssystem erfasst. Hier wurde die Anwendung der NIRF-Bildgebung zur Untersuchung der MMP2-Aktivität bei abdominalen Aortenaneurysmen in vivo und ex vivonachgewiesen. Im Gegensatz zu SPECT oder PET, die als Goldstandards bei der Untersuchung von Stoffwechselprozessen im Körper nicht-invasiv gelten, ist NIRF-Bildgebung eine schnelle und hochdurchsatzige Bildgebungstechnik, die keine ionisierende Strahlung beinhaltet. Eine der Einschränkungen dieser Modalität ist ihre relativ geringe Eindringtiefe. Obwohl diese Einschränkung die klinische Bildgebung von tiefen Geweben schwierig macht, spielt die NIRF-Bildgebung eine wichtige Rolle bei der Untersuchung von Tumoren und Herz-Kreislauf-Erkrankungen bei Kleintieren.
Angesichts der entsprechenden Fluoreszenzsonde können viele molekulare Strukturen mithilfe der vorgestellten NIRF-Bildgebungsverfahren visualisiert werden, um sowohl die Krankheitsinitiierung als auch das Fortschreiten in Kleintiermodellen zu untersuchen. Spezifische Ex-vivo- und In-vivo-Anwendungen umfassen 1) Die Bewertung der MMP-Aktivität in der Nagetiervaskulatur, 2) die Früherkennung von Tumoren bei verschiedenen Krebsarten und 3) die Bewertung der Nanopartikel-Pharmakokinetik und Der Bioverteilung für therapeutische Anwendungen. Zusätzlich zur erhöhten MMP2-Aktivität innerhalb von AAAs wurden andere MMP-Fluoreszenzsonden eingesetzt, um die Progression der Arteriosklerose zu untersuchen und die kardiale extrazelluläre Matrixzusammensetzung nach einem Myokardinfarkt zu charakterisieren. Darüber hinaus wurde das Fluorophor-Indocyaningrün verwendet, um Gewebeperfusion in murinen Modellen der Hinterbleibs-Ischämie zu untersuchen. Um mehr über die Anwendung der NIRF-Bildgebung bei der Krebsfrüherkennung zu erarbeiten, können tumororientierte NIRF-Farbstoffe verwendet werden, um Tumormargen zu bewerten und bei Resektionsverfahren zu helfen. Die Integration von Nahinfrarot-Fluorophoren in Nanopartikel, die für die Arzneimittelabgabe entwickelt wurden, ermöglicht es Wissenschaftlern, effektivere Nanopartikel-basierte Therapeutika für eine Vielzahl von Krankheiten zu entwickeln. Schließlich ist die Fähigkeit, das fluoreszierende Signal in ganzen Tieren oder intaktem Gewebe räumlich zu lokalisieren, ein klarer Vorteil gegenüber anderen herkömmlichen enzymatischen Assays (Gelzymographie) und Proteinanalysen (Westlicher Fleck), die eine Opferung der Tiere und eine Homogenisierung des Gewebes erfordern.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Nahinfrarot-Fluoreszenz-Bildgebung von Abdominalaortenaneurysmen
Biomedical Engineering
8.2K Ansichten

Bildgebung biologischer Proben mit optischer und konfokaler Mikroskopie
Biomedical Engineering
35.7K Ansichten

SEM-Bildgebung biologischer Proben
Biomedical Engineering
23.5K Ansichten

Biodistribution von Nano-Wirkstoffträgern: Anwendungen von SEM
Biomedical Engineering
9.3K Ansichten

Hochfrequenz-Ultraschall-Bildgebung der Bauchaorta
Biomedical Engineering
14.4K Ansichten

Abbildung der Dehnungsbelastung eines Bauchaortenaneurysmas
Biomedical Engineering
4.6K Ansichten

Photoakustische Tomographie zur Darstellung von Blut und Lipiden in der infrarenalen Aorta
Biomedical Engineering
5.7K Ansichten

Kardiale Magnetresonanztomographie
Biomedical Engineering
14.7K Ansichten

Numerische Strömungsmechaniksimulationen des Blutflusses in einem zerebralen Aneurysma
Biomedical Engineering
11.7K Ansichten

Nichtinvasive Blutdruckmesstechniken
Biomedical Engineering
11.9K Ansichten

Erfassung und Analyse eines EKG-Signals (Elektrokardiographie)
Biomedical Engineering
104.8K Ansichten

Zugfestigkeit resorbierbarer Biomaterialien
Biomedical Engineering
7.5K Ansichten

Mikro-CT-Bildgebung von Maus-Rückenmark
Biomedical Engineering
8.0K Ansichten

Visualisierung der Kniegelenksdegeneration nach nicht-invasiver Kreuzbandverletzung bei Ratten
Biomedical Engineering
8.2K Ansichten

Kombinierte SPECT- und CT-Bildgebung zur Visualisierung der Herzfunktionalität
Biomedical Engineering
11.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten