Imagerie d'échantillons biologiques par MEB
Vue d'ensemble
Source : Peiman Shahbeigi-Roodposhti et Sina Shahbazmohamadi, Département de génie biomédical, Université du Connecticut, Storrs, Connecticut
Un microscope électronique à balayage (SEM) est un instrument qui utilise un faisceau d'électrons pour imager et caractériser les matériaux conductrices dans le vide. Comme analogie, un faisceau d'électrons est à la SEM comme la lumière est au microscope optique. La différence est que le microscope électronique donne des images de résolution et de grossissement beaucoup plus élevés. Les meilleurs microscopes optiques ont généralement une résolution jusqu'à 200 nm, tandis que les SEM revendiquent généralement une résolution de 0,5 nm. Cela est dû au fait que les microscopes optiques sont limités par la diffraction des ondes, fonction de la longueur d'onde, qui est d'environ 500 nm pour la lumière visible. Inversement, le SEM utilise un faisceau d'électrons sous tension, qui comme longueur d'onde de 1 nm. Cette caractéristique en fait des outils très fiables pour l'étude des nanostructures et des microstructures. Les microscopes électroniques permettent également l'étude d'échantillons biologiques dont la taille des caractéristiques est trop petite pour la microscopie optique.
Cette démonstration offre une introduction à la préparation d'échantillons et à l'acquisition initiale d'échantillons biologiques à l'aide d'un microscope électronique à balayage. Dans ce cas, un échafaudage cellulaire collagène-hydroxyapatite (HA) sera étudié. L'environnement sous vide du SEM et la charge induite par le faisceau d'électrons sur des échantillons non-conductifs (tels que la matière organique) créent des défis qui seront abordés dans la préparation. Les avantages et les inconvénients des différentes méthodes d'imagerie en ce qui concerne la résolution, la profondeur de mise au point et le type d'échantillon seront également discutés. Le but de cette démonstration est de donner au participant plus d'informations sur SEM pour déterminer si ce module de microscopie est le meilleur ajustement pour un type d'échantillon biologique.
Principles
Lorsqu'un faisceau d'électrons à haute énergie (généralement de 5 à 30 keV) atteint un échantillon, une gamme de signaux sont émis par l'échantillon. Ces interactions peuvent être utilisées pour étudier la topographie, la cristallographie, le potentiel électrique et les champs magnétiques locaux. Les électrons subissent deux types de diffusion : élastique et inélastique. La diffusion inélastique provoque l'émission d'électrons secondaires. Ces électrons à faible énergie (50 eV) sont les électrons de coquille externe des atomes d'échantillon qui acquièrent juste assez d'énergie pour quitter la surface de l'atome. La diffusion d'électrons secondaires fournit des informations topographiques, car le niveau d'énergie des électrons quittant l'atome de l'échantillon n'est pas assez élevé pour voyager à travers l'échantillon. Par conséquent, seules les informations de niveau de surface sont recueillies par le détecteur.
La diffusion élastique, d'autre part, n'est pas causée par des électrons délogés des atomes de l'échantillon. C'est le principal faisceau d'électrons après interaction avec le noyau, comme on le voit dans la figure 1. Ces électrons ne changent pas leur énergie ou leur vitesse, mais ils changent de direction en fonction de leur interaction avec le noyau. La détection de ces électrons fournit des informations de composition, et leur contraste variable sur l'interaction avec les atomes de différents poids atomiques permet à l'utilisateur de distinguer les différences dans la composition de l'échantillon. Dans les échantillons biologiques, cela peut être utilisé pour étudier les nanoparticules et les nanostructures intégrées ou attachées avec des poids atomiques plus lourds, tels que l'or ou le fer.
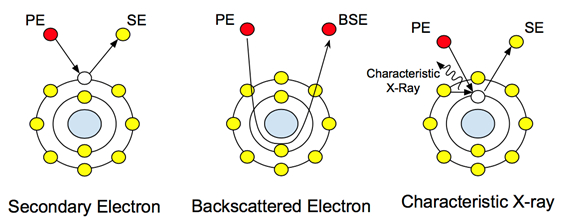
Figure 1 : Interactions atomiques avec les principaux électrons (PE) et comment ils créent les différents signaux.
La préparation des échantillons est une procédure importante, en particulier pour les échantillons biologiques. Pour obtenir des images SEM à haute résolution, les électrons doivent atteindre l'échantillon. Ensuite, les signaux qui sont le résultat de l'interaction entre les électrons et l'échantillon doivent atteindre les détecteurs. Cela signifie que l'instrument doit fonctionner sous un vide élevé pour empêcher la diffusion d'électrons avant que le faisceau n'atteigne l'échantillon et que les signaux atteignent les détecteurs. Ce vide est très sensible et peut extraire les particules de l'échantillon, ce qui signifie qu'il est important de s'assurer que l'échantillon est sec et exempt de particules.
Une autre considération dans la préparation de l'échantillon est la nature du faisceau d'électrons. Parce que le faisceau est composé de particules très chargées, Quand un échantillon non-conducteur est bombardé de particules très chargées du faisceau d'électrons, il ya une accumulation de charges sur la surface qui affectent la déviation du faisceau d'électrons et de provoquer une grande augmentation de la diffusion du faisceau. En enrobant l'échantillon d'une couche conductrice avant l'imagerie, ces artefacts de charge dans l'image peuvent être évités.
Les méthodes décrites ici s'appliquent à la plupart des matériaux non-conducteurs. Un revêtement est nécessaire pour atténuer les artefacts de charge. L'échafaudage cellulaire collagène-HA a été fait par les étapes de synthèse suivantes : co-précipitation de collagène avec HA dans le gel composite, création de boue et coulée de gel, liaison croisée de l'échafaudage et séchage final. Ce séchage final est effectué sur 5 jours dans un séchoir à vide et sèche suffisamment l'échantillon pour l'analyse SEM sans affecter les propriétés structurelles des échafaudages. Cependant, lors de l'imagerie des cellules, la principale préoccupation lors de la préparation de l'échantillon est de préserver la structure cellulaire. Les méthodes de fixation chimiques et à base de résine sont couramment utilisées pour observer les cellules tout en préservant la structure des cellules, telles que la fixation du glutaraldéhyde et les résines époxy et acrylique. Typiquement, le glutaraldéhyde est utilisé comme un fixatif qui crée des liens croisés dans le cytoplasme des cellules, mais provoque également une baisse du pH. Par conséquent, la mise en mémoire tampon est nécessaire lors de la préparation d'échantillons avec du glutaraldéhyde. L'ajout de ces techniques permet à la structure de la cellule de ressembler le plus à sa structure lorsqu'elle était vivante [3].

Figure 2 : Enduit de crachat d'or-palladium montrant la chambre d'échantillon (navire argenté sur le dessus) et les jauges à vide (à gauche) et à courant (à droite). Dans ce modèle, un courant de 2 mA est utilisé avec un vide de chambre de 0,1 torr, qui est maintenu constant à l'aide d'une soupape de fuite d'argon.
Procédure
1. Préparation de l'échantillon
- Portez des gants et prenez des précautions pour éviter toute contamination lors de la manipulation de l'échantillon.
- Assurez-vous que l'échantillon sur la lame est séché et qu'il n'y a pas de contamination sur l'échantillon. C'est parce que SEM mesure la caractérisation de surface, et ces défauts peuvent sérieusement entraver le signal.
- Si l'échantillon est chargé sur une glissière de verre standard, diminuer la taille de l'échantillon en marquant la diapositive avec un coupe-verre à pointe de diamant en ligne droite et pousser doucement sur la ligne marquée loin du corps jusqu'à ce que le verre se fracture.
- Selon l'échantillon, choisissez un revêtement qui n'a pas la même composition élémentaire (cela entraverait le signal reçu par EDS). Pour cette démonstration, un revêtement or-palladium est utilisé.
- Utilisez le peleur de claquement comme indiqué. Laissez la machine cracher l'échantillon pour environ 40 s pour un revêtement mince avec une couverture adéquate.
- Montez l'échantillon sur un talon SEM à l'aide d'un ruban de carbone conducteur à double face. Cette bande doit également être placée de la scène vers le haut de la glissière qui a été pulvée pour broyer l'échantillon si elle est montée sur une glissière non conductrice. Une fine couche de peinture argentée conductrice pourrait également être utilisée pour augmenter la conductivité de l'échantillon jusqu'à la scène.
- Montez le talon sur la scène et serrez la vis sur le côté.
2. Procédure d'imagerie
- Chargez la scène dans la chambre. Fermez et scellez la porte. Appuyez ensuite sur le bouton "Transfert" pour ouvrir le passage de la chambre de chargement au vide.
- Une fois que le bouton de transfert cesse de clignoter et que la porte interne est ouverte, l'échantillon peut être déplacé dans la chambre à vide en baisant dans les tiges métalliques et en poussant l'échantillon dans la chambre.
- Dévisser la tige, rétracter et fixer la tige entièrement dans la chambre de chargement, et appuyez sur "magasin" pour fermer la chambre de chargement de la chambre à vide. L'échantillon est maintenant chargé et le reste du processus a lieu à partir du poste de travail de l'ordinateur.
- Déplacez la scène à l'aide du contrôleur et en ouvrant le panneau de navigation de scène jusqu'à ce qu'il soit dans votre champ de vision.
- Déplacez l'échantillon verticalement jusqu'à ce que la distance de travail soit de 5 à 10 mm. Lorsque vous déplacez la scène dans la direction z, allumez la caméra de chambre pour vous assurer que votre échantillon ne se rapproche pas du pistolet à électrons.
- Activez le faisceau de tension extra-haute (EHT). Notez que vous devrez peut-être également ouvrir la colonne si elle a été éteinte pendant un certain temps.
- Sélectionnez le signal SE2 à partir des options de détecteur.
- Utilisez un réglage kV d'environ 5 kV pour l'imagerie initiale, puis augmentez à 20-30 kV pour plus de signal en utilisant le mode de diffusion arrière. Si l'échantillon n'a pas été enduit, gardez le keV bas pour éviter un trop grand nombre d'artefacts de charge dans l'image et pour éviter les dommages de l'échantillon.
- S'il n'y a pas d'image claire, tournez la mise au point, la luminosité et les boutons de contraste jusqu'à ce qu'une structure soit visible. Ce sera une référence pour le raffinement.
- Tournez le bouton de mise au point en mode grossier jusqu'à ce qu'une image soit visible. Ensuite, passez à l'amende pour trouver la meilleure mise au point.
- Utilisez la navigation d'étape (pas dans la direction z) et le grossissement pour trouver une zone pour enregistrer une image à partir.
- Diminuez la vitesse d'analyse et tournez sur la moyenne de ligne pour acquérir une meilleure image pour l'enregistrement.
- Enregistrez l'image en cliquant à droite et en enregistrant dans un fichier.
- Insérez le BSD et déplacez la scène vers une position z où l'échantillon est concentré.
- Répétez les étapes 8-11 tout en recherchant des zones de contraste qui indiquent un nombre atomique plus élevé.
- Retirez le BSD une fois terminé.
- Lorsque vous êtes prêt à retirer l'échantillon, appuyez sur le bouton « échange ».
- Déplacez l'échantillon dans la chambre de chargement et appuyez sur «magasin» puis «vent».
Résultats
Les images SEM des figures 3 et 4 montrent que la structure imagelée est très tridimensionnelle avec des caractéristiques micro-échelle. La qualité de l'image est affectée par la mise au point et l'épaisseur du revêtement de pulvérisation.

Figure 3 : Les images suivantes montrent comment la mise au point de l'échantillon peut affecter la qualité de l'image. Dans l'image de droite, tout le champ de vision est au point, alors qu'il est flou sur la gauche. Jouer avec des paramètres comme la mise au point peut fournir une image beaucoup mieux.
Figure 4: Images de l'échantillon de collagène-hydroxyapatite.
Applications et Résumé
Ici, nous avons démontré la profondeur de mise au point, le champ de vision et la résolution maximale et le grossissement d'un microscope électronique et comment ces propriétés peuvent être utilisées pour voir des échantillons biologiques. Cette démonstration a été conçue pour aider les téléspectateurs à décider quel module de microscopie est le meilleur pour une certaine application. Comme démontré, SEM a une très haute profondeur de mise au point, une résolution beaucoup plus élevée et de plus grands grossissements. Cependant, il n'est pas approprié pour tous les types d'échantillons.
Cette démonstration a introduit les principes de la microscopie électronique et a montré plusieurs de leurs applications dans les laboratoires de recherche. Les microscopes électroniques sont utilisés pour l'inspection, la caractérisation et le contrôle de la qualité. Par exemple, ils sont utilisés pour visualiser les IC, les circuits imprimés, la propagation des fissures et les systèmes nanoélectromécaniques. Dans le domaine de la biologie, ces instruments jouent également un rôle clé. Il existe même des microscopes électroniques spécialement conçus pour accueillir des échantillons biologiques humides. Ces échantillons biologiques vont des tissus aux os, aux cellules et aux micro-organismes. L'utilisation de détecteurs supplémentaires peut permettre encore plus d'analyse, comme une analyse précise de la surface.
Liste des matériaux
| Nom | Société | Numéro de catalogue | Commentaires |
| Équipement | |||
| Biosample | |||
| Enduit de carbone ou d'or | |||
| Poutre transversale-SEM | Zeiss | ||
| Échafaudages cellulaires Collagène-Hydroxyappetite | Développé par Wei Laboratory à l'Université du Connecticut |
References
- Oatley, C. W., W. C. Nixon, and R. F. W. Pease. "Scanning electron microscopy." Advances in Electronics and Electron Physics 21 (1966): 181-247.
- Goldstein, Joseph, et al. Scanning electron microscopy and X-ray microanalysis: a text for biologists, materials scientists, and geologists. Springer Science & Business Media, 2012.
- Carol Heckman, et al. Preparation of cultural cells for scanning electron microscope. Nature Protocols Network, 2007, doi:10.1038/nprot.2007.504
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
23.5K Vues

Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
35.7K Vues

Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.3K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.4K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.7K Vues

Imagerie par résonance magnétique cardiaque
Biomedical Engineering
14.7K Vues

Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.7K Vues

Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.2K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
11.9K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
104.8K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.5K Vues

Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.0K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.2K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.0K Vues