Imágenes con MEB de muestras biológicas
Visión general
Fuente: Peiman Shahbeigi-Roodposhti y Sina Shahbazmohamadi, Departamento de Ingeniería Biomédica, Universidad de Connecticut, Storrs, Connecticut
Un microscopio electrónico de barrido (SEM) es un instrumento que utiliza un haz de electrones para la imagen no destructiva y caracterizar materiales conductores en un vacío. Como analogía, un haz de electrones es al SEM como la luz es al microscopio óptico. La diferencia es que el microscopio electrónico produce imágenes de resolución y aumento mucho más altas. Los mejores microscopios ópticos suelen tener una resolución de hasta 200 nm, mientras que los SEM suelen reclamar una resolución de 0,5 nm. Esto se debe al hecho de que los microscopios ópticos están limitados por la difracción de ondas, una función de la longitud de onda, que es alrededor de 500 nm para la luz visible. Por el contrario, el SEM utiliza un haz de electrones energizado, que como una longitud de onda de 1 nm. Esta característica las hace herramientas muy fiables para el estudio de nano y microestructuras. Los microscopios electrónicos también permiten el estudio de muestras biológicas con tamaños de características demasiado pequeños para la microscopía óptica.
Esta demostración proporciona una introducción a la preparación de muestras y la adquisición inicial de imágenes de muestras biológicas utilizando un microscopio electrónico de barrido. En este caso, se estudiará un andamio celular de colágeno-hidroxiapatita (HA). El entorno de vacío de la SEM y la carga inducida por el haz de electrones en muestras no conductoras (como la materia orgánica) crea desafíos que se abordarán en la preparación. También se discutirán las ventajas y desventajas de los diferentes métodos de diagnóstico por imágenes relacionados con la resolución, la profundidad de enfoque y el tipo de muestra. El propósito de esta demostración es dar al participante más información sobre SEM para determinar si este módulo de microscopía es el más adecuado para un tipo de muestra biológica.
Principios
Cuando un haz de electrones de alta energía (normalmente que oscila entre 5-30 keV) golpea una muestra, se emite una gama de señales de la muestra. Estas interacciones se pueden utilizar para estudiar la topografía, la cristalografía, el potencial eléctrico y los campos magnéticos locales. Los electrones se someten a dos tipos de dispersión: elástico e inelástico. La dispersión inelástica provoca la emisión de electrones secundarios. Estos electrones de baja energía (50 eV) son los electrones de la cáscara externa de los átomos de muestra que adquieren la suficiente energía para salir de la superficie del átomo. La dispersión de electrones secundarios proporciona información topográfica, ya que el nivel de energía de los electrones que salen del átomo de muestra no es lo suficientemente alto como para viajar a través de la muestra. Por lo tanto, el detector solo recopila información sobre el nivel de superficie.
La dispersión elástica, por otro lado, no es causada por electrones desalojados de los átomos de la muestra. Es el haz principal de electrones después de la interacción con el núcleo, como se ve en la Figura 1. Estos electrones no cambian su energía o velocidad, pero sí cambian su dirección en función de su interacción con el núcleo. La detección de estos electrones proporciona información compositiva, y su contraste variable tras la interacción con átomos de diferentes pesos atómicos permite al usuario distinguir las diferencias en la composición de la muestra. En muestras biológicas, esto se puede utilizar para estudiar nanopartículas y nanoestructuras incrustadas o unidas con pesos atómicos más pesados, como el oro o el hierro.
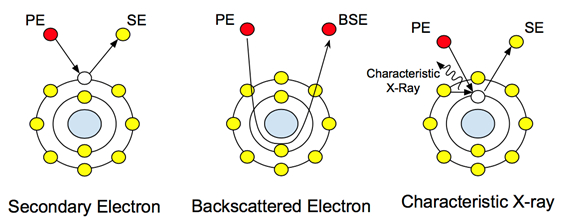
Figura 1: Interacciones atómicas con los electrones principales (PE) y cómo crean las diferentes señales.
La preparación de muestras es un procedimiento importante, especialmente para muestras biológicas. Para obtener imágenes SEM de alta resolución, los electrones necesitan llegar a la muestra. Entonces, las señales que son el resultado de la interacción entre los electrones y la muestra necesitan llegar a los detectores. Esto significa que el instrumento debe trabajar bajo un alto vacío para evitar la dispersión de electrones antes de que el haz llegue a la muestra y las señales lleguen a los detectores. Este vacío es altamente sensible y puede extraer partículas de la muestra, lo que significa que es importante asegurarse de que la muestra esté seca y libre de partículas.
Otra consideración en la preparación de muestras es la naturaleza del haz de electrones. Debido a que el haz se compone de partículas altamente cargadas, Cuando una muestra no conductiva es bombardeada con partículas altamente cargadas del haz de electrones, hay una acumulación de cargas en la superficie que afectan la desviación del haz de electrones y causan una gran aumento de la dispersión del haz. Al recubrir la muestra con una capa conductora antes de tomar imágenes, se pueden evitar estos artefactos de carga en la imagen.
Los métodos descritos aquí son aplicables a la mayoría de los materiales no conductores. Un recubrimiento es necesario para mitigar los artefactos de carga. El andamio celular colágeno-HA se realizó mediante los siguientes pasos de síntesis: co-precipitación de colágeno con HA en el gel compuesto, creación de lodos y fundición por congelación, reticulación del andamio y secado final. Este secado final se completa durante 5 días en una secadora al vacío y seca suficientemente la muestra para el análisis SEM sin afectar las propiedades estructurales de los andamios. Sin embargo, cuando se toma imágenes de las células, la principal preocupación al preparar la muestra es preservar la estructura celular. Los métodos de fijación químicos y a base de resina se utilizan comúnmente para observar las células mientras se preserva la estructura de las células, como la fijación de glutaraldehído y resinas epoxi y acrílicas. Típicamente, el glutaraldehído se utiliza como un fijador que crea vínculos cruzados en el citoplasma de las células, pero también causa una caída en el pH. Por lo tanto, el almacenamiento en búfer es necesario al preparar muestras con glutaraldehído. La adición de estas técnicas permite que la estructura de la célula se asemeje más a su estructura cuando estaba viva [3].

Figura 2: Revestimiento de esputo de oro-paladio que muestra la cámara de muestra (vaso de plata en la parte superior) y los medidores de vacío (izquierda) y corriente (derecha). En este modelo, se utiliza una corriente de 2 mA con un vacío de cámara de 0,1 torr, que se mantiene constante utilizando una válvula de fuga de argón.
Procedimiento
1. Preparación de muestras
- Use guantes y tome precauciones para evitar la contaminación al manipular la muestra.
- Asegúrese de que la muestra de la diapositiva esté seca y de que no haya contaminación en la muestra. Esto se debe a que SEM mide la caracterización de la superficie, y estos defectos pueden obstaculizar gravemente la señal.
- Si la muestra está cargada en un portaobjetos de vidrio estándar, disminuya el tamaño de la muestra anotando la diapositiva con un cortador de vidrio con punta de diamante en línea recta y empuje suavemente la línea puntuada lejos del cuerpo hasta que el vidrio se fracture.
- Dependiendo de la muestra, elija un recubrimiento que no tenga la misma composición elemental (que obstaculizaría la señal recibida por EDS). Para esta demostración, se utiliza un recubrimiento de oro-paladio.
- Utilice el revestimiento de esputo como se indica. Deje que la máquina instor la muestra durante unos 40 s para un recubrimiento fino con una cobertura adecuada.
- Monte la muestra en un talón SEM utilizando cinta de carbono conductor a doble cara. Esta cinta también debe colocarse desde el escenario hasta la parte superior de la diapositiva que fue saltered para atierra la muestra si está montada en una diapositiva no conductora. También se podría utilizar una fina capa de pintura de plata conductora para aumentar la conductividad de la muestra al escenario.
- Monte el talón en el escenario y apriete el tornillo en el lateral.
2. Procedimiento de imagen
- Cargue el escenario en la cámara. Cierra y cierra la puerta. A continuación, pulse el botón "Transferir" para abrir el paso de la cámara de carga al vacío.
- Una vez que el botón de transferencia deja de parpadear y la puerta interna está abierta, la muestra se puede mover a la cámara de vacío atornillando las barras de metal y empujando la muestra en la cámara.
- Desenrosque la varilla, retraiga y fije la varilla completamente en la cámara de carga y presione "store" para cerrar la cámara de carga de la cámara de vacío. El ejemplo se carga ahora y el resto del proceso tiene lugar desde la estación de trabajo del equipo.
- Mueva el escenario con el controlador y abriendo el panel de navegación del escenario hasta que esté en su campo de visión.
- Mueva la muestra verticalmente hasta que la distancia de trabajo sea de 5-10 mm. Cuando mueva el escenario en la dirección z, encienda la cámara de la cámara para asegurarse de que la muestra no se acerque a la pistola de electrones.
- Encienda el haz de tensión extra alta (EHT). Tenga en cuenta que es posible que también deba abrir la columna si ha estado desactivada durante un tiempo.
- Seleccione la señal SE2 en las opciones del detector.
- Utilice un ajuste de kV de aproximadamente 5 kV para la toma de imágenes iniciales y, a continuación, aumente a 20-30 kV para obtener más señal utilizando el modo de dispersión inversa. Si la muestra no estaba recubierta, mantenga el keV bajo para evitar demasiados artefactos de carga en la imagen y para evitar daños en la muestra.
- Si no hay una imagen clara, gire las perillas de enfoque, brillo y contraste hasta que una estructura sea visible. Esto será una referencia para el refinamiento.
- Gire la perilla de enfoque en modo grueso hasta que una imagen sea visible. A continuación, cambie a fi no para encontrar el mejor enfoque.
- Utilice la navegación por etapas (no en la dirección z) y la ampliación para encontrar un área desde la que guardar una imagen.
- Disminuya la velocidad de escaneo y active el promedio de línea para adquirir una mejor imagen para guardar.
- Guarde la imagen haciendo clic con el botón derecho y guardarla en una ubicación de archivo.
- Inserte el BSD y mueva el escenario de nuevo a una posición z donde se enfoca la muestra.
- Repita los pasos 8-11 mientras busca áreas de contraste que indiquen un número atómico más alto.
- Retire el BSD cuando haya terminado.
- Cuando esté listo para eliminar la muestra, pulse el botón "intercambio".
- Vuelva a mover la muestra a la cámara de carga y pulse "store" y luego "vent".
Resultados
Las imágenes SEM de las figuras 3 y 4 muestran que la estructura de imágenes es altamente tridimensional con características de microescala. La calidad de la imagen se ve afectada por el enfoque y el grosor del recubrimiento del sputter.

Figura 3: Las siguientes imágenes muestran cómo el enfoque de la muestra puede afectar a la calidad de la imagen. En la imagen de la derecha, todo el campo de visión está enfocado, mientras que está fuera de foco a la izquierda. Jugar con parámetros como el enfoque puede proporcionar una imagen mucho mejor.
Figura 4: Imágenes de la muestra de colágeno-hidroxiapatita.
Aplicación y resumen
Aquí demostramos la profundidad de enfoque, campo de visión y la máxima resolución y ampliación de un microscopio electrónico y cómo estas propiedades se pueden utilizar para ver muestras biológicas. Esta demostración fue diseñada para ayudar a los espectadores a decidir qué módulo de microscopía es el mejor para una determinada aplicación. Como se ha demostrado, SEM tiene una profundidad de enfoque muy alta, una resolución mucho más alta y mayores aumentos. Sin embargo, no es adecuado para todos los tipos de muestra.
Esta demostración introdujo los principios de la microscopía electrónica y mostró varias de sus aplicaciones en laboratorios de investigación. Los microscopios electrónicos se utilizan para la inspección, caracterización y control de calidad. Por ejemplo, se utilizan para visualizar circuitos integrados, placas de circuitos, propagación de grietas y sistemas nanoelectromecánicos. En el campo de la biología, estos instrumentos también juegan un papel clave. Incluso hay microscopios electrónicos especialmente diseñados para acomodar muestras biológicas húmedas. Estas muestras biológicas van desde tejidos hasta huesos, células y microorganismos. El uso de detectores adicionales puede permitir aún más análisis, como un análisis preciso de la superficie.
Lista de materiales
| Nombre | Empresa | Número de catálogo | Comentarios |
| Equipo | |||
| Biomuestra | |||
| Recubridor de carbono o oro | |||
| Viga cruzada-SEM | Zeiss | ||
| Andamios celulares de colágeno-hidroxiapetito | Desarrollado por Wei Laboratory de la Universidad de Connecticut |
Referencias
- Oatley, C. W., W. C. Nixon, and R. F. W. Pease. "Scanning electron microscopy." Advances in Electronics and Electron Physics 21 (1966): 181-247.
- Goldstein, Joseph, et al. Scanning electron microscopy and X-ray microanalysis: a text for biologists, materials scientists, and geologists. Springer Science & Business Media, 2012.
- Carol Heckman, et al. Preparation of cultural cells for scanning electron microscope. Nature Protocols Network, 2007, doi:10.1038/nprot.2007.504
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Imágenes con MEB de muestras biológicas
Biomedical Engineering
23.5K Vistas

Obtención de imágenes de muestras biológicas con microscopía óptica y confocal
Biomedical Engineering
35.7K Vistas

Biodistribución de nanotransportadores de fármacos: Aplicaciones del MEB
Biomedical Engineering
9.3K Vistas

Imágenes por ultrasonido de alta frecuencia de la aorta abdominal
Biomedical Engineering
14.4K Vistas

Mapeo cuantitativo de la deformación de un aneurisma de la aorta abdominal
Biomedical Engineering
4.6K Vistas

Tomografía fotoacústica para obtener imágenes de sangre y lípidos de la Aorta Infrarrenal
Biomedical Engineering
5.7K Vistas

Resonancia Magnética Cardíaca
Biomedical Engineering
14.7K Vistas

Simulaciones de dinámica de fluidos computacionales del flujo sanguíneo en un aneurisma cerebral
Biomedical Engineering
11.7K Vistas

Imágenes de fluorescencia infrarroja de aneurismas aórticos abdominales
Biomedical Engineering
8.2K Vistas

Técnicas no invasivas para medir la presión arterial
Biomedical Engineering
11.9K Vistas

Adquisición y análisis de una señal de ECG (electrocardiografía)
Biomedical Engineering
104.8K Vistas

Resistencia a la tracción de biomateriales reabsorbibles
Biomedical Engineering
7.5K Vistas

Imágenes por micro-CT de la médula espinal de un ratón
Biomedical Engineering
8.0K Vistas

Visualización de la degeneración articular de rodilla posterior a una lesión no invasiva del LCA en ratas
Biomedical Engineering
8.2K Vistas

Imágenes combinadas de SPECT y TC para visualizar la funcionalidad cardíaca
Biomedical Engineering
11.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados