Photoakustische Tomographie zur Darstellung von Blut und Lipiden in der infrarenalen Aorta
Quelle: Gurneet S. Sangha und Craig J. Goergen, Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
Die Photoakustische Tomographie (PAT) ist eine aufkommende biomedizinische Bildgebungsmodalität, die lichterzeugte akustische Wellen nutzt, um kompositorische Informationen aus Geweben zu erhalten. PAT kann verwendet werden, um Blut- und Lipidkomponenten abzubilden, was für eine Vielzahl von Anwendungen nützlich ist, einschließlich Kardiovaskulär- und Tumorbildgebung. Derzeit verwendete bildgebende Verfahren haben inhärente Einschränkungen, die ihre Verwendung mit Forschern und Ärzten einschränken. Zum Beispiel sind lange Anschaffungszeiten, hohe Kosten, die Verwendung von schädlichem Kontrast und minimale bis hohe Invasivität faktoren, die den Einsatz verschiedener Modalitäten im Labor und in der Klinik einschränken. Derzeit sind die einzigen vergleichbaren bildgebenden Verfahren mit PAT aufkommende optische Techniken. Diese haben aber auch Nachteile, wie z. B. die begrenzte Durchdringungstiefe und die Notwendigkeit exogener Kontrastmittel. PAT liefert aussagekräftige Informationen in einer schnellen, nichtinvasiven, etikettenfreien Weise. In Verbindung mit Ultraschall kann PAT verwendet werden, um strukturelle, hämodynamische und kompositorische Informationen aus Geweben zu erhalten und so die derzeit verwendeten bildgebenden Verfahren zu ergänzen. Die Vorteile von PAT veranschaulichen seine Fähigkeit, sowohl im präklinischen als auch im klinischen Umfeld Einfluss zu nehmen.
PAT ist eine hybride Modalität, die lichtinduzierte akustische Wellen nutzt, um kompositorische Informationen aus Gewebe zu erhalten. Die akustische Ausbreitung wird der thermoelastischen Ausdehnung zugeschrieben. Dies tritt auf, wenn bestimmte chemische Bindungen in einem Gewebe Licht absorbieren und der Anstieg der Umgebungstemperatur dazu führt, dass sich das Gewebe ausdehnt. Um es zu erarbeiten, absorbieren spezifische chemische Bindungen Licht, wodurch das Molekül vibriert und einen Teil dieser Schwingungsenergie in Wärme umwandelt. Diese Wärmeerzeugung verursacht eine lokale Gewebeausdehnung, die akustische Ausbreitungen induziert, die von einem Ultraschallwandler erkannt werden können. Um den photoakustischen Effekt zu induzieren, müssen sowohl die thermischen als auch die Spannungseingrenzungsbedingungen erfüllt sein, um die Wärmeableitung zu minimieren und den thermoelastisch induzierten Druck im Gewebe aufbauen zu können. Die resultierende photoakustische Druckwelle kann durch Gleichung (1) charakterisiert werden, die besagt, dass die lichtinduzierte akustische Welle (Po) durch den temperaturabhängigen Grueneisen-Parameter (-), den Absorptionskoeffizienten(a) und den lokalen optischen Einfluss (F) gesteuert wird.
Po =aF Gleichung 1
Dadurch erzeugt jeder mK-Temperaturanstieg charakteristischerweise eine 800 Pascal Druckwelle, die mit einem Ultraschallwandler erkannt werden kann. Diese bindungsselektive Absorption von Licht ermöglicht es Benutzern, verschiedene biologische Komponenten zu zielen, indem sie die Wellenlänge des Lichts optimieren, wie z. B. die Verwendung von 1100 nm Licht, um Blut und 1210 nm Licht auf Lipide auszurichten. Da Licht zur induzierenden akustischen Wellenausbreitung verwendet wird, kann diese Technik in der Regel dazu verwendet werden, tiefere Strukturen als andere optische Techniken abzubilden, ohne kontrastreiche Mittel oder invasive Verfahren zu benötigen. Diese spezielle Methode, bei der langwelliges Licht im zweiten Nahinfrarotfensterlicht verwendet wird, um akustische Wellen auszulösen, bietet dem Anwender zahlreiche Vorteile, so dass Vibrations-PAT (oder VPAT) potenziell für eine Vielzahl biomedizinischer Anwendungen eingesetzt werden kann.
Das folgende Verfahren beschreibt die Methoden, die erforderlich sind, um VPAT für die Blut- und Lipidbildgebung der Infrarot-Aorta bei apolipoprotein-E-mangelhaften (apoE-/-) Mäusen einzurichten.
1. Laser-Ultraschall-Kupplung
- Erhalten Sie einen nd:YAG gepulsten optischen parametrischen Oszillatorlaser und ein Ultraschallsystem. Erfassen Sie einen Impulsgenerator, 1 BNC-Kabel und einen D-Anschluss, der an zwei BNC-Kabel angeschlossen ist.
- Schließen Sie mit dem D-Stecker-Setup das BNC-Kabel "Fire" an Anschluss A des Impulsgenerators und "Q-Switch" an Anschluss B des Impulsgenerators an. Schließlich schließen Sie ein BNC-Kabel von Port C an, um auf der Rückseite des Ultraschallsystems "einzulösen".
- Richten Sie das Glasfaserkabel mit dem Laser aus und befestigen Sie die Faserenden an den Seiten des 40 MHz Ultraschallwandlers.
- Passen Sie die Verzögerung der Ports A, B und C an die hier aufgeführten Werte an (Port A: 0.00000000, Port B: 0.00021440, Port C: 0.00000910). Stellen Sie die Ports A und B auf invertiertes Signal und Port C auf normales Signal ein.
2. Tiervorbereitung und Bildaufnahme
- Anästhetisieren Sie eine ApoE-/- Maus mit 3% Isofluran in einer Anästhesie-Induktionskammer. Sobald das Tier anästhesisiert ist, bewegen Sie die Maus zu einem Nasenkegel, um 1-2% Isofluran zu liefern.
- Tragen Sie Augenschmierung auf die Augen der Tiere auf, um Hornhautaustrocknung zu verhindern. Kleben Sie die Pfoten der Maus an Elektroden, die in die beheizte Stufe eingebaut sind, um die Atmung und Herzfrequenz des Tieres zu überwachen. Setzen Sie schließlich eine Rektalsonde ein, um die Körpertemperatur zu überwachen.
- Tragen Sie Enthaarungscreme auf, um Haare aus dem Bauch des Tieres zu entfernen. Abwischen Sie nach 30 s mit einem Gazepad.
- Legen Sie den Ultraschallwandler auf den Bauch des Tieres und lokalisieren Sie die Infrarot-Aorta. Die linke Nierenvene und die Aortentrifurkation in die Schwanzarterie sind zwei Sehenswürdigkeiten, die dem Benutzer helfen, diesen Bereich zu lokalisieren.
- Führen Sie den Laser aus, um 1100 nm Licht auszugeben, um Blut zu zielen, gefolgt von 1210 nm Licht, um Lipid zu zielen. Verwenden Sie geeignete Laserschutzbrillen, wenn der Laser im Einsatz ist.
Hier wurden VPAT-Methoden verwendet, um Lipid- und blutspezifische Bildgebung in vivodurchzuführen. Durch die Kopplung eines Laser- und Ultraschallsystems wurde Licht ins Gewebe geleitet und die daraus resultierenden akustischen Wellen erkannt. Ultraschall-Bildgebung ermöglichte es uns, strukturelle Informationen der Infrarot-Aorta (Abbildung 1a) zu erhalten, die verwendet werden können, um VPAT-Kompositionsinformationen besser zu interpretieren. Insbesondere wurde ein 1100 nm Licht verwendet, um Blut innerhalb der Aorta abzubilden (Abbildung 1b), und ein 1210 nm Licht wurde verwendet, um subkutane und periaortische Fettansammlung abzubilden (Abbildung 1c). Aus den Ultraschall- und VPAT-Bildern kann man sehen, dass das subkutane Fett der Geometrie der Haut folgt, das periaortische Fett der Kontur der Aorta folgt und das Blutsignal aus der Aorta kommt. Diese Ergebnisse bestätigen, dass VPAT tatsächlich verwendet werden kann, um Blut und Lipidansammlung in vivo abzubilden.
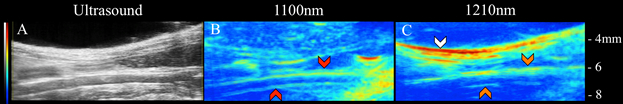
Abbildung 1: Ultraschall (links), Blut VPAT (Mitte) und Lipid VPAT (rechts) Bilder von ApoE-/-. Das subkutane Fett (weiße Pfeile), periaortisches Fett (orange Pfeile) und Blut (rote Pfeile) sind deutlich sichtbar.
VPAT ist eine schnelle, nichtinvasive, etikettenfreie Methode zur Abbildung von Blut und Lipidin vivo. Durch die Lieferung von gepulstem Laserlicht in das Gewebe wurden akustische Ausbreitungen induziert, um eine relative Dichte zu erhalten und biologische Komponenten zu lokalisieren. In Verbindung mit Ultraschall-Bildgebung können kompositorische sowie strukturelle und hämodynamische Informationen aus Gewebe gelöst werden. Eine aktuelle Einschränkung dieser Technik ist ihre Eindringtiefe, die für die lipidbasierte Bildgebung etwa 3 mm beträgt. Dies ist zwar besser als die aktuellen optischen Techniken, aber Verbesserungen der Lichtabgabetechniken würden die Tiefe der Penetration verbessern. Eine Möglichkeit, dies zu verbessern, besteht darin, einen photoakustischen Wandler zu entwickeln, der die Lichtabgabe an die Region des Interesses maximiert und reflektiertes Licht in das Gewebe umleitet. Obwohl VPAT eine bildgebende Technik ist, die noch in den Kinderschuhen steckt, hat sie in den letzten Jahren großes Interesse geweckt, so dass es wahrscheinlich ist, dass diese Technik in Zukunft in mehr Labors und Kliniken eingesetzt wird.
Das beschriebene Protokoll kann für eine Vielzahl von Anwendungen sowohl im präklinischen als auch im klinischen Bereich verwendet werden. Drei mögliche VPAT-Anwendungen umfassen die Anwendung der Technik zur 1) Untersuchung des lipidbasierten Krankheitsverlaufs, 2) Bewertung vielversprechender Therapeutika und 3) Verbesserung der Diagnose von lipidbasierten Krankheiten. Die Fähigkeit, strukturelle, hämodynamische und kompositorische Informationen zu verfolgen, macht VPAT zu einer attraktiven Technologie, um zu untersuchen, wie sich Gefäßlipid in Kleintiermodellen ansammelt (Abbildung 1). Da VPAT eine nichtinvasive Methode ist, kann sie zur Bewertung der Wirkung von Therapeutika in Längsstudien eingesetzt werden. Dies könnte insbesondere die Forschungskosten senken, indem die Anzahl der Tiere verringert wird, die für die Therapievalidierung benötigt werden. Schließlich macht die Fähigkeit von VPAT, kompositorische Informationen zur Verfügung zu stellen, es zu einer attraktiven Technik, verschiedene Arten von Plaques bei Patienten abzubilden, die an atherosklerotischen Erkrankungen wie Karotis und peripherer Arterienerkrankung leiden. Eine der aktuellen Herausforderungen in der Herz-Kreislauf-Medizin ist die Vorhersage, welche Plaques bruchanfällig sind und daher das Potenzial haben, Myokardinfarkt und ischämische Schlaganfälle zu induzieren. Daher kann VPAT aufgrund seiner Fähigkeit, biologische Komponenten zu unterscheiden, auch eine wichtige Rolle bei der Charakterisierung von anfälligen im Vergleich zu stabilen Plaques spielen. Zusammengenommen hat VPAT das Potenzial, sowohl in der Forschung als auch in der klinischen Praxis der Medizin einen signifikanten Einfluss zu erzielen.
Materialliste
| Namen | Unternehmen | Katalognummer | Kommentare |
| VPAT-Ausrüstung | |||
| Ultraschallsystem | VisualSonics | Vevo2100 | |
| Nd:YAG OPO Laser | Kontinuum | Surelite EX | |
| Saphir-Pulsgenerator | Quantum Composers | 9200 | 4 Ports erforderlich |
| BNC-Kabel | Thor Labs | 2249-C-120 | Außendurchmesser 0,2'', Länge des BNC-Kabels hängt von der Benutzerpräferenz ab. |
| B-Stecker an zwei BNC-Kabeln | L-com | CTL4CAD-1.5 | Continuum bietet auch diesen Anschluss |
| Optische Brille | LaserShields | #37 0914 UV400 | Jede Brille mit OD 7+ genügt. |
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Photoakustische Tomographie zur Darstellung von Blut und Lipiden in der infrarenalen Aorta
Biomedical Engineering
5.7K Ansichten

Bildgebung biologischer Proben mit optischer und konfokaler Mikroskopie
Biomedical Engineering
35.7K Ansichten

SEM-Bildgebung biologischer Proben
Biomedical Engineering
23.5K Ansichten

Biodistribution von Nano-Wirkstoffträgern: Anwendungen von SEM
Biomedical Engineering
9.3K Ansichten

Hochfrequenz-Ultraschall-Bildgebung der Bauchaorta
Biomedical Engineering
14.4K Ansichten

Abbildung der Dehnungsbelastung eines Bauchaortenaneurysmas
Biomedical Engineering
4.6K Ansichten

Kardiale Magnetresonanztomographie
Biomedical Engineering
14.7K Ansichten

Numerische Strömungsmechaniksimulationen des Blutflusses in einem zerebralen Aneurysma
Biomedical Engineering
11.7K Ansichten

Nahinfrarot-Fluoreszenz-Bildgebung von Abdominalaortenaneurysmen
Biomedical Engineering
8.2K Ansichten

Nichtinvasive Blutdruckmesstechniken
Biomedical Engineering
11.9K Ansichten

Erfassung und Analyse eines EKG-Signals (Elektrokardiographie)
Biomedical Engineering
104.8K Ansichten

Zugfestigkeit resorbierbarer Biomaterialien
Biomedical Engineering
7.5K Ansichten

Mikro-CT-Bildgebung von Maus-Rückenmark
Biomedical Engineering
8.0K Ansichten

Visualisierung der Kniegelenksdegeneration nach nicht-invasiver Kreuzbandverletzung bei Ratten
Biomedical Engineering
8.2K Ansichten

Kombinierte SPECT- und CT-Bildgebung zur Visualisierung der Herzfunktionalität
Biomedical Engineering
11.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten