Imageamento por MEV de Amostras Biológicas
Visão Geral
Fonte: Peiman Shahbeigi-Roodposhti e Sina Shahbazmohamadi, Departamento de Engenharia Biomédica, Universidade de Connecticut, Storrs, Connecticut
Um microscópio eletrônico de varredura (SEM) é um instrumento que usa um feixe de elétrons para imagem não destrutiva e caracterizar materiais condutivos em um vácuo. Como analogia, um feixe de elétrons é para o SEM como a luz é para o microscópio óptico. A diferença é que o microscópio eletrônico produz imagens de resolução e ampliação muito maiores. Os melhores microscópios ópticos normalmente têm uma resolução de até 200 nm, enquanto os SEMs geralmente reivindicam uma resolução de 0,5 nm. Isso se deve ao fato de que os microscópios ópticos são limitados pela difração das ondas, uma função do comprimento de onda, que é em torno de 500 nm para luz visível. Por outro lado, o SEM usa um feixe de elétrons energizado, que como um comprimento de onda de 1 nm. Essa característica as torna ferramentas muito confiáveis para o estudo de nano e microestruturas. Microscópios eletrônicos também permitem o estudo de amostras biológicas com tamanhos de características muito pequenos para microscopia óptica.
Esta demonstração fornece uma introdução à preparação da amostra e aquisição inicial de imagens de amostras biológicas usando um microscópio eletrônico de varredura. Neste caso, será estudado um andaime celular de colágeno-hidroxiapatita (HA). O ambiente de vácuo do SEM e o carregamento induzido pelo feixe de elétrons em amostras não condutoras (como matéria orgânica) criam desafios que serão abordados na preparação. As vantagens e desvantagens de diferentes métodos de imagem no que se referem à resolução, profundidade de foco e tipo de amostra também serão discutidas. O objetivo desta demonstração é dar ao participante mais informações sobre o SEM para determinar se este módulo de microscopia é o melhor adequado para um tipo de amostra biológica.
Princípios
Quando um feixe de elétrons de alta energia (tipicamente variando de 5 a 30 keV) atinge uma amostra, uma série de sinais são emitidos a partir da amostra. Essas interações podem ser usadas para estudar topografia, cristalografia, potencial elétrico e campos magnéticos locais. Os elétrons passam por dois tipos de dispersão: elástico e inelástico. A dispersão inelástica causa a emissão de elétrons secundários. Estes elétrons de baixa energia (~50 eV) são os elétrons de camada externa dos átomos de amostra que adquirem energia suficiente para deixar a superfície do átomo. A dispersão de elétrons secundários fornece informações topográficas, já que o nível de energia dos elétrons que saem do átomo de amostra não é alto o suficiente para viajar através da amostra. Portanto, apenas informações de nível de superfície são coletadas pelo detector.
A dispersão elástica, por outro lado, não é causada por elétrons desalojados dos átomos amostrais. É o principal feixe de elétrons após a interação com o núcleo, como visto na Figura 1. Esses elétrons não mudam sua energia ou velocidade, mas mudam sua direção com base em sua interação com o núcleo. A detecção desses elétrons fornece informações composicionais, e seu contraste variado com a interação com átomos de diferentes pesos atômicos permite ao usuário distinguir diferenças na composição da amostra. Em amostras biológicas, isso pode ser usado para estudar nanopartículas incorporadas ou anexadas e nanoestruturas com pesos atômicos mais pesados, como ouro ou ferro.
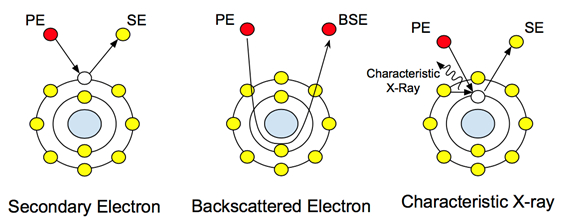
Figura 1: Interações atômicas com os elétrons principais (PE) e como eles criam os diferentes sinais.
A preparação da amostra é um procedimento importante, especialmente para amostras biológicas. Para obter imagens SEM de alta resolução, os elétrons precisam chegar à amostra. Então, os sinais que são o resultado da interação entre os elétrons e a amostra precisam chegar aos detectores. Isso significa que o instrumento deve trabalhar sob um vácuo alto para evitar a dispersão de elétrons antes que o feixe atinja a amostra e os sinais cheguem aos detectores. Este vácuo é altamente sensível e pode retirar material particulado da amostra, o que significa que é importante certificar-se de que a amostra está seca e livre de partículas.
Outra consideração na preparação da amostra é a natureza do feixe de elétrons. Como o feixe é composto de partículas altamente carregadas, quando uma amostra não condutora é bombardeada com partículas altamente carregadas do feixe de elétrons, há um acúmulo de cargas na superfície que afetam a deflexão do feixe de elétrons e causam um grande aumento na dispersão do feixe. Ao revestir a amostra com uma camada condutora antes da imagem, esses artefatos de carregamento na imagem podem ser evitados.
Os métodos aqui descritos são aplicáveis à maioria dos materiais não condutores. Um revestimento é necessário para mitigar artefatos de carregamento. O andaime celular de colágeno-HA foi feito pelas seguintes etapas de síntese: co-precipitação de colágeno com HA no gel composto, criação de chorume e fundição congelante, crosslinking do andaime e secagem final. Esta secagem final é concluída ao longo de 5 dias em um secador de vácuo e seca suficientemente a amostra para análise SEM sem afetar as propriedades estruturais dos andaimes. No entanto, quando as célulasde imagem, a principal preocupação ao preparar a amostra é preservar a estrutura celular. Métodos de fixação químicos e baseados em resina são comumente usados para observar células, preservando a estrutura das células, como fixação de glutaraldeído e epóxi e resinas acrílicas. Normalmente, o glutaraldeído é usado como um fixador que cria crosslinkages no citoplasma das células, mas também causa uma queda no pH. Portanto, é necessário tamponamento na preparação de amostras com glutaraldeído. A adição dessas técnicas permite que a estrutura da célula se assemelhe mais à sua estrutura quando estava viva [3].

Figura 2: Revestador de sputter de paládio dourado mostrando os medidores de câmara de amostra (vaso de prata em cima) e vácuo (esquerda) e corrente (direita). Neste modelo, uma corrente de 2 mA é usada com um vácuo de câmara de 0,1 torr, que é mantido constante usando uma válvula de vazamento de argônio.
Procedimento
1. Preparação da amostra
- Use luvas e tome precauções para evitar contaminação ao manusear a amostra.
- Certifique-se de que a amostra no slide está seca e não há contaminação na amostra. Isso ocorre porque o SEM mede a caracterização da superfície, e esses defeitos podem dificultar severamente o sinal.
- Se a amostra estiver carregada em uma lâmina de vidro padrão, diminua o tamanho da amostra marcando o slide com um cortador de vidro com ponta de diamante em linha reta e empurre suavemente a linha pontuada para longe do corpo até que o vidro se frature.
- Dependendo da amostra, escolha um revestimento que não tenha a mesma composição elementar (dificultaria o sinal recebido pela EDS). Para esta demonstração, é usado um revestimento de paládio dourado.
- Use o revestimento de sputter conforme indicado. Deixe a máquina sputter a amostra por cerca de 40 s para um revestimento fino com cobertura adequada.
- Monte a amostra em um stub SEM usando fita de carbono de dupla face condutora. Esta fita também deve ser colocada do palco até o topo do slide que foi sputtered para aterrar a amostra se ela for montada em um slide não condutor. Uma fina camada de tinta de prata condutiva também poderia ser usada para aumentar a condutividade da amostra para o estágio.
- Monte o stub no palco e aperte o parafuso na lateral.
2. Procedimento de imagem
- Coloque o palco na câmara. Feche e feche a porta. Em seguida, aperte o botão "Transferir" para abrir a passagem da câmara de carregamento para o vácuo.
- Uma vez que o botão de transferência pare de piscar e a porta interna esteja aberta, a amostra pode ser movida para a câmara de vácuo, aparafusando as hastes metálicas e empurrando a amostra para dentro da câmara.
- Desaparafusar a haste, retrair e fixar a haste totalmente na câmara de carga e pressione "armazenar" para fechar a câmara de carga da câmara de vácuo. A amostra agora está carregada e o resto do processo ocorre a partir da estação de trabalho do computador.
- Mova o estágio usando o controlador e abrindo o painel de navegação de palco até que esteja no seu campo de visão.
- Mova a amostra verticalmente até que a distância de trabalho seja de 5 a 10 mm. Ao mover o palco na direção z, ligue a câmera da câmara para garantir que sua amostra não se aproxime da arma eletrônica.
- Ligue o feixe de tensão extra alta (EHT). Observe que você também pode precisar abrir a coluna se ela estiver desligada por um tempo.
- Selecione o sinal SE2 nas opções do detector.
- Use uma configuração kV de cerca de 5 kV para imagens iniciais e, em seguida, aumente para 20-30 kV para obter mais sinal usando o modo de dispersão traseira. Se a amostra não foi revestida, mantenha o keV baixo para evitar muitos artefatos de carregamento na imagem e para evitar danos à amostra.
- Se não houver uma imagem clara, gire o foco, o brilho e os botões de contraste até que uma estrutura seja visível. Esta será uma referência para refinamento.
- Gire o botão de foco no modo grosseiro até que uma imagem esteja visível. Em seguida, mude para a multa para encontrar o melhor foco.
- Use a navegação de palco (não na direção z) e a ampliação para encontrar uma área para salvar uma imagem.
- Diminua a velocidade de varredura e ligue a linha em média para adquirir uma imagem melhor para salvar.
- Salve a imagem clicando com o botão direito do mouse e salvando para um local de arquivo.
- Insira o BSD e mova o palco de volta para uma posição z onde a amostra está focada.
- Repita as etapas 8-11 enquanto procura áreas de contraste que indiquem um número atômico maior.
- Remova o BSD quando estiver pronto.
- Quando estiver pronto para remover a amostra, aperte o botão "exchange".
- Mova a amostra de volta para a câmara de carga e bata em "armazenar" e depois "ventar".
Resultados
As imagens SEM nas Figuras 3 e 4 mostram que a estrutura imagem é altamente tridimensional com características de microescala. A qualidade da imagem é afetada pelo foco e pela espessura do revestimento da sputter.

Figura 3: As imagens a seguir demonstram como o foco da amostra pode afetar a qualidade da imagem. Na imagem à direita, todo o campo de visão está em foco, enquanto está fora de foco na esquerda. Jogar com parâmetros como o foco pode fornecer uma imagem muito melhor.
Figura 4: Imagens da amostra de colágeno-hidroxiapatita.
Aplicação e Resumo
Aqui demonstramos a profundidade de foco, campo de visão e resolução máxima e ampliação de um microscópio eletrônico e como essas propriedades podem ser usadas para visualizar amostras biológicas. Esta demonstração foi projetada para ajudar os espectadores a decidir qual módulo de microscopia é o melhor para uma determinada aplicação. Como demonstrado, o SEM tem uma profundidade de foco muito alta, resolução muito maior e ampliações maiores. No entanto, não é apropriado para todos os tipos de amostra.
Esta demonstração introduziu os princípios da microscopia eletrônica e mostrou várias de suas aplicações em laboratórios de pesquisa. Microscópios eletrônicos são usados para inspeção, caracterização e controle de qualidade. Por exemplo, eles são usados para visualizar ICs, placas de circuito, propagação de crack e sistemas nano-eletromecânicos. No campo da biologia, esses instrumentos também desempenham um papel fundamental. Há até microscópios eletrônicos especialmente projetados para acomodar amostras biológicas molhadas. Essas amostras biológicas variam de tecidos a ossos, células e microrganismos. O uso de detectores adicionais pode permitir ainda mais análises, como análises precisas da superfície.
Lista de Materiais
| Nome | Companhia | Número do catálogo | Comentários |
| Equipamento | |||
| Biosample | |||
| Casaco de carbono ou ouro | |||
| Traves transversal-SEM | ZEISS | ||
| Andaimes celulares colágeno-hidroxiappetito | Desenvolvido pelo Laboratório Wei na Universidade de Connecticut |
Referências
- Oatley, C. W., W. C. Nixon, and R. F. W. Pease. "Scanning electron microscopy." Advances in Electronics and Electron Physics 21 (1966): 181-247.
- Goldstein, Joseph, et al. Scanning electron microscopy and X-ray microanalysis: a text for biologists, materials scientists, and geologists. Springer Science & Business Media, 2012.
- Carol Heckman, et al. Preparation of cultural cells for scanning electron microscope. Nature Protocols Network, 2007, doi:10.1038/nprot.2007.504
Tags
Pular para...
Vídeos desta coleção:

Now Playing
Imageamento por MEV de Amostras Biológicas
Biomedical Engineering
23.5K Visualizações

Imageamento de amostras biológicas com microscopia ótica e confocal
Biomedical Engineering
35.7K Visualizações

Biodistribuição de Nano-fármacos Transportadores: Aplicações de MEV
Biomedical Engineering
9.3K Visualizações

Ultrassonografia de alta frequência da aorta abdominal
Biomedical Engineering
14.4K Visualizações

Mapeamento Quantitativo de Tensão de um Aneurisma da Aorta Abdominal
Biomedical Engineering
4.6K Visualizações

Tomografia fotoacústica para imageamento de sangue e lipídios na aorta infrarrenal
Biomedical Engineering
5.7K Visualizações

Ressonância Magnética Cardíaca
Biomedical Engineering
14.7K Visualizações

Simulações computacionais de fluidodinâmica do fluxo sanguíneo em um aneurisma cerebral
Biomedical Engineering
11.7K Visualizações

Imageamento de fluorescência de infravermelho próximo de aneurismas da aorta abdominal
Biomedical Engineering
8.2K Visualizações

Técnicas não invasivas de medição da pressão arterial
Biomedical Engineering
11.9K Visualizações

Aquisição e análise de um sinal de ECG (eletrocardiografia)
Biomedical Engineering
104.8K Visualizações

Resistência à Tração de Biomateriais Reabsorvíveis
Biomedical Engineering
7.5K Visualizações

Imagem de micro-TC de uma medula espinal de camundongo
Biomedical Engineering
8.0K Visualizações

Visualização da degeneração da articulação do joelho após lesão não invasiva do LCA em ratos
Biomedical Engineering
8.2K Visualizações

Combinação de imagens de SPECT e TC para visualizar a funcionalidade cardíaca
Biomedical Engineering
11.0K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados