Kardiale Magnetresonanztomographie
Quelle: Frederick W. Damen und Craig J. Goergen, Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
In diesem Video wird gezeigt, dass hochfeldige, kleinbohrige Magnetresonanztomographie (MRT) mit physiologischer Überwachung gated cine Loops des murinen Herz-Kreislauf-Systems erfasst. Dieses Verfahren bietet eine Grundlage für die Beurteilung der linksventrikulären Funktion, die Visualisierung von Gefäßnetzwerken und die Quantifizierung der Bewegung von Organen durch Atmung. Vergleichbare kardiovaskuläre Bildgebungsmodalitäten für Kleintiere umfassen Hochfrequenz-Ultraschall und Mikrocomputertomographie (CT); Jede Modalität ist jedoch mit Kompromissen verbunden, die in Betracht gezogen werden sollten. Während Ultraschall eine hohe räumliche und zeitliche Auflösung bietet, sind bildgebende Artefakte häufig. Beispielsweise kann dichtes Gewebe (d. h. das Brustbein und die Rippen) die Bildtiefe der Bilddaten einschränken, und hyperechoisches Signal an der Schnittstelle zwischen Gas und Flüssigkeit (d. h. Pleura, die die Lunge umgibt) kann den Kontrast im nahegelegenen Gewebe verwischen. Micro-CT dagegen leidet nicht unter so vielen in-ebenen Artefakten, aber hat eine geringere zeitliche Auflösung und einen begrenzten Weichgewebekontrast. Darüber hinaus verwendet micro-CT Röntgenstrahlung und erfordert häufig die Verwendung von Kontrastmitteln, um die Vaskulatur zu visualisieren, von denen beide bekanntermaßen Nebenwirkungen bei hohen Dosen verursachen, einschließlich Strahlenschäden und Nierenverletzungen. Herz-Kreislauf-MRT bietet einen netten Kompromiss zwischen diesen Techniken, indem die Notwendigkeit von ionisierender Strahlung negiert und dem Benutzer die Möglichkeit gegeben wird, ohne Kontrastmittel abzubilden (obwohl Kontrastmittel häufig für MRT verwendet werden).
Diese Daten wurden mit einer auslösenden Fast Low Angle SHot (FLASH) MRT-Sequenz erfasst, die von den R-Spitzen im Herzzyklus und expiratorischen Plateaus in der Atmung abgegrenzt wurde. Diese physiologischen Ereignisse wurden durch subkutane Elektroden und ein druckempfindliches Kissen überwacht, das gegen den Bauch gesichert war. Um sicherzustellen, dass die Maus richtig erwärmt wurde, wurde eine rektale Temperatursonde eingesetzt, mit der der Ausgang eines MRT-sicheren Heizlüfters gesteuert wurde. Sobald das Tier in die Bohrung des MRT-Scanners eingeführt wurde und Navigationssequenzen ausgeführt wurden, um die Positionierung zu bestätigen, wurden die abgesperrten FLASH-Bildebenen vorgeschrieben und Daten erfasst. Insgesamt ist die High-Field-MRT ein leistungsfähiges Forschungswerkzeug, das Weichteilkontrast für die Untersuchung von Modellen für kleine Tierseuchen liefern kann.
Magnetresonanztomographie ist eine Technik, die die paramagnetischen Eigenschaften des Gewebes nutzt, um Weichteilkontrast eisbildt zu visualisieren. Die Bohrung einer MRT-Maschine wird konventionell mit einer Magnetspule umwickelt, die bei Anwendung eines elektrischen Stroms ein konstantes homogenes Magnetfeld (B0)liefert. In der vorgestellten Hochfeld-Murine-Bildgebung wird eine 7 Tesla (T) magnetische Feldstärke verwendet, die etwa 140.000 Mal so hoch ist wie das Erdmagnetfeld und mehr als das Doppelte der üblichen klinischen 3T- und 1,5T-Scannerfeldstärken. Dieses homogene Magnetfeld bewirkt, dass die Wasserstoffprotonen, die fast allen lebenden Geweben inhärent sind, ihre Rotationsachsen ausrichten. Diese Spins können dann mit Hochfrequenzwellen (RF) in einem bestimmten Winkel relativ zur Drehachse (d. h. dem Drehwinkel) "gekippt" werden. Während die Protonen dann versuchen, sich wieder in ihre ursprüngliche Ausrichtung zu entspannen, induziert die Komponente ihrer Drehung senkrecht zu ihrer Hauptachse ein nachweisbares elektrisches Signal.
Darüber hinaus können magnetische Gradienten angewendet werden, die das Hauptmagnetfeld stören und räumlich isolierte HF-Erregungen ermöglichen, um das empfangene Signal zu lokalisieren. Spezifisch für die hier beschriebenen Methoden verwendet die FLASH-Sequenz repetitive Niedrigwinkelanregungen, um ein stationäres Muster in der Protonenbewegung zu induzieren. Dieses Paradigma ermöglicht es, Gewebe, die von Natur aus dynamisch sind, wie z. B. im Herz-Kreislauf-System, schnell abzubilden und relativ stabile Momentaufnahmen innerhalb des Herzzyklus zu erzielen. Durch das Auslösen der FLASH-Sequenz mit physiologischen Signalen können Bilder des Herz-Kreislauf-Systems erfasst werden, die sowohl die Herz-, Gefäß- als auch die Atembewegung hervorheben.
1. Tierzubereitung
- Identifizieren Sie die Maus, die in ihrem Käfig abgebildet werden soll, und übertragen Sie sie in die Anästhesie-Induktionskammer.
- Anästhetisieren Sie die Maus mit Isofluran und bestätigen Knockdown mit einer Zehen-Pinch-Technik. Nehmen Sie die Pfote zwischen Daumen und Zeigefinger und kneifen Sie fest, um nach einer Antwort zu suchen. Wenn das Tier seinen Fuß zurückzieht, sollten Sie entweder warten oder mit Anästhesie nach dem genehmigten Protokoll erneut dosieren.
- Überprüfen Sie, ob alle Mitarbeiter, die die Bildgebungseinrichtung betreten, MR-sicher sind. Dazu gehören das Entfernen von magnetischer Kleidung/Zubehör, die Bestätigung von magnetisch-implantaten oder Herzschrittmachern und das Entfernen von Metall, das Piercings enthält.
- Offener Isofluran-Fluss zum Nosecon im MRT-Raum. Dadurch können die längeren Schläuche vor dem Maustransfer mit Anästhetikum grundiert werden, um sicherzustellen, dass das Tier nicht aufwacht.
- Schließen Sie den Isofluranfluss zur Anästhesie-Induktionskammer und übertragen Sie die Maus in die Bildaufnahme. Platzieren Sie die Maus auf der Bühne so, dass die ungefähre Position des Herzens mit der Mitte des Magneten ausgerichtet ist.
- Sichern Sie den Nasenkegel und bestätigen Sie den Knockdown mit der Zehen-Pinch-Technik.
- Fügen Sie die drei Elektrokardiogramm-Leitungen subkutan mit einer Leitung nach links und rechts des Herzens und eine an der Basis der linken Hinterglied.
- Setzen Sie die rektale Temperatursonde mit einem sterilen Sondenmantel und Schmiermittel ein.
- Stellen Sie den Kissen-Atmungssensor auf den epigastrischen Bereich des Bauches und sichern Sie ihn mit einem Pappteller an Ort und Stelle. Der Karton sorgt für ein druckempfindliches Signal.
- Bestätigen Sie, dass alle physiologischen Signale über die Überwachungssoftware außerhalb des Scannerraums erfasst werden. Wenn eine Herzfrequenz, Atemfrequenz oder Temperatur außerhalb des normalen Bereichs festgestellt wird, halten Sie die Bildgebung an und beurteilen Sie, ob das Tier entsprechend anästhesiert ist. Wenn festgestellt wird, dass sich das Tier in Not befindet, sollte die Anästhesieanwendung eingestellt und das Tier zur Genesung in den Käfig zurückgebracht werden.
- Richten Sie das Heizmodul und den Lüfter ein und beginnen Sie mit der Erwärmung des Luftstroms zum Tier. Sichern Sie alle Luftschläuche an Ort und Stelle, so dass die warme Luft in Richtung der Maus bläst, die kurz hinter der Spitze des Schwanzes beginnt.
- Legen Sie die Gradientenspule über das Tier und stellen Sie sicher, dass alle Kabel/Schläuche gesichert sind.
2. Herzmagnetresonanztomographie - Dieser Abschnitt kann für andere Anwendungen angepasst werden.
- Optimieren und passen Sie die Gradientenspule außerhalb der Bohrung des Magneten an, um sicherzustellen, dass das maximale Signal vom Motiv erkannt wird.
- Setzen Sie die Bildstufe langsam in die Bohrung des Magneten ein, so dass das Tier direkt in der Mitte der Bohrung positioniert ist. Dazu gehört auch, sicherzustellen, dass die Gradientenspule den gleichen Abstand entlang aller radialen Richtungen aufweist. Dies ist die Position, wo das Hauptmagnetfeld am homogensten sein wird.
- Führen Sie einen Lokalisierungs-/Navigator-Scan aus, um den Speicherort der Maus im Scanner zu bestätigen. Ein Teil des Herzens sollte innerhalb aller drei Ebenen visualisiert werden (d. h. axial, sagittal und koronal). Wenn dies nicht der Fall ist, wiederholen Sie den Vorgang der Neupositionierung der Maus und der Ausführen von Lokalisierungs-/Navigationsscans, bis die gewünschte Position erreicht ist.
- Richten Sie die Parameter für die FLASH-Sequenz ein. Zum Beispiel: TR/TE = 8,0/2,0 ms, FA = 20°, FOV = 35 x 35 mm, Matrixgröße = 192 x 192 und NEX = 6. Wählen Sie dann die externe Auslösung aus, um "ein" zu sein.
- Konfigurieren Sie auf der Überwachungssoftware die externen Auslöser so, dass die MRT-Sequenzen bei der Identifizierung der R-Peaks in den Herzzyklen gestartet werden und während die Atmung während der Exspirierungsphase stabil ist. Da diese beiden Bedingungen erfüllt sind, kann die Sequenz seriell ausgeführt werden, und Daten werden erfasst.
- Verschreiben und führen Sie eine erste FLASH-Sequenzscheibe in der koronalen Ansicht so aus, dass die Schnittebene der Achse vom Scheitelpunkt des Herzens durch die Aortenklappe folgt. Diese erste Cine-Schleife wird eine Zwei-Kammer-Ansicht des Herzens bieten.
- Unter Bezugnahme auf die Ergebnisse aus der Zweikammeransicht wird eine neue FLASH-Sequenz entlang der Apex-Aorten-Ventilachse vorgeschrieben und ausgeführt, um eine Vierkammeransicht zu visualisieren.
- Verschreiben Sie schließlich eine Kurzachsscheibe, die senkrecht zur Spitzenaortenklappenachse etwa auf halbem Weg durch das Herz liegt. Die Papillenmuskeln sollten an dieser Stelle innerhalb des Cine-Loop-Ausgangs deutlich sichtbar sein.
- Zusätzliche Slices können parallel zu diesem Slice erworben werden, um zeitsynchronisierte Volumes des Herzens zu erstellen. Diese Volumes werden durch Ververketten benachbarter Cine-Schleifen in der Nachbearbeitung erstellt.
- Nach Abschluss der Bildgebung übertragen Sie die erfassten Daten an einen geeigneten Ort für die Analyse und entfernen Sie das Tier aus dem Scanner.
Abbildung 1 zeigt eine Cine-Schleife einer Kurzachsansicht des linken Ventrikels, die direkt senkrecht zur Basisspitzenachse des Herzens und an einer Position ist, die die Papillenmuskeln einschließt.

Abbildung 1:Helle Blutcine-Bildgebung eines Mausherzes mit 14 Kurzachs-Ansichtsmomentaufnahmen über den Herzzyklus, einschließlich Enddiastole (t = 8) und Peak-Systole (t = 13). Die Regionen des Aussetzersignals innerhalb des Lumens des linken Ventrikels weisen auf eine schnelle Blutbewegung hin, die ursprünglich aus der Ebene heraus und nicht durch die HF-Wellenerregung markiert wurde.
Das zweite repräsentative Bild zeigt eine 4-Kammer-Ansicht des Herzens mit hellem Blutdurchfluss durch die Mitral- und Trikuspidalklappen, die dann durch die Aorten- bzw. Lungenklappen ausströmt.
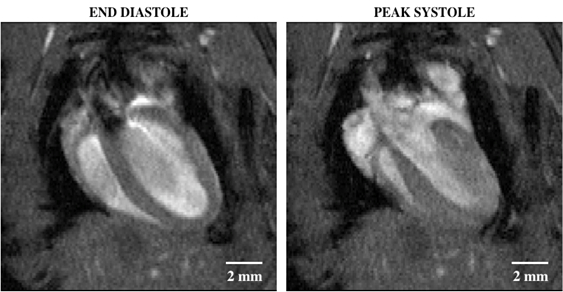
Abbildung 2:Helle Blut-Cine-Bildgebung eines Mausherzes mit einer Vier-Kammer-Ansicht, die Enddiastole (links) und Spitzen-Systole (rechts) zeigt. Die Regionen des Aussetzersignals innerhalb des Lumens des linken Ventrikels weisen auf eine schnelle Blutbewegung hin, die ursprünglich aus der Ebene heraus und nicht durch die HF-Wellenerregung markiert wurde.
Ein drittes repräsentatives Ergebnis ist schließlich eine Projektion mit maximaler Intensität (Maximum Intensity Projection, MIP), die zeigt, wie die mehrfachen Slices räumlich kombiniert werden können, um das Herz-Kreislauf-System des gesamten Mauskörpers zu visualisieren.
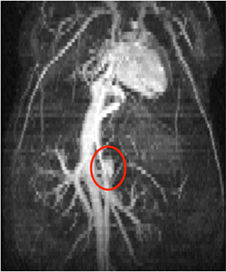
Abbildung 3: Maximale Intensitätsprojektion eines dreidimensionalen Stapels von zeitsynchronisierten zweidimensionalen hellen Blutbildern, die die Brust- und Bauchbereiche einer Maus zeigen. Das Herz, die minderwertige Vena cava und das kleine bauchige Aortenaneurysm (roter Kreis) sind aus dieser Sicht zu sehen.
Hier bei Herz-MRT wird in Verbindung mit Herz- und Atmungs-Gating cine Loop-Daten des murinen Herzens erfasst. Während das Herz im Mittelpunkt der Demonstration stand, können weitere Regionen des Herz-Kreislauf-Systems nach der gleichen Methodik abgebildet werden. Auch wenn die MRT nicht unter den gleichen Artefakten leidet, die häufig mit anderen bildgebenden Modalitäten zu sehen sind, gibt es einen spürbaren Kompromiss mit räumlicher Auflösung, die pro Erfassungsdauer erreicht wird. Dieser Kompromiss ist bedenklich, wenn die Maus längeren Dauern der Anästhesie nicht standhalten kann, wie z. B. bei Modellen schwerer Krankheiten. Dennoch hat die MRT den Vorteil, das darunter liegende Gewebe zu visualisieren, ohne das Risiko einer ionisierenden Strahlenschädigung, die dem Mikro-CT innewohnt. Mit MRT-Techniken kann eine In-vivo-Bewertung des Kardiovaskulärs durchgeführt werden, die den Grundstein für Längsschnittstudien sowohl der Krankheitsprogression als auch der damit verbundenen Therapiereaktion in Kleintiermodellen legt.
Als Erweiterung der beschriebenen Technik kann diese Technologie verwendet werden, um die Kinematik von gesunden und kranken Herzen zu vergleichen. Murine Modelle der Herzdysfunktion kann viel kontrollierter als die in der Klinik gefunden werden, so dass Forscher bestimmte Faktoren, die zu Herzerkrankungen zu identifizieren sowie den Umbauprozess nach mechanischen Verletzungen zu studieren. Darüber hinaus kann ein vergleichbares Forschungsprojekt mit einem vaskulären Fokus wie dem mit Abdominalaortenaneurysm (AAA) durchgeführt werden. Da Blut unter den beschriebenen Methoden ein Signal mit hoher Intensität ausgibt, kann der Kontrast genutzt werden, um die Ausdehnung eines AAA zu bewerten und Veränderungen der biomechanischen Eigenschaften des Gefäßes zu messen. Schließlich können Studien zur Vaskularisation des Gehirns durchgeführt werden, um angiogene Reaktionen auf traumatische Hirnverletzungen oder Schlaganfall zu vergleichen. Idealerweise können Techniken wie die kardiovaskuläre MRT mit hohem Feld, wie z. B. die kardiovaskuläre MRT mit hohem Feld, unser Verständnis menschlicher Krankheitsprozesse fördern und Innovationen in Richtung der nächsten Generation diagnostischer Technologien anregen.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Kardiale Magnetresonanztomographie
Biomedical Engineering
14.7K Ansichten

Bildgebung biologischer Proben mit optischer und konfokaler Mikroskopie
Biomedical Engineering
35.7K Ansichten

SEM-Bildgebung biologischer Proben
Biomedical Engineering
23.5K Ansichten

Biodistribution von Nano-Wirkstoffträgern: Anwendungen von SEM
Biomedical Engineering
9.3K Ansichten

Hochfrequenz-Ultraschall-Bildgebung der Bauchaorta
Biomedical Engineering
14.4K Ansichten

Abbildung der Dehnungsbelastung eines Bauchaortenaneurysmas
Biomedical Engineering
4.6K Ansichten

Photoakustische Tomographie zur Darstellung von Blut und Lipiden in der infrarenalen Aorta
Biomedical Engineering
5.7K Ansichten

Numerische Strömungsmechaniksimulationen des Blutflusses in einem zerebralen Aneurysma
Biomedical Engineering
11.7K Ansichten

Nahinfrarot-Fluoreszenz-Bildgebung von Abdominalaortenaneurysmen
Biomedical Engineering
8.2K Ansichten

Nichtinvasive Blutdruckmesstechniken
Biomedical Engineering
11.9K Ansichten

Erfassung und Analyse eines EKG-Signals (Elektrokardiographie)
Biomedical Engineering
104.8K Ansichten

Zugfestigkeit resorbierbarer Biomaterialien
Biomedical Engineering
7.5K Ansichten

Mikro-CT-Bildgebung von Maus-Rückenmark
Biomedical Engineering
8.0K Ansichten

Visualisierung der Kniegelenksdegeneration nach nicht-invasiver Kreuzbandverletzung bei Ratten
Biomedical Engineering
8.2K Ansichten

Kombinierte SPECT- und CT-Bildgebung zur Visualisierung der Herzfunktionalität
Biomedical Engineering
11.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten