Ozonolyse von Alkenen
Überblick
Quelle: Vy M. Dong und Zhiwei Chen, Department of Chemistry, University of California, Irvine, CA
Dieses Experiment zeigt ein Beispiel einer Ozonolyse Reaktion zur Synthese von Vanillin aus Ligninsulfonsäure (Abbildung 1). Ozonolyse von Alkenen, eine Oxidationsreaktion zwischen Ozon und ein Alken ist eine gängige Methode, Aldehyde, Ketone und Carbonsäuren vorzubereiten. Dieses Experiment zeigt auch den Einsatz von Ozon-Generator und eine niedrige Temperatur (−78 ° C) Reaktion.

Abbildung 1. Das Diagramm zeigt die Ozonolyse von Ligninsulfonsäure, Vanillin.
Grundsätze
Die oxidative Spaltung von Alkenen zu zwei Carbonyl-Gruppe-haltigen Verbindungen nennt man eine Ozonolyse Reaktion (Abbildung 2). Der vorgeschlagene Mechanismus (Abbildung 3) beginnt mit einem [3 + 2]-Cycloaddition zwischen Alken 1 mit Ozon, die Molozonide zwischen Azu generieren. A ist instabil und ordnet in stabiler Ozonide C über die experimentellen B. C zersetzt sich in Gegenwart von einem Reduktionsmittel wie Dimethyl Sulfid, die zwei Carbonyl-Produkte (2, 3) und Dimethyl Sulfoxid einzurichten. Wenn ein nukleophilen Lösungsmittel verwendet (z.B. Methanol), die Nucleophile Angriffe intermediate B um ein Hydroperoxid E, bilden das Produkt 3 zerfällt, wenn Dimethyl Sulfide (Abbildung 4) hinzugefügt wird. Die Reaktion erfolgt in der Regel bei −78 ° C um Nebenreaktionen zu vermeiden und in der Gegenwart einen Indikator zu bestimmen, wann die Reaktion abgeschlossen ist. Sudan III ist eine häufig verwendete Indikator. Zu Beginn die Reaktionsmischung ist rot und lila/blau wenn abwechselnd alle die Alken ist verbraucht. Wenn alle die Alken hat reagiert, reagiert die Anzeige, die eine N-N-Doppelbindung, mit dem Ozon, wodurch die Farbe zu ändern.

Abbildung 2. Das Diagramm zeigt die allgemeine Ozonolyse Reaktion ein Alken mit eine reduktive Aufarbeitung.
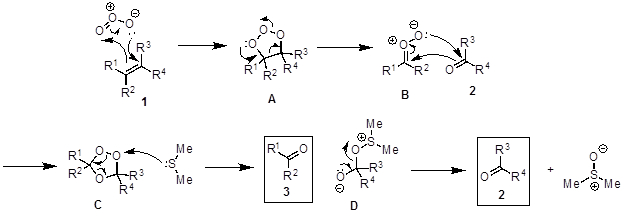
Abbildung 3. Das Diagramm zeigt den allgemeinen Mechanismus der Ozonolyse Alken.

Abbildung 4. Das Diagramm zeigt die Bildung von einem Hydroperoxid von intermediate B.
Verfahren
- Fügen Sie 200 mg Ligninsulfonsäure, 15 mL MeOH, und ~ 2 mg des Sudan III in einem 3-necked 50 mL Rundboden-Kolben ausgestattet mit einer magnetischen Stir Bar.
- Schließen Sie den Reaktionskolben an eine Sauerstoffflasche und ein Bubbler.
- Schalten Sie die Zufuhr von Sauerstoff.
- Das Reaktionsgemisch mit Trockeneis/Aceton Bad abkühlen.
- Schalten Sie den Ozon-Generator, der den Sauerstoff aus dem Tank zu Ozon umwandelt, die in der Reaktionskolben geht. Der Generator wird zwischen die Sauerstoffflasche und der Reaktionskolben sein. Lassen Sie das Reaktionsgemisch zu rühren, bis sich die rote Farbe ändert, lila/blau.
- Ausschalten der Ozon-Generator, und Sauerstoff, das Reaktionsgemisch von Ozon für 5 min zu bereinigen.
- Entfernen Sie das kühlende Bad und 0,2 mL Dimethyl Sulfid.
- Rühren Sie das Reaktionsgemisch während Erwärmung um 1 h bei Raumtemperatur.
- Entfernen Sie durch rotierende Verdunstung der Lösungsmittel. Machen Sie eine Kieselsäure Stecker durch die Platzierung von Kieselgel in einen Büchner-Trichter. Lösen Sie den Rückstand in 10 % Ethylacetat in Hexanes auf und fahren Sie die Lösung durch die Silica-Stecker unter Vakuum, um Verunreinigungen zu entfernen. Waschen Sie die Kieselsäure Stecker 2 weitere Male mit 10 % Ethylacetat in Hexanes. Sammeln Sie das Filtrat zu und entfernen Sie das Lösungsmittel durch rotary Verdampfung, Vanillin als weißer Feststoff zu erhalten.
- Berechnen Sie die prozentuale Ausbeute von Vanillin gewonnen und seine Reinheit und Identität durch Schmelzpunkt (m.p.) und 1H NMR zu etablieren.
Ergebnisse
Vanillin erhielt als weißer Feststoff (150 mg, 76 % Ausbeute); m.p. 76-79 ° C; 1 H NMR (400 MHz, CDCl3) δ 9,82 (Br s, 1 H), 7.43-7.41 (m, 2 H), 7.04 (d, J = 8,8 Hz, 1 H), 6.30 (s, 1 H), 3,96 (s, 3 H).
Anwendung und Zusammenfassung
In diesem Experiment haben wir die Synthese von Vanillin aus Ligninsulfonsäure mit der Ozonolyse Reaktion gezeigt. Auch verwenden einen Ozon-Generator, während der Durchführung einer Niedertemperatur-Reaktion gezeigt wurde.
Ozonolyse ist eine nützliche Reaktion, Aldehyde, Ketone und Carbonsäuren von Alkenen vorzubereiten. Es wurde in Naturprodukt Synthese und industrielle Herstellung von Arzneimitteln angewendet. Artemisinin ist ein potenter Malaria Agent und gehörte zu den Naturprodukten in 2015 den Nobelpreis für Medizin anerkannt. In einer 10-stufigen Synthese von (R)-(+) - Pulegon Ozonolyse im letzten Schritt diente um das Naturprodukt (Abbildung 5) zu machen. Ceftibuten und fort sind Cephalosporin-Antibiotika im industriellen Maßstab produziert. Eine Handelsroute greift Ozonolyse auf einen gemeinsamen Schlüssel Mittelstufe, die auf beide Verbindungen (Abbildung 6) erarbeitet werden können.

Abbildung 5 . Schematische Darstellung der Ozonolyse als letzter Schritt in einer Synthese von Artemisinin.
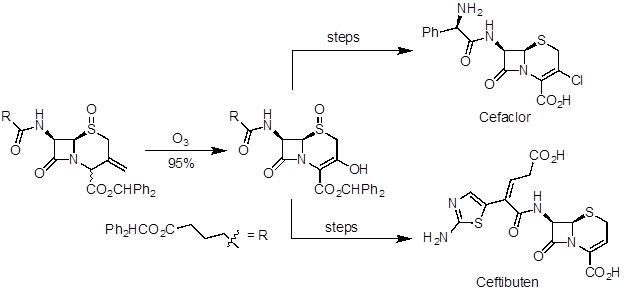
Abbildung 6 . Diagramm, Ozonolyse, bereiten Sie einen Schlüssel Zwischenprodukt bei der divergierenden Synthese von Medikament und Ceftibuten.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Ozonolyse von Alkenen
Organic Chemistry II
67.1K Ansichten

Reinigung der Glaswaren
Organic Chemistry II
123.8K Ansichten

Nucelophile Substitution
Organic Chemistry II
99.6K Ansichten

Reduktionsmittel
Organic Chemistry II
43.1K Ansichten

Grignard-Reaktion
Organic Chemistry II
149.2K Ansichten

n- Butyllithium Titration
Organic Chemistry II
48.0K Ansichten

Dean-Stark-Falle
Organic Chemistry II
100.6K Ansichten

Organokatalyse
Organic Chemistry II
16.9K Ansichten

Palladiumkatalysierte Kreuzkupplungsreaktionen
Organic Chemistry II
34.6K Ansichten

Festphasen-Synthese
Organic Chemistry II
41.2K Ansichten

Hydrierung
Organic Chemistry II
49.7K Ansichten

Polymerisation
Organic Chemistry II
94.5K Ansichten

Schmelzpunkt
Organic Chemistry II
150.0K Ansichten

Infrarot-Spektroskopie
Organic Chemistry II
215.6K Ansichten

Polarimeter
Organic Chemistry II
100.2K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten