Method Article
Tam Kandan Düşük ve Normal Yoğunluklu Nötrofillerin İzolasyonu ve Karakterizasyonu
Bu Makalede
Özet
Burada, manyetik izolasyon (negatif seçim) ve süreksiz yoğunluk gradyan ortamı kullanarak düşük ve normal yoğunluklu nötrofillerin tam kandan izole edilmesi için güvenilir bir yaklaşım sunuyoruz. Yüksek saflıkta hücrelerin (%≥93) el değmeden izolasyonunu sağlayarak, sağlık ve hastalıktaki rollerini anlamak için çok önemli olan nötrofil alt popülasyonlarının doğru aşağı akış analizini kolaylaştırır.
Özet
Ortaya çıkan araştırmalar, insanlarda dolaşımdaki nötrofil popülasyonunun çeşitli alt tiplerden oluştuğunu ve tarihsel olarak yapıldığı gibi tek bir popülasyon olarak incelenmemesi gerektiğini göstermektedir. Özellikle, düşük yoğunluklu ve normal yoğunluklu nötrofillerin (LDN'ler, NDN'ler) fonksiyonel ve metabolik olarak farklı profillere sahip olduğu gösterilmiştir, bu da nötrofil araştırmaları yayınlanırken dikkate alınması gereken bir faktördür. Burada, LDN'lerin ve NDN'lerin tam kandan el değmeden izolasyonu ve ayrılması için modifiye edilmiş bir yöntem sunuyoruz.
Yoğunluk gradyan ortamı (1.135 g/mL) 9:10'da 10x PBS ile birleştirilir. %55, %70 ve %81'lik özgül yoğunluk gradyanları daha sonra %100 yoğunluk gradyan ortamının 1x fosfat tamponlu salin (PBS) ile birleştirilmesiyle yapılır. Negatif seleksiyona dayalı manyetik izolasyon kiti kullanılarak rıza gösterilen donörlerden elde edilen 12 mL periferik tam kandan izole edilen nötrofiller, %55'lik fraksiyonda yeniden süspanse edilir. % 81 ve% 70 fraksiyonların 3 mL'lik bir hacmi 15 mL'lik bir tüpe katmanlanır, ardından toplam nötrofilleri içeren% 55 fraksiyon gelir. Yoğunluk gradyanları daha sonra 30 dakika boyunca 720 x g'da santrifüjlenir. %55/%70 arayüzde (LDN'ler) ve %70/%81 arayüzde (NDN'ler) iki farklı bant elde edilir. Hücreler dikkatlice ayrı tüplere pipetlenir ve PBS kullanılarak yıkanır. İzole edilen fraksiyonların saflığı, akış sitometrisi kullanılarak belirlenir. Hem LDN'ler hem de NDN'ler akım sitometrisi ile CD14lo, CD15+ SSChi olarak tanımlandı. İzolasyon saflığı, her iki tip için de canlı hücrelerin% ≥93'ü olarak hesaplandı.
Bu yöntem, LDN ve NDN'leri periferik kandan ayırmak için güvenilir ve verimli bir yaklaşım sağlar ve izole edilen hücrelerin yüksek saflığını ve canlılığını sağlar. Nötrofil izolasyonunun hassasiyetinin arttırılması, bu farklı nötrofil alt popülasyonlarının daha doğru aşağı akış analizlerini kolaylaştırır. Bunlar, nötrofil heterojenliği ve bunun çeşitli fizyolojik ve patolojik bağlamlardaki etkileri hakkındaki anlayışımızı ilerletmek için kritik öneme sahiptir.
Giriş
Nötrofiller granüler bağışıklık hücreleridir ve periferik kanda en bol bulunan lökosittir ve ortalama olarak lökositlerin yaklaşık %50-70'ini oluşturur. Kemik iliğinde granülosit-monosit öncüllerinden (GMP'ler) gelişirler ve bu da granülosit koloni uyarıcı faktör (G-CSF) varlığında hematopoietik progenitör hücrelerden (HPC'ler) gelişir. Homeostazda, ~ 24 saatlik bir ömre sahiptirler, ancak çalışmalar, ömürlerinin belirli fizyolojik koşullar ve kronik bağışıklık aktivasyonu1, iltihaplanma1 ve hatta kararlı durumda doku ikametgahı2 gibi ilişkili mikro ortamlar altında uzatılabileceğini göstermiştir. Nötrofiller uzun zamandır patojenlere karşı ilk savunma hattı olarak kabul edilmektedir ve anti-mikrobiyal etkilerini 3 ana efektör işlevi aracılığıyla ortaya çıkarır - degranülasyon, fagositoz ve nötrofil hücre dışı tuzak (NET) aktivasyonu ve salınımı (NETosis).
Nötrofil fonksiyonu ve biyolojisi üzerine yapılan çoğu çalışma, toplam nötrofil popülasyonu için sonuçları inceler. Bununla birlikte, N1 (anti-tümör) / N2 (pro-tümör) alt tiplerini tanımlayan kanser ortamlarında yapılan çalışmalardan, nötrofillerin olgunluk, hastalık ve fizyolojik duruma ve hatta hücresel yoğunluğa (düşük yoğunluklu ve normal yoğunluklu nötrofiller) göre sınıflandırılmasına kadar, insan nötrofil popülasyonunun fenotipik olarak çeşitli alt tipler oluşturduğu giderek daha belirgin hale gelmiştir. Bu nötrofil alt tiplerinin varlığının tamamen farklı hücre tipleri olmasına veya plastisitenin karmaşık doğasına atfedilip atfedilemeyeceğine, atipik nötrofiller hakkında giderek artan bir literatür vardır ve normal yoğunluklu nötrofillerden ayrı düşük yoğunluklu nötrofilleri incelemek için zorlayıcı bir fırsat sunmaktadır3.
SLE hastalarında ilk kez proinflamatuar nötrofil alt kümesi4 olarak tanımlanan LDN'ler, o zamandan beri kronik hastalıklarda, gebelikte ve hatta sağlıklı dolaşımda, pro-inflamatuar ve baskılayıcı kapasitelerdetanımlanmıştır 5,6,7,8. LDN'ler, tam kan yoğunluk gradyan ortamı üzerinde santrifüj edildiğinde periferik kan mononükleer hücreleri (PBMC'ler) ile eş zamanlı olarak bulunur. Özgül yoğunlukları, 1.083 g/mL'deki NDN'lere kıyasla yaklaşık 1.077 g/mL'ye karşılık gelir9. Konuyla ilgili hala önemli tartışmalar olsa da, LDN'lerin daha olgunlaşmamış bir granülosit fenotipine benzediğine dair spekülasyonlar vardır (promiyelositlere ve miyelositlere benzer, yoğunluğu 1.080 g/mL'nin altındadır)9,10. Diğerleri hala hastalığın varlığına veya yokluğuna bağlı olarak hem olgun hem de olgunlaşmamış LDN fenotipleri olduğunu düşünmektedir 11,12,13. Bununla birlikte, LDN'ler sağlıklı bireylerde de tespit edilmiştir; Bununla birlikte, yeterli sayıda izole edilmesinin zorluğu nedeniyle bazı çalışmalara dahil edilmeleri sınırlıdır5.
Bu çalışma, bu iki popülasyonu, yerinde metabolik deneyler yapmamıza izin verecek miktarlarda (minimum 0.5 × 106 hücre / mL) izole etmeyi amaçladı. Bunu yaparken, mevcut bir protokol5, LDN'leri ve NDN'leri tam kandan izole etmek ve karakterize etmek için en iyi sonucu sağlayan, yaygın olarak bildirilen fenotipik belirteçler13,14 ile optimize edilmiştir (Şekil 1A).
Protokol
Kan örnekleri, sağlıklı katılımcılardan bilgilendirilmiş onam alınarak toplandı. Çalışma, hem St. James's Hastanesi hem de Tallaght Üniversite Hastanesi'nin Araştırma Etik Kurulu'ndan onay aldı.
1. Yoğunluk gradyan ortamı, izotonik çalışma çözeltileri fraksiyonları ve hücre ayırma tamponunun hazırlanması
- Yoğunluk gradyan ortamından izotonik çalışma çözeltilerinin hazırlanması
- İzotonik% 100 çalışma çözeltisinin hazırlanması (~ 1.123 g / mL)
- İzotonik% 100 çalışma çözeltisini hazırlamak için, 27 mL yoğunluk gradyan ortamını 3 mL 10x PBS ile birleştirin. Bu, daha fazla seyreltme için uygun bir izotonik çözelti ile sonuçlanır.
- İzotonik% 81 çalışma çözeltisinin hazırlanması (~ 1.0996 g / mL)
- 8.1 mL izotonik %100 çalışma solüsyonunu (adım 1.1.1'de hazırlanan) 1.9 mL 1x PBS ile karıştırarak izotonik %81 çalışma solüsyonunu hazırlayın. Homojenliği sağlamak için iyice karıştırın.
- İzotonik% 70 çalışma çözeltisinin hazırlanması (~ 1.0861 g / mL)
- İzotonik% 70 çalışma çözeltisini hazırlamak için, 7 mL izotonik% 100 çalışma çözeltisini 3 mL 1x PBS ile birleştirin. Çözeltinin iyice karıştırıldığından emin olun.
- İzotonik% 55 çalışma çözeltisinin hazırlanması (1.0676 g / mL)
- 5.5 mL izotonik %100 çalışma solüsyonunu 4.5 mL 1x PBS ile karıştırarak izotonik %55 çalışma solüsyonunu yapın. İyice karıştırın.
- İzotonik% 100 çalışma çözeltisinin hazırlanması (~ 1.123 g / mL)
- Degrade kesirlerin katmanlanması
- Degrade kesir katmanlaması
- 15 mL'lik bir konik tüp kullanarak, altta 3 mL izotonik% 81 çalışma solüsyonunu dikkatlice katman. Ardından, katmanları karıştırmaktan kaçınarak üstüne 3 mL izotonik %70 çalışma solüsyonunu yavaşça ve nazikçe katmanlayın. Bu gradyan, hücre ayrımı için kullanılacaktır.
- Degrade kesir katmanlaması
- Hücre ayırma tamponunun hazırlanması
- 500 mL hücre ayırma tamponunun hazırlanması
- Hücre ayırma tamponunu hazırlamak için,% 2 fetal sığır serumu (FBS) ve 1 mM etilendiamintetraasetik asidi (EDTA) 1x PBS ile toplam 500 mL hacme birleştirin. İzolasyon işlemi sırasında hücreleri yıkamak ve yeniden süspanse etmek için bu tamponu kullanın.
NOT: Katmanların iyi ayrıldığından ve rahatsız edilmediğinden emin olun. Bu protokolde, izotonik çalışma solüsyonları, önceki çalışmalarla tutarlı olarak, hazırlama yöntemine göre "%100", "%81", "%70" ve "%55" olarak adlandırılır5. Bununla birlikte, bu etiketlerin çalışma çözeltilerinin gerçek nihai konsantrasyonlarını temsil etmediğini açıklığa kavuşturmak önemlidir. Örneğin, "%100" yoğunluk gradyan ortamı, 27 mL saf yoğunluk gradyan ortamının 3 mL 10x PBS ile karıştırılmasıyla hazırlanır ve bu da %90 İzotonik çalışma çözeltisinin nihai konsantrasyonu ile sonuçlanır. Sonraki seyreltmeler (örneğin, "%81", "%70" ve "%55") benzer şekilde gerçek yüzde konsantrasyonlarından ziyade hazırlama oranlarını yansıtır. Bu isimlendirme, konuyla ilgili daha önceki literatürde kullanılan terminoloji ile tutarlılığı korumak için korunmuştur.
- Hücre ayırma tamponunu hazırlamak için,% 2 fetal sığır serumu (FBS) ve 1 mM etilendiamintetraasetik asidi (EDTA) 1x PBS ile toplam 500 mL hacme birleştirin. İzolasyon işlemi sırasında hücreleri yıkamak ve yeniden süspanse etmek için bu tamponu kullanın.
- 500 mL hücre ayırma tamponunun hazırlanması
2. Negatif seçim kullanılarak nötrofillerin tam kandan izolasyonu
- Manyetik boncukların hazırlanması
- Kullanmadan önce tamamen yeniden askıya alındıklarından emin olmak için manyetik boncukları 30 saniye boyunca iyice sarın.
- Kan hazırlama
- Her donör için, 4 mL tam kanı üç ayrı 14 mL yuvarlak tabanlı tüpe alın.
- Nötrofil izolasyon kokteyli ve manyetik boncukların eklenmesi
- Her tüpe 50 μL nötrofil izolasyon kokteyli ve mL kan başına 50 μL manyetik boncuk ekleyin. 4 mL kan için, her reaktiften 200 μL ekleyin.
- Nazikçe pipetleyerek karışımı iyice süspanse edin ve reaktiflerin istenmeyen hücrelere bağlanmasını sağlamak için oda sıcaklığında (RT) 5 dakika inkübe edin.
- Yıkama ve manyetik ayırma - ilk tur
- Hücre ayırma tamponu kullanarak her tüpü 12 mL'ye kadar doldurun ve iyice karıştırın.
- Kapaksız tüpleri bir mıknatıs üzerine yerleştirin ve istenmeyen hücrelere bağlı manyetik boncukların tüp duvarına çekilmesini sağlamak için RT'de 10 dakika inkübe etmelerine izin verin.
- İlişkisiz hücrelerin toplanması
- Nötrofil içeren berrak hücre süspansiyonunu her tüpten bir transfer pipeti kullanarak yeni, temiz bir tüpe dikkatlice aktarın. Orijinal tüpü mıknatıstan çıkarın.
- Manyetik boncuk yeniden uygulama ve inkübasyon - ikinci tur
- Manyetik boncukları 30 saniye boyunca tekrar vorteksleyin. Yeni aktarılan hücre süspansiyonuna adım 2.3'te olduğu gibi aynı hacimde manyetik boncuk ekleyin. İyice yeniden askıya alın ve RT'de 5 dakika daha inkübe edin.
- Son manyetik ayırma ve toplama
- Tüpleri kapaksız mıknatısın üzerine geri yerleştirin ve RT'de 10 dakika daha inkübe edin.
- Şeffaf hücre süspansiyonunu dikkatlice yeni bir tüpe aktarın. Bu son süspansiyon, izole edilmiş toplam nötrofil popülasyonunu temsil eder.
3. Düşük yoğunluklu nötrofillerin (LDN'ler) ve normal yoğunluklu nötrofillerin (NDN'ler) toplam nötrofil popülasyonundan ayrılması
- Hücre süspansiyonlarının havuzlanması ve hazırlanması
- Her donör için, izole edilmiş nötrofil süspansiyonlarını 50 mL'lik tüplere koyun. Hücre ayırma tamponunu kullanarak her tüpü toplam 50 mL hacme kadar doldurun.
- Santrifüj
- Tüpleri, fren açıkken RT'de 5 dakika boyunca 400 x g'da santrifüjleyin.
- Yeniden süspansiyon ve hücre sayımı
- Süpernatanı atın ve nötrofil peletini 1 mL hücre ayırma tamponunda yeniden süspanse edin. Toplam nötrofil sayısını belirlemek için bir hücre sayımı yapın.
- Yoğunluk gradyan ortamı hazırlama
- Tüpleri, fren açıkken RT'de 5 dakika boyunca 400 x g'da tekrar santrifüjleyin. Süpernatanı atın ve nötrofil peletini %55 yoğunluklu gradyan ortamının 3 mL'sinde yeniden süspanse edin. Optimum çözünürlük için, 5-6 × 106 toplam nötrofil başına 3 mL %55 yoğunluk gradyan ortamı kullanın.
- Gerekirse, yeniden süspanse edilmiş hücreleri önceden hazırlanmış birden fazla yoğunluk gradyan tüpüne bölün ve her tüpe 3 mL hücre süspansiyonunun katmanlandığından emin olun.
- Yoğunluk gradyan tüpleri üzerine katmanlama
- %55 yoğunluk gradyan ortamını içeren 3 mL hücre süspansiyonunu önceden hazırlanmış yoğunluk gradyan tüplerinin üzerine yavaşça katmanlayın (bölüm 1'de açıklandığı gibi hazırlanır). Degradeyi bozmamak için dikkatli katmanlama sağlayın.
- Yoğunluk gradyan santrifüjleme
- Tüpleri freni kullanmadan 30 dakika boyunca 720 x g'da santrifüjleyin. Santrifüjlemeden sonra, katmanları rahatsız etmemek için tüpleri dikkatli bir şekilde tutun.
- Nötrofil fraksiyonlarının izolasyonu
- Santrifüjlemeyi takiben, nötrofillerin iki ayrı katmana ayrıldığını gözlemleyin:
Düşük yoğunluklu nötrofiller (LDN'ler) %55/%70 arayüzde yer alacak ve yaklaşık 3 mL işaretinde bir üst bant oluşturacak ve normal yoğunluklu nötrofiller (NDN'ler) %70/%81 arayüzde olacak ve 6 mL işareti civarında bir alt bant olarak görünecektir. - Bir transfer pipeti kullanarak, her katmanı dikkatlice izole edin ve bunları ayrı 15 mL'lik tüplere aktarın.
- Santrifüjlemeyi takiben, nötrofillerin iki ayrı katmana ayrıldığını gözlemleyin:
- İzole fraksiyonların yıkanması
- Herhangi bir artık yoğunluk gradyan ortamını yıkamak için, her 15 mL'lik tüpe 15 mL işaretine kadar 1x PBS ekleyin.
- Fren açıkken RT'de 5 dakika boyunca 400 × g'da santrifüjleyin. Hücreler sert bir pelet oluşturmazsa ve bunun yerine askıda kalırsa, kalan yoğunluk gradyan ortamının varlığını gösteren bu yıkama adımını tekrarlayın.
- Hücre sayımı ve aşağı akış uygulamaları
- Her fraksiyondaki hücreleri sayın ve gerektiğinde metabolik deneyler, akış sitometrisi boyama, RNA ekstraksiyonu veya protein lizisi gibi aşağı akış uygulamalarına devam edin.
NOT: Hücreleri kapladıktan sonra, plakayı 210 dakika boyunca 1 × g'da döndürmeniz (frenleme) önerilir.
- Her fraksiyondaki hücreleri sayın ve gerektiğinde metabolik deneyler, akış sitometrisi boyama, RNA ekstraksiyonu veya protein lizisi gibi aşağı akış uygulamalarına devam edin.
4. İzole LDN ve NDN'nin fenotiplendirilmesi
- ~ 0.5-1 × 106 LDN ve NDN'yi izole edin. CD14, CD86, CD15, CD16, CD10, Fc bloğu ve canlılık boyası kullanarak 2x konsantre antikor mastermix yapın.
- İzole edilmiş LDN ve NDN popülasyonlarını, hücreleri boyayan antikorların son seyreltilmesi sırasıyla 1:100 (CD14, CD86, CD15, CD16, CD10, Fc bloğu) ve 1:50 (canlılık boyası) olacak şekilde eşdeğer bir antikor mastermix hacmi ile boyayın.
- Hücreleri RT'de karanlıkta 10 dakika inkübe edin.
NOT: Hücrelerin antikor mastermix ve Fc bloğu ile iyice karıştığından emin olun. - Hücreleri PBS ile bir kez yıkayın, ardından 400 × g'da 5 dakika santrifüjleyin. Süpernatanı atın.
- Hücreleri karanlıkta RT'de 15 dakika boyunca% 1 paraformaldehit (PFA) içinde sabitleyin.
- Hücreleri tekrar PBS ile yıkayın, 400 × g'da 5 dakika santrifüjleyin ve süpernatanı atın.
- Hücreleri 200 μL PBS'de veya gerektiği gibi yeniden süspanse edin ve hücreleri mümkün olan en kısa sürede bir akış sitometresinde alın.
NOT: Lekeli ve sabit hücreler, floroforların foto-ağartılmasını önlemek için karanlıkta 4 ° C'de kısa süreli olarak saklanabilir. Bununla birlikte, ideal olarak, fenotipleme prosedürü, optimal hücre canlılığı ve doğru sonuçlar sağlamak için boyama ve fiksasyondan hemen sonra gerçekleştirilmelidir.
Sonuçlar
Toplam nötrofillerin yoğunluk gradyan ortamı üzerinde başarılı bir şekilde katmanlanması Şekil 1B'de gözlemlenebilir. İki farklı bant elde edilmelidir. Gradyanların karışımı meydana gelirse veya tüp başına katmanlanan toplam nötrofil sayısı yüksekse (kabaca 5-6'dan × 106'dan büyükse), bantlar dağınık görünecektir (Şekil 1C) ve iki nötrofil alt tipinin karışma riski önemli ölçüde artar. İkincisini önlemek için, yoğunluk gradyanlı tüp başına 5-6 × 106 toplam nötrofil katmanlamanızı öneririz. LDN'lerin sağlıklı bireylerde çok düşük sayılarda olduğuna dair raporlara rağmen, bu nedenle onları sonraki çalışmalar için ulaşılamaz hale getirir, bu yöntem hem LDN'lerin (ortalama 3.28 × 106 hücre / mL) hem de NDN'lerin (ortalama 10.64 × 106 hücre / mL) iyi verimini ve sağlıklı katılımcılardan saflığı gösterir (Şekil 2).
LDN'ler için ortalama izolasyon saflığı %93.80 (± 5.80) ve NDN'ler için %96.30 (± 3.30; Şekil 2A) izolasyon prosedüründen sonra, diğer hücre tiplerinde minimum kontaminasyon ile (Şekil 2B). Çekirdeklerin DAPI boyaması, çekirdek morfolojisi yoluyla LDN/NDN varlığını doğruladı ve izolasyondan sonra NDN'lerde belirgin çok loblu çekirdekler gösterdi (Şekil 2C). İzolasyondan sonraki mutlak sayımlar, LDN'lerden daha fazla NDN'nin mevcut olduğu ortak bir eğilim gösterdi, ortalama verimler sırasıyla 10.64 × 106 hücre / mL ve 3.28 × 106 hücre / mL'dir (Şekil 2D). Flow sitometri kullanılarak, hem LDN'ler hem de NDN'ler CD14lo CD86- CD15+ SSCyüksek hücreleri13 olarak tanımlandı (Şekil 2E). CD14 yaygın bir miyeloid belirteçtir, CD15 bir nötrofil tanımlama belirtecidir ve CD10 ve CD16 yaygın olarak tanımlanan nötrofil olgunluk ve aktivasyonbelirteçleridir 13. CD16 ve CD10 pozitif popülasyonları negatif popülasyonlardan ayırt etmek için floresan eksi bir kontroller (FMO'lar) kullanıldı. Sağlıklı bireylerde olgun LDN'lerin yanı sıra NDN'lerin (CD16hiCD10+) büyük ölçüde tekil bir popülasyonu gözlenmiştir, bu da literatürdeki raporlarla tutarlıdır13, çünkü sağlıklı bireylerin dolaşımda yüksek oranda olgunlaşmamış nötrofil (CD16lo/intCD10+) olması muhtemel değildir (Şekil 2F,G). Ortalama olarak, CD16hiCD10+ LDNs sıklığı %93.33 (± 5.29), CD16hiCD10+ NDNs %98.03 (± 1.40), CD16lo/intCD10+ %0.49 (± 0.38) ve CD16lo/intCD10+ %0.17 (± 0.06; Şekil 2F,G). CD16 + CD10 + popülasyonları birbiri üzerine bindirildiğinde, örtüşme derecesi, NDN'lere kıyasla LDN'lerde bu belirteçlerin ekspresyonunda gözle görülür bir fark göstermedi (Şekil 2H). Hücreler bir akış sitometresi kullanılarak elde edildi ve tüm veri analizi akış sitometrisi için uygun yazılım kullanılarak gerçekleştirildi.
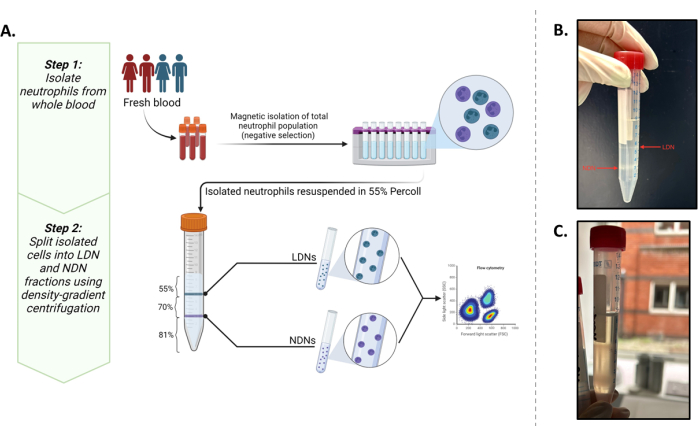
Şekil 1: Protokole genel bakış. (A) Tam kandan LDN'lerin ve NDN'lerin iki aşamalı izolasyon protokolü. İlk adım, negatif seleksiyon kullanılarak tam kandan izole edilen toplam nötrofillerden oluşur. İkinci adım, toplam nötrofillerin %55 İzotonik çalışma çözeltisinde yeniden süspanse edilmesini ve %81 ve %70'lik bir gradyanın üzerine katmanlanmasını içerir. Santrifüjlemelerden sonra, LDN'ler %55 ve %70 katmanlarının arayüzünde ve NDN'ler %81 ve %70 katmanların arayüzünde olacaktır. (B) Gradyan ortam santrifüjünden sonra ideal olarak ayrılmış LDN'lerin ve NDN'lerin görsel temsili. (C) Bantların dağınık doğası ile görüldüğü gibi LDN'lerin ve NDN'lerin optimal olmayan ayrılması. Bu durumda, NDN'lerin LDN fraksiyonunu kontamine etme olasılığı yüksektir veya bunun tersi de geçerlidir. BioRender'da oluşturulan grafik. Yennemadi, A. (2025) https://BioRender.com/t03m122. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
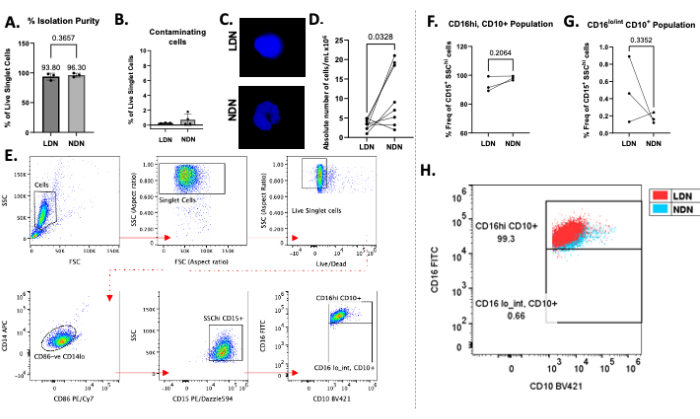
Şekil 2: Protokolün temsili sonuçları. (A) LDN'lerin ve NDN'lerin tam kandan yüzde izolasyon saflığı. (B) İzolasyondan sonra kirletici hücrelerin (B hücreleri, T hücreleri ve monositler) yüzdesi. (C) NDN'lerde çok loblu çekirdekleri ve LDN'lerde tek loblu çekirdekleri gösteren izolasyondan sonra LDN'lerin ve NDN'lerin DAPI boyaması. (D) Tam kandan izole edilen LDN'lerin ve eşleşen NDN'lerin mutlak sayısı. (E) LDN'leri ve NDN'leri tanımlamak, saflıklarını belirlemek ve frekanslarını hesaplamak için kullanılan geçit stratejisi. Enkaz, çiftler ve ölü hücreler analizden çıkarıldı (üst sıra) ve nötrofilleri tanımlamak için CD86-CD14lo, CD15+ SSChi hücreleri üzerine geçit yapıldı. (F,G) CD16 ve CD10 ekspresyonu, floresan eksi bir kontrollerin kullanımı ile birlikte alt popülasyonları tanımlamak için kullanıldı. İzole edilmiş olgun (CD16hiCD10 +) ve olgunlaşmamış (CD16lo / intCD10 +) LDN ve NDN alt popülasyonlarının sıklığı, toplam LDN'lerin ve NDN'lerin yüzdesi olarak rapor edilir (CD15 + SSChi hücreleri olarak tanımlanır). (H) Sağlıklı bireylerde CD16 + CD10 + NDN'lerin üzerine bindirilmiş CD16 + CD10 + LDN'leri gösteren nokta grafiği. Ortalama ± SD, Eşleştirilmiş t-testi, n = 3-8. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada, toplam nötrofil popülasyonunu düşük yoğunluklu ve normal yoğunluklu nötrofillere bölmek için optimize edilmiş bir yöntem, önceki yöntemlerden uyarlanan akış sitometrisi kullanılarak her hücre tipinin fenotipik karakterizasyonu ile birliktesunuyoruz 5.
Bu protokol, LDN'lerin ve NDN'lerin tam kandan izole edilmesine dayanır. Önemli bir adım, toplam nötrofillerin negatif seçim yöntemleriyle izole edilmesidir. Pozitif seçim yöntemleri, yüzey belirteçlerine bağlanan, potansiyel olarak nötrofilleri aktive eden ve degranülasyonutetikleyen antikorların kullanımını içerir 5. Bu aktivasyon, nötrofillerin fonksiyonel ve metabolik durumunu değiştirerek, yanlış sonuçlara yol açarak ve deneysel sonuçların yorumlanmasını çarpıtarak aşağı akış deneylerine müdahale edebilir. Bu nedenle, negatif seçim, aktivasyon veya fonksiyonel değişikliklere neden olmadan nötrofillerin izolasyonunu sağlar. Ek olarak, negatif ayırma tabanlı manyetik izolasyonun kullanılması, kırmızı kan hücresi (RBC) lizizine olan ihtiyacı ortadan kaldırır. Bu sadece ekstra yıkama adımlarını ve hücre ölümünü azaltmakla kalmaz, böylece verimi korur, aynı zamanda RBC kontaminasyonunu en aza indirerek izole edilen nötrofillerin saflığını da artırır. Orijinal protokolle karşılaştırıldığında, PBS yerine yıkama ve yeniden süspansiyon dahil olmak üzere tüm süreç boyunca bir hücre ayırma tamponu kullanıldı. Bu, hücre topaklanmasını azaltan ve manyetik izolasyon sırasında spesifik olmayan bağlanmayı en aza indiren katkı maddeleri içerir. Hücre ayırma tamponunu tutarlı bir şekilde kullanarak, PBS kullanmaya kıyasla daha iyi hücre ayırma verimliliği, daha yüksek saflık ve daha fazla canlı, el değmemiş nötrofil verimi elde ettik. Bu, sonraki analizler için gelişmiş hassasiyetle sonuçlandı. Ek olarak, yoğunluk gradyanı, iki hücre tipi arasındaki çözünürlüğü iyileştirmek için tek bir tüp yerine birden fazla tüp üzerinde gerçekleştirildi.
İki nötrofil alt tipinin başarılı bir şekilde ayrılması, şaşırtıcı olmayan bir şekilde, her bir gradyan15'in kesin formülasyonuna ve doğru katmanlamasına bağlıdır. Aynı derecede önemli olan,% 70'in% 81'inin üzerine katmanlanması ve% 55'in üzerine nötrofil süspansiyonunun (% 70'te) katmanlanmasıdır. Bu yöntemi uygulamanızı şiddetle tavsiye ederiz. 15 mL'lik tüpü biyogüvenlik kabininin tabanına neredeyse paralel olarak katmanlarken ve yerleştirirken bir transfer pipeti kullanmak en iyisidir. Gradyanların karıştırılması, hafifçe bile, belirsiz ve dağınık bantlara neden olur ve bu da belirsiz popülasyonlar oluşturabilir. Bir Pasteur pipeti kullanarak sadece nötrofil bantlarının yavaşça çıkarılmasına özen gösterilmelidir, çünkü toksisiteleri nedeniyle mümkünse üst ve alt katmanlar aspire edilmemelidir. Hücreler üzerinde herhangi bir olumsuz etkiden kaçınmak için nötrofil fraksiyonunun İzotonik çalışma solüsyonu ile kontaminasyonunu en aza indirmekönemlidir 15. Son olarak, daha yüksek hücre sayıları, LDN ve NDN bantlarının genel olarak daha yüksek bir yoğunluğuna neden olabilir ve bu da hücre popülasyonlarının daha zayıf çözünürlüğüne neden olabilir. Bu nedenle,% 55'lik çözeltide yeniden süspansiyondan önce toplam nötrofil sayımı yapılmasını öneririz. Bu, nötrofil izolasyonu için >12 mL tam kan kullanılıyorsa veya toplam nötrofil sayısı 5-6 × 106'yı aşıyorsa özellikle önemlidir.
Bu yönteme alternatifler, manyetik ayırmaya dayanmayan ve esasen tek adımlı bir protokol olan dekstran/Percoll kombinasyonundan oluşur16. Eritrositleri uzaklaştırmak için dekstran sedimantasyonunun kullanılması, doğrudan RBC lizisi veya yoğunluk gradyanları gibi diğer yöntemler kadar verimli veya tutarlı olmayabilir. Dekstran sedimantasyonu, süpernatantta kalıntı RBC'ler bırakabilir ve bu da nötrofil popülasyonunun saflığını etkileyebilir. Negatif bir seçim adımı olmadan, nötrofillerin artık antikorlar veya diğer uyaranlar tarafından aktive edilme riski vardır, bu da aşağı akış tahlillerindeki davranışlarını etkileyebilir. PBMC ve nötrofil katmanlarının yoğunluk gradyan ortamından manuel olarak çıkarılması, özellikle ayırma temiz değilse, hücre popülasyonları arasında kontaminasyona neden olabilir.
Bu çalışma, izole LDN'lerin ve NDN'lerin saflığını belirlemek ve bu hücrelerin minimal bir karakterizasyonunu gerçekleştirmek için nispeten basit bir akış sitometrisi paneli sunmaktadır. Burada kullanılan belirteçler, nötrofil araştırmalarını içeren çoklu, daha karmaşık akış sitometrisi panellerinin bir parçası olarak literatürde yaygın olarak bildirilmektedir. İzolasyon saflığını, canlı ve ölü hücrelerin yüzde sıklığını belirlemek ve nötrofil olgunlaşma durumunu incelemek (CD10 ve CD16 ekspresyonuna dayanarak) paneli yoğunlaştırmayı seçtik. Bununla birlikte, çeşitli son kullanıcıların çalışmalarının ihtiyaçlarına uyacak şekilde genişletilebilir. Bu protokol, LDN'leri ve NDN'leri bireysel değerlendirme için ayırmak için özel olarak tasarlanmıştır, çünkü bu alt popülasyonları bir akış sitometrisi panelinde birlikte ayırt etmenin, göreceli belirsizlikleri nedeniyle zor olduğu kanıtlanmıştır (Şekil 2H). Önceki raporlarla tutarlı olarak5, sağlıklı bireylerden alınan LDN'lerin ve NDN'lerin aynı anda analiz edildiğinde güvenilir bir şekilde ayırt edilemediği bulunmuştur. Bu nedenle, onları önceden izole etmek, her bir alt popülasyonun daha doğru ve ayrıntılı bir karakterizasyonuna izin verir.
Bu protokolün optimizasyon aşamasında, son kullanıcıların akış sitometrisi panellerine CD3 ve CD19 gibi temel lenfosit belirteçlerini dahil etmeyi seçebileceklerini öneriyoruz. Bu, sorun gidermeye yardımcı olabilir, çünkü optimal olmayan manyetik izolasyon, lenfositlerin toplam nötrofil izolatına dahil edilmesine neden olabilir ve bu da benzer hücresel yoğunluklar nedeniyle potansiyel olarak LDN fraksiyonuna ilerleyebilir. Optimizasyon amacıyla, kullanıcılar izole fraksiyonlarındaki kirleticileri daha iyi gidermek için CD45 eklemeyi seçebilirler, yani CD45-ve RBC'ler olabilir ve CD45+ve PBMC kontaminasyonunu gösterebilir. Nötrofil alt popülasyonları, dinamik bir özellik olan ve donörler arasında yüksek düzeyde değişkenlik gösterebilen yüzey işaretleyici ekspresyonuna dayalı olarak tanımlandı. Bu nedenle, iyi akış sitometrisi uygulamalarına uygun olarak, donörler arası değişkenliği azaltmaya ve daha net alt popülasyonları tanımlamaya yardımcı olabileceğinden, FMO kontrollerinin kullanılması da önerilmektedir.
Ayrıca, bu protokolün, bu kit ile yalnızca işlenmemiş tam kanın kullanılması gerektiğini ve istenen izole hücrelerin geri kazanımının >24 saatlik örneklerle azaldığını belirten manyetik izolasyon kitindeki yönergelere uygun olarak yalnızca taze tam kan için optimize edildiğini kabul ediyoruz. Bu, bronkoalveoler lavaj sıvısı (BALF), plevral sıvı, asitler vb. gibi nötrofillerin izole edilebileceği başlangıç materyali seçeneklerini ortadan kaldırır. Connelly ve ark. nötrofillerin17 işlenmesindeki gecikmelerin, taze çekilmiş tam kandan bile, fenotiplerini ve yüzey ekspresyonlarını değiştirebileceğini göstermiştir. Buna uygun olarak, kan alma zamanından itibaren mümkün olan en az gecikmeyle işlemeye başlamanızı öneririz. Bu nedenle, bu protokol taze tam kan için ideal olsa da, dekstran / Percoll gibi tek adımlı protokollerle karşılaştırıldığında, bir ara durma noktası sunmayan nispeten uzun ve zaman alıcı bir yöntem olabilir. Bu, numunelerin günün ilerleyen saatlerinde alınabileceği klinik çalışmalarda bir sınırlama sunar. Ek olarak, bu yöntem LDN ve NDN alt kümelerinin sıralanmasına izin vermez, çünkü alt kümeleri sıralama yöntemleri (akış sitometrisi veya başka bir şekilde) istemeden nötrofilleri aktive etme riski taşır.
Nötrofil alt popülasyonları, sistemik lupus eritematozus (SLE)18,19, kanser20 ve COVID-1921 gibi durumlarda önemli ölçüde dikkat çekmiştir. Bu hücre tiplerine olan ilginin artması, özellikle enflamatuar ve otoimmün hastalıklar bağlamında, her bir popülasyonu doğru bir şekilde değerlendirmek ve patogeneze bireysel katkılarını daha iyi anlamak için güvenilir yöntemlere duyulan ihtiyacın altını çizmektedir.
Açıklamalar
Yazarların herhangi bir açıklaması yoktur.
Teşekkürler
Bu çalışma, Sağlık Araştırma Kurulu EIA-2024-002 ve Dublin Kraliyet Şehri Hastanesi Vakfı tarafından finanse edilmiştir. Bu el yazması için sağlıklı bağışçılardan örnek toplamadaki yardımları için Dr. Lorraine Thong ve Dr. Kevin Brown'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
Referanslar
- Tracchi, I., et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I., et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E., et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963(2021).
- Hacbarth, E., Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R., et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922(2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A., et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696(2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M., et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B., Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520(2021).
- Park, J., et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282(2023).
- Denny, M. F., et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A., et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603(2019).
- Mosca, T., Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y., et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N., et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667(2022).
- Carmona-Rivera, C., Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y., et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154(2023).
- Dwivedi, A., et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659(2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır