Method Article
عزل وتوصيف العدلات منخفضة الكثافة والطبيعية من الدم الكامل
In This Article
Summary
هنا ، نقدم نهجا موثوقا به لعزل العدلات منخفضة الكثافة وطبيعية عن الدم الكامل باستخدام العزل المغناطيسي (الاختيار السلبي) ووسط تدرج الكثافة المتقطع. إنه يضمن عزلا لم يمسها أحد للخلايا عالية النقاء (≥93٪) ، مما يسهل التحليل الدقيق للمصب للمجموعات السكانية الفرعية للعدلات ، وهو أمر بالغ الأهمية لفهم أدوارها في الصحة والمرض.
Abstract
تظهر الأبحاث الناشئة أن مجموعة العدلات المنتشرة في البشر تتكون من أنواع فرعية متنوعة ولا ينبغي دراستها كمجموعة واحدة ، كما حدث تاريخيا. على وجه الخصوص ، ثبت أن العدلات منخفضة الكثافة والكثافة الطبيعية (LDNs ، NDNs) لها ملامح متميزة وظيفيا وأيضيا ، وهو عامل يجب مراعاته عند نشر أبحاث العدلات. هنا ، نقدم طريقة معدلة لعزل وفصل LDNs و NDNs عن الدم الكامل.
يتم دمج وسط تدرج الكثافة (1.135 جم / مل) عند 9:10 مع 10x PBS. يتم بعد ذلك إجراء تدرجات كثافة محددة بنسبة 55٪ و 70٪ و 81٪ من خلال الجمع بين وسط التدرج الكثافة بنسبة 100٪ مع محلول ملحي مخزن بالفوسفات 1x (PBS). يتم إعادة تعليق العدلات المعزولة من 12 مل من الدم الكامل المحيطي الذي تم الحصول عليه من المتبرعين الموافقين باستخدام مجموعة العزل المغناطيسي القائم على الانتقاء السلبي في جزء 55٪. يتم وضع حجم 3 مل من الكسور 81٪ و 70٪ في أنبوب سعة 15 مل ، متبوعا بجزء 55٪ يحتوي على العدلات الكلية. ثم يتم طرد تدرجات الكثافة عند 720 × جم لمدة 30 دقيقة. يتم الحصول على نطاقين متميزين عند واجهة 55٪ / 70٪ (LDNs) وواجهة 70٪ / 81٪ (NDNs). يتم سحب الخلايا بعناية في أنابيب منفصلة وغسلها باستخدام PBS. يتم تحديد نقاء الكسور المعزولة باستخدام قياس التدفق الخلوي. تم تعريف كل من LDNs و NDNs على أنها CD14lo CD15 + SSChi عن طريق قياس التدفق الخلوي. تم حساب نقاء العزل عند ≥93٪ من الخلايا القابلة للحياة لكلا النوعين.
توفر هذه الطريقة نهجا موثوقا وفعالا لفصل LDN و NDNs عن الدم المحيطي ، مما يضمن نقاء عاليا وقابلية للحياة للخلايا المعزولة. يسهل تعزيز دقة عزل العدلات إجراء تحليلات أكثر دقة لهذه المجموعات السكانية الفرعية للعدلات المتميزة. هذه ضرورية لتعزيز فهمنا لعدم تجانس العدلات وآثارها في مختلف السياقات الفسيولوجية والمرضية.
Introduction
العدلات هي خلايا مناعية حبيبية وأكثر الكريات البيض وفرة في الدم المحيطي ، وتشكل حوالي 50٪ -70٪ من الكريات البيض في المتوسط. تتطور في نخاع العظام من سلائف الخلايا الحبيبية وحيدة الخلايا (GMPs) ، والتي بدورها تتطور من الخلايا السلفية المكونة للدم (HPCs) في وجود عامل تحفيز مستعمرة الخلايا المحببة (G-CSF). في التوازن ، يبلغ عمرها الافتراضي ~ 24 ساعة ، لكن الدراسات أظهرت أنه يمكن إطالة عمرها في ظل ظروف فسيولوجية محددة والبيئات الدقيقة المرتبطة بها مثل التنشيط المناعيالمزمن 1 ، والالتهاب1 ، وحتى إقامة الأنسجة في حالةمستقرة 2. لطالما اعتبرت العدلات خط الدفاع الأول ضد مسببات الأمراض وتثير آثارها المضادة للميكروبات من خلال 3 وظائف مستجيب رئيسية - التحلل ، والبلعمة ، وتنشيط وإطلاق مصيدة العدلات خارج الخلية (NET).
تفحص معظم الدراسات حول وظيفة العدلات والبيولوجيا نتائج إجمالي العدلات. ومع ذلك ، من الدراسات التي أجريت على إعدادات السرطان التي تحدد الأنواع الفرعية N1 (المضادة للورم) / N2 (المؤيدة للورم) إلى تصنيف العدلات بناء على النضج والمرض والحالة الفسيولوجية ، وحتى الكثافة الخلوية (العدلات منخفضة الكثافة والكثافة الطبيعية) ، أصبح من الواضح بشكل متزايد أن مجموعة العدلات البشرية تشكل أنواعا فرعية متنوعة ظاهريا. سواء كان وجود هذه الأنواع الفرعية للعدلات يمكن أن يعزى إلى كونها أنواعا متميزة تماما من الخلايا أو بسبب الطبيعة المعقدة للدونة ، فهناك مجموعة متزايدة من الأدبيات حول العدلات غير النمطية وتقدم فرصة مقنعة لدراسة العدلات منخفضة الكثافة المنفصلة عن العدلات ذات الكثافةالطبيعية 3.
تم وصفها لأول مرة في مرضى الذئبة الحمراء على أنها مجموعة فرعية من العدلاتالمؤيدة للالتهابات 4 ، وقد تم تحديدها منذ ذلك الحين في الأمراض المزمنة والحمل وحتى في الدورة الدموية الصحية ، في القدرات المؤيدة للالتهابات وكذلك القمعية5،6،7،8. تم العثور على LDNs بالتزامن مع خلايا الدم المحيطية أحادية النواة (PBMCs) عندما يتم طرد الدم الكامل فوق وسائط متدرجة الكثافة. تتوافق كثافتها النوعية مع حوالي 1.077 جم / مل ، مقارنة ب NDNs عند 1.083 جم / مل9. في حين أنه لا يزال هناك جدل كبير حول هذا الموضوع ، إلا أن هناك تكهنات بأن LDNs تشبه نمطا ظاهريا للخلايا الحبيبية غير الناضجة (على غرار الخلايا النخاعية والخلايا النخاعية ، بكثافة أقل من 1.080 جم / مل) 9،10. لا يزال آخرون يتكهنون بوجود أنماط ظاهرية LDN ناضجة وغير ناضجة اعتمادا على وجود أو عدم وجود المرض11،12،13. ومع ذلك ، فقد تم الكشف عن LDNs أيضا في الأفراد الأصحاء. ومع ذلك ، فإن إدراجها في بعض الدراسات محدود بسبب صعوبة عزلها بأعداد كافية5.
تهدف هذه الدراسة إلى عزل هاتين المجموعتين بكميات تسمح لنا بإجراء تجارب التمثيل الغذائي في الموقع (0.5 × 106 خلايا / مل). عند القيام بذلك ، تم تحسين البروتوكولالحالي 5 باستخدام علامات النمط الظاهري المبلغ عنها بشكل شائع13،14 والتي توفر أفضل نتيجة لعزل وتوصيف LDNs و NDNs من الدم الكامل (الشكل 1 أ).
Protocol
تم جمع عينات الدم بموافقة مستنيرة من المشاركين الأصحاء. حصلت الدراسة على موافقة لجنة أخلاقيات البحث في كل من مستشفى سانت جيمس ومستشفى جامعة تالاغت.
1. إعداد وسط تدرج الكثافة ، وكسور حلول العمل متساوية التوتر ومخزن لفصل الخلايا
- تحضير محاليل العمل متساوية التوتر من وسط تدرج الكثافة
- تحضير محلول عمل متساوي التوتر بنسبة 100٪ (~ 1.123 جم / مل)
- لتحضير محلول العمل متساوي التوتر بنسبة 100٪ ، اجمع بين 27 مل من وسط تدرج الكثافة مع 3 مل من 10x PBS. ينتج عن هذا محلول متساوي التوتر مناسب لمزيد من التخفيفات.
- تحضير محلول عمل متساوي التوتر بنسبة 81٪ (~ 1.0996 جم / مل)
- قم بإعداد محلول العمل متساوي التوتر بنسبة 81٪ عن طريق خلط 8.1 مل من محلول العمل متساوي التوتر بنسبة 100٪ (المحضر في الخطوة 1.1.1) مع 1.9 مل من 1x PBS. تخلط جيدا لضمان التجانس.
- تحضير محلول عمل متساوي التوتر بنسبة 70٪ (~ 1.0861 جم / مل)
- لتحضير محلول العمل متساوي التوتر بنسبة 70٪ ، امزج 7 مل من محلول العمل متساوي التوتر بنسبة 100٪ مع 3 مل من 1x PBS. تأكد من خلط المحلول جيدا.
- تحضير محلول عمل متساوي التوتر بنسبة 55٪ (1.0676 جم / مل)
- اصنع محلول العمل متساوي التوتر بنسبة 55٪ عن طريق خلط 5.5 مل من محلول العمل متساوي التوتر بنسبة 100٪ مع 4.5 مل من 1x PBS. تخلط جيدا.
- تحضير محلول عمل متساوي التوتر بنسبة 100٪ (~ 1.123 جم / مل)
- طبقات الكسور المتدرجة
- طبقات كسر التدرج
- باستخدام أنبوب مخروطي سعة 15 مل ، ضع طبقة بعناية 3 مل من محلول العمل متساوي التوتر بنسبة 81٪ في الأسفل. بعد ذلك ، ضع ببطء ورفق 3 مل من محلول العمل متساوي التوتر بنسبة 70٪ في الأعلى ، مع تجنب خلط الطبقات. سيتم استخدام هذا التدرج لفصل الخلايا.
- طبقات كسر التدرج
- تحضير المخزن المؤقت لفصل الخلايا
- تحضير 500 مل من المخزن المؤقت لفصل الخلايا
- لتحضير المخزن المؤقت لفصل الخلايا ، امزج 2٪ مصل بقري الجنين (FBS) و 1 ملي مولار حمض الإيثيلين ديامين تترا أسيتيك (EDTA) مع 1x PBS بحجم إجمالي قدره 500 مل. استخدم هذا المخزن المؤقت لغسل الخلايا وإعادة تعليقها أثناء عملية العزل.
ملاحظة: تأكد من أن الطبقات مفصولة جيدا وغير مضطربة. في هذا البروتوكول ، يشار إلى محاليل العمل متساوية التوتر باسم "100٪" و "81٪" و "70٪" و "55٪" بناء على طريقة التحضير ، بما يتفق مع الدراسات السابقة5. ومع ذلك ، من المهم توضيح أن هذه الملصقات لا تمثل التركيزات النهائية الفعلية لحلول العمل. على سبيل المثال ، يتم تحضير وسط التدرج الكثافة "100٪" عن طريق خلط 27 مل من وسط التدرج النقي الكثافة مع 3 مل من 10x PBS ، مما ينتج عنه تركيز نهائي بنسبة 90٪ محلول عمل متساوي التوتر. وتعكس التخفيفات اللاحقة (على سبيل المثال، "81٪" و"70٪" و"55٪") بالمثل نسب التحضير بدلا من تركيزات النسبة المئوية الحقيقية. تم الاحتفاظ بهذه التسمية للحفاظ على الاتساق مع المصطلحات المستخدمة في الأدبيات السابقة حول هذا الموضوع.
- لتحضير المخزن المؤقت لفصل الخلايا ، امزج 2٪ مصل بقري الجنين (FBS) و 1 ملي مولار حمض الإيثيلين ديامين تترا أسيتيك (EDTA) مع 1x PBS بحجم إجمالي قدره 500 مل. استخدم هذا المخزن المؤقت لغسل الخلايا وإعادة تعليقها أثناء عملية العزل.
- تحضير 500 مل من المخزن المؤقت لفصل الخلايا
2. عزل العدلات عن الدم الكامل باستخدام الانتقاء السلبي
- تحضير الخرز المغناطيسي
- قم بتدوير الخرزات المغناطيسية جيدا لمدة 30 ثانية لضمان إعادة تعليقها بالكامل قبل الاستخدام.
- تحضير الدم
- لكل متبرع ، تناول 4 مل من الدم الكامل في ثلاثة أنابيب منفصلة 14 مل مستديرة القاع.
- إضافة كوكتيل عزل العدلات والخرز المغناطيسي
- أضف 50 ميكرولتر من كوكتيل عزل العدلات و 50 ميكرولتر من الخرز المغناطيسي لكل مل من الدم إلى كل أنبوب. للحصول على 4 مل من الدم ، أضف 200 ميكرولتر من كل كاشف.
- أعد تعليق الخليط جيدا عن طريق الماصة برفق واحتضانه في درجة حرارة الغرفة (RT) لمدة 5 دقائق للسماح للكواشف بالارتباط بالخلايا غير المرغوب فيها.
- الغسيل والفصل المغناطيسي - الجولة الأولى
- قم بتعبئة كل أنبوب إلى 12 مل باستخدام المخزن المؤقت لفصل الخلايا واخلطه جيدا.
- ضع الأنابيب بدون أغطية على مغناطيس واتركها تحتضن في RT لمدة 10 دقائق للسماح بسحب الخرزات المغناطيسية المرتبطة بالخلايا غير المرغوب فيها إلى جدار الأنبوب.
- مجموعة من الخلايا غير المنضمة
- انقل معلق الخلية الشفافة الذي يحتوي على عدلات بعناية من كل أنبوب إلى أنبوب جديد ونظيف باستخدام ماصة نقل. قم بإزالة الأنبوب الأصلي من المغناطيس.
- إعادة تطبيق الحبة المغناطيسية وحضانة - الجولة الثانية
- دوامة الخرز المغناطيسي مرة أخرى لمدة 30 ثانية. أضف نفس حجم الخرزات المغناطيسية إلى تعليق الخلية المنقول حديثا كما في الخطوة 2.3. قم بالتعليق جيدا واحتضانه في RT لمدة 5 دقائق أخرى.
- الفصل المغناطيسي النهائي والتجميع
- ضع الأنابيب مرة أخرى على المغناطيس بدون أغطية واحتضنها في RT لمدة 10 دقائق أخرى.
- انقل تعليق الخلية الشفافة بعناية إلى أنبوب جديد. يمثل هذا المعلق النهائي إجمالي عدد العدلات المعزولة.
3. فصل العدلات منخفضة الكثافة (LDNs) والعدلات ذات الكثافة الطبيعية (NDNs) عن إجمالي عدد العدلات
- تجميع وإعداد معلقات الخلايا
- لكل متبرع ، قم بتجميع معلقات العدلات المعزولة في أنابيب سعة 50 مل. قم بتعبئة كل أنبوب بحجم إجمالي يبلغ 50 مل باستخدام المخزن المؤقت لفصل الخلية.
- الطرد المركزي
- قم بالطرد المركزي للأنابيب عند 400 × جم لمدة 5 دقائق في RT مع تشغيل الفرامل.
- إعادة التعليق وعد الخلايا
- تخلص من المادة الطافية وأعد تعليق حبيبات العدلات في 1 مل من المخزن المؤقت لفصل الخلايا. قم بإجراء تعداد الخلايا لتحديد العدد الإجمالي للعدلات.
- تحضير وسط تدرج الكثافة
- قم بالطرد المركزي للأنابيب مرة أخرى عند 400 × جم لمدة 5 دقائق في RT مع تشغيل الفرامل. تخلص من المادة الطافية وأعد تعليق حبيبات العدلات في 3 مل من وسط التدرج الكثافة 55٪. للحصول على الدقة المثلى ، استخدم 3 مل من وسط التدرج الكثافة 55٪ لكل 5-6× 10 6 عدلات إجمالية.
- إذا لزم الأمر ، قم بتقسيم الخلايا المعلقة عبر عدة أنابيب متدرجة كثافة مسبقة الصنع ، مع التأكد من وضع 3 مل من تعليق الخلية في كل أنبوب.
- طبقات على أنابيب تدرج الكثافة
- ضع طبقة ببطء من معلق الخلية سعة 3 مل الذي يحتوي على وسط تدرج الكثافة بنسبة 55٪ على أنابيب تدرج الكثافة المعدة مسبقا (المعدة كما هو موضح في القسم 1). تأكد من وضع طبقات دقيقة لتجنب إزعاج التدرج.
- الطرد المركزي المتدرج الكثافة
- قم بالطرد المركزي للأنابيب عند 720 × جم لمدة 30 دقيقة دون استخدام الفرامل. بعد الطرد المركزي ، تعامل مع الأنابيب بعناية لتجنب إزعاج الطبقات.
- عزل كسور العدلات
- بعد الطرد المركزي ، لاحظ أن العدلات تنفصل إلى طبقتين متميزتين:
سيتم وضع العدلات منخفضة الكثافة (LDNs) عند واجهة 55٪ / 70٪ ، وتشكل نطاقا علويا عند علامة 3 مل تقريبا ، وستكون العدلات ذات الكثافة العادية (NDNs) عند واجهة 70٪ / 81٪ ، وتظهر كنطاق سفلي حول علامة 6 مل. - باستخدام ماصة النقل ، قم بعزل كل طبقة بعناية ونقلها إلى أنابيب منفصلة سعة 15 مل.
- بعد الطرد المركزي ، لاحظ أن العدلات تنفصل إلى طبقتين متميزتين:
- غسل الكسور المعزولة
- لغسل أي وسط تدرج كثافة متبقية ، أضف 1x PBS إلى كل أنبوب سعة 15 مل حتى علامة 15 مل.
- جهاز طرد مركزي عند 400 × جم لمدة 5 دقائق عند RT مع تشغيل الفرامل. إذا لم تشكل الخلايا حبيبات صلبة وبدلا من ذلك ظلت معلقة ، كرر خطوة الغسيل هذه ، مما يشير إلى وجود وسط تدرج الكثافة المتبقي.
- عدد الخلايا والتطبيقات النهائية
- عد الخلايا في كل جزء واستمر في التطبيقات النهائية مثل تجارب التمثيل الغذائي أو تلطيخ قياس التدفق الخلوي أو استخراج الحمض النووي الريبي أو تحلل البروتين حسب الحاجة.
ملاحظة: بعد طلاء الخلايا ، يوصى بتدوير اللوحة عند 210 × جم لمدة دقيقة واحدة (إيقاف تشغيل الفرامل).
- عد الخلايا في كل جزء واستمر في التطبيقات النهائية مثل تجارب التمثيل الغذائي أو تلطيخ قياس التدفق الخلوي أو استخراج الحمض النووي الريبي أو تحلل البروتين حسب الحاجة.
4. التنميط الظاهري ل LDN و NDN المعزول
- عزل ~ 0.5-1 × 106 LDNs و NDNs. اصنع مزيجا رئيسيا للأجسام المضادة المركزة 2x باستخدام CD14 و CD86 و CD15 و CD16 و CD10 و Fc block وصبغة البقاء.
- قم بتلطيخ مجموعات LDN و NDN المعزولة بحجم مكافئ من الأجسام المضادة الرئيسية بحيث يكون التخفيف النهائي للأجسام المضادة التي تلطخ الخلايا 1: 100 (CD14 ، CD86 ، CD15 ، CD16 ، CD10 ، Fc block) و 1:50 (بقعة البقاء) ، على التوالي.
- احتضان الخلايا لمدة 10 دقائق في الظلام في RT.
ملاحظة: تأكد من خلط الخلايا جيدا مع الجسم المضاد mastermix وكتلة Fc. - اغسل الخلايا مرة واحدة باستخدام PBS ، ثم جهاز الطرد المركزي على حرارة 400 × جم لمدة 5 دقائق. تخلص من المادة الطافية.
- قم بإصلاح الخلايا في 1٪ بارافورمالدهيد (PFA) لمدة 15 دقيقة عند RT في الظلام.
- اغسل الخلايا مرة أخرى باستخدام PBS ، وجهاز الطرد المركزي على حرارة 400 × جم لمدة 5 دقائق ، وتخلص من المادة الطافية.
- أعد تعليق الخلايا في 200 ميكرولتر من PBS أو حسب الحاجة لاستخدامها واحصل على الخلايا على مقياس التدفق الخلوي في أسرع وقت ممكن.
ملاحظة: يمكن تخزين الخلايا الملطخة والثابتة على المدى القصير عند درجة حرارة 4 درجات مئوية في الظلام لمنع التبييض الضوئي للفلوروفورات. ومع ذلك ، من الناحية المثالية ، يجب تنفيذ إجراء التنميط الظاهري على الفور بعد التلوين والتثبيت لضمان بقاء الخلية المثلى والنتائج الدقيقة.
النتائج
يمكن ملاحظة الطبقات الناجحة للعدلات الكلية على وسط تدرج الكثافة في الشكل 1 ب. يجب الحصول على نطاقين متميزين. في حالة حدوث خلط التدرجات ، أو كان عدد العدلات الكلية ذات الطبقات لكل أنبوب مرتفعا (أكبر من 5-6 تقريبا × 106) ، ستبدو النطاقات منتشرة (الشكل 1 ج) ، ويزداد خطر اختلاط النوعين الفرعيين من العدلات بشكل كبير. لتجنب هذا الأخير ، نوصي بوضع طبقات تصل إلى 5-6 × 106 عدلات إجمالية لكل أنبوب متدرج كثافة. على الرغم من التقارير التي تفيد بأن LDNs بأعداد منخفضة جدا في الأفراد الأصحاء ، مما يجعلها بعيدة المنال للدراسات النهائية ، إلا أن هذه الطريقة تظهر إنتاجية جيدة لكل من LDNs (متوسط 3.28 × 106 خلايا / مل) و NDNs (متوسط 10.64 × 106 خلايا / مل) ونقاء من المشاركين الأصحاء (الشكل 2).
كان متوسط نقاء العزل ل LDNs 93.80٪ (± 5.80) ، وبالنسبة لشبكات NDN ، كان 96.30٪ (± 3.30 ؛ الشكل 2 أ) بعد إجراء العزل ، مع الحد الأدنى من التلوث لأنواع الخلايا الأخرى (الشكل 2 ب). أكد تلطيخ DAPI للنوى وجود LDN / NDN من خلال مورفولوجيا النوى وأظهر نوى مميزة متعددة الفصوص في NDNs بعد العزل (الشكل 2 ج). أظهرت الأعداد المطلقة بعد العزل اتجاها شائعا لوجود المزيد من NDNs أكثر من LDNs ، بمتوسط غلة 10.64 × 106 خلايا / مل و 3.28 × 106 خلايا / مل ، على التوالي (الشكل 2 د). باستخدام قياس التدفق الخلوي ، تم تعريف كل من LDNs و NDNs على أنها CD14lo CD86- CD15 + SSChi-cells 13 (الشكل 2E). CD14 هي علامة نخاعية شائعة ، و CD15 هي علامة تحديد العدلات ، و CD10 و CD16 هي علامات العدلات الموصوفة بشكل شائع للنضج والتنشيط13. تم استخدام عناصر التحكم في التألق ناقص واحد (FMOs) للتمييز بين المجموعات السكانية الإيجابية CD16 و CD10 عن السكان السلبيين. لوحظ وجود مجموعة فردية إلى حد كبير من LDNs الناضجة بالإضافة إلى NDNs (CD16hiCD10 +) في الأفراد الأصحاء ، وهو ما يتوافق مع التقارير الواردة في الأدبيات13 ، حيث من غير المحتمل أن يكون لدى الأفراد الأصحاء نسبة عالية من العدلات غير الناضجة (CD16lo / intCD10 +) في الدورة التداولية (الشكل 2F ، G). في المتوسط ، كان تواتر CD16hiCD10 + LDNs 93.33٪ (± 5.29) ، وكان CD16hiCD10 + NDNs 98.03٪ (± 1.40) ، و CD16lo / intCD10 + كان 0.49٪ (± 0.38) ، و CD16lo / intCD10 + كان 0.17٪ (± 0.06 ؛ الشكل 2F ، G). عندما تم تركيب مجموعات CD16 + CD10 + على بعضها البعض ، أشارت درجة التداخل إلى عدم وجود اختلافات ملحوظة في التعبير عن هذه العلامات في LDNs مقارنة بشبكات NDN (الشكل 2H). تم الحصول على الخلايا باستخدام مقياس التدفق الخلوي وتم إجراء جميع تحليلات البيانات باستخدام البرنامج المناسب لقياس التدفق الخلوي.
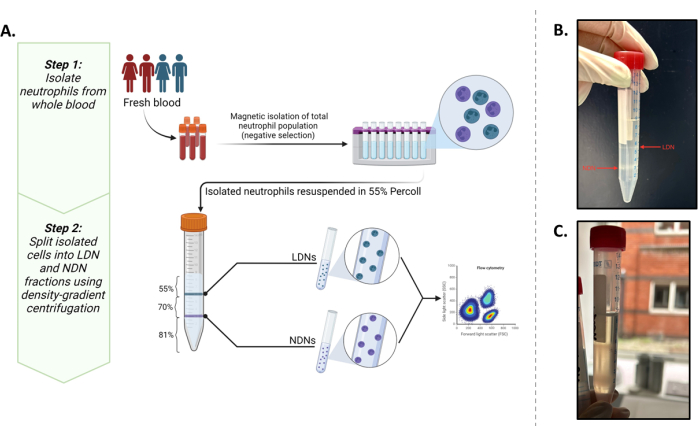
الشكل 1: نظرة عامة على البروتوكول. (أ) بروتوكول عزل من خطوتين ل LDNs و NDNs من الدم الكامل. تتكون الخطوة الأولى من العدلات الكلية المعزولة من الدم الكامل باستخدام الانتقاء السلبي. تتضمن الخطوة الثانية إعادة تعليق إجمالي العدلات في محلول عمل متساوي التوتر بنسبة 55٪ ووضعها فوق تدرج 81٪ و 70٪. بعد أجهزة الطرد المركزي ، ستكون LDNs عند سطح سطح السطح البيني للطبقات 55٪ و 70٪ و NDNs عند سطح سطح الطبقات 81٪ و 70٪. (ب) التمثيل البصري ل LDNs و NDNs المنفصلة بشكل مثالي بعد الطرد المركزي المتوسط المتدرج. (ج) الفصل دون المستوى الأمثل بين LDNs و NDNs كما يتضح من الطبيعة المنتشرة للنطاقات. هناك احتمال كبير في هذه الحالة أن تلوث NDNs جزء LDN أو العكس. تم إنشاء الرسم في BioRender. ينيمادي ، أ. (2025) https://BioRender.com/t03m122. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
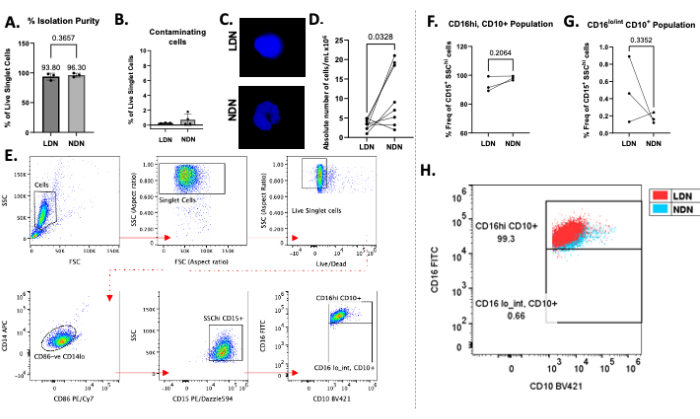
الشكل 2: النتائج التمثيلية للبروتوكول. (أ) النسبة المئوية للعزل النقاء من LDNs و NDNs من الدم الكامل. (ب) النسبة المئوية للخلايا الملوثة (الخلايا البائية والخلايا التائية والخلايا الوحيدة) بعد العزلة. (ج) تلطيخ DAPI ل LDNs و NDNs بعد العزل الذي يظهر نوى متعددة الفصوص في NDNs والنوى أحادية الفصوص في LDNs. (د) العدد المطلق من LDNs و NDNs المتطابقة المعزولة من الدم الكامل. (ه) استراتيجية البوابات المستخدمة لتحديد LDNs و NDNs ، وتحديد نقائها ، وحساب تواترها. تم التخلص من الحطام والزوجات والخلايا الميتة من التحليل (الصف العلوي) ، وتمربط خلايا CD86- CD14lo و CD15 + SSC hi لتحديد العدلات. (إف ، ز) تم استخدام تعبير CD16 و CD10 لتحديد المجموعات السكانية الفرعية بالتزامن مع استخدام عناصر التحكم المضان ناقص واحد. تواتر المجموعات السكانية الفرعية للLDN و NDNالمعزولة الناضجة (CD16 hi CD10 +) وغير الناضجة (CD16lo / intCD10 +) ، تم الإبلاغ عنها كنسبة مئوية من إجمالي LDNs و NDNs (المعرفة على أنها خلايا CD15 + SSChi). (ح) مخطط نقطي يوضح CD16 + CD10 + LDNs متراكبة فوق CD16 + CD10 + NDNs في الأفراد الأصحاء. يعني ± SD ، اختبار t المقترن ، ن = 3-8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا ، نقدم طريقة محسنة لتقسيم إجمالي عدد العدلات إلى عدلات منخفضة الكثافة وذات كثافة طبيعية ، جنبا إلى جنب مع التوصيف الظاهري لكل نوع من أنواع الخلايا باستخدام قياس التدفق الخلوي المقتبس من الطرق السابقة5.
يعتمد هذا البروتوكول على عزل LDNs و NDNs عن الدم الكامل. الخطوة الحاسمة هي عزل العدلات الكلية من خلال طرق الاختيار السلبية. تتضمن طرق الانتقاء الإيجابية استخدام الأجسام المضادة التي ترتبط بعلامات السطح ، مما قد يؤدي إلى تنشيط العدلات وتحفيز التحلل5. يمكن أن يتداخل هذا التنشيط مع التجارب النهائية عن طريق تغيير الحالة الوظيفية والتمثيل الغذائي للعدلات ، مما يؤدي إلى نتائج غير دقيقة وتحريف تفسير النتائج التجريبية. لذلك ، يضمن الانتقاء السلبي عزل العدلات دون إحداث تنشيط أو تغييرات وظيفية. بالإضافة إلى ذلك ، فإن استخدام العزل المغناطيسي القائم على الفصل السلبي يلغي الحاجة إلى تحلل خلايا الدم الحمراء (RBC). هذا لا يقلل فقط من خطوات الغسيل الإضافية وموت الخلايا ، وبالتالي الحفاظ على المحصول ، ولكنه يزيد أيضا من نقاء العدلات المعزولة عن طريق تقليل تلوث كرات الدم الحمراء. بالمقارنة مع البروتوكول الأصلي ، تم استخدام مخزن مؤقت لفصل الخلايا طوال العملية برمتها ، بما في ذلك الغسيل وإعادة التعليق ، بدلا من PBS. يحتوي هذا على إضافات تقلل من تكتل الخلايا وتقلل من الارتباط غير المحدد أثناء العزل المغناطيسي. باستخدام المخزن المؤقت لفصل الخلايا باستمرار ، حققنا كفاءة محسنة لفصل الخلايا ، ونقاء أعلى ، وإنتاجية أكبر من العدلات القابلة للحياة والتي لم تمسها مقارنة باستخدام PBS. نتج عن ذلك تحسين الدقة في التحليلات النهائية للمصب بالإضافة إلى ذلك ، تم إجراء تدرج الكثافة على أنابيب متعددة بدلا من أنبوب واحد لتحسين الدقة بين نوعي الخلايا.
من غير المستغرب أن يعتمد الفصل الناجح للنوعين الفرعيين من العدلات بشكل كبير على الصياغة الدقيقة والطبقات الدقيقة لكل تدرج15. على نفس القدر من الأهمية هو طبقات من 70٪ على 81٪, [أس ول س] تعليق العدلات (في 55٪) على ال 70٪ طبقة. نوصي بشدة بممارسة هذه الطريقة. من الأفضل استخدام ماصة نقل عند وضع طبقات ووضع أنبوب سعة 15 مل بالتوازي تقريبا مع الجزء السفلي من خزانة السلامة الحيوية. سيؤدي خلط التدرجات ، ولو بشكل طفيف ، إلى ظهور نطاقات غير واضحة ومنتشرة ، مما قد يؤدي إلى مجموعات سكانية غير واضحة. يجب توخي الحذر لإزالة أشرطة العدلات فقط ببطء باستخدام ماصة باستور ، حيث لا ينبغي شفط الطبقات أعلاه والسفلية ، إن أمكن ، بسبب سميتها. من المهم تقليل تلوث جزء العدلات بمحلول العمل متساوي التوتر لتجنب أي آثار ضارة على الخلايا15. أخيرا ، يمكن أن تؤدي أعداد الخلايا الأعلى إلى كثافة أعلى بشكل عام لنطاقات LDN و NDN ، مما يؤدي إلى دقة أقل لمجموعات الخلايا. لذلك ، نوصي بإجراء عدد إجمالي للعدلات قبل إعادة التعليق في محلول 55٪. هذا مهم بشكل خاص في حالة استخدام >12 مل من الدم الكامل لعزل العدلات أو إذا تجاوز إجمالي عدد العدلات 5-6 × 106.
تتكون بدائل هذه الطريقة من تركيبة ديكستران / بيركول ، والتي لا تعتمد على الفصل المغناطيسي وهي في الأساس بروتوكول من خطوةواحدة 16. قد لا يكون استخدام ترسيب ديكستران لإزالة كريات الدم الحمراء فعالا أو متسقا مثل الطرق الأخرى مثل التحلل المباشر لكرات الدم الحمراء أو تدرجات الكثافة. يمكن أن يترك ترسيب ديكستران كرات الدم الحمراء المتبقية في المادة الطافية ، مما قد يؤثر على نقاء مجموعة العدلات. بدون خطوة اختيار سلبية ، هناك خطر من أن يتم تنشيط العدلات بواسطة الأجسام المضادة المتبقية أو المحفزات الأخرى ، مما قد يؤثر على سلوكها في فحوصات المصب. يمكن أن تؤدي الإزالة اليدوية لطبقات PBMC والعدلات من وسط تدرج الكثافة إلى تلوث بين مجموعات الخلايا ، خاصة إذا لم يكن الفصل نظيفا.
تقدم هذه الدراسة لوحة قياس التدفق الخلوي المبسطة نسبيا لتحديد نقاء LDNs و NDNs المعزولة وإجراء الحد الأدنى من التوصيف لهذه الخلايا. تم الإبلاغ عن العلامات المستخدمة هنا على نطاق واسع في الأدبيات كجزء من لوحات قياس التدفق الخلوي المتعددة والأكثر تعقيدا التي تتضمن أبحاث العدلات. اخترنا تكثيف اللوحة لتحديد نقاء العزل ، والنسبة المئوية لتكرار الخلايا الحية والميتة ، وفحص حالة نضج العدلات (بناء على تعبير CD10 و CD16). ومع ذلك ، يمكن توسيعه ليناسب احتياجات دراسات المستخدمين النهائيين المختلفة. تم تصميم هذا البروتوكول خصيصا لفصل LDNs و NDNs للتقييم الفردي ، حيث أثبت التمييز بين هذه المجموعات الفرعية معا في لوحة قياس التدفق الخلوي أنه يمثل تحديا بسبب عدم وضوحها النسبي (الشكل 2H). تمشيا مع التقارير السابقة5 ، وجد أنه لا يمكن تمييز LDNs و NDNs من الأفراد الأصحاء بشكل موثوق عند تحليلها في وقت واحد. لذلك ، فإن عزلها مسبقا يسمح بتوصيف أكثر دقة وتفصيلا لكل مجموعة سكانية فرعية.
نقترح أنه خلال مرحلة التحسين لهذا البروتوكول ، قد يختار المستخدمون النهائيون تضمين علامات الخلايا الليمفاوية الأساسية مثل CD3 و CD19 في لوحة قياس التدفق الخلوي الخاصة بهم. يمكن أن يساعد هذا في استكشاف الأخطاء وإصلاحها ، حيث يمكن أن يؤدي العزل المغناطيسي دون المستوى الأمثل إلى إدراج الخلايا الليمفاوية في عزل العدلات الكلي ، والذي يمكن أن ينتقل إلى جزء LDN بسبب الكثافة الخلوية المماثلة. لأغراض التحسين ، قد يختار المستخدمون إضافة CD45 لاستكشاف أخطاء الملوثات وإصلاحها بشكل أفضل في أجزائها المعزولة ، أي أن CD45-ve يمكن أن تكون كرات الدم الحمراء ، ويمكن أن يشير CD45 + ve إلى تلوث PBMC. تم تحديد المجموعات السكانية الفرعية للعدلات بناء على تعبير علامة السطح ، وهي خاصية ديناميكية ويمكن أن تقدم مستوى عال من التباين بين المتبرعين. وبالتالي ، تمشيا مع ممارسات قياس التدفق الخلوي الجيدة ، يقترح أيضا استخدام ضوابط FMO ، حيث يمكن أن يساعد ذلك في تقليل التباين بين المانحين وتحديد مجموعات سكانية فرعية أكثر وضوحا.
نقر أيضا بأن هذا البروتوكول قد تم تحسينه فقط للدم الكامل الطازج ، وفقا للإرشادات الواردة في مجموعة العزل المغناطيسي ، والتي تنص على أنه يجب استخدام الدم الكامل غير المعالج فقط مع هذه المجموعة وأن استعادة الخلايا المعزولة المرغوبة ينخفض مع العينات التي يبلغ عمرها >24 ساعة. هذا يلغي خيارات المواد الأولية التي يمكن عزل العدلات منها ، مثل سائل غسل القصبات الهوائية (BALF) ، والسائل الجنبي ، والاستسقاء ، وما إلى ذلك. أظهر كونيلي وآخرون أن التأخير في معالجة العدلات17 ، حتى من الدم الكامل المسحب حديثا ، يمكن أن يغير نمطها الظاهري والتعبير السطحي. تمشيا مع ذلك ، نوصي ببدء المعالجة بأقل قدر ممكن من التأخير من وقت سحب الدم. لذلك ، في حين أن هذا البروتوكول مثالي للدم الكامل الطازج ، مقارنة بالبروتوكولات أحادية الخطوة مثل ديكستران / بيركول ، إلا أنه يمكن أن يكون طريقة طويلة نسبيا وتستغرق وقتا طويلا ولا توفر نقطة توقف وسيطة. يمثل هذا قيدا في حالات الدراسات السريرية حيث يمكن تلقي العينات في ساعات لاحقة من اليوم. بالإضافة إلى ذلك ، لا تسمح هذه الطريقة بفرز المجموعات الفرعية LDN و NDN ، حيث أن طرق فرز المجموعات الفرعية (عن طريق قياس التدفق الخلوي أو غير ذلك) تتعرض لخطر تنشيط العدلات عن غير قصد.
حظيت المجموعات السكانية الفرعية للعدلات باهتمام كبير في حالات مثل الذئبة الحمامية الجهازية (SLE) 18،19 ، والسرطان20 ، و COVID-1921. يؤكد الاهتمام المتزايد بهذه الأنواع من الخلايا ، لا سيما في سياق الأمراض الالتهابية وأمراض المناعة الذاتية ، الحاجة إلى طرق موثوقة لتقييم كل مجموعة بدقة وفهم مساهماتهم الفردية في التسبب في التسبب بشكل أفضل.
Disclosures
لم يكشف المؤلفان عن أي إفصاح.
Acknowledgements
تم تمويل هذا العمل من قبل مجلس البحوث الصحية EIA-2024-002 وصندوق مستشفى مدينة دبلن الملكية. نود أن نشكر الدكتورة لورين ثونغ والدكتور كيفن براون على مساعدتهم في جمع عينات من متبرعين أصحاء لهذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
References
- Tracchi, I., et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I., et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E., et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963(2021).
- Hacbarth, E., Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R., et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922(2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A., et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696(2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M., et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B., Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520(2021).
- Park, J., et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282(2023).
- Denny, M. F., et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A., et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603(2019).
- Mosca, T., Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y., et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N., et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667(2022).
- Carmona-Rivera, C., Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y., et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154(2023).
- Dwivedi, A., et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved