Method Article
L'isolamento e la caratterizzazione di neutrofili a bassa e normale densità da sangue intero
In questo articolo
Riepilogo
In questo caso, forniamo un approccio affidabile per isolare neutrofili a bassa e normale densità dal sangue intero utilizzando l'isolamento magnetico (selezione negativa) e il mezzo a gradiente di densità discontinuo. Garantisce l'isolamento intatto di cellule ad alta purezza (≥93%), facilitando un'analisi accurata a valle delle sottopopolazioni di neutrofili, fondamentale per comprendere il loro ruolo nella salute e nella malattia.
Abstract
Ricerche emergenti mostrano che la popolazione di neutrofili circolanti nell'uomo è costituita da diversi sottotipi e non dovrebbe essere studiata come un'unica popolazione, come è stato fatto storicamente. In particolare, è stato dimostrato che i neutrofili a bassa e normale densità (LDN, NDN) hanno profili funzionalmente e metabolicamente distinti, un fattore che deve essere considerato quando si pubblica una ricerca sui neutrofili. Qui, presentiamo un metodo modificato per l'isolamento e la separazione intatti di LDN e NDN dal sangue intero.
Il mezzo del gradiente di densità (1,135 g/mL) viene combinato a 9:10 con 10x PBS. Successivamente vengono realizzati gradienti di densità specifici del 55%, 70% e 81% combinando il mezzo di gradiente di densità al 100% con soluzione salina tamponata con fosfato 1x (PBS). I neutrofili isolati da 12 mL di sangue intero periferico ottenuto da donatori consenzienti utilizzando un kit di isolamento magnetico basato sulla selezione negativa vengono risospesi nella frazione al 55%. Un volume di 3 mL delle frazioni dell'81% e del 70% viene stratificato in una provetta da 15 mL, seguito dalla frazione al 55% contenente neutrofili totali. I gradienti di densità vengono quindi centrifugati a 720 x g per 30 minuti. Si ottengono due bande distinte all'interfaccia 55%/70% (LDN) e all'interfaccia 70%/81% (NDN). Le cellule vengono accuratamente pipettate in provette separate e lavate con PBS. La purezza delle frazioni isolate viene determinata mediante citometria a flusso. Sia LDN che NDN sono stati definiti CD14lo, CD15+, SSChi mediante citometria a flusso. La purezza dell'isolamento è stata calcolata al ≥93% delle cellule vitali per entrambi i tipi.
Questo metodo fornisce un approccio affidabile ed efficiente per separare LDN e NDN dal sangue periferico, garantendo un'elevata purezza e vitalità delle cellule isolate. Il miglioramento della precisione dell'isolamento dei neutrofili facilita analisi più accurate a valle di queste distinte sottopopolazioni di neutrofili. Questi sono fondamentali per far progredire la nostra comprensione dell'eterogeneità dei neutrofili e delle sue implicazioni in vari contesti fisiologici e patologici.
Introduzione
I neutrofili sono cellule immunitarie granulari e i leucociti più abbondanti nel sangue periferico, costituendo in media circa il 50%-70% dei leucociti. Si sviluppano nel midollo osseo da precursori di granulociti-monociti (GMP), che a loro volta si sviluppano da cellule progenitrici ematopoietiche (HPC) in presenza di fattore stimolante le colonie di granulociti (G-CSF). All'omeostasi, hanno una durata di vita di ~ 24 ore, ma gli studi hanno dimostrato che la loro durata di vita può essere prolungata in condizioni fisiologiche specifiche e nei microambienti associati come l'attivazione immunitaria cronica1, l'infiammazione1 e persino la residenza dei tessuti nello stato stazionario2. I neutrofili sono stati a lungo considerati la prima linea di difesa contro i patogeni e suscitano i loro effetti antimicrobici attraverso 3 principali funzioni effettrici: degranulazione, fagocitosi e attivazione e rilascio della trappola extracellulare dei neutrofili (NET) (NETosi).
La maggior parte degli studi sulla funzione e la biologia dei neutrofili esamina i risultati per la popolazione totale di neutrofili. Tuttavia, dagli studi in contesti oncologici che delineano i sottotipi N1 (antitumorale)/ N2 (pro-tumorale) alla classificazione dei neutrofili in base alla maturità, alla malattia e allo stato fisiologico, e persino alla densità cellulare (neutrofili a bassa densità e densità normale), è diventato sempre più evidente che la popolazione umana di neutrofili costituisce sottotipi fenotipicamente diversi. Indipendentemente dal fatto che l'esistenza di questi sottotipi di neutrofili possa essere attribuita all'essere tipi cellulari completamente distinti o alla natura complessa della plasticità, esiste un crescente corpo di letteratura sui neutrofili atipici e presenta un'opportunità convincente per studiare i neutrofili a bassa densità separati dai neutrofili a densità normale3.
Descritti per la prima volta nei pazienti con LES come un sottogruppodi neutrofili pro-infiammatori 4, gli LDN sono stati da allora identificati nelle malattie croniche, in gravidanza e persino nella circolazione sana, nelle capacità pro-infiammatorie e soppressive 5,6,7,8. Le LDN si trovano in concomitanza con le cellule mononucleate del sangue periferico (PBMC) quando il sangue intero viene centrifugato su terreni a gradiente di densità. La loro densità specifica corrisponde a circa 1,077 g/mL, rispetto agli NDN a 1,083 g/mL9. Sebbene vi sia ancora un notevole dibattito sull'argomento, esiste l'ipotesi che le LDN assomiglino a un fenotipo granulocitario più immaturo (simile ai promielociti e ai mielociti, con una densità inferiore a 1,080 g/mL)9,10. Altri ancora ipotizzano che esistano fenotipi LDN sia maturi che immaturi a seconda della presenza o assenza di malattia 11,12,13. Tuttavia, le LDN sono state rilevate anche in individui sani; Tuttavia, la loro inclusione in alcuni studi è limitata a causa della difficoltà di isolarli in numero sufficiente5.
Questo studio mirava a isolare queste due popolazioni in quantità che ci permettessero di eseguire esperimenti metabolici in situ a valle (minimo 0,5 × 106 cellule/mL). In tal modo, un protocollo esistente5 è stato ottimizzato con i marcatori fenotipici comunemente riportati13,14 che forniscono il miglior risultato per isolare e caratterizzare LDN e NDN dal sangue intero (Figura 1A).
Protocollo
I campioni di sangue sono stati raccolti con il consenso informato dei partecipanti sani. Lo studio ha ricevuto l'approvazione dal Comitato Etico di Ricerca sia del St. James's Hospital che del Tallaght University Hospital.
1. Preparazione del mezzo a gradiente di densità, delle frazioni delle soluzioni di lavoro isotoniche e del tampone di separazione cellulare
- Preparazione di soluzioni di lavoro isotoniche da mezzo a gradiente di densità
- Preparazione della soluzione di lavoro Isotonic 100% (~1,123 g/mL)
- Per preparare la soluzione di lavoro isotonica al 100%, combinare 27 mL di terreno a gradiente di densità con 3 mL di PBS 10x. Ciò si traduce in una soluzione isotonica adatta per ulteriori diluizioni.
- Preparazione della soluzione di lavoro isotonica all'81% (~1,0996 g/mL)
- Preparare la soluzione di lavoro isotonica all'81% mescolando 8,1 mL della soluzione di lavoro isotonica al 100% (preparata al punto 1.1.1) con 1,9 mL di 1x PBS. Mescolare accuratamente per garantire l'omogeneità.
- Preparazione della soluzione di lavoro isotonica al 70% (~1,0861 g/mL)
- Per preparare la soluzione di lavoro isotonica al 70%, combinare 7 mL della soluzione di lavoro isotonica al 100% con 3 mL di 1x PBS. Assicurarsi che la soluzione sia ben miscelata.
- Preparazione della soluzione di lavoro isotonica al 55% (1,0676 g/mL)
- Preparare la soluzione di lavoro isotonica al 55% mescolando 5,5 mL della soluzione di lavoro isotonica al 100% con 4,5 mL di 1x PBS. Mescolare accuratamente.
- Preparazione della soluzione di lavoro Isotonic 100% (~1,123 g/mL)
- Stratificazione delle frazioni di gradiente
- Stratificazione delle frazioni di gradiente
- Utilizzando una provetta conica da 15 mL, sovrapporre accuratamente 3 mL della soluzione di lavoro isotonica all'81% sul fondo. Quindi, sovrapporre lentamente e delicatamente 3 mL della soluzione di lavoro isotonica al 70%, evitando di mescolare gli strati. Questo gradiente verrà utilizzato per la separazione cellulare.
- Stratificazione delle frazioni di gradiente
- Preparazione del tampone di separazione cellulare
- Preparazione di 500 mL di tampone di separazione cellulare
- Per preparare il tampone di separazione cellulare, combinare il 2% di siero fetale bovino (FBS) e 1 mM di acido etilendiamminotetraacetico (EDTA) con 1x PBS per un volume totale di 500 mL. Utilizzare questo tampone per lavare e risospendere le cellule durante il processo di isolamento.
NOTA: Assicurarsi che gli strati siano ben separati e indisturbati. In questo protocollo, le soluzioni di lavoro isotoniche sono indicate come "100%", "81%", "70%" e "55%" in base al metodo di preparazione, coerente con gli studi precedenti5. Tuttavia, è importante chiarire che queste etichette non rappresentano le effettive concentrazioni finali delle soluzioni di lavoro. Ad esempio, il terreno di gradiente di densità "100%" viene preparato mescolando 27 mL di terreno di gradiente di densità puro con 3 mL di 10x PBS, ottenendo una concentrazione finale del 90% di soluzione di lavoro isotonica. Le diluizioni successive (ad esempio, "81%", "70%" e "55%") riflettono in modo simile i rapporti di preparazione piuttosto che le vere concentrazioni percentuali. Questa nomenclatura è stata mantenuta per mantenere la coerenza con la terminologia utilizzata nella letteratura precedente sull'argomento.
- Per preparare il tampone di separazione cellulare, combinare il 2% di siero fetale bovino (FBS) e 1 mM di acido etilendiamminotetraacetico (EDTA) con 1x PBS per un volume totale di 500 mL. Utilizzare questo tampone per lavare e risospendere le cellule durante il processo di isolamento.
- Preparazione di 500 mL di tampone di separazione cellulare
2. Isolamento di neutrofili da sangue intero mediante selezione negativa
- Preparazione di perle magnetiche
- Agitare accuratamente le perline magnetiche per 30 s per assicurarsi che siano completamente risospese prima dell'uso.
- Preparazione del sangue
- Per ogni donatore, aliquotare 4 mL di sangue intero in tre provette separate da 14 mL a fondo tondo.
- Aggiunta di cocktail di isolamento dei neutrofili e microsfere magnetiche
- Aggiungere 50 μL di cocktail di isolamento dei neutrofili e 50 μL di microsfere magnetiche per mL di sangue a ciascuna provetta. Per 4 mL di sangue, aggiungere 200 μL di ciascun reagente.
- Risospendere bene la miscela pipettandola delicatamente e incubare a temperatura ambiente (RT) per 5 minuti per consentire ai reagenti di legarsi alle cellule indesiderate.
- Lavaggio e separazione magnetica - primo giro
- Rabboccare ciascuna provetta a 12 mL utilizzando il tampone di separazione cellulare e mescolare accuratamente.
- Posizionare le provette senza coperchio su un magnete e lasciarle incubare a RT per 10 minuti per consentire alle perle magnetiche legate alle cellule indesiderate di essere attirate sulla parete della provetta.
- Raccolta di cellule non legate
- Trasferire con cautela la sospensione cellulare trasparente contenente neutrofili da ciascuna provetta in una nuova provetta pulita utilizzando una pipetta di trasferimento. Rimuovere il tubo originale dal magnete.
- Riapplicazione e incubazione di biglie magnetiche - secondo ciclo
- Agitare nuovamente le perline magnetiche per 30 s. Aggiungere lo stesso volume di perline magnetiche alla sospensione cellulare appena trasferita come al punto 2.3. Risospendere accuratamente e incubare a RT per altri 5 minuti.
- Separazione e raccolta magnetica finale
- Riposizionare le provette sul magnete senza coperchi e incubare a RT per altri 10 minuti.
- Trasferire con cautela la sospensione a celle trasparenti in un nuovo tubo. Questa sospensione finale rappresenta la popolazione totale isolata di neutrofili.
3. Separazione dei neutrofili a bassa densità (LDN) e dei neutrofili a densità normale (NDN) dalla popolazione totale di neutrofili
- Raggruppamento e preparazione di sospensioni cellulari
- Per ogni donatore, raggruppare le sospensioni di neutrofili isolate in provette da 50 mL. Rabboccare ogni provetta fino a un volume totale di 50 mL utilizzando il tampone di separazione cellulare.
- Centrifugazione
- Centrifugare le provette a 400 x g per 5 minuti a RT con il freno inserito.
- Risospensione e conteggio cellulare
- Scartare il surnatante e risospendere il pellet di neutrofili in 1 mL di tampone di separazione cellulare. Eseguire una conta cellulare per determinare il numero totale di neutrofili.
- Gradiente di densità: preparazione del mezzo
- Centrifugare nuovamente le provette a 400 x g per 5 minuti a RT con il freno inserito. Scartare il surnatante e risospendere il pellet di neutrofili in 3 mL del terreno con gradiente di densità del 55%. Per una risoluzione ottimale, utilizzare 3 mL di terreno con gradiente di densità al 55% per 5-6 × 106 neutrofili totali.
- Se necessario, dividere le cellule risospese in più provette a gradiente di densità prefabbricate, assicurandosi che 3 mL della sospensione cellulare siano stratificati in ciascuna provetta.
- Stratificazione su tubi a gradiente di densità
- Sovrapporre lentamente la sospensione cellulare da 3 mL contenente il terreno con gradiente di densità del 55% sulle provette con gradiente di densità preconfezionate (preparate come descritto nella sezione 1). Assicurati di un'attenta stratificazione per evitare di disturbare la sfumatura.
- Centrifugazione in gradiente di densità
- Centrifugare le provette a 720 x g per 30 minuti senza utilizzare il freno. Dopo la centrifugazione, maneggiare le provette con cura per evitare di disturbare gli strati.
- Isolamento di frazioni di neutrofili
- Dopo la centrifugazione, osservare i neutrofili separarsi in due strati distinti:
I neutrofili a bassa densità (LDN) saranno localizzati all'interfaccia 55%/70%, formando una banda superiore a circa 3 mL, e i neutrofili a densità normale (NDN) saranno all'interfaccia 70%/81%, apparendo come una banda inferiore intorno al segno di 6 mL. - Utilizzando una pipetta di trasferimento, isolare accuratamente ogni strato e trasferirli in provette separate da 15 mL.
- Dopo la centrifugazione, osservare i neutrofili separarsi in due strati distinti:
- Lavaggio di frazioni isolate
- Per lavare via qualsiasi mezzo di gradiente di densità residuo, aggiungere 1x PBS a ciascuna provetta da 15 mL fino al segno di 15 mL.
- Centrifugare a 400 × g per 5 min a RT con il freno inserito. Se le celle non formano un pellet solido e rimangono invece sospese, ripetere questa fase di lavaggio, indicando la presenza del mezzo di gradiente di densità rimanente.
- Conteggio delle cellule e applicazioni a valle
- Conta le cellule in ogni frazione e procedi con le applicazioni a valle come esperimenti metabolici, colorazione con citometria a flusso, estrazione dell'RNA o lisi delle proteine, se necessario.
NOTA: Dopo aver placcato le celle, si consiglia di far girare la piastra a 210 × g per 1 minuto (freno spento).
- Conta le cellule in ogni frazione e procedi con le applicazioni a valle come esperimenti metabolici, colorazione con citometria a flusso, estrazione dell'RNA o lisi delle proteine, se necessario.
4. Fenotipizzazione di LDN e NDN isolati
- Isolare ~0,5-1 × 106 LDN e NDN. Preparare un mastermix di anticorpi concentrato 2x utilizzando CD14, CD86, CD15, CD16, CD10, blocco Fc e colorazione di vitalità.
- Colorare le popolazioni isolate di LDN e NDN con un volume equivalente del mastermix di anticorpi in modo che la diluizione finale degli anticorpi che colorano le cellule sia rispettivamente 1:100 (CD14, CD86, CD15, CD16, CD10, blocco Fc) e 1:50 (colorazione di vitalità).
- Incubare le cellule per 10 minuti al buio a RT.
NOTA: Assicurarsi che le cellule siano accuratamente miscelate con la mastermix di anticorpi e il blocco Fc. - Lavare le celle una volta con PBS, quindi centrifugare a 400 × g per 5 minuti. Scartare il surnatante.
- Fissare le cellule in paraformaldeide all'1% (PFA) per 15 minuti a RT al buio.
- Lavare nuovamente le cellule con PBS, centrifugare a 400 × g per 5 minuti ed eliminare il surnatante.
- Risospendere le cellule in 200 μL di PBS o secondo necessità e acquisire le cellule su un citometro a flusso il prima possibile.
NOTA: Le cellule colorate e fissate possono essere conservate a breve termine a 4 °C al buio per evitare il fotosbiancamento dei fluorofori. Tuttavia, idealmente, la procedura di fenotipizzazione dovrebbe essere eseguita prontamente dopo la colorazione e la fissazione per garantire una vitalità cellulare ottimale e risultati accurati.
Risultati
La stratificazione di successo dei neutrofili totali sul mezzo del gradiente di densità può essere osservata nella Figura 1B. Si dovrebbero ottenere due bande distinte. Se si verifica un mescolamento dei gradienti, o il numero totale di neutrofili stratificati per provetta è elevato (maggiore di circa 5-6 × 106), le bande appariranno diffuse (Figura 1C) e il rischio che i due sottotipi di neutrofili si mescolino aumenti significativamente. Per evitare quest'ultimo, si consiglia di stratificare fino a 5-6 × 106 neutrofili totali per provetta a gradiente di densità. Nonostante le segnalazioni di LDN siano a numeri molto bassi in individui sani, il che li rende quindi irraggiungibili per gli studi a valle, questo metodo mostra una buona resa sia di LDN (media 3,28 × 106 cellule/mL) che di NDN (media 10,64 × 106 cellule/mL) e purezza da partecipanti sani (Figura 2).
La purezza media dell'isolamento per gli LDN era del 93,80% (± 5,80) e per gli NDN era del 96,30% (± 3,30; Figura 2A) dopo la procedura di isolamento, con una contaminazione minima di altri tipi di cellule (Figura 2B). La colorazione DAPI dei nuclei ha confermato la presenza di LDN/NDN attraverso la morfologia dei nuclei e ha mostrato nuclei multilobati distintivi nelle NDN dopo l'isolamento (Figura 2C). I conteggi assoluti dopo l'isolamento hanno mostrato una tendenza comune alla presenza di più NDN rispetto agli LDN, con rese medie rispettivamente di 10,64 × 106 cellule/mL e 3,28 × 106 cellule/mL (Figura 2D). Utilizzando la citometria a flusso, sia le LDN che le NDN sono state definite come cellule CD14e CD86- CD15+ SSChi 13 (Figura 2E). CD14 è un marcatore mieloide comune, CD15 è un marcatore di identificazione dei neutrofili e CD10 e CD16 sono marcatori neutrofili comunemente descritti di maturità e attivazione13. I controlli a fluorescenza meno uno (FMO) sono stati utilizzati per distinguere le popolazioni CD16 e CD10 positive dalle popolazioni negative. In individui sani è stata osservata una popolazione in gran parte singolare di LDN maturi e NDN (CD16hiCD10+), il che è coerente con i rapporti in letteratura13, poiché è improbabile che gli individui sani abbiano un'alta percentuale di neutrofili immaturi (CD16lo/intCD10+) in circolazione (Figura 2F, G). In media, la frequenza di CD16hiCD10+ LDNs è stata del 93,33% (± 5,29), CD16hiCD10+ NDNs è stata del 98,03% (± 1,40), CD16lo/intCD10+ è stata dello 0,49% (± 0,38) e CD16lo/intCD10+ è stata dello 0,17% (± 0,06; Figura 2F,G). Quando le popolazioni CD16+CD10+ sono state sovrapposte l'una all'altra, il grado di sovrapposizione non ha indicato differenze evidenti nell'espressione di questi marcatori nelle LDN rispetto alle NDN (Figura 2H). Le cellule sono state acquisite utilizzando un citometro a flusso e tutte le analisi dei dati sono state eseguite utilizzando il software appropriato per la citometria a flusso.
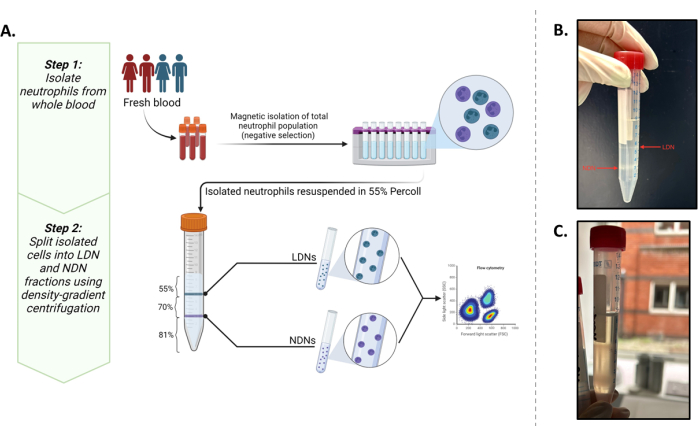
Figura 1: Panoramica del protocollo. (A) Un protocollo di isolamento in due fasi di LDN e NDN da sangue intero. La prima fase consiste in neutrofili totali isolati da sangue intero mediante selezione negativa. La seconda fase prevede la risospensione dei neutrofili totali in una soluzione di lavoro isotonica al 55% e la loro stratificazione su un gradiente dell'81% e del 70%. Dopo le centrifugazioni, le LDN si troveranno all'interfaccia degli strati del 55% e del 70% e le NDN all'interfaccia degli strati dell'81% e del 70%. (B) Rappresentazione visiva di LDN e NDN idealmente separati dopo la centrifugazione in mezzo gradiente. (C) Separazione subottimale di LDN e NDN, come si vede dalla natura diffusa delle bande. In questo caso c'è un'alta probabilità che gli NDN contaminino la frazione LDN o viceversa. Grafica creata in BioRender. Yennemadi, A. (2025) https://BioRender.com/t03m122. Clicca qui per visualizzare una versione più grande di questa figura.
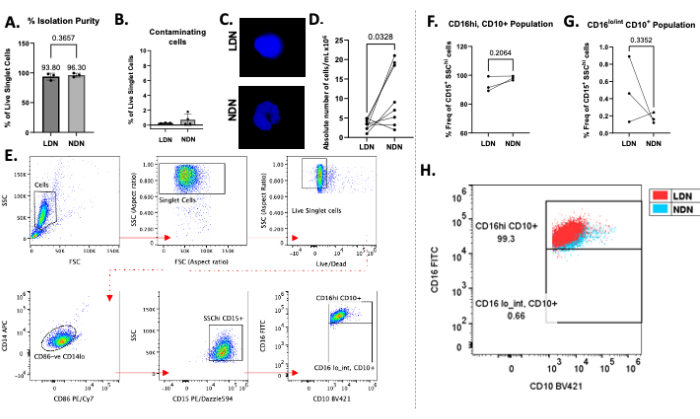
Figura 2: Risultati rappresentativi del protocollo. (A) Percentuale di purezza dell'isolamento di LDN e NDN da sangue intero. (B) Percentuale di cellule contaminanti (cellule B, cellule T e monociti) dopo l'isolamento. (C) Colorazione DAPI di LDN e NDN dopo l'isolamento che mostra nuclei multilobati nelle NDN e nuclei monolobati nelle LDN. (D) Numero assoluto di LDN e NDN abbinati isolati da sangue intero. (E) Strategia di gating utilizzata per definire LDN e NDN, determinarne la purezza e calcolarne la frequenza. I detriti, i doppietti e le cellule morte sono stati eliminati dall'analisi (riga superiore) e le cellule CD86-CD14lo, CD15+ SSChi sono state controllate per definire i neutrofili. (F,G) L'espressione di CD16 e CD10 è stata utilizzata per definire le sottopopolazioni in combinazione con l'uso di controlli a fluorescenza meno uno. Frequenza delle sottopopolazioni isolate di LDN e NDN mature (CD16hi, CD10+) e immature (CD16lo/int, CD10+), riportate come percentuale di LDN e NDN totali (definite come celluleCD15+SSC hi). (H) Dot plot che mostra le LDN CD16+ CD10+ sovrapposte alle NDN CD16+ CD10+ in individui sani. Media ± SD, test t accoppiato, n = 3-8. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui, presentiamo un metodo ottimizzato per suddividere la popolazione totale di neutrofili in neutrofili a bassa densità e a densità normale, insieme alla caratterizzazione fenotipica di ciascun tipo di cellula utilizzando la citometria a flusso adattata dai metodi precedenti5.
Questo protocollo si basa sull'isolamento di LDN e NDN dal sangue intero. Un passaggio cruciale è l'isolamento dei neutrofili totali attraverso metodi di selezione negativa. I metodi di selezione positiva prevedono l'uso di anticorpi che si legano ai marcatori di superficie, attivando potenzialmente i neutrofili e innescando la degranulazione5. Questa attivazione può interferire con gli esperimenti a valle alterando lo stato funzionale e metabolico dei neutrofili, portando a risultati imprecisi e distorcendo l'interpretazione dei risultati sperimentali. Pertanto, la selezione negativa garantisce l'isolamento dei neutrofili senza indurre attivazione o cambiamenti funzionali. Inoltre, l'uso dell'isolamento magnetico basato sulla separazione negativa elimina la necessità di lisi dei globuli rossi (RBC). Ciò non solo riduce le fasi di lavaggio extra e la morte cellulare, preservando così la resa, ma aumenta anche la purezza dei neutrofili isolati riducendo al minimo la contaminazione da globuli rossi. Rispetto al protocollo originale, durante l'intero processo è stato utilizzato un tampone di separazione cellulare, compreso il lavaggio e la risospensione, al posto del PBS. Questo contiene additivi che riducono l'aggregazione cellulare e minimizzano il legame non specifico durante l'isolamento magnetico. Utilizzando il tampone di separazione cellulare in modo coerente, abbiamo ottenuto una migliore efficienza di separazione cellulare, una maggiore purezza e una maggiore resa di neutrofili vitali e intatti rispetto all'utilizzo di PBS. Ciò ha comportato una maggiore precisione per le analisi a valle. Inoltre, il gradiente di densità è stato eseguito su più tubi piuttosto che su un singolo tubo per migliorare la risoluzione tra i due tipi di cellule.
Non sorprende che la separazione dei due sottotipi di neutrofili dipenda fortemente dalla formulazione precisa e dall'accurata stratificazione di ciascun gradiente15. Altrettanto importante è la stratificazione del 70% rispetto all'81%, così come la sospensione dei neutrofili (nel 55%) rispetto allo strato del 70%. Consigliamo vivamente di praticare questo metodo. È meglio utilizzare una pipetta di trasferimento durante la stratificazione e il posizionamento della provetta da 15 ml quasi parallelamente al fondo della camera di biosicurezza. Il rimescolamento dei gradienti, anche leggermente, causerà bande indistinte e diffuse, che potrebbero rendere indistinte le popolazioni. Bisogna fare attenzione a rimuovere lentamente solo le bande neutrofile usando una pipetta Pasteur, poiché gli strati sopra e sotto non devono essere aspirati, se possibile, a causa della loro tossicità. È importante ridurre al minimo la contaminazione della frazione neutrofila con la soluzione di lavoro isotonica per evitare effetti negativi sulle cellule15. Infine, un numero più elevato di cellule può comportare una densità complessiva più elevata delle bande LDN e NDN, con conseguente minore risoluzione delle popolazioni cellulari. Pertanto, si raccomanda di eseguire una conta totale dei neutrofili prima della risospensione nella soluzione al 55%. Ciò è particolarmente significativo se si utilizza >12 ml di sangue intero per l'isolamento dei neutrofili o se la conta totale dei neutrofili supera 5-6 × 106.
Le alternative a questo metodo consistono nella combinazione destrano/Percoll, che non si basa sulla separazione magnetica ed è essenzialmente un protocollo16 a passo singolo. L'uso della sedimentazione del destrano per rimuovere gli eritrociti potrebbe non essere efficiente o coerente come altri metodi come la lisi diretta dei globuli rossi o i gradienti di densità. La sedimentazione del destrano può lasciare globuli rossi residui nel surnatante, il che potrebbe influire sulla purezza della popolazione di neutrofili. Senza una fase di selezione negativa, c'è il rischio che i neutrofili possano essere attivati da anticorpi residui o altri stimoli, che potrebbero influenzare il loro comportamento nei saggi a valle. La rimozione manuale degli strati di PBMC e neutrofili dal mezzo del gradiente di densità potrebbe provocare una contaminazione tra le popolazioni cellulari, in particolare se la separazione non è pulita.
Questo studio presenta un pannello di citometria a flusso relativamente semplicistico per determinare la purezza delle LDN e delle NDN isolate ed eseguire una caratterizzazione minima di queste cellule. I marcatori utilizzati qui sono ampiamente riportati in letteratura come parte di molteplici e più complessi pannelli di citometria a flusso che coinvolgono la ricerca sui neutrofili. Abbiamo scelto di condensare il pannello per determinare la purezza dell'isolamento, la frequenza percentuale delle cellule vive e morte ed esaminare lo stato di maturazione dei neutrofili (in base all'espressione di CD10 e CD16). Tuttavia, può essere ampliato per soddisfare le esigenze dei vari studi degli utenti finali. Questo protocollo è stato specificamente progettato per separare LDN e NDN per la valutazione individuale, poiché la distinzione di queste sottopopolazioni su un pannello di citometria a flusso si è rivelata difficile a causa della loro relativa indistinzione (Figura 2H). Coerentemente con i rapporti precedenti5, è stato riscontrato che LDN e NDN di individui sani non possono essere differenziati in modo affidabile se analizzati simultaneamente. Pertanto, isolarli in anticipo consente una caratterizzazione più accurata e dettagliata di ciascuna sottopopolazione.
Suggeriamo che durante la fase di ottimizzazione di questo protocollo, gli utenti finali potrebbero scegliere di includere marcatori linfocitari di base come CD3 e CD19 nel loro pannello di citometria a flusso. Questo può aiutare con la risoluzione dei problemi, poiché un isolamento magnetico non ottimale può comportare l'inclusione di linfociti nell'isolato totale di neutrofili, che potrebbero potenzialmente trasferirsi nella frazione LDN a causa di densità cellulari simili. Ai fini dell'ottimizzazione, gli utenti possono scegliere di aggiungere CD45 per risolvere meglio i problemi dei contaminanti nelle loro frazioni isolate, ad esempio, CD45-ve potrebbe essere globuli rossi e CD45+ve potrebbe indicare la contaminazione da PBMC. Le sottopopolazioni di neutrofili sono state definite in base all'espressione del marcatore di superficie, che è una proprietà dinamica e può presentare un alto livello di variabilità tra i donatori. Pertanto, in linea con le buone pratiche di citometria a flusso, si suggerisce anche l'utilizzo di controlli FMO, in quanto ciò può aiutare a ridurre la variabilità tra donatori e definire sottopopolazioni più chiare.
Riconosciamo inoltre che questo protocollo è stato ottimizzato solo per il sangue intero fresco, in conformità con le linee guida del kit di isolamento magnetico, che affermano che con questo kit deve essere utilizzato solo sangue intero non trattato e che il recupero delle cellule isolate desiderate diminuisce con campioni risalenti a >24 ore. Ciò elimina le opzioni per il materiale di partenza da cui è possibile isolare i neutrofili, come il liquido di lavaggio broncoalveolare (BALF), il liquido pleurico, l'ascite, ecc. Connelly et al. hanno dimostrato che i ritardi nell'elaborazione dei neutrofili17, anche da sangue intero appena prelevato, possono alterare il loro fenotipo e l'espressione superficiale. In linea con ciò, si consiglia di iniziare la lavorazione con il minor ritardo possibile dal momento del prelievo di sangue. Quindi, sebbene questo protocollo sia ideale per il sangue intero fresco, rispetto ai protocolli a passaggio singolo come il destrano/Percoll, può essere un metodo relativamente lungo e dispendioso in termini di tempo che non offre un punto di arresto intermedio. Ciò rappresenta una limitazione nei casi di studi clinici in cui i campioni possono essere ricevuti in ore successive nel corso della giornata. Inoltre, questo metodo non consente lo smistamento di sottogruppi LDN e NDN, poiché i metodi per lo smistamento di sottogruppi (mediante citometria a flusso o altro) corrono il rischio di attivare involontariamente i neutrofili.
Le sottopopolazioni di neutrofili hanno attirato un'attenzione significativa in condizioni come il lupus eritematoso sistemico (LES)18,19, il cancro20 e il COVID-1921. Il crescente interesse per questi tipi di cellule, in particolare nel contesto delle malattie infiammatorie e autoimmuni, sottolinea la necessità di metodi affidabili per valutare accuratamente ogni popolazione e comprendere meglio i loro contributi individuali alla patogenesi.
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Questo lavoro è stato finanziato dall'Health Research Board EIA-2024-002 e dal Royal City of Dublin Hospital Trust. Vorremmo ringraziare la dottoressa Lorraine Thong e il dottor Kevin Brown per la loro assistenza nella raccolta di campioni da donatori sani per questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
Riferimenti
- Tracchi, I. et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I. et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E. et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963 (2021).
- Hacbarth, E. Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R. et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922 (2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A. et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696 (2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M. et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B. Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520 (2021).
- Park, J. et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282 (2023).
- Denny, M. F. et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A. et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603 (2019).
- Mosca, T. Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y. et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N. et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667 (2022).
- Carmona-Rivera, C. Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y. et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154 (2023).
- Dwivedi, A. et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon