Method Article
Выделение и характеристика нейтрофилов низкой и нормальной плотности из цельной крови
В этой статье
Резюме
В этой работе мы предлагаем надежный подход к выделению нейтрофилов низкой и нормальной плотности из цельной крови с помощью магнитной изоляции (отрицательного отбора) и прерывистой градиентной среды. Он обеспечивает нетронутую изоляцию клеток высокой чистоты (≥93%), способствуя точному последующему анализу субпопуляций нейтрофилов, что имеет решающее значение для понимания их роли в здоровье и болезнях.
Аннотация
Новые исследования показывают, что циркулирующая популяция нейтрофилов у человека состоит из различных подтипов и не должна изучаться как единая популяция, как это делалось исторически. В частности, было показано, что нейтрофилы низкой и нормальной плотности (LDN, NDNs) имеют функционально и метаболически различные профили, что необходимо учитывать при публикации исследований нейтрофилов. В этой статье мы представляем модифицированный метод нетронутого выделения и отделения LDN и NDN от цельной крови.
Градиент плотности среды (1,135 г/мл) объединяется в соотношении 9:10 с 10-кратным PBS. Удельные градиенты плотности 55%, 70% и 81% впоследствии получают путем объединения среды со 100% градиентом плотности с 1x фосфатно-солевой буфером (PBS). Нейтрофилы, выделенные из 12 мл периферической цельной крови, полученной от доноров, давших согласие с использованием набора магнитной изоляции на основе отрицательного отбора, ресуспендируются в 55% фракции. Объем 3 мл 81% и 70% фракций помещают слоями в пробирку объемом 15 мл, после чего следует 55% фракция, содержащая общее количество нейтрофилов. Затем градиенты плотности центрифугируют при 720 x g в течение 30 мин. На границе 55%/70% (LDNs) и 70%/81% (NDNs) получаются две отдельные полосы. Клетки тщательно пипетируются в отдельные пробирки и промываются с помощью PBS. Чистоту выделенных фракций определяют с помощью проточной цитометрии. Как LDN, так и NDN были определены как CD14lo CD15+ SSChi с помощью проточной цитометрии. Чистота изоляции была рассчитана на уровне ≥93% жизнеспособных клеток для обоих типов.
Этот метод обеспечивает надежный и эффективный подход к отделению LDN и NDN от периферической крови, обеспечивая высокую чистоту и жизнеспособность выделенных клеток. Повышение точности выделения нейтрофилов способствует более точному последующему анализу этих различных субпопуляций нейтрофилов. Это имеет решающее значение для углубления нашего понимания гетерогенности нейтрофилов и ее последствий в различных физиологических и патологических контекстах.
Введение
Нейтрофилы являются гранулированными иммунными клетками и наиболее распространенными лейкоцитами в периферической крови, составляя в среднем около 50-70% лейкоцитов. Они развиваются в костном мозге из гранулоцитарно-моноцитарных предшественников (ГМП), которые, в свою очередь, развиваются из гемопоэтических клеток-предшественников (ГПК) в присутствии гранулоцитарного колониестимулирующего фактора (G-CSF). При гомеостазе продолжительность жизни составляет ~24 часа, но исследования показали, что продолжительность их жизни может быть увеличена при определенных физиологических условиях и связанных с ними микроокружениях, таких как хроническая иммунная активация1, воспаление1 и даже проживание в тканях в устойчивом состоянии2. Нейтрофилы долгое время считались первой линией защиты от патогенов и вызывали их антимикробное действие через 3 основные эффекторные функции - дегрануляцию, фагоцитоз и активацию и высвобождение внеклеточной ловушки нейтрофилов (NET) (NETosis).
В большинстве исследований функции и биологии нейтрофилов изучаются результаты для общей популяции нейтрофилов. Тем не менее, из исследований в раковых условиях, определяющих подтипы N1 (противоопухолевые) / N2 (проопухолевые) и классификацию нейтрофилов на основе зрелости, болезни и физиологического состояния, и даже клеточной плотности (нейтрофилы низкой и нормальной плотности), становится все более очевидным, что популяция нейтрофилов человека представляет собой фенотипически разнообразные подтипы. Независимо от того, можно ли объяснить существование этих подтипов нейтрофилов совершенно разными типами клеток или сложной природой пластичности, существует растущий объем литературы об атипичных нейтрофилах, которая предоставляет прекрасную возможность изучать нейтрофилы низкой плотности отдельно от нейтрофилов нормальной плотности.
Впервые описанные у пациентов с СКВ как подгруппа провоспалительных нейтрофилов4, LDN с тех пор были идентифицированы при хронических заболеваниях, беременности и даже в здоровом кровообращении, как в провоспалительной, так и в супрессивной способности 5,6,7,8. LDN обнаруживаются одновременно с мононуклеарными клетками периферической крови (PBMC), когда цельная кровь центрифугируется на среде с градиентом плотности. Их удельная плотность соответствует примерно 1,077 г/мл, по сравнению с NDN на уровне 1,083 г/мл9. Несмотря на то, что до сих пор ведутся значительные споры по этому вопросу, существует предположение, что LDN напоминают более незрелый фенотип гранулоцитов (похожий на промиелоциты и миелоциты, с плотностью ниже 1,080 г/мл)9,10. Другие до сих пор предполагают, что существуют как зрелые, так и незрелые фенотипы LDN в зависимости от наличия или отсутствия заболевания 11,12,13. Тем не менее, LDN также были обнаружены у здоровых людей; Тем не менее, их включение в некоторые исследования ограничено из-за сложности их выделения в достаточномколичестве5.
Это исследование было направлено на изоляцию этих двух популяций в количествах, которые позволили бы нам проводить последующие метаболические эксперименты in situ (минимум 0,5 × 10-6 клеток/мл). При этом существующий протокол5 был оптимизирован с использованием широко известных фенотипических маркеров13,14, которые обеспечивают наилучший результат для выделения и характеристики LDN и NDNs из цельной крови (рисунок 1A).
протокол
Образцы крови были собраны с информированного согласия здоровых участников. Исследование получило одобрение Комитета по этике исследований больницы Святого Джеймса и Университетской больницы Талла.
1. Приготовление градиентной среды плотности, фракций изотонических рабочих растворов и буфера для разделения ячеек
- Приготовление изотонических рабочих растворов из градиентной среды
- Приготовление изотонического 100% рабочего раствора (~1,123 г/мл)
- Для приготовления изотонического 100% рабочего раствора соедините 27 мл градиентной среды плотности с 3 мл 10x PBS. В результате получается изотонический раствор, пригодный для дальнейших разведений.
- Приготовление изотонического 81% рабочего раствора (~1,0996 г/мл)
- Приготовьте изотонический 81% рабочий раствор, смешав 8,1 мл изотонического 100% рабочего раствора (приготовленного на шаге 1.1.1) с 1,9 мл 1x PBS. Тщательно перемешайте для обеспечения однородности.
- Приготовление изотонического 70% рабочего раствора (~1,0861 г/мл)
- Для приготовления изотонического 70% рабочего раствора соедините 7 мл изотонического 100% рабочего раствора с 3 мл 1x PBS. Следите за тем, чтобы раствор хорошо перемешался.
- Приготовление изотонического 55% рабочего раствора (1,0676 г/мл)
- Приготовьте изотонический 55% рабочий раствор, смешав 5,5 мл изотонического 100% рабочего раствора с 4,5 мл 1x PBS. Тщательно перемешиваем.
- Приготовление изотонического 100% рабочего раствора (~1,123 г/мл)
- Наслоение градиентных дробей
- Наслоение градиентных фракций
- С помощью конической пробирки объемом 15 мл аккуратно нанесите на дно 3 мл изотонического 81% рабочего раствора. Затем медленно и аккуратно нанесите сверху 3 мл изотонического 70% рабочего раствора, избегая смешивания слоев. Этот градиент будет использоваться для разделения ячеек.
- Наслоение градиентных фракций
- Приготовление буфера для разделения ячеек
- Приготовление 500 мл буфера для разделения клеток
- Чтобы приготовить буфер для разделения клеток, смешайте 2% фетальную бычью сыворотку (FBS) и 1 мМ этилендиаминтетрауксусную кислоту (ЭДТА) с 1x PBS до общего объема 500 мл. Используйте этот буфер для промывания и ресуспендирования клеток во время процесса изоляции.
ПРИМЕЧАНИЕ: Убедитесь, что слои хорошо разделены и не нарушены. В этом протоколе изотонические рабочие растворы обозначаются как «100%», «81%», «70%» и «55%» в зависимости от способа получения, согласующегося с предыдущими исследованиями5. Однако важно уточнить, что эти метки не отражают фактические конечные концентрации рабочих растворов. Например, среду с градиентом плотности «100%» получают путем смешивания 27 мл чистой среды с градиентом плотности с 3 мл 10x PBS, в результате чего получается конечная концентрация 90% изотонического рабочего раствора. Последующие разведения (например, «81%», «70%» и «55%») аналогичным образом отражают соотношения препаратов, а не истинные процентные концентрации. Эта номенклатура была сохранена для поддержания согласованности с терминологией, используемой в более ранней литературе по этому вопросу.
- Чтобы приготовить буфер для разделения клеток, смешайте 2% фетальную бычью сыворотку (FBS) и 1 мМ этилендиаминтетрауксусную кислоту (ЭДТА) с 1x PBS до общего объема 500 мл. Используйте этот буфер для промывания и ресуспендирования клеток во время процесса изоляции.
- Приготовление 500 мл буфера для разделения клеток
2. Выделение нейтрофилов из цельной крови с помощью отрицательного отбора
- Приготовление магнитных шариков
- Перед использованием тщательно окуните магнитные шарики в течение 30 секунд, чтобы убедиться, что они полностью ресуспендированы.
- Заготовка крови
- На каждого донора насыпьте 4 мл цельной крови в три отдельные пробирки по 14 мл с круглым дном.
- Добавление коктейля из изолирующих нейтрофилов и магнитных шариков
- Добавьте в каждую пробирку 50 μл коктейля для выделения нейтрофилов и 50 μл магнитных шариков на мл крови. На 4 мл крови добавьте по 200 мкл каждого реагента.
- Хорошо восстановите суспендию смеси с помощью осторожного пипетирования и инкубируйте при комнатной температуре (RT) в течение 5 минут, чтобы реагенты могли связываться с нежелательными клетками.
- Промывка и магнитная сепарация - первый раунд
- Долейте каждую пробирку до 12 мл с помощью буфера для разделения клеток и тщательно перемешайте.
- Поместите пробирки без крышек на магнит и дайте им инкубироваться при RT в течение 10 минут, чтобы магнитные шарики, связанные с нежелательными клетками, притянулись к стенке трубки.
- Коллекция непривязанных ячеек
- Осторожно перенесите суспензию прозрачных клеток, содержащую нейтрофилы, из каждой пробирки в новую чистую пробирку с помощью переводной пипетки. Снимите оригинальную трубку с магнита.
- Повторное нанесение магнитных шариков и инкубация - второй раунд
- Снова закрутите магнитные шарики в течение 30 секунд. Добавьте во вновь перенесенную клеточную суспензию тот же объем магнитных шариков, что и в шаге 2.3. Тщательно восстановите суспензию и инкубируйте при RT еще 5 минут.
- Окончательная магнитная сепарация и сбор
- Поместите пробирки обратно на магнит без крышек и инкубируйте при RT еще 10 минут.
- Осторожно переложите суспензию с прозрачными ячейками в новую пробирку. Эта окончательная суспензия представляет собой изолированную общую популяцию нейтрофилов.
3. Выделение нейтрофилов низкой плотности (НДН) и нейтрофилов нормальной плотности (НДН) из общей популяции нейтрофилов
- Объединение и приготовление клеточных суспензий
- Для каждого донора объедините выделенные суспензии нейтрофилов в пробирки объемом 50 мл. Долейте каждую пробирку до общего объема 50 мл с помощью буфера для разделения клеток.
- Центрифугирование
- Центрифугируйте пробирки при давлении 400 x g в течение 5 минут при RT при включенном тормозе.
- Ресуспензия и подсчет клеток
- Выбросьте надосадочную жидкость и ресуспендируйте гранулу нейтрофила в 1 мл буфера для разделения клеток. Выполните подсчет клеток, чтобы определить общее количество нейтрофилов.
- Подготовка среды с градиентом плотности
- Снова центрифугируйте пробирки при давлении 400 x g в течение 5 минут при RT с включенным тормозом. Выбросьте надосадочную жидкость и ресуспендируйте гранулу нейтрофила в 3 мл среды с градиентом плотности 55%. Для оптимального разрешения используйте 3 мл среды с градиентом плотности 55% на 5-6 × 106 общих нейтрофилов.
- При необходимости разделите ресуспензированные клетки на несколько заранее изготовленных пробирок с градиентом плотности, следя за тем, чтобы 3 мл клеточной суспензии были помещены слоями в каждую пробирку.
- Нанесение слоев на пробирки с градиентом плотности
- Медленно нанесите клеточную суспензию объемом 3 мл, содержащую среду с градиентом плотности 55%, на предварительно изготовленные пробирки с градиентом плотности (приготовленные, как описано в разделе 1). Обеспечьте тщательное наслоение, чтобы не нарушить градиент.
- Центрифугирование с градиентом плотности
- Центрифугируйте пробирки при давлении 720 x g в течение 30 мин без использования тормоза. После центрифугирования обращайтесь с пробирками осторожно, чтобы не нарушить слои.
- Выделение нейтрофильных фракций
- После центрифугирования наблюдайте, как нейтрофилы разделяются на два отдельных слоя:
Нейтрофилы низкой плотности (LDN) будут расположены на границе 55%/70%, образуя верхнюю полосу примерно на отметке 3 мл, а нейтрофилы нормальной плотности (NDN) будут находиться на границе 70%/81%, проявляясь как нижняя полоса вокруг отметки 6 мл. - С помощью переводной пипетки тщательно изолируйте каждый слой и перенесите их в отдельные пробирки объемом 15 мл.
- После центрифугирования наблюдайте, как нейтрофилы разделяются на два отдельных слоя:
- Промывка выделенных фракций
- Чтобы смыть любую среду с остаточным градиентом плотности, добавьте 1x PBS в каждую пробирку объемом 15 мл до отметки 15 мл.
- Центрифугировать при 400 × г в течение 5 мин при RT при включенном тормозе. Если ячейки не образуют твердую гранулу и вместо этого остаются во взвешенном состоянии, повторите этот этап промывки, указывая на наличие оставшейся среды градиента плотности.
- Количество ячеек и последующие приложения
- Подсчитайте количество клеток в каждой фракции и при необходимости приступайте к последующим операциям, таким как метаболические эксперименты, окрашивание методом проточной цитометрии, экстракция РНК или лизис белка.
ПРИМЕЧАНИЕ: После выгрузки ячеек рекомендуется откручивать пластину при давлении 210 × g в течение 1 минуты (тормозить).
- Подсчитайте количество клеток в каждой фракции и при необходимости приступайте к последующим операциям, таким как метаболические эксперименты, окрашивание методом проточной цитометрии, экстракция РНК или лизис белка.
4. Фенотипирование изолированных LDN и NDN
- Изолируйте ~0,5-1 × 106 LDN и NDNs. Сделайте мастермикс 2x концентрированных антител, используя CD14, CD86, CD15, CD16, CD10, Fc-блок и окрашивание жизнеспособности.
- Окрашивают выделенные популяции LDN и NDN эквивалентным объемом мастермикса антител таким образом, чтобы окончательное разведение антител, окрашивающих клетки, составляло 1:100 (CD14, CD86, CD15, CD16, CD10, Fc-блок) и 1:50 (окрашивание жизнеспособности) соответственно.
- Инкубируйте клетки в течение 10 минут в темноте при RT.
ПРИМЕЧАНИЕ: Убедитесь, что клетки тщательно перемешаны с мастермиксом антител и блоком Fc. - Промойте клетки один раз PBS, затем центрифугируйте при 400 × г в течение 5 минут. Выбросьте надосадочную жидкость.
- Зафиксируйте клетки в 1% параформальдегиде (PFA) на 15 минут в RT в темноте.
- Снова промойте клетки PBS, центрифугируйте при 400 × г в течение 5 минут и выбросьте надосадочную жидкость.
- Ресуспендируйте клетки в 200 мкл PBS или по мере необходимости использования и как можно скорее зарегистрируйте клетки на проточном цитометре.
ПРИМЕЧАНИЕ: Окрашенные и неподвижные клетки можно хранить кратковременно при температуре 4 °C в темноте, чтобы предотвратить фотообесцвечивание флуорофоров. Однако в идеале процедура фенотипирования должна проводиться сразу после окрашивания и фиксации, чтобы обеспечить оптимальную жизнеспособность клеток и точные результаты.
Результаты
Успешное наслоение общих нейтрофилов на среду с градиентом плотности можно наблюдать на рисунке 1В. Должны быть получены две отдельные полосы. Если происходит смешение градиентов или количество общих нейтрофилов, наслоенных на трубку, велико (более примерно 5-6 × 106), полосы будут выглядеть диффузными (рис. 1C), и риск смешивания двух подтипов нейтрофилов значительно возрастает. Чтобы избежать последнего, мы рекомендуем наслаивать до 5-6 ×10-6 нейтрофилов на пробирку с градиентом плотности. Несмотря на сообщения о том, что LDN находятся на очень низком уровне у здоровых людей, что делает их недостижимыми для последующих исследований, этот метод показывает хороший выход как LDN (в среднем 3,28 × 106 клеток/мл), так и NDN (в среднем 10,64 × 106 клеток/мл), а также чистоту у здоровых участников (рис. 2).
Средняя чистота изоляции для LDN составила 93,80% (± 5,80), а для NDN — 96,30% (± 3,30; Рисунок 2А) после процедуры изоляции, с минимальной контаминацией других типов клеток (рисунок 2В). Окрашивание ядер методом DAPI подтвердило наличие LDN/NDN по морфологии ядер и показало характерные многолопастные ядра в NDN после выделения (рис. 2C). Абсолютные подсчеты после выделения показали общую тенденцию к присутствию большего количества NDN, чем LDN, со средними выходами 10,64 × 106 клеток/мл и 3,28 × 106 клеток/мл соответственно (рисунок 2D). С помощью проточной цитометрии как LDN, так и NDN были определены как CD14lo CD86- CD15+ SSChi cells13 (рисунок 2E). CD14 является распространенным миелоидным маркером, CD15 является идентификационным маркером нейтрофилов, а CD10 и CD16 обычно описываются как нейтрофильные маркеры зрелости и активации13. Флуоресцентный контроль «минус один» (FMO) использовался для отличия CD16 и CD10-положительных популяций от отрицательных. У здоровых людей наблюдалась в значительной степени единичная популяция зрелых LDN, а также NDN (CD16hiCD10+), что согласуется с сообщениями в литературе13, поскольку здоровые люди вряд ли имеют высокий процент незрелых нейтрофилов (CD16lo/intCD10+) в циркуляции (рисунок 2F, G). В среднем, частота CD16hiCD10+ LDN составила 93,33% (± 5,29), CD16hiCD10+ NDNs составила 98,03% (± 1,40), CD16lo/intCD10+ составила 0,49% (± 0,38), а CD16lo/intCD10+ составила 0,17% (± 0,06; Рисунок 2F,G). Когда популяции CD16+CD10+ накладывались друг на друга, степень перекрытия не указывала на заметные различия в экспрессии этих маркеров в LDN по сравнению с NDN (рисунок 2H). Клетки были получены с помощью проточного цитометра, и весь анализ данных был выполнен с использованием соответствующего программного обеспечения для проточной цитометрии.
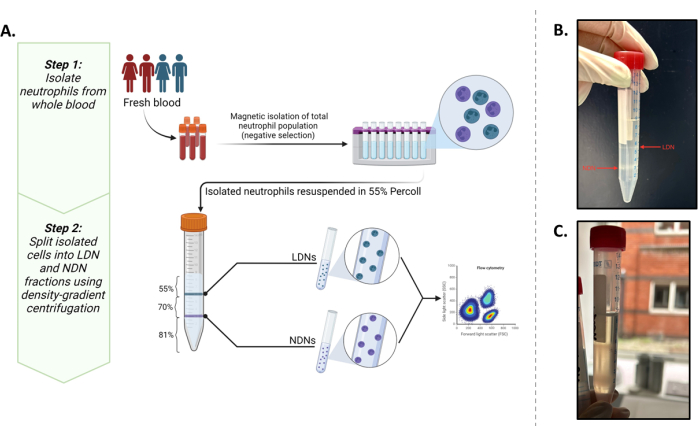
Рисунок 1: Обзор протокола. (A) Двухэтапный протокол выделения LDN и NDNs из цельной крови. Первый этап состоит из общих нейтрофилов, выделенных из цельной крови с помощью отрицательного отбора. Второй этап включает в себя суспендирование общего количества нейтрофилов в 55% изотоническом рабочем растворе и наложение его поверх 81% и 70% градиента. После центрифугирования LDN будут находиться на границе 55% и 70% слоев, а NDN — на границе 81% и 70% слоев. (B) Визуальное представление идеально разделенных LDN и NDN после центрифугирования градиентной среды. (C) Неоптимальное разделение LDN и NDN, что видно по диффузному характеру полос. В этом случае существует высокая вероятность того, что NDN загрязняют фракцию LDN или наоборот. Графика создана в BioRender. Йеннемади, А. (2025) https://BioRender.com/t03m122. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
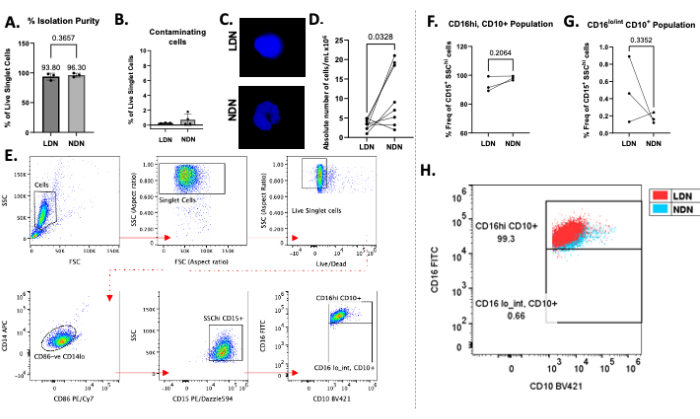
Рисунок 2: Репрезентативные результаты протокола. (А) Процентная чистота выделения LDN и NDNs из цельной крови. (В) Процент контаминирующих клеток (В-клеток, Т-клеток и моноцитов) после выделения. (C) Окрашивание LDN и NDN по DAPI после выделения с демонстрацией многолопастных ядер в NDN и однодолевых ядер в LDN. (D) Абсолютное число LDN и совместимых NDN, выделенных из цельной крови. (E) Стратегия стробирования, используемая для определения LDN и NDN, определения их чистоты и вычисления их частоты. Мусор, дублеты и мертвые клетки были исключены из анализа (верхний ряд), а клетки CD86-CD14lo, CD15+ SSChi были забиты для определения нейтрофилов. (Ф,Г) Экспрессия CD16 и CD10 использовалась для определения субпопуляций в сочетании с использованием контрольной группы «флуоресценция минус один». Частота изолированных зрелых (CD16hiCD10+) и незрелых (CD16lo/intCD10+) субпопуляций LDN и NDN, выраженная в процентах от общего числа LDN и NDN (определяемых как CD15+SSChi cells). (H) Точечная диаграмма, показывающая CD16+ CD10+ LDN, наложенные на CD16+ CD10+ NDN у здоровых людей. Среднее значение ± SD, парный t-критерий, n = 3-8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В данной работе мы представляем оптимизированный метод расщепления общей популяции нейтрофилов на нейтрофилы низкой и нормальной плотности, а также фенотипическую характеристику каждого типа клеток с помощью проточной цитометрии, адаптированной из предыдущихметодов5.
Этот протокол основан на выделении LDN и NDN из цельной крови. Важным шагом является выделение общих нейтрофилов с помощью методов отрицательного отбора. Методы положительного отбора предполагают использование антител, которые связываются с поверхностными маркерами, потенциально активируя нейтрофилы и запускаядегрануляцию. Эта активация может мешать последующим экспериментам, изменяя функциональное и метаболическое состояние нейтрофилов, что приводит к неточным результатам и искажает интерпретацию экспериментальных результатов. Таким образом, отрицательный отбор обеспечивает выделение нейтрофилов, не вызывая активации или функциональных изменений. Кроме того, использование магнитной изоляции на основе отрицательного разделения устраняет необходимость в лизисе эритроцитов (эритроцитов). Это не только снижает количество дополнительных этапов промывки и гибель клеток, тем самым сохраняя выход, но и повышает чистоту изолированных нейтрофилов, сводя к минимуму загрязнение эритроцитами. По сравнению с оригинальным протоколом, вместо PBS на протяжении всего процесса, включая промывку и ресуспендирование, использовался буфер для разделения клеток. Он содержит добавки, которые уменьшают комкование клеток и минимизируют неспецифическое связывание при магнитной изоляции. При последовательном использовании буфера для разделения клеток мы добились повышения эффективности разделения клеток, более высокой чистоты и большего выхода жизнеспособных, нетронутых нейтрофилов по сравнению с использованием PBS. Это привело к повышению точности последующих анализов. Кроме того, градиент плотности был выполнен над несколькими пробирками, а не над одной пробиркой, чтобы улучшить разрешение между двумя типами клеток.
Неудивительно, что успешное разделение двух подтипов нейтрофилов в значительной степени зависит от точной формулировки и точного наслоения каждого градиента15. Не менее важным является наслоение 70% на 81%, а также суспензия нейтрофилов (у 55%) на 70% слое. Мы настоятельно рекомендуем практиковать этот метод. Лучше всего использовать переводную пипетку при наложении слоев и расположении пробирки объемом 15 мл почти параллельно дну шкафа биобезопасности. Смешение градиентов, даже незначительное, приведет к появлению нечетких и диффузных полос, которые могут привести к образованию нечетких популяций. Следует соблюдать осторожность и медленно удалять только нейтрофильные полосы с помощью пастеровской пипетки, так как слои выше и ниже не должны аспирироваться, по возможности, из-за их токсичности. Важно свести к минимуму контаминацию фракции нейтрофилов рабочим раствором Изотоника, чтобы избежать каких-либо неблагоприятных воздействий на клетки15. Наконец, большее количество клеток может привести к общей более высокой плотности полос LDN и NDN, что приводит к более низкому разрешению клеточных популяций. Поэтому мы рекомендуем проводить общее количество нейтрофилов перед ресуспендированием в 55% растворе. Это особенно важно при использовании >12 мл цельной крови для выделения нейтрофилов или если общее количество нейтрофилов превышает 5-6 × 106.
Альтернативой этому способу является комбинация декстрана/Перколла, которая не основана на магнитном разделении и по существу представляет собой одноступенчатый протокол16. Использование седиментации декстрана для удаления эритроцитов может быть не таким эффективным или последовательным, как другие методы, такие как прямой лизис эритроцитов или градиенты плотности. Осаждение декстрана может оставлять остаточные эритроциты в надосадочной жидкости, что может повлиять на чистоту популяции нейтрофилов. Без этапа отрицательного отбора существует риск того, что нейтрофилы могут быть активированы остаточными антителами или другими стимулами, что может повлиять на их поведение в последующих анализах. Ручное удаление слоев PBMC и нейтрофилов из среды с градиентом плотности может привести к загрязнению между клеточными популяциями, особенно если разделение не является чистым.
В этом исследовании представлена относительно упрощенная панель проточной цитометрии для определения чистоты выделенных LDN и NDN и выполнения минимальной характеристики этих клеток. Используемые здесь маркеры широко известны в литературе как часть множественных, более сложных панелей проточной цитометрии, включающих исследования нейтрофилов. Мы решили конденсировать панель для определения чистоты выделения, процентной частоты живых и мертвых клеток, а также для изучения статуса созревания нейтрофилов (на основе экспрессии CD10 и CD16). Тем не менее, он может быть расширен в соответствии с потребностями различных исследований конечных пользователей. Этот протокол был специально разработан для разделения LDN и NDN для индивидуальной оценки, поскольку различить эти субпопуляции вместе на панели проточной цитометрии оказалось сложной задачей из-за их относительной неразличимости (рисунок 2H). В соответствии с предыдущими отчетами5 было обнаружено, что LDN и NDN от здоровых людей не могут быть надежно дифференцированы при одновременном анализе. Таким образом, их предварительная изоляция позволяет более точно и детально охарактеризовать каждую субпопуляцию.
Мы предполагаем, что на этапе оптимизации этого протокола конечные пользователи могут выбрать включение основных маркеров лимфоцитов, таких как CD3 и CD19, в свою панель проточной цитометрии. Это может помочь в устранении неполадок, так как неоптимальная магнитная изоляция может привести к включению лимфоцитов в общий изолят нейтрофилов, что потенциально может быть перенесено во фракцию LDN из-за схожей клеточной плотности. В целях оптимизации пользователи могут выбрать добавление CD45 для лучшего устранения загрязняющих веществ в их изолированных фракциях, т.е. CD45-ve может быть эритроцитами, а CD45+ve может указывать на загрязнение PBMC. Субпопуляции нейтрофилов были определены на основе экспрессии поверхностных маркеров, которая является динамическим свойством и может демонстрировать высокий уровень вариабельности между донорами. Таким образом, в соответствии с надлежащей практикой проточной цитометрии, также рекомендуется использовать контроль FMO, поскольку это может помочь снизить междонорскую вариабельность и определить более четкие субпопуляции.
Мы также признаем, что этот протокол был оптимизирован только для свежей цельной крови в соответствии с рекомендациями из набора для магнитной изоляции, в которых говорится, что с этим набором следует использовать только необработанную цельную кровь и что восстановление желаемых выделенных клеток снижается при использовании образцов возрастом >24 часа. Это исключает варианты исходного материала, из которого могут быть выделены нейтрофилы, такие как жидкость бронхоальвеолярного лаважа (BALF), плевральная жидкость, асцит и т. д. Connelly et al. показали, что задержки в обработке нейтрофилов17, даже из свежеполученной цельной крови, могут изменить их фенотип и поверхностную экспрессию. В соответствии с этим мы рекомендуем начинать обработку как можно скорее с момента забора крови. Таким образом, хотя этот протокол идеально подходит для свежей цельной крови, по сравнению с одноэтапными протоколами, такими как декстран/Перколл, он может быть относительно длительным и трудоемким методом, который не предлагает промежуточной точки остановки. Это представляет собой ограничение в случаях клинических исследований, когда образцы могут быть получены в более поздние часы дня. Кроме того, этот метод не позволяет сортировать подмножества LDN и NDN, так как методы сортировки подмножеств (с помощью проточной цитометрии или иным способом) сопряжены с риском непреднамеренной активации нейтрофилов.
Субпопуляции нейтрофилов привлекли значительное внимание при таких состояниях, как системная красная волчанка (СКВ)18,19, рак20 и COVID-1921. Растущий интерес к этим типам клеток, особенно в контексте воспалительных и аутоиммунных заболеваний, подчеркивает необходимость надежных методов для точной оценки каждой популяции и лучшего понимания их индивидуального вклада в патогенез.
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Эта работа финансировалась Советом по исследованиям в области здравоохранения EIA-2024-002 и Фондом больницы Королевского города Дублина. Мы хотели бы поблагодарить доктора Лоррейн Тонг и доктора Кевина Брауна за их помощь в сборе образцов от здоровых доноров для этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
Ссылки
- Tracchi, I., et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I., et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E., et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963(2021).
- Hacbarth, E., Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R., et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922(2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A., et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696(2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M., et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B., Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520(2021).
- Park, J., et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282(2023).
- Denny, M. F., et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A., et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603(2019).
- Mosca, T., Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y., et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N., et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667(2022).
- Carmona-Rivera, C., Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y., et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154(2023).
- Dwivedi, A., et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659(2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены