Method Article
전혈에서 저밀도 및 정상 밀도 호중구의 분리 및 특성화(The Isolation and Characterization of Low- and Normal- Density Neutrophils from Whole Blood)
요약
여기에서는 자기 분리(negative selection) 및 불연속 밀도 구배 매체를 사용하여 전혈에서 저밀도 및 정상 밀도 호중구를 분리하기 위한 신뢰할 수 있는 접근 방식을 제공합니다. 이는 고순도 세포(≥93%)의 손대지 않은 분리를 보장하여 건강과 질병에서 호중구 하위 집단의 역할을 이해하는 데 중요한 호중구 하위 집단의 정확한 다운스트림 분석을 용이하게 합니다.
초록
새로운 연구에 따르면 인간의 순환 호중구 개체군은 다양한 하위 유형으로 구성되어 있으며 역사적으로 그랬던 것처럼 단일 개체군으로 연구해서는 안 됩니다. 특히, 저밀도 및 정상 밀도 호중구(LDN, NDN)는 기능적으로나 대사적으로 뚜렷한 프로필을 가지고 있는 것으로 나타났으며, 이는 호중구 연구를 발표할 때 반드시 고려해야 하는 요소입니다. 여기에서는 전혈에서 LDN과 NDN을 손대지 않고 분리하기 위한 수정된 방법을 제시합니다.
밀도 구배 배지(1.135g/mL)는 9:10에서 10x PBS와 결합됩니다. 55%, 70% 및 81%의 특정 밀도 구배는 100% 밀도 구배 배지와 1x 인산염 완충 식염수(PBS)를 결합하여 만듭니다. 음성 선택 기반 자기 분리 키트를 사용하여 동의한 기증자로부터 얻은 12mL의 말초 전혈에서 분리된 호중구는 55% 분획으로 재현탁됩니다. 81% 및 70% 분획 3mL 부피를 15mL 튜브에 층상 형성한 후 총 호중구를 포함하는 55% 분획을 층상화합니다. 그런 다음 밀도 구배를 720 x g 에서 30분 동안 원심분리합니다. 55%/70% 인터페이스(LDN) 및 70%/81% 인터페이스(NDN)에서 두 개의 고유한 대역을 얻을 수 있습니다. 세포를 별도의 튜브에 조심스럽게 피펫으로 넣고 PBS를 사용하여 세척합니다. 분리된 분획의 순도는 유세포 분석을 사용하여 측정됩니다. LDN과 NDN은 모두 유세포 분석에 의해 CD14lo CD15+ SSChi로 정의되었습니다. 분리 순도는 두 유형 모두에 대해 생존 가능한 세포의 ≥93%로 계산되었습니다.
이 방법은 말초 혈액에서 LDN 및 NDN을 분리하기 위한 신뢰할 수 있고 효율적인 접근 방식을 제공하여 분리된 세포의 높은 순도와 생존력을 보장합니다. 호중구 분리의 정밀도를 높이면 이러한 뚜렷한 호중구 하위 집단에 대한 보다 정확한 다운스트림 분석이 용이해집니다. 이는 호중구 이질성과 다양한 생리학적 및 병리학적 맥락에서 그 의미에 대한 이해를 진전시키는 데 중요합니다.
서문
호중구는 과립 면역 세포이며 말초 혈액에서 가장 풍부한 백혈구로 평균적으로 백혈구의 약 50%-70%를 구성합니다. 이들은 과립구-단핵구 전구체(GMP)로부터 골수에서 발생하며, GMP는 다시 과립구 집락 자극 인자(G-CSF)가 존재하는 조혈전구세포(HPC)에서 발생합니다. 항상성에서 이들의 수명은 ~24시간이지만, 연구에 따르면 특정 생리학적 조건과 만성 면역 활성화1, 염증1, 심지어정상 상태의 조직 상주2와 같은 관련 미세환경 하에서 수명을 연장할 수 있다고 합니다. 호중구는 오랫동안 병원체에 대한 1차 방어선으로 간주되어 왔으며 탈과립화(degranulation), 식세포작용(phagocytosis), 호중구 세포외 트랩(NET) 활성화 및 방출(NETosis)의 3가지 주요 효과기 기능을 통해 항균 효과를 이끌어냅니다.
호중구 기능 및 생물학에 대한 대부분의 연구는 전체 호중구 개체군에 대한 결과를 조사합니다. 그러나 N1(항종양)/N2(전종양) 아형을 구분하는 암 환경에서의 연구에서 성숙도, 질병 및 생리학적 상태, 심지어 세포 밀도(저밀도 및 정상 밀도 호중구)에 따른 호중구 분류에 이르기까지, 인간 호중구 집단이 표현형적으로 다양한 아형을 구성한다는 것이 점점 더 분명해지고 있습니다. 이러한 호중구 아형의 존재가 완전히 다른 세포 유형이기 때문인지 아니면 가소성의 복잡한 특성 때문이든, 비정형 호중구에 대한 문헌이 증가하고 있으며 정상 밀도 호중구와 분리된 저밀도 호중구를 연구할 수 있는 강력한 기회를 제공합니다3.
전염증성 호중구 부분 집합4로 전신홍반루푸스 환자에서 처음으로 기술된 LDN은 이후 만성 질환, 임신, 심지어 건강한 혈액 순환에서도 전염증 및 억제 능력으로 확인되었습니다 5,6,7,8. LDN은 전혈이 밀도 구배 매체를 통해 원심분리될 때 말초 혈액 단핵 세포(PBMC)와 동시에 발견됩니다. 비밀도는 약 1.077g/mL에 해당하며, NDN은 1.083g/mL에 해당합니다9. 이 주제에 대해서는 여전히 상당한 논쟁이 있지만, LDN이 더 미성숙한 과립구 표현형(전골수구 및 골수구와 유사하며 밀도가 1.080g/mL 미만)과 유사하다는 추측이 있습니다9,10. 다른 사람들은 여전히 질병의 유무에 따라 성숙한 LDN 표현형과 미성숙한 LDN 표현형이 모두 있다고 추측합니다11 , 12 , 13 . 그럼에도 불구하고, LDN은 건강한 개인에게서도 발견되었습니다. 그러나 일부 연구에서는 충분한 숫자로 이들을 분리하는 것이 어렵기 때문에 제한적이다5.
이 연구는 다운스트림 현장 대사 실험(최소 0.5 × 106 cells/mL)을 수행할 수 있는 양으로 이 두 집단을 분리하는 것을 목표로 했습니다. 이를 통해, 기존 프로토콜5는 전혈에서 LDN 및 NDN을 분리하고 특성화하기 위한 최상의 결과를 제공하는 일반적으로 보고되는 표현형 마커13,14로 최적화되었습니다(그림 1A).
프로토콜
혈액 샘플은 건강한 참가자의 사전 동의하에 수집되었습니다. 이 연구는 세인트 제임스 병원(St. James's Hospital)과 탤러트 대학병원(Tallaght University Hospital)의 연구 윤리 위원회(Research Ethics Committee)의 승인을 받았습니다.
1. 조밀도 기온변화도 매체, 등장성 작동 해결책 분획 및 세포 별거 완충액의 준비
- Preparation of isotonic working solution from density gradient medium(밀도 구배 매질로부터 등장성 작업 용액) 준비
- 등장성 100% 작업 용액(~1.123g/mL)의 준비
- 등장성 100% 작동 용액을 준비하려면 27mL의 밀도 구배 배지와 3mL의 10x PBS를 결합합니다. 그 결과 추가 희석에 적합한 등장성 용액이 생성됩니다.
- 등장성 81% 작업 용액(~1.0996g/mL)의 준비
- 8.1mL의 등장성 100% 작업 용액(1.1.1단계에서 준비)과 1x PBS 1.9mL를 혼합하여 등장성 81% 작업 용액을 준비합니다. 균질성을 보장하기 위해 철저히 혼합하십시오.
- 등장성 70% 작업 용액(~1.0861g/mL)의 준비
- 등장성 70% 작동 용액을 준비하려면 7mL의 등장성 100% 작동 용액을 3mL의 1x PBS와 결합합니다. 용액이 잘 혼합되었는지 확인하십시오.
- 등장성 55% 작업 용액(1.0676g/mL)의 준비
- 5.5mL의 등장성 100% 용액을 4.5mL의 1x PBS와 혼합하여 등장성 55% 작동 용액을 만듭니다. 철저히 섞는다.
- 등장성 100% 작업 용액(~1.123g/mL)의 준비
- gradient fractions의 계층화
- 그라디언트 분수 레이어링
- 15mL 원뿔형 튜브를 사용하여 바닥에 3mL의 등장성 81% 작업 용액을 조심스럽게 겹쳐 놓습니다. 그런 다음 층이 섞이지 않도록 3mL의 등장성 70% 작업 용액을 천천히 부드럽게 그 위에 겹쳐 놓습니다. 이 그래디언트는 세포 분리에 사용됩니다.
- 그라디언트 분수 레이어링
- 세포 분리 완충액의 준비
- 500mL의 세포 분리 완충액 준비
- 세포 분리 완충액을 준비하기 위해 2% 소 태아 혈청(FBS) 및 1mM 에틸렌디아민테트라아세트산(EDTA)을 1x PBS와 총 부피 500mL에 결합합니다. 이 버퍼를 사용하여 분리 프로세스 중에 세포를 세척하고 재현탁합니다.
참고: 레이어가 잘 분리되어 있고 방해받지 않는지 확인하십시오. 이 프로토콜에서 등장성 작업 용액은 이전 연구와 일치하는 준비 방법에 따라 "100%", "81%", "70%" 및 "55%"라고 합니다5. 그러나 이러한 라벨이 작업 용액의 실제 최종 농도를 나타내지 않는다는 점을 명확히하는 것이 중요합니다. 예를 들어, "100%" 밀도 구배 배지는 27mL의 순수 밀도 구배 배지와 3mL의 10x PBS를 혼합하여 준비되며, 그 결과 최종 농도는 90% 아이소톤 작업 용액이 됩니다. 후속 희석액(예: "81%", "70%" 및 "55%")은 실제 농도가 아닌 준비 비율을 유사하게 반영합니다. 이 명명법은 이 주제에 대한 초기 문헌에서 사용된 용어와의 일관성을 유지하기 위해 유지되었습니다.
- 세포 분리 완충액을 준비하기 위해 2% 소 태아 혈청(FBS) 및 1mM 에틸렌디아민테트라아세트산(EDTA)을 1x PBS와 총 부피 500mL에 결합합니다. 이 버퍼를 사용하여 분리 프로세스 중에 세포를 세척하고 재현탁합니다.
- 500mL의 세포 분리 완충액 준비
2. 음성 선택을 사용한 전혈에서 호중구 분리
- 마그네틱 비드의 준비
- 사용하기 전에 완전히 재현탁되도록 30초 동안 마그네틱 비드를 철저히 소용돌이치십시오.
- 혈액 제제
- 각 기증자에 대해 4mL의 전혈을 3개의 14mL 둥근 바닥 튜브로 분주합니다.
- 호중구 분리 칵테일 및 마그네틱 비드 추가
- 각 튜브에 혈액 mL당 50μL의 호중구 분리 칵테일과 50μL의 마그네틱 비드를 추가합니다. 혈액 4mL의 경우 각 시약 200μL를 추가합니다.
- 부드럽게 피펫팅하여 혼합물을 잘 재현탁시키고 시약이 원치 않는 세포에 결합할 수 있도록 실온(RT)에서 5분 동안 배양합니다.
- 세척 및 자기 분리 - 첫 번째 라운드
- 세포 분리 완충액을 사용하여 각 튜브를 12mL로 채우고 철저히 혼합합니다.
- 뚜껑이 없는 튜브를 자석에 놓고 RT에서 10분 동안 배양하여 원치 않는 세포에 결합된 자기 비드가 튜브 벽으로 끌어당겨질 수 있도록 합니다.
- 결합되지 않은 세포의 수집
- 전사 피펫을 사용하여 각 튜브의 호중구가 포함된 투명 세포 현탁액을 새롭고 깨끗한 튜브로 조심스럽게 옮깁니다. 자석에서 원래 튜브를 제거합니다.
- 마그네틱 비드 재도포 및 배양 - 2차
- 30초 동안 마그네틱 비드를 다시 소용돌이칩니다. 2.3단계에서와 같이 새로 이전된 cell suspension에 동일한 부피의 마그네틱 비드를 추가합니다. 완전히 재현탁하고 RT에서 5분 더 배양합니다.
- 최종 자기 분리 및 수집
- 뚜껑이 없는 자석에 튜브를 다시 끼우고 RT에서 10분 더 배양합니다.
- 투명 셀 현탁액을 새 튜브로 조심스럽게 옮깁니다. 이 최종 현탁액은 고립된 총 호중구 개체군을 나타냅니다.
3. 전체 호중구 개체군에서 저밀도 호중구(LDN)와 정상 밀도 호중구(NDN)의 분리
- pooling and preparation of cell suspensions(세포 현탁액의 풀링 및 준비)
- 각 donor에 대해 분리된 호중구 현탁액을 50mL 튜브에 풀링합니다. 세포 분리 버퍼를 사용하여 각 튜브를 총 부피 50mL까지 보충합니다.
- 원심 분리
- 브레이크를 켠 상태에서 RT에서 5분 동안 400 x g 에서 튜브를 원심분리합니다.
- 재현탁액(Resuspension) 및 세포 계수(cell counting)
- 상등액을 버리고 호중구 펠릿을 1mL의 세포 분리 완충액에 재현탁합니다. 세포 계수를 수행하여 총 호중구 수를 확인합니다.
- 밀도 구배 배지 준비
- 브레이크를 켠 상태에서 RT에서 5분 동안 400 x g 에서 튜브를 다시 원심분리합니다. 상등액을 버리고 호중구 펠릿을 55% 밀도 구배 배지 3mL에 재현탁합니다. 최적의 해상도를 위해 총 호중구 5-6 × 106 개당 3mL의 55% 밀도 구배 매체를 사용합니다.
- 필요한 경우, 재현탁 세포를 미리 만들어진 여러 개의 밀도 구배 튜브에 걸쳐 나누어 3mL의 세포 현탁액이 각 튜브에 층을 이루도록 합니다.
- 밀도 gradient 튜브에 레이어링
- 55% 밀도 구배 배지가 포함된 3mL 세포 현탁액을 사전 제작된 밀도 구배 튜브(섹션 1에 설명된 대로 준비)에 천천히 층을 이룹니다. 그라데이션을 방해하지 않도록 조심스럽게 레이어링하십시오.
- 밀도 구배 원심분리
- 브레이크를 사용하지 않고 720 x g 에서 30분 동안 튜브를 원심분리합니다. 원심분리 후 층을 방해하지 않도록 튜브를 조심스럽게 다루십시오.
- 호중구 분획의 분리
- 원심분리 후 호중구가 두 개의 별개의 층으로 분리되는 것을 관찰하십시오.
저밀도 호중구(LDN)는 55%/70% 계면에 위치하여 약 3mL 표시에서 상위 대역을 형성하고, 보통 밀도 호중구(NDN)는 70%/81% 계면에 위치하여 6mL 표시 부근에서 더 낮은 띠로 나타납니다. - 전사 피펫을 사용하여 각 층을 조심스럽게 분리하고 별도의 15mL 튜브로 옮깁니다.
- 원심분리 후 호중구가 두 개의 별개의 층으로 분리되는 것을 관찰하십시오.
- 분리된 분획의 세척
- 잔류 밀도 구배 매체를 씻어내려면 각 15mL 튜브에 15mL 표시까지 1x PBS를 추가합니다.
- 브레이크를 켠 상태에서 400 × g 에서 RT에서 5분 동안 원심분리기. 세포가 단단한 펠릿을 형성하지 않고 대신 부유 상태로 유지되는 경우 이 세척 단계를 반복하여 남아 있는 밀도 구배 매체의 존재를 나타냅니다.
- 세포 계수 및 다운스트림 응용 분야
- 각 분획의 세포를 계수하고 필요에 따라 대사 실험, 유세포 분석 염색, RNA 추출 또는 단백질 용해와 같은 다운스트림 응용 프로그램을 진행합니다.
참고: 셀을 도금한 후 210×g 에서 1분 동안(브레이크 꺼짐) 플레이트를 회전시키는 것이 좋습니다.
- 각 분획의 세포를 계수하고 필요에 따라 대사 실험, 유세포 분석 염색, RNA 추출 또는 단백질 용해와 같은 다운스트림 응용 프로그램을 진행합니다.
4. 고립된 LDN 및 NDN의 표현형 분석
- ~0.5-1 × 106 LDN 및 NDN을 분리합니다. CD14, CD86, CD15, CD16, CD10, Fc block 및 viability stain을 사용하여 2x 농축 항체 마스터믹스를 만듭니다.
- 세포를 염색하는 항체의 최종 희석이 각각 1:100(CD14, CD86, CD15, CD16, CD10, Fc 블록) 및 1:50(생존도 염색)이 되도록 분리된 LDN 및 NDN 집단을 동일한 부피의 항체 마스터믹스로 염색합니다.
- RT에서 어둠 속에서 10분 동안 세포를 배양합니다.
참고: 세포가 항체 마스터믹스 및 Fc 블록과 완전히 혼합되었는지 확인합니다. - PBS로 세포를 한 번 세척한 다음 400×g에서 5 분 동안 원 심분리합니다. 상등액을 버리십시오.
- 어둠 속에서 RT에서 15분 동안 1% 파라포름알데히드(PFA)에 세포를 고정합니다.
- PBS로 세포를 다시 세척하고 400 ×g에서 5 분 동안 원심 분리 한 후 상층액을 버립니다.
- 200 μL의 PBS에 세포를 재현탁시키거나 필요에 따라 세포를 재현탁하고 가능한 한 빨리 유세포 분석기에서 세포를 획득합니다.
참고: 염색되고 고정된 세포는 형광단의 광표백을 방지하기 위해 어둠 속에서 4 °C에서 단기간 보관할 수 있습니다. 그러나 이상적으로는 최적의 세포 생존력과 정확한 결과를 보장하기 위해 염색 및 고정 후 표현형 분석 절차를 즉시 수행해야 합니다.
결과
밀도 구배 매질에 걸친 총 호중구의 성공적인 층화는 그림 1B에서 관찰할 수 있습니다. 두 개의 별개의 밴드를 얻어야 합니다. 구배의 혼합이 발생하거나 튜브당 층을 이룬 총 호중구의 수가 많으면(대략 5-6 × 106 이상) 띠가 분산되어 보이며(그림 1C), 두 호중구 아형이 혼합될 위험이 크게 증가합니다. 후자를 피하려면 밀도 구배 튜브당 총 호중구를 최대 5-6개 ×10-6 개까지 층을 이루는 것이 좋습니다. 건강한 개인에서 LDN의 수가 매우 낮아 다운스트림 연구에서 달성할 수 없다는 보고에도 불구하고, 이 방법은 LDN(평균 3.28 × 106 cells/mL)과 NDN(평균 10.64 ×10 6 cells/mL) 모두의 우수한 수율과 건강한 참가자의 순도를 보여줍니다(그림 2).
LDN의 평균 분리 순도는 93.80%(± 5.80)였고, NDN의 경우 96.30%(± 3.30; 그림 2A) 분리 절차 후 다른 세포 유형의 오염을 최소화합니다(그림 2B). 핵의 DAPI 염색은 핵 형태학을 통해 LDN/NDN의 존재를 확인했으며 분리 후 NDN에서 독특한 다엽 핵을 보여주었습니다(그림 2C). 분리 후 절대 계수는 LDN보다 NDN이 더 많은 일반적인 경향을 보였으며, 평균 수율은 각각 10.64 × 106 cells/mL 및 3.28 × 106 cells/mL였습니다(그림 2D). 유세포 분석을 사용하여 LDN과 NDN을 모두 CD14lo CD86- CD15+ SSChi cells13으로 정의했습니다(그림 2E). CD14는 일반적인 골수성 마커이고, CD15는 호중구 식별 마커이며, CD10 및 CD16은 일반적으로 성숙 및 활성화를 나타내는 호중구 마커입니다13. CD16 및 CD10 양성 집단과 음성 집단을 구별하기 위해 FMO(Fluorescence-minus-one control)를 사용했습니다. 건강한 개인에서 NDN(CD16hiCD10+)뿐만 아니라 성숙한 LDN의 대체로 단일한 집단이 관찰되었는데, 이는 건강한 개인이 순환하는 미성숙 호중구(CD16lo/intCD10+)의 비율이 높지 않기 때문에 문헌13의 보고와 일치합니다(그림 2F,G). 평균적으로 CD16hiCD10+ LDN의 빈도는 93.33%(± 5.29), CD16hiCD10+ NDN은 98.03%(± 1.40), CD16lo/intCD10+는 0.49%(± 0.38), CD16lo/intCD10+는 0.17%(± 0.06; 그림 2F,G). CD16+CD10+ 집단을 서로 겹쳐 놓았을 때, 겹침 정도는 NDN과 비교하여 LDN에서 이러한 마커의 발현에 눈에 띄는 차이가 없음을 나타냈습니다(그림 2H). 세포는 유세포 분석기를 사용하여 획득했으며 모든 데이터 분석은 유세포 분석에 적합한 소프트웨어를 사용하여 수행되었습니다.
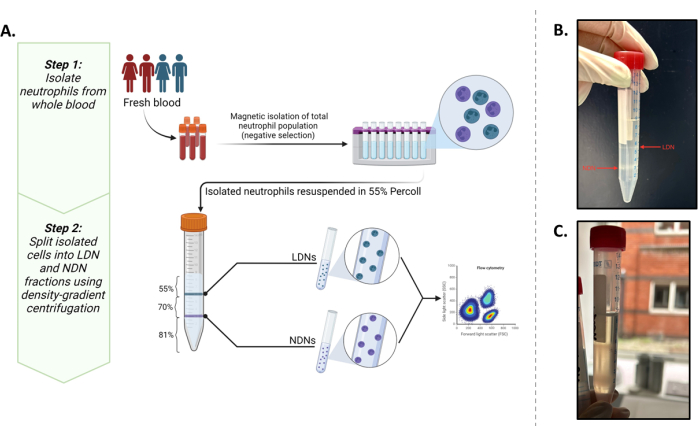
그림 1: 프로토콜 개요. (A) 전혈에서 LDN과 NDN의 2단계 분리 프로토콜. 첫 번째 단계는 음성 선택을 사용하여 전혈에서 분리된 총 호중구로 구성됩니다. 두 번째 단계는 55% 아이소톤 작업 용액에 총 호중구를 재현탁하고 81% 및 70% 구배 위에 층을 이루는 것입니다. 원심분리 후 LDN은 55% 및 70% 레이어의 계면에 있고 NDN은 81% 및 70% 레이어의 계면에 있습니다. (B) 그래디언트 중간 원심분리 후 이상적으로 분리된 LDN과 NDN의 시각적 표현. (C) 밴드의 확산 특성에서 볼 수 있듯이 LDN과 NDN의 차선의 분리. 이 경우 NDN이 LDN 분획을 오염시키거나 그 반대의 경우가 될 가능성이 높습니다. BioRender에서 만든 그래픽. 예네마디, A. (2025) https://BioRender.com/t03m122. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
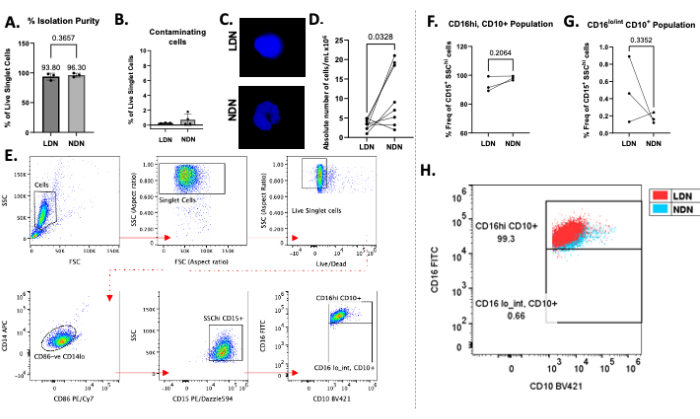
그림 2: 프로토콜의 대표적인 결과. (A) 전혈에서 LDN 및 NDN의 분리 순도 비율. (B) 분리 후 오염된 세포(B 세포, T 세포 및 단핵구)의 비율. (C) NDN에서 다엽 핵을 보여주고 LDN에서 단엽 핵을 보여주는 분리 후 LDN 및 NDN의 DAPI 염색.(D) 전혈에서 분리된 LDN 및 일치하는 NDN의 절대 수. (E) LDN 및 NDN을 정의하고, 순도를 결정하고, 빈도를 계산하는 데 사용되는 게이팅 전략. 파편, 이중선 및 죽은 세포를 분석에서 제거하고(맨 윗줄), CD86-CD14lo, CD15+ SSChi 세포를 게이트하여 호중구를 정의했습니다. (여,지) CD16 및 CD10 발현은 형광 마이너스 1 대조군의 사용과 함께 하위 집단을 정의하는 데 사용되었습니다. 고립된 성숙(CD16,hi, CD10+) 및 미성숙(CD16,lo/int, CD10+), LDN 및 NDN 하위 모집단의 빈도, 총 LDN 및 NDN(CD15+SSChi 세포로 정의됨)의 백분율로 보고됨. (H) 건강한 개인에서 CD16+ CD10+ NDN에 중첩된 CD16+ CD10+ LDN을 보여주는 점도표. 평균 ± SD, 쌍체 t-검정, n = 3-8. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 전체 호중구 집단을 저밀도 호중구와 정상 밀도 호중구로 분할하는 최적화된 방법과 이전 방법5에서 채택된 유세포 분석을 사용하여 각 세포 유형의 표현형 특성화를 제시합니다.
이 프로토콜은 전혈에서 LDN과 NDN을 분리하는 것을 기반으로 합니다. 중요한 단계는 음성 선택 방법을 통해 전체 호중구를 분리하는 것입니다. 양성 선택 방법은 표면 마커에 결합하는 항체를 사용하여 잠재적으로 호중구를 활성화하고 탈과립화를 유발하는 것입니다5. 이러한 활성화는 호중구의 기능 및 대사 상태를 변경하여 부정확한 결과를 초래하고 실험 결과의 해석을 왜곡하여 다운스트림 실험을 방해할 수 있습니다. 그러므로, negative selection은 활성화나 기능적 변화를 유도하지 않고 호중구의 분리를 보장합니다. 또한 음성 분리 기반 자기 분리를 사용하면 적혈구(RBC) 용해가 필요하지 않습니다. 이는 추가 세척 단계와 세포 사멸을 줄여 수율을 보존할 뿐만 아니라 적혈구 오염을 최소화하여 분리된 호중구의 순도를 높입니다. 원래 프로토콜과 비교하여, PBS 대신 세척 및 재부유를 포함한 전체 공정에 걸쳐 세포 분리 완충액이 사용되었습니다. 여기에는 세포 응집을 줄이고 자기 분리 중 비특이적 결합을 최소화하는 첨가제가 포함되어 있습니다. 세포 분리 완충액을 지속적으로 사용함으로써 PBS를 사용하는 것에 비해 세포 분리 효율이 향상되고 순도가 높아지며 건드리지 않은 생존 호중구의 수율이 더 높았습니다. 그 결과 다운스트림 분석의 정밀도가 향상되었습니다. 또한, 밀도 구배는 두 세포 유형 간의 분해능을 개선하기 위해 단일 튜브가 아닌 여러 튜브에 걸쳐 수행되었습니다.
두 호중구 아형의 성공적인 분리는 당연히 각 구배(gradient) 15의 정확한 공식화와 정확한 층화에 크게 좌우됩니다. 마찬가지로 중요한 것은 81% 위에 70%가 겹겹이 쌓이는 것뿐만 아니라 70% 층에 걸쳐 호중구 현탁액(55%)이 겹쳐지는 것입니다. 이 방법을 연습하는 것이 좋습니다. 15mL 튜브를 생물 안전 캐비닛 바닥과 거의 평행하게 겹쳐 배치하고 배치할 때 전사 피펫을 사용하는 것이 가장 좋습니다. 기울기를 약간이라도 혼합하면 불분명하고 확산된 띠가 발생하여 불분명한 개체군이 렌더링될 수 있습니다. 파스퇴르 피펫을 사용하여 호중구 띠만 천천히 제거하도록 주의해야 하며, 위와 아래의 층은 독성으로 인해 가능하면 흡인되어서는 안 됩니다. 세포에 대한 부작용을 피하기 위해 호중구 분획의 오염을 등장성 작용 용액으로 최소화하는 것이 중요합니다15. 마지막으로, 세포 수가 높을수록 LDN 및 NDN 대역의 밀도가 전반적으로 높아져 세포 집단의 해상도가 떨어질 수 있습니다. 따라서 55% 용액에서 재현탁액을 재부유하기 전에 총 호중구 수를 수행하는 것이 좋습니다. 이는 호중구 분리를 위해 >12mL 전혈을 사용하거나 총 호중구 수가 5-6 × 106을 초과하는 경우 특히 중요합니다.
이 방법의 대안은 자기 분리에 의존하지 않고 본질적으로 단일 단계 프로토콜인 dextran/Percoll 조합으로 구성됩니다16. 적혈구를 제거하기 위한 덱스트란 침전의 사용은 직접 적혈구 용해 또는 밀도 구배와 같은 다른 방법만큼 효율적이거나 일관성이 없을 수 있습니다. 덱스트란 침강은 상층액에 잔류 적혈구를 남길 수 있으며, 이는 호중구 개체군의 순도에 영향을 미칠 수 있습니다. 음성 선택 단계가 없으면 호중구가 잔류 항체 또는 기타 자극에 의해 활성화될 수 있으며, 이는 다운스트림 분석에서 호중구의 거동에 영향을 미칠 수 있습니다. 밀도 구배 배지에서 PBMC 및 호중구층을 수동으로 제거하면 특히 분리가 깨끗하지 않은 경우 세포 집단 간에 오염이 발생할 수 있습니다.
이 연구는 분리된 LDN 및 NDN의 순도를 측정하고 이러한 세포의 최소 특성화를 수행하기 위해 비교적 단순한 유세포 분석 패널을 제시합니다. 여기에 사용된 마커는 호중구 연구와 관련된 여러 복잡한 유세포 분석 패널의 일부로 문헌에 널리 보고되어 있습니다. 우리는 분리 순도, 살아있는 세포와 죽은 세포의 빈도 퍼센트를 결정하고 호중구 성숙 상태(CD10 및 CD16 발현 기반)를 조사하기 위해 패널을 압축하기로 결정했습니다. 그러나 다양한 최종 사용자의 연구 요구에 맞게 확장할 수 있습니다. 이 프로토콜은 유세포 분석 패널에서 이러한 하위 집단을 함께 구별하는 것이 상대적인 불명확성으로 인해 어려운 것으로 입증되었기 때문에 개별 평가를 위해 LDN과 NDN을 분리하도록 특별히 설계되었습니다(그림 2H). 이전보고서와 일관되게 5, 건강한 개인의 LDN과 NDN은 동시에 분석할 때 안정적으로 구별할 수 없는 것으로 나타났습니다. 따라서 사전에 이들을 분리하면 각 하위 모집단을 보다 정확하고 세부적으로 특성화할 수 있습니다.
이 프로토콜의 최적화 단계에서 최종 사용자는 유세포 분석 패널에 CD3 및 CD19와 같은 기본 림프구 마커를 포함하도록 선택할 수 있습니다. 이는 문제 해결에 도움이 될 수 있는데, 차선의 자기 분리로 인해 전체 호중구 분리체에 림프구가 포함될 수 있으며, 이는 유사한 세포 밀도로 인해 LDN 분획으로 이어질 수 있기 때문입니다. 최적화를 위해 사용자는 분리된 분획의 오염 물질을 더 잘 해결하기 위해 CD45를 추가하도록 선택할 수 있습니다(예: CD45-ve는 적혈구일 수 있고 CD45+ve는 PBMC 오염을 나타낼 수 있음). 호중구 하위 모집단은 표면 마커 발현을 기반으로 정의되었으며, 이는 동적 특성이며 공여체 간에 높은 수준의 변동성을 나타낼 수 있습니다. 따라서 우수한 유세포 분석 관행에 따라 FMO 대조군을 사용하는 것도 권장되며, 이는 기증자 간 변동성을 줄이고 더 명확한 하위 집단을 정의하는 데 도움이 될 수 있습니다.
우리는 또한 이 프로토콜이 이 키트와 함께 처리되지 않은 전혈만 사용해야 하며 >24시간이 지난 샘플에서는 원하는 격리 세포의 회수가 감소한다고 명시한 자기 격리 키트의 지침에 따라 신선한 전혈에만 최적화되었음을 인정합니다. 이것은 호중구를 분리할 수 있는 시작 물질(예: 기관지폐포 세척액(BALF), 흉막액, 복수 등과 같은 옵션을 제거합니다. Connelly 등은 호중구17 처리의 지연이, 심지어 새로 채취한 전혈로부터조차도, 이들의 표현형과 표면 발현을 변화시킬 수 있음을 보여주었다. 이에 따라 채혈 시점부터 가능한 한 지체하지 않고 처리를 시작하는 것이 좋습니다. 따라서 이 프로토콜은 dextran/Percoll과 같은 단일 단계 프로토콜에 비해 신선한 전혈에 이상적이지만 중간 정지 지점을 제공하지 않는 상대적으로 길고 시간이 많이 걸리는 방법일 수 있습니다. 이는 하루 중 늦은 시간에 샘플을 받을 수 있는 임상 연구의 경우 한계가 있습니다. 또한 이 방법은 LDN 및 NDN 하위 집합의 정렬을 허용하지 않는데, 이는 하위 집합을 정렬하는 방법(유세포 분석 또는 기타 방법으로)이 의도하지 않게 호중구를 활성화할 위험이 있기 때문입니다.
호중구 하위 집단은 전신성 홍반성 루푸스(SLE)18,19, 암20 및 COVID-1921와 같은 조건에서 상당한 관심을 받았습니다. 특히 염증성 질환 및 자가면역 질환과 관련하여 이러한 세포 유형에 대한 관심이 높아짐에 따라 각 집단을 정확하게 평가하고 발병에 대한 개별 기여도를 더 잘 이해할 수 있는 신뢰할 수 있는 방법의 필요성이 강조되고 있습니다.
공개
저자는 공개하지 않습니다.
감사의 말
이 작업은 Health Research Board EIA-2024-002와 Royal City of Dublin Hospital Trust의 지원을 받았습니다. 이 원고를 위해 건강한 기증자로부터 샘플을 수집하는 데 도움을 주신 Lorraine Thong 박사와 Kevin Brown 박사에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
참고문헌
- Tracchi, I., et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I., et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E., et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963(2021).
- Hacbarth, E., Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R., et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922(2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A., et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696(2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M., et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B., Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520(2021).
- Park, J., et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282(2023).
- Denny, M. F., et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A., et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603(2019).
- Mosca, T., Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y., et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N., et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667(2022).
- Carmona-Rivera, C., Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y., et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154(2023).
- Dwivedi, A., et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659(2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유