Method Article
Die Isolierung und Charakterisierung von Neutrophilen niedriger und normaler Dichte aus Vollblut
In diesem Artikel
Zusammenfassung
Hier bieten wir einen zuverlässigen Ansatz für die Isolierung von Neutrophilen niedriger und normaler Dichte aus Vollblut mittels magnetischer Isolierung (negative Selektion) und diskontinuierlichem Dichtegradientenmedium. Es gewährleistet die unberührte Isolierung hochreiner Zellen (≥93%) und ermöglicht eine genaue nachgelagerte Analyse von Neutrophilen-Subpopulationen, die für das Verständnis ihrer Rolle bei Gesundheit und Krankheit entscheidend ist.
Zusammenfassung
Neue Forschungsergebnisse zeigen, dass die zirkulierende neutrophile Population beim Menschen aus verschiedenen Subtypen besteht und nicht als eine einzige Population untersucht werden sollte, wie dies in der Vergangenheit der Fall war. Insbesondere wurde gezeigt, dass Neutrophile mit niedriger und normaler Dichte (LDNs, NDNs) funktionell und metabolisch unterschiedliche Profile aufweisen, ein Faktor, der bei der Veröffentlichung von Neutrophilenforschung berücksichtigt werden muss. In dieser Arbeit stellen wir eine modifizierte Methode zur unberührten Isolierung und Trennung von LDNs und NDNs aus Vollblut vor.
Das Dichtegradientenmedium (1,135 g/mL) wird bei 9:10 mit 10x PBS kombiniert. Spezifische Dichtegradienten von 55%, 70% und 81% werden anschließend durch die Kombination des 100%igen Dichtegradientenmediums mit 1x phosphatgepufferter Kochsalzlösung (PBS) hergestellt. Neutrophile, die aus 12 ml peripherem Vollblut isoliert wurden, das von eingewilligten Spendern unter Verwendung eines auf negativer Selektion basierenden magnetischen Isolationskits gewonnen wurde, werden in der 55%-Fraktion resuspendiert. Ein Volumen von 3 mL der 81%- und 70%-Fraktion wird in ein 15-ml-Röhrchen geschichtet, gefolgt von der 55%-Fraktion mit der Gesamtanzahl der Neutrophilen. Die Dichtegradienten werden dann bei 720 x g für 30 min zentrifugiert. An der 55%/70%-Schnittstelle (LDNs) und der 70%/81%-Schnittstelle (NDNs) werden zwei unterschiedliche Banden erhalten. Die Zellen werden vorsichtig in separate Röhrchen pipettiert und mit PBS gewaschen. Die Reinheit der isolierten Fraktionen wird mittels Durchflusszytometrie bestimmt. Sowohl LDNs als auch NDNs wurden mittels Durchflusszytometrie als CD14lo CD15+ SSChi definiert. Die Isolationsreinheit wurde für beide Typen mit ≥93 % lebensfähiger Zellen berechnet.
Diese Methode bietet einen zuverlässigen und effizienten Ansatz zur Trennung von LDN und NDNs aus dem peripheren Blut und gewährleistet eine hohe Reinheit und Lebensfähigkeit der isolierten Zellen. Die Verbesserung der Präzision der Neutrophilenisolierung ermöglicht genauere nachgelagerte Analysen dieser unterschiedlichen Neutrophilen-Subpopulationen. Diese sind entscheidend für unser Verständnis der Heterogenität von Neutrophilen und ihrer Auswirkungen in verschiedenen physiologischen und pathologischen Kontexten.
Einleitung
Neutrophile sind granuläre Immunzellen und die am häufigsten vorkommenden Leukozyten im peripheren Blut und machen im Durchschnitt etwa 50 % bis 70 % der Leukozyten aus. Sie entwickeln sich im Knochenmark aus Granulozyten-Monozyten-Vorläufern (GMPs), die sich wiederum aus hämatopoetischen Vorläuferzellen (HPCs) in Gegenwart des Granulozyten-Kolonie-stimulierenden Faktors (G-CSF) entwickeln. Bei der Homöostase haben sie eine Lebensdauer von ~24 Stunden, aber Studien haben gezeigt, dass ihre Lebensdauer unter bestimmten physiologischen Bedingungen und den damit verbundenen Mikroumgebungen wie chronischer Immunaktivierung1, Entzündung1 und sogar Gewebeaufenthalt im Steady State2 verlängert werden kann. Neutrophile gelten seit langem als die erste Verteidigungslinie gegen Krankheitserreger und lösen ihre antimikrobielle Wirkung durch 3 Haupteffektorfunktionen aus - Degranulation, Phagozytose und Aktivierung und Freisetzung der extrazellulären Falle (NET) (NETosis) für Neutrophile.
Die meisten Studien zur Funktion und Biologie von Neutrophilen untersuchen die Ergebnisse für die gesamte Neutrophilenpopulation. Von Studien in Krebsumgebungen, in denen die Subtypen N1 (Antitumor)/ N2 (Pro-Tumor) abgegrenzt wurden, bis hin zur Klassifizierung von Neutrophilen auf der Grundlage von Reife, Krankheit und physiologischem Zustand und sogar der Zelldichte (Neutrophile mit niedriger Dichte und normaler Dichte) wurde jedoch zunehmend deutlich, dass die menschliche Neutrophilenpopulation phänotypisch vielfältige Subtypen umfasst. Unabhängig davon, ob die Existenz dieser neutrophilen Subtypen auf völlig unterschiedliche Zelltypen oder auf die komplexe Natur der Plastizität zurückzuführen ist, gibt es eine wachsende Menge an Literatur über atypische Neutrophile und bietet eine überzeugende Möglichkeit, Neutrophile mit niedriger Dichte getrennt von Neutrophilen mit normaler Dichte zu untersuchen3.
LDNs, die zum ersten Mal bei SLE-Patienten als proinflammatorische Neutrophilen-Untergruppe4 beschrieben wurden, wurden seitdem bei chronischen Krankheiten, in der Schwangerschaft und sogar in einem gesunden Kreislauf sowohl in proinflammatorischen als auch in suppressiven Funktionen identifiziert 5,6,7,8. LDNs werden gleichzeitig mit mononukleären Zellen des peripheren Blutes (PBMCs) gefunden, wenn Vollblut über Dichtegradientenmedien zentrifugiert wird. Ihre spezifische Dichte entspricht etwa 1,077 g/ml, verglichen mit NDNs bei 1,083 g/mL9. Obwohl es immer noch erhebliche Debatten zu diesem Thema gibt, gibt es Spekulationen, dass LDNs einem unreiferen Granulozyten-Phänotyp ähneln (ähnlich wie Promyelozyten und Myelozyten, mit einer Dichte unter 1.080 g/ml)9,10. Andere spekulieren immer noch, dass es sowohl reife als auch unreife LDN-Phänotypen gibt, abhängig vom Vorhandensein oder Nichtvorhandensein der Krankheit 11,12,13. Nichtsdestotrotz wurden LDNs auch bei gesunden Personen nachgewiesen; Ihre Einbeziehung in einige Studien ist jedoch aufgrund der Schwierigkeit, sie in ausreichender Zahl zu isolieren, begrenzt5.
Ziel dieser Studie war es, diese beiden Populationen in Mengen zu isolieren, die es uns ermöglichen würden, nachgelagerte In-situ-Stoffwechselexperimente durchzuführen (mindestens 0,5 × 106 Zellen/ml). Dabei wurde ein bestehendes Protokoll5 mit häufig berichteten phänotypischen Markern13,14 optimiert, die das beste Ergebnis für die Isolierung und Charakterisierung von LDNs und NDNs aus Vollblut liefern (Abbildung 1A).
Protokoll
Blutproben wurden mit Einverständniserklärung von gesunden Teilnehmern entnommen. Die Studie wurde von der Forschungsethikkommission des St. James's Hospital und des Tallaght University Hospital genehmigt.
1. Aufbereitung des Dichtegradientenmediums, der isotonischen Arbeitslösungsfraktionen und des Zelltrennpuffers
- Herstellung isotonischer Arbeitslösungen aus Dichtegradientenmedium
- Herstellung von isotonischer 100%iger Arbeitslösung (~1,123 g/ml)
- Um die isotonische 100%ige Arbeitslösung herzustellen, kombinieren Sie 27 mL Dichtegradientenmedium mit 3 mL 10x PBS. Daraus ergibt sich eine isotonische Lösung, die für weitere Verdünnungen geeignet ist.
- Herstellung einer isotonischen 81%igen Arbeitslösung (~1,0996 g/ml)
- Bereiten Sie die isotonische 81%ige Arbeitslösung vor, indem Sie 8,1 ml der isotonischen 100%igen Arbeitslösung (hergestellt in Schritt 1.1.1) mit 1,9 ml 1x PBS mischen. Gründlich mischen, um die Homogenität zu gewährleisten.
- Herstellung einer isotonischen 70%igen Arbeitslösung (~1,0861 g/ml)
- Um die isotonische 70%ige Arbeitslösung herzustellen, kombinieren Sie 7 mL der isotonischen 100%igen Arbeitslösung mit 3 mL 1x PBS. Stellen Sie sicher, dass die Lösung gut vermischt ist.
- Herstellung einer isotonischen 55%igen Arbeitslösung (1,0676 g/ml)
- Stellen Sie die isotonische 55%ige Arbeitslösung her, indem Sie 5,5 ml der isotonischen 100%igen Arbeitslösung mit 4,5 ml 1x PBS mischen. Gründlich mischen.
- Herstellung von isotonischer 100%iger Arbeitslösung (~1,123 g/ml)
- Schichtung von Gradientenfraktionen
- Schichtung von Gradientenfraktionen
- Mit einem konischen 15-ml-Röhrchen vorsichtig 3 mL der isotonischen 81%igen Arbeitslösung auf den Boden schichten. Schichten Sie dann langsam und vorsichtig 3 mL der isotonischen 70%igen Arbeitslösung darauf, wobei Sie ein Mischen der Schichten vermeiden sollten. Dieser Gradient wird für die Zelltrennung verwendet.
- Schichtung von Gradientenfraktionen
- Vorbereitung des Zelltrennpuffers
- Vorbereitung von 500 mL Zelltrennpuffer
- Zur Herstellung des Zelltrennungspuffers kombinieren Sie 2 % fötales Rinderserum (FBS) und 1 mM Ethylendiamintetraessigsäure (EDTA) mit 1x PBS zu einem Gesamtvolumen von 500 ml. Verwenden Sie diesen Puffer, um Zellen während des Isolierungsprozesses zu waschen und wieder zu suspendieren.
HINWEIS: Stellen Sie sicher, dass die Schichten gut voneinander entfernt und ungestört sind. In diesem Protokoll werden die isotonischen Arbeitslösungen als "100 %", "81 %", "70 %" und "55 %" bezeichnet, basierend auf der Zubereitungsmethode, die mit früheren Studien übereinstimmt5. Es ist jedoch wichtig klarzustellen, dass diese Etiketten nicht die tatsächlichen Endkonzentrationen der Arbeitslösungen darstellen. Zum Beispiel wird das "100%"-Dichtegradientenmedium hergestellt, indem 27 mL reines Dichtegradientenmedium mit 3 mL 10x PBS gemischt werden, was zu einer Endkonzentration von 90% isotonischer Arbeitslösung führt. Die nachfolgenden Verdünnungen (z. B. "81 %", "70 %" und "55 %") spiegeln in ähnlicher Weise die Präparationsverhältnisse und nicht die tatsächlichen prozentualen Konzentrationen wider. Diese Nomenklatur wurde beibehalten, um die Konsistenz mit der Terminologie zu wahren, die in der früheren Literatur zu diesem Thema verwendet wurde.
- Zur Herstellung des Zelltrennungspuffers kombinieren Sie 2 % fötales Rinderserum (FBS) und 1 mM Ethylendiamintetraessigsäure (EDTA) mit 1x PBS zu einem Gesamtvolumen von 500 ml. Verwenden Sie diesen Puffer, um Zellen während des Isolierungsprozesses zu waschen und wieder zu suspendieren.
- Vorbereitung von 500 mL Zelltrennpuffer
2. Isolierung von Neutrophilen aus Vollblut mittels Negativselektion
- Aufbereitung von magnetischen Kügelchen
- Wirbeln Sie die magnetischen Kügelchen 30 s lang gründlich ein, um sicherzustellen, dass sie vor der Verwendung vollständig resuspendiert sind.
- Blutaufbereitung
- Für jeden Spender aliquotieren Sie 4 ml Vollblut in drei separate 14-ml-Röhrchen mit rundem Boden.
- Zugabe von Neutrophilen-Isolationscocktail und magnetischen Kügelchen
- Geben Sie 50 μl Neutrophilen-Isolationscocktail und 50 μl magnetische Kügelchen pro ml Blut in jedes Röhrchen. Für 4 ml Blut fügen Sie 200 μl jedes Reagenzes hinzu.
- Resuspendieren Sie die Mischung gut, indem Sie sie vorsichtig pipettieren und 5 Minuten lang bei Raumtemperatur (RT) inkubieren, damit die Reagenzien an unerwünschte Zellen binden können.
- Waschen und magnetische Abscheidung - erste Runde
- Füllen Sie jedes Röhrchen mit Zelltrennpuffer auf 12 ml auf und mischen Sie es gründlich.
- Legen Sie die Röhrchen ohne Deckel auf einen Magneten und lassen Sie sie 10 Minuten lang bei RT inkubieren, damit die magnetischen Kügelchen, die an unerwünschte Zellen gebunden sind, an die Röhrchenwand gezogen werden können.
- Sammlung ungebundener Zellen
- Die Klarzellsuspension, die Neutrophile aus jedem Röhrchen enthält, wird mit einer Transferpipette vorsichtig in ein neues, sauberes Röhrchen überführt. Entfernen Sie das Originalrohr vom Magneten.
- Wiederaufbringen und Inkubieren von magnetischen Beads - zweite Runde
- Vortex die magnetischen Kügelchen erneut für 30 s. Geben Sie das gleiche Volumen an magnetischen Kügelchen in die neu übertragene Zellsuspension wie in Schritt 2.3. Gründlich resuspendieren und weitere 5 Minuten bei RT inkubieren.
- Abschließende magnetische Trennung und Sammlung
- Setzen Sie die Röhrchen ohne Deckel wieder auf den Magneten und inkubieren Sie weitere 10 Minuten bei RT.
- Übertragen Sie die Klarzellensuspension vorsichtig in ein neues Röhrchen. Diese letzte Suspension stellt die isolierte Gesamtpopulation der Neutrophilen dar.
3. Trennung von Neutrophilen niedriger Dichte (LDNs) und Neutrophilen normaler Dichte (NDNs) von der Gesamtpopulation von Neutrophilen
- Pooling und Aufbereitung von Zellsuspensionen
- Für jeden Spender werden die isolierten neutrophilen Suspensionen in 50-ml-Röhrchen zusammengefasst. Füllen Sie jedes Röhrchen mit dem Zelltrennpuffer auf ein Gesamtvolumen von 50 mL auf.
- Zentrifugation
- Die Röhrchen bei 400 x g für 5 min bei RT mit angezogener Bremse zentrifugieren.
- Resuspension und Zellzählung
- Den Überstand verwerfen und das neutrophile Pellet in 1 ml Zelltrennungspuffer resuspendieren. Führen Sie eine Zellzählung durch, um die Gesamtzahl der Neutrophilen zu bestimmen.
- Dichtegradienten-Medium-Vorbereitung
- Die Röhrchen erneut bei 400 x g für 5 min bei RT mit angezogener Bremse zentrifugieren. Entsorgen Sie den Überstand und resuspendieren Sie das Neutrophilenpellet in 3 mL des Mediums mit einem Dichtegradienten von 55 %. Für eine optimale Auflösung verwenden Sie 3 ml 55% Dichtegradientenmedium pro 5-6 × 106 Neutrophilen insgesamt.
- Teilen Sie die resuspendierten Zellen bei Bedarf auf mehrere vorgefertigte Dichtegradientenröhrchen auf und stellen Sie sicher, dass 3 ml der Zellsuspension in jedes Röhrchen geschichtet werden.
- Schichtung auf Rohre mit Dichtegradient
- Schichten Sie die 3-ml-Zellsuspension mit dem 55%igen Dichtegradientenmedium langsam auf die vorgefertigten Dichtegradientenröhrchen (wie in Abschnitt 1 beschrieben vorbereitet). Achten Sie auf eine sorgfältige Schichtung, um den Farbverlauf nicht zu stören.
- Dichtegradienten-Zentrifugation
- Zentrifugieren Sie die Röhrchen bei 720 x g für 30 min, ohne die Bremse zu benutzen. Behandeln Sie die Röhrchen nach dem Zentrifugieren vorsichtig, um eine Störung der Schichten zu vermeiden.
- Isolierung von neutrophilen Fraktionen
- Beobachten Sie, wie sich die Neutrophilen nach der Zentrifugation in zwei verschiedene Schichten aufteilen:
Neutrophile mit niedriger Dichte (LDNs) befinden sich an der 55%/70%-Grenzfläche und bilden eine obere Bande bei etwa der 3-ml-Marke, und Neutrophile mit normaler Dichte (NDNs) befinden sich an der 70%/81%-Grenzfläche und erscheinen als untere Bande um die 6-ml-Marke. - Isolieren Sie jede Schicht vorsichtig mit einer Transferpipette und übertragen Sie sie in separate 15-ml-Röhrchen.
- Beobachten Sie, wie sich die Neutrophilen nach der Zentrifugation in zwei verschiedene Schichten aufteilen:
- Waschen von isolierten Fraktionen
- Um das restliche Dichtegradientenmedium abzuwaschen, geben Sie 1x PBS zu jedem 15-ml-Röhrchen bis zur 15-ml-Markierung.
- Bei 400 × g für 5 min bei RT mit angezogener Bremse zentrifugieren. Wenn die Zellen kein festes Pellet bilden und stattdessen suspendiert bleiben, wiederholen Sie diesen Waschschritt, um das Vorhandensein von verbleibendem Dichtegradientenmedium anzuzeigen.
- Zellzählung und Downstream-Anwendungen
- Zählen Sie die Zellen in jeder Fraktion und fahren Sie bei Bedarf mit nachgelagerten Anwendungen wie Stoffwechselexperimenten, Durchflusszytometrie-Färbung, RNA-Extraktion oder Proteinlyse fort.
HINWEIS: Nach dem Herausplattieren der Zellen wird empfohlen, die Platte 1 Minute lang bei 210 × g (Bremse aus) herunterzudrehen.
- Zählen Sie die Zellen in jeder Fraktion und fahren Sie bei Bedarf mit nachgelagerten Anwendungen wie Stoffwechselexperimenten, Durchflusszytometrie-Färbung, RNA-Extraktion oder Proteinlyse fort.
4. Phänotypisierung von isolierten LDN und NDN
- Isolieren Sie ~0,5-1 × 106 LDNs und NDNs. Stellen Sie einen 2x konzentrierten Antikörper-Mastermix mit CD14, CD86, CD15, CD16, CD10, Fc-Block und Viabilitätsfärbung her.
- Die isolierten LDN- und NDN-Populationen werden mit einem äquivalenten Volumen des Antikörper-Mastermixes gefärbt, so dass die endgültige Verdünnung der Antikörper, die die Zellen färben, 1:100 (CD14, CD86, CD15, CD16, CD10, Fc-Block) bzw. 1:50 (Viabilitätsfärbung) beträgt.
- Inkubieren Sie die Zellen 10 Minuten lang im Dunkeln bei RT.
HINWEIS: Stellen Sie sicher, dass die Zellen gründlich mit dem Antikörper-Mastermix und dem Fc-Block gemischt sind. - Waschen Sie die Zellen einmal mit PBS, zentrifugieren Sie sie dann bei 400 × g für 5 min. Entsorgen Sie den Überstand.
- Fixieren Sie die Zellen in 1% Paraformaldehyd (PFA) für 15 min bei RT im Dunkeln.
- Waschen Sie die Zellen erneut mit PBS, zentrifugieren Sie sie 5 Minuten lang bei 400 × g und entsorgen Sie den Überstand.
- Resuspendieren Sie die Zellen in 200 μl PBS oder nach Bedarf und entnehmen Sie die Zellen so schnell wie möglich auf einem Durchflusszytometer.
HINWEIS: Die gefärbten und fixierten Zellen können kurzfristig bei 4 °C im Dunkeln gelagert werden, um ein Photobleichen der Fluorophore zu verhindern. Im Idealfall sollte das Phänotypisierungsverfahren jedoch unmittelbar nach der Färbung und Fixierung durchgeführt werden, um eine optimale Zellviabilität und genaue Ergebnisse zu gewährleisten.
Ergebnisse
Die erfolgreiche Schichtung der Gesamtneutrophilen über das Dichtegradientenmedium ist in Abbildung 1B zu sehen. Es sollten zwei unterschiedliche Banden erhalten werden. Wenn es zu einer Vermischung der Gradienten kommt oder die Anzahl der insgesamt geschichteten Neutrophilen pro Röhrchen hoch ist (größer als etwa 5-6 × 106), sehen die Banden diffus aus (Abbildung 1C), und das Risiko, dass sich die beiden neutrophilen Subtypen vermischen, steigt signifikant an. Um Letzteres zu vermeiden, empfehlen wir eine Schichtung von bis zu 5-6 × 106 Neutrophilen insgesamt pro Dichtegradientenröhrchen. Trotz Berichten über LDNs, die bei gesunden Personen sehr niedrig sind, was sie für nachgelagerte Studien unerreichbar macht, zeigt diese Methode eine gute Ausbeute sowohl an LDNs (Mittelwert 3,28 × 106 Zellen/ml) als auch an NDNs (Mittelwert 10,64 × 106 Zellen/ml) und Reinheit von gesunden Teilnehmern (Abbildung 2).
Die durchschnittliche Isolationsreinheit für LDNs betrug 93,80 % (± 5,80) und für NDNs 96,30 % (± 3,30; Abbildung 2A) nach dem Isolierungsverfahren mit minimaler Kontamination anderer Zelltypen (Abbildung 2B). Die DAPI-Färbung von Zellkernen bestätigte das Vorhandensein von LDN/NDN durch die Kernmorphologie und zeigte nach der Isolierung ausgeprägte mehrlappige Kerne in NDNs (Abbildung 2C). Die absoluten Zählungen nach der Isolierung zeigten einen gemeinsamen Trend, dass mehr NDNs als LDNs vorhanden waren, mit mittleren Ausbeuten von 10,64 × 106 Zellen/ml bzw. 3,28 × 106 Zellen/ml (Abbildung 2D). Mittels Durchflusszytometrie wurden sowohl LDNs als auch NDNs als CD14lo CD86- CD15+ SSCHi-Zellen 13 definiert (Abbildung 2E). CD14 ist ein häufiger myeloischer Marker, CD15 ist ein Identifikationsmarker für Neutrophile und CD10 und CD16 werden häufig als neutrophile Marker für Reife und Aktivierung beschrieben13. Fluoreszenz-minus-eins-Kontrollen (FMOs) wurden verwendet, um CD16- und CD10-positive Populationen von negativen Populationen zu unterscheiden. Bei gesunden Personen wurde eine weitgehend singuläre Population von reifen LDNs sowie NDNs (CD16,hi, CD10+) beobachtet, was mit Berichten in der Literaturübereinstimmt 13, da bei gesunden Personen wahrscheinlich kein hoher Prozentsatz an unreifen Neutrophilen (CD16,lo/int, CD10+) im Umlauf ist (Abbildung 2F, G). Im Durchschnitt betrug die Häufigkeit von CD16hiCD10+ LDNs 93,33 % (± 5,29), CD16hiCD10+ NDNs betrug 98,03 % (± 1,40), CD16lo/intCD10+ betrug 0,49 % (± 0,38) und CD16lo/intCD10+ betrug 0,17 % (± 0,06; Abbildung 2F,G). Wenn CD16+CD10+-Populationen übereinander gelegt wurden, zeigte der Grad der Überlappung keine signifikanten Unterschiede in der Expression dieser Marker in LDNs im Vergleich zu NDNs (Abbildung 2H). Die Zellen wurden mit einem Durchflusszytometer entnommen und die gesamte Datenanalyse mit der entsprechenden Software für die Durchflusszytometrie durchgeführt.
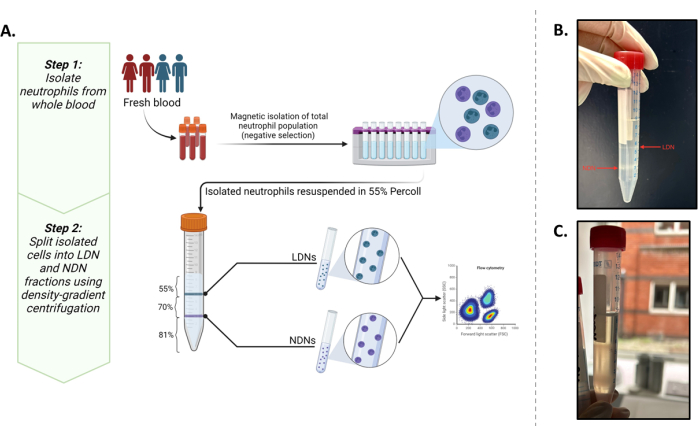
Abbildung 1: Überblick über das Protokoll. (A) Ein zweistufiges Isolationsprotokoll von LDNs und NDNs aus Vollblut. Der erste Schritt besteht aus der Gesamtzahl der Neutrophilen, die mittels negativer Selektion aus Vollblut isoliert werden. Der zweite Schritt besteht darin, die Gesamtzahl der Neutrophilen in einer 55%igen isotonischen Arbeitslösung zu resuspendieren und auf einem 81%igen und 70%igen Gradienten zu schichten. Nach der Zentrifugation befinden sich LDNs an der Grenzfläche der 55 %- und 70 %-Schichten und NDNs an der Grenzfläche der 81 %- und 70 %-Schichten. (B) Visuelle Darstellung von ideal getrennten LDNs und NDNs nach der Gradienten-Medium-Zentrifugation. (C) Suboptimale Trennung von LDNs und NDNs, gesehen durch die diffuse Natur der Banden. In diesem Fall besteht eine hohe Wahrscheinlichkeit, dass NDNs die LDN-Fraktion kontaminieren oder umgekehrt. Die Grafik wurde in BioRender erstellt. Yennemadi, A. (2025) https://BioRender.com/t03m122. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
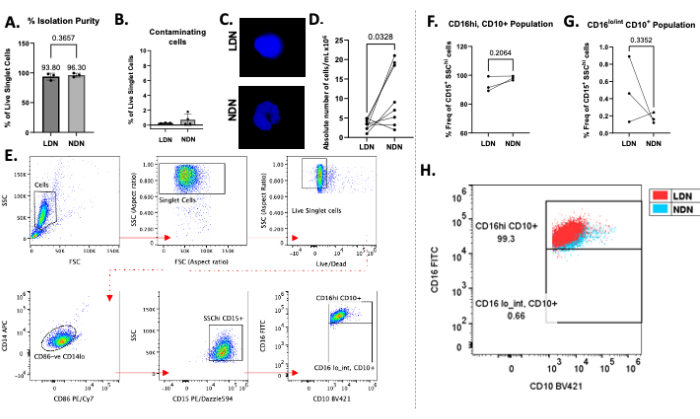
Abbildung 2: Repräsentative Ergebnisse des Protokolls. (A) Prozentuale Isolationsreinheit von LDNs und NDNs aus Vollblut. (B) Prozentsatz der kontaminierenden Zellen (B-Zellen, T-Zellen und Monozyten) nach der Isolierung. (C) DAPI-Färbung von LDNs und NDNs nach der Isolierung mit mehrlappigen Kernen in NDNs und einlappigen Kernen in LDNs. (D) Absolute Anzahl von LDNs und passenden NDNs, die aus Vollblut isoliert wurden. (E) Gating-Strategie zur Definition von LDNs und NDNs, zur Bestimmung ihrer Reinheit und zur Berechnung ihrer Häufigkeit. Trümmer, Dubletten und tote Zellen wurden aus der Analyse eliminiert (obere Reihe), und CD86-CD14lo, CD15+ SSChi-Zellen wurden untersucht, um Neutrophile zu definieren. (F,G) Die CD16- und CD10-Expression wurde verwendet, um Subpopulationen in Verbindung mit der Verwendung von Fluoreszenz-Minus-Eins-Kontrollen zu definieren. Häufigkeit isolierter reifer (CD16hi, CD10+) und unreifer (CD16lo/intCD10+) LDN- und NDN-Subpopulationen, angegeben als Prozentsatz der gesamten LDNs und NDNs (definiert als CD15+SSChi-Zellen). (H) Punktdiagramm, das CD16+ CD10+ LDNs über CD16+ CD10+ NDNs bei gesunden Personen zeigt. Mittlerer ± SD, gepaarter t-Test, n = 3-8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier stellen wir eine optimierte Methode zur Aufspaltung der gesamten Neutrophilenpopulation in Neutrophile mit niedriger und normaler Dichte vor, zusammen mit einer phänotypischen Charakterisierung jedes Zelltyps mittels Durchflusszytometrie, die von früheren Methoden adaptiert wurde5.
Dieses Protokoll basiert auf der Isolierung von LDNs und NDNs aus Vollblut. Ein entscheidender Schritt ist, dass die Gesamtzahl der Neutrophilen durch negative Selektionsmethoden isoliert wird. Positive Selektionsmethoden beinhalten die Verwendung von Antikörpern, die an Oberflächenmarker binden, wodurch möglicherweise die Neutrophilen aktiviert und die Degranulation ausgelöstwird 5. Diese Aktivierung kann nachgelagerte Experimente beeinträchtigen, indem sie den funktionellen und metabolischen Zustand der Neutrophilen verändert, was zu ungenauen Ergebnissen führt und die Interpretation der experimentellen Ergebnisse verzerrt. Daher gewährleistet die negative Selektion die Isolierung von Neutrophilen, ohne eine Aktivierung oder funktionelle Veränderungen zu induzieren. Darüber hinaus macht die Verwendung einer auf negativer Trennung basierenden magnetischen Isolierung die Lyse roter Blutkörperchen (RBC) überflüssig. Dies reduziert nicht nur zusätzliche Waschschritte und den Zelltod und bewahrt so die Ausbeute, sondern erhöht auch die Reinheit der isolierten Neutrophilen, indem die Erythrozytenkontamination minimiert wird. Im Vergleich zum ursprünglichen Protokoll wurde während des gesamten Prozesses, einschließlich Waschen und Resuspension, anstelle von PBS ein Zelltrennungspuffer anstelle von PBS verwendet. Diese enthält Additive, die die Zellverklumpung reduzieren und die unspezifische Bindung während der magnetischen Isolierung minimieren. Durch die konsequente Verwendung von Zelltrennpuffer erreichten wir eine verbesserte Zelltrennungseffizienz, eine höhere Reinheit und eine größere Ausbeute an lebensfähigen, unberührten Neutrophilen im Vergleich zur Verwendung von PBS. Dies führte zu einer erhöhten Präzision bei nachgelagerten Analysen. Zusätzlich wurde der Dichtegradient über mehrere Röhren statt über eine einzelne Röhre durchgeführt, um die Auflösung zwischen den beiden Zelltypen zu verbessern.
Es überrascht nicht, dass die erfolgreiche Trennung der beiden neutrophilen Subtypen stark von der präzisen Formulierung und der genauen Schichtung jedes Gradientenabhängt 15. Ebenso wichtig ist die Schichtung der 70% über die 81% sowie der Neutrophilensuspension (in 55%) über die 70% Schicht. Wir empfehlen dringend, diese Methode zu üben. Verwenden Sie am besten eine Transferpipette, wenn Sie das 15-ml-Röhrchen fast parallel zum Boden der Biosicherheitswerkbank schichten und positionieren. Eine auch nur geringfügige Vermischung der Gradienten führt zu undeutlichen und diffusen Banden, die zu undeutlichen Populationen führen können. Es sollte darauf geachtet werden, nur die neutrophilen Banden langsam mit einer Pasteur-Pipette zu entfernen, da die Schichten darüber und darunter aufgrund ihrer Toxizität nach Möglichkeit nicht aspiriert werden sollten. Es ist wichtig, die Kontamination der neutrophilen Fraktion mit der isotonischen Arbeitslösung zu minimieren, um nachteilige Auswirkungen auf die Zellenzu vermeiden 15. Schließlich können höhere Zellzahlen zu einer insgesamt höheren Dichte der LDN- und NDN-Banden führen, was zu einer schlechteren Auflösung der Zellpopulationen führt. Wir empfehlen daher, vor der Resuspension in der 55%igen Lösung eine Gesamtneutrophilenzählung durchzuführen. Dies ist besonders wichtig, wenn >12 ml Vollblut für die Neutrophilenisolierung verwendet werden oder wenn die Gesamtanzahl der Neutrophilen 5-6 × 106 übersteigt.
Alternativen zu diesem Verfahren bestehen in der Dextran/Percoll-Kombination, die nicht auf einer magnetischen Trennung beruht und im Wesentlichen ein einstufiges Protokoll16 ist. Die Verwendung der Dextran-Sedimentation zur Entfernung von Erythrozyten ist möglicherweise nicht so effizient oder konsistent wie andere Methoden wie die direkte Erythrozytenlyse oder Dichtegradienten. Bei der Dextran-Sedimentation können verbleibende Erythrozyten im Überstand zurückbleiben, was die Reinheit der Neutrophilenpopulation beeinträchtigen könnte. Ohne einen negativen Selektionsschritt besteht das Risiko, dass Neutrophile durch Restantikörper oder andere Reize aktiviert werden, was ihr Verhalten in nachgeschalteten Assays beeinträchtigen könnte. Die manuelle Entfernung von PBMC- und Neutrophilenschichten aus dem Dichtegradientenmedium kann zu einer Kontamination zwischen den Zellpopulationen führen, insbesondere wenn die Trennung nicht sauber ist.
Diese Studie stellt ein relativ vereinfachtes Durchflusszytometrie-Panel vor, um die Reinheit der isolierten LDNs und NDNs zu bestimmen und eine minimale Charakterisierung dieser Zellen durchzuführen. Die hier verwendeten Marker werden in der Literatur als Teil mehrerer, komplexerer Durchflusszytometrie-Panels, an denen die Neutrophilenforschung beteiligt ist, ausführlich beschrieben. Wir entschieden uns, das Panel zu kondensieren, um die Reinheit der Isolierung, die prozentuale Häufigkeit lebender und toter Zellen zu bestimmen und den Reifungsstatus der Neutrophilen (basierend auf der CD10- und CD16-Expression) zu untersuchen. Es kann jedoch erweitert werden, um den Anforderungen verschiedener Endbenutzerstudien gerecht zu werden. Dieses Protokoll wurde speziell entwickelt, um LDNs und NDNs für die individuelle Beurteilung zu trennen, da sich die gemeinsame Unterscheidung dieser Subpopulationen auf einem Durchflusszytometrie-Panel aufgrund ihrer relativen Undeutlichkeit als schwierig erwiesen hat (Abbildung 2H). In Übereinstimmung mit früheren Berichten5 wurde festgestellt, dass LDNs und NDNs von gesunden Personen nicht zuverlässig unterschieden werden können, wenn sie gleichzeitig analysiert werden. Daher ermöglicht die vorherige Isolierung eine genauere und detailliertere Charakterisierung jeder Subpopulation.
Wir schlagen vor, dass sich Endbenutzer während der Optimierungsphase für dieses Protokoll dafür entscheiden sollten, grundlegende Lymphozytenmarker wie CD3 und CD19 in ihr Durchflusszytometrie-Panel aufzunehmen. Dies kann bei der Fehlerbehebung hilfreich sein, da eine suboptimale magnetische Isolierung dazu führen kann, dass Lymphozyten in das Gesamtisolat der Neutrophilen aufgenommen werden, die aufgrund ähnlicher zellulärer Dichten möglicherweise in die LDN-Fraktion übertragen werden könnten. Zum Zwecke der Optimierung können Benutzer CD45 hinzufügen, um die Verunreinigungen in ihren isolierten Fraktionen besser zu beheben, d. h. CD45-ve könnten Erythrozyten sein, und CD45+ve könnte auf eine PBMC-Kontamination hinweisen. Neutrophilen-Subpopulationen wurden auf der Grundlage der Oberflächenmarkerexpression definiert, die eine dynamische Eigenschaft ist und ein hohes Maß an Variabilität zwischen den Spendern aufweisen kann. Daher wird im Einklang mit einer guten Praxis der Durchflusszytometrie auch die Verwendung von FMO-Kontrollen empfohlen, da dies dazu beitragen kann, die Variabilität zwischen den Donoren zu reduzieren und klarere Subpopulationen zu definieren.
Wir erkennen auch an, dass dieses Protokoll nur für frisches Vollblut optimiert wurde, in Übereinstimmung mit den Richtlinien des magnetischen Isolationskits, die besagen, dass mit diesem Kit nur unverarbeitetes Vollblut verwendet werden sollte und dass die Rückgewinnung der gewünschten isolierten Zellen bei Proben, die >24 h alt sind, abnimmt. Dadurch entfallen die Optionen für das Ausgangsmaterial, aus dem Neutrophile isoliert werden können, wie z. B. bronchoalveoläre Lavageflüssigkeit (BALF), Pleuraflüssigkeit, Aszites usw. Connelly et al. haben gezeigt, dass Verzögerungen bei der Verarbeitung von Neutrophilen17, selbst aus frisch entnommenem Vollblut, ihren Phänotyp und ihre Oberflächenexpression verändern können. Dementsprechend empfehlen wir, mit der Verarbeitung so schnell wie möglich ab dem Zeitpunkt der Blutabnahme zu beginnen. Obwohl dieses Protokoll ideal für frisches Vollblut ist, kann es im Vergleich zu einstufigen Protokollen wie dem Dextran/Percoll eine relativ lange und zeitaufwändige Methode sein, die keinen Zwischenstopp bietet. Dies stellt eine Einschränkung bei klinischen Studien dar, bei denen Proben zu späteren Tageszeiten entgegengenommen werden können. Darüber hinaus erlaubt diese Methode nicht die Sortierung von LDN- und NDN-Teilmengen, da Methoden zur Sortierung von Teilmengen (durch Durchflusszytometrie oder auf andere Weise) das Risiko bergen, Neutrophile unbeabsichtigt zu aktivieren.
Neutrophilen-Subpopulationen haben bei Erkrankungen wie systemischem Lupus erythematodes (SLE)18,19, Krebs 20 und COVID-1921 erhebliche Aufmerksamkeit erregt. Das wachsende Interesse an diesen Zelltypen, insbesondere im Zusammenhang mit Entzündungs- und Autoimmunerkrankungen, unterstreicht den Bedarf an zuverlässigen Methoden, um jede Population genau zu beurteilen und ihren individuellen Beitrag zur Pathogenese besser zu verstehen.
Offenlegungen
Die Autoren machen keine Angaben.
Danksagungen
Diese Arbeit wurde vom Health Research Board EIA-2024-002 und dem Royal City of Dublin Hospital Trust finanziert. Wir danken Dr. Lorraine Thong und Dr. Kevin Brown für ihre Unterstützung bei der Entnahme von Proben von gesunden Spendern für dieses Manuskript.
Materialien
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
Referenzen
- Tracchi, I., et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I., et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E., et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963(2021).
- Hacbarth, E., Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R., et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922(2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A., et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696(2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M., et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B., Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520(2021).
- Park, J., et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282(2023).
- Denny, M. F., et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A., et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603(2019).
- Mosca, T., Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y., et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N., et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667(2022).
- Carmona-Rivera, C., Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y., et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154(2023).
- Dwivedi, A., et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659(2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten