Method Article
O Isolamento e Caracterização de Neutrófilos de Baixa e Densidade Normal do Sangue Total
Neste Artigo
Resumo
Aqui, fornecemos uma abordagem confiável para isolar neutrófilos de baixa e normal densidade de sangue total usando isolamento magnético (seleção negativa) e meio de gradiente de densidade descontínuo. Ele garante o isolamento intocado de células de alta pureza (≥93%), facilitando a análise precisa a jusante das subpopulações de neutrófilos, cruciais para entender seus papéis na saúde e na doença.
Resumo
Pesquisas emergentes mostram que a população circulante de neutrófilos em humanos consiste em diversos subtipos e não deve ser estudada como uma única população, como tem sido feito historicamente. Em particular, neutrófilos de baixa densidade e densidade normal (LDNs, NDNs) demonstraram ter perfis funcional e metabolicamente distintos, um fator que deve ser considerado ao publicar pesquisas com neutrófilos. Aqui, apresentamos um método modificado para o isolamento e separação intocados de LDNs e NDNs do sangue total.
O meio gradiente de densidade (1,135 g/mL) é combinado a 9:10 com 10x PBS. Gradientes de densidade específicos de 55%, 70% e 81% são feitos subsequentemente combinando o meio de gradiente de densidade de 100% com 1x solução salina tamponada com fosfato (PBS). Neutrófilos isolados de 12 mL de sangue total periférico obtido de doadores consentidos usando um kit de isolamento magnético baseado em seleção negativa são ressuspensos na fração de 55%. Um volume de 3 mL das frações de 81% e 70% é colocado em camadas em um tubo de 15 mL, seguido pela fração de 55% contendo neutrófilos totais. Os gradientes de densidade são então centrifugados a 720 x g por 30 min. Duas bandas distintas são obtidas na interface 55%/70% (LDNs) e 70%/81% (NDNs). As células são cuidadosamente pipetadas em tubos separados e lavadas com PBS. A pureza das fracções isoladas é determinada por citometria de fluxo. Tanto os LDNs quanto os NDNs foram definidos como CD14lo, CD15+ SSChi por citometria de fluxo. A pureza do isolamento foi calculada em ≥93% das células viáveis para ambos os tipos.
Este método fornece uma abordagem confiável e eficiente para separar LDN e NDNs do sangue periférico, garantindo alta pureza e viabilidade das células isoladas. Aumentar a precisão do isolamento de neutrófilos facilita análises mais precisas a jusante dessas subpopulações distintas de neutrófilos. Estes são críticos para avançar nossa compreensão da heterogeneidade dos neutrófilos e suas implicações em vários contextos fisiológicos e patológicos.
Introdução
Os neutrófilos são células imunes granulares e o leucócito mais abundante no sangue periférico, constituindo cerca de 50% a 70% dos leucócitos em média. Eles se desenvolvem na medula óssea a partir de precursores de granulócitos-monócitos (GMPs), que por sua vez se desenvolvem a partir de células progenitoras hematopoiéticas (HPCs) na presença de fator estimulador de colônias de granulócitos (G-CSF). Na homeostase, eles têm uma vida útil de ~ 24 h, mas estudos mostraram que sua vida útil pode ser estendida sob condições fisiológicas específicas e seus microambientes associados, como ativação imunológica crônica1, inflamação1 e até residência tecidual em estado estacionário2. Os neutrófilos há muito são considerados a primeira linha de defesa contra patógenos e provocam seus efeitos antimicrobianos por meio de 3 funções efetoras principais - degranulação, fagocitose e ativação e liberação de armadilha extracelular de neutrófilos (NET) (NETosis).
A maioria dos estudos sobre função e biologia de neutrófilos examina os resultados para a população total de neutrófilos. No entanto, desde estudos em ambientes de câncer delineando subtipos N1 (antitumoral) / N2 (pró-tumoral) até a classificação de neutrófilos com base na maturidade, doença e estado fisiológico, e até mesmo densidade celular (neutrófilos de baixa densidade e densidade normal), tornou-se cada vez mais aparente que a população de neutrófilos humanos constitui subtipos fenotipicamente diversos. Se a existência desses subtipos de neutrófilos pode ser atribuída a tipos de células completamente distintos ou devido à natureza complexa da plasticidade, existe um crescente corpo de literatura sobre neutrófilos atípicos e apresenta uma oportunidade convincente para estudar neutrófilos de baixa densidade separados de neutrófilos de densidade normal3.
Descritos pela primeira vez em pacientes com LES como um subgrupo pró-inflamatóriode neutrófilos 4, os LDNs foram identificados em doenças crônicas, gravidez e até mesmo na circulação saudável, em capacidades pró-inflamatórias e supressoras 5,6,7,8. Os LDNs são encontrados concomitantemente com células mononucleares do sangue periférico (PBMCs) quando o sangue total é centrifugado em meios de gradiente de densidade. Sua densidade específica corresponde a aproximadamente 1,077 g/mL, em comparação com NDNs a 1,083 g/mL9. Embora ainda haja um debate considerável sobre o assunto, especula-se que os LDNs se assemelhem a um fenótipo de granulócitos mais imaturo (semelhante aos promielócitos e mielócitos, com densidade abaixo de 1,080 g/mL)9,10. Outros ainda especulam que existem fenótipos de LDN maduros e imaturos, dependendo da presença ou ausência de doença 11,12,13. No entanto, LDNs também foram detectados em indivíduos saudáveis; no entanto, sua inclusão em alguns estudos é limitada devido à dificuldade em isolá-los em número suficiente5.
Este estudo teve como objetivo isolar essas duas populações em quantidades que nos permitissem realizar experimentos metabólicos in situ a jusante (mínimo 0,5 × 106 células/mL). Ao fazer isso, um protocolo existente5 foi otimizado com marcadores fenotípicos comumente relatados13,14 que fornecem o melhor resultado para isolar e caracterizar LDNs e NDNs de sangue total (Figura 1A).
Protocolo
Amostras de sangue foram coletadas com consentimento informado de participantes saudáveis. O estudo recebeu aprovação do Comitê de Ética em Pesquisa do St. James's Hospital e do Tallaght University Hospital.
1. Preparação do meio de gradiente de densidade, frações de soluções de trabalho isotônicas e tampão de separação celular
- Preparação de soluções de trabalho isotônicas a partir de meio de gradiente de densidade
- Preparação da solução isotônica 100% de trabalho (~ 1,123 g / mL)
- Para preparar a solução isotônica 100% de trabalho, combine 27 mL de meio gradiente de densidade com 3 mL de PBS 10x. Isso resulta em uma solução isotônica adequada para diluições adicionais.
- Preparação da solução de trabalho isotônica a 81% (~ 1,0996 g / mL)
- Prepare a solução de trabalho isotônica a 81% misturando 8,1 mL da solução isotônica de trabalho a 100% (preparada na etapa 1.1.1) com 1,9 mL de 1x PBS. Misture bem para garantir a homogeneidade.
- Preparação de solução de trabalho isotônica a 70% (~ 1,0861 g / mL)
- Para preparar a solução isotônica de trabalho a 70%, combine 7 mL da solução isotônica de trabalho a 100% com 3 mL de 1x PBS. Certifique-se de que a solução esteja bem misturada.
- Preparação da solução de trabalho isotônica a 55% (1,0676 g/mL)
- Faça a solução de trabalho isotônica a 55% misturando 5,5 mL da solução isotônica de trabalho a 100% com 4,5 mL de 1x PBS. Homogeneizar.
- Preparação da solução isotônica 100% de trabalho (~ 1,123 g / mL)
- Camadas de frações de gradiente
- Camadas de fração de gradiente
- Usando um tubo cônico de 15 mL, coloque cuidadosamente 3 mL da solução de trabalho isotônica a 81% na parte inferior. Em seguida, coloque lenta e suavemente 3 mL da solução isotônica de trabalho a 70% por cima, evitando misturar as camadas. Este gradiente será usado para separação celular.
- Camadas de fração de gradiente
- Preparação do tampão de separação celular
- Preparação de 500 mL de tampão de separação celular
- Para preparar o tampão de separação celular, combine 2% de soro fetal bovino (FBS) e 1 mM de ácido etilenodiaminotetracético (EDTA) com 1x PBS para um volume total de 500 mL. Use este tampão para lavar e ressuspender as células durante o processo de isolamento.
NOTA: Certifique-se de que as camadas estejam bem separadas e sem perturbações. Neste protocolo, as soluções de trabalho isotônicas são referidas como "100%", "81%", "70%" e "55%" com base no método de preparação, consistente com estudos anteriores5. No entanto, é importante esclarecer que esses rótulos não representam as concentrações finais reais das soluções de trabalho. Por exemplo, o meio de gradiente de densidade "100%" é preparado misturando 27 mL de meio gradiente de densidade puro com 3 mL de 10x PBS, resultando em uma concentração final de 90% de solução de trabalho isotônica. As diluições subsequentes (por exemplo, "81%", "70%" e "55%") refletem de forma semelhante as proporções de preparação, em vez de concentrações percentuais verdadeiras. Essa nomenclatura foi mantida para manter a consistência com a terminologia usada na literatura anterior sobre o assunto.
- Para preparar o tampão de separação celular, combine 2% de soro fetal bovino (FBS) e 1 mM de ácido etilenodiaminotetracético (EDTA) com 1x PBS para um volume total de 500 mL. Use este tampão para lavar e ressuspender as células durante o processo de isolamento.
- Preparação de 500 mL de tampão de separação celular
2. Isolamento de neutrófilos do sangue total usando seleção negativa
- Preparação de esferas magnéticas
- Vortex os grânulos magnéticos completamente por 30 s para garantir que eles sejam totalmente ressuspensos antes do uso.
- Preparação de sangue
- Para cada doador, alíquota de 4 mL de sangue total em três tubos separados de 14 mL de fundo redondo.
- Adição de coquetel de isolamento de neutrófilos e contas magnéticas
- Adicione 50 μL de coquetel de isolamento de neutrófilos e 50 μL de esferas magnéticas por mL de sangue a cada tubo. Para 4 mL de sangue, adicione 200 μL de cada reagente.
- Ressuspenda bem a mistura pipetando suavemente e incube à temperatura ambiente (RT) por 5 min para permitir que os reagentes se liguem às células indesejadas.
- Lavagem e separação magnética - primeira rodada
- Complete cada tubo com 12 mL usando tampão de separação de células e misture bem.
- Coloque os tubos sem tampas em um ímã e deixe-os incubar em RT por 10 min para permitir que as esferas magnéticas ligadas às células indesejadas sejam atraídas para a parede do tubo.
- Coleção de células não ligadas
- Transfira cuidadosamente a suspensão de células claras contendo neutrófilos de cada tubo para um tubo novo e limpo usando uma pipeta de transferência. Remova o tubo original do ímã.
- Reaplicação e incubação de esferas magnéticas - segunda rodada
- Vortex as contas magnéticas novamente por 30 s. Adicione o mesmo volume de esferas magnéticas à suspensão de células recém-transferidas como na etapa 2.3. Ressuspenda completamente e incube em RT por mais 5 min.
- Separação e coleta magnética final
- Coloque os tubos de volta no ímã sem tampas e incube em RT por mais 10 min.
- Transfira cuidadosamente a suspensão de célula transparente para um novo tubo. Esta suspensão final representa a população total de neutrófilos isolada.
3. Separação de neutrófilos de baixa densidade (LDNs) e neutrófilos de densidade normal (NDNs) da população total de neutrófilos
- Agrupamento e preparação de suspensões celulares
- Para cada doador, agrupe as suspensões isoladas de neutrófilos em tubos de 50 mL. Complete cada tubo até um volume total de 50 mL usando o tampão de separação de células.
- Centrifugação
- Centrifugue os tubos a 400 x g por 5 min em RT com o freio acionado.
- Ressuspensão e contagem de células
- Descarte o sobrenadante e ressuspenda o pellet de neutrófilos em 1 mL de tampão de separação celular. Faça uma contagem de células para determinar o número total de neutrófilos.
- Preparação do meio gradiente de densidade
- Centrifugue os tubos novamente a 400 x g por 5 min em RT com o freio acionado. Rejeitar o sobrenadante e ressuspender o sedimento de neutrófilos em 3 ml do meio de gradiente de densidade de 55%. Para uma resolução ideal, use 3 mL de gradiente de densidade de 55% por 5-6 × 106 neutrófilos totais.
- Se necessário, divida as células ressuspensas em vários tubos de gradiente de densidade pré-fabricados, garantindo que 3 mL da suspensão celular sejam colocados em camadas em cada tubo.
- Camadas em tubos de gradiente de densidade
- Coloque lentamente a suspensão celular de 3 mL contendo o meio de gradiente de densidade de 55% nos tubos de gradiente de densidade pré-fabricados (preparados conforme descrito na seção 1). Garanta camadas cuidadosas para evitar perturbar o gradiente.
- Centrifugação com gradiente de densidade
- Centrifugue os tubos a 720 x g por 30 min sem usar o freio. Após a centrifugação, manuseie os tubos com cuidado para evitar perturbar as camadas.
- Isolamento das fracções neutrófilas
- Após a centrifugação, observe os neutrófilos separados em duas camadas distintas:
Os neutrófilos de baixa densidade (LDNs) estarão localizados na interface 55%/70%, formando uma banda superior em aproximadamente a marca de 3 mL, e os neutrófilos de densidade normal (NDNs) estarão na interface 70%/81%, aparecendo como uma banda inferior em torno da marca de 6 mL. - Usando uma pipeta de transferência, isole cuidadosamente cada camada e transfira-as para tubos separados de 15 mL.
- Após a centrifugação, observe os neutrófilos separados em duas camadas distintas:
- Lavagem de fracções isoladas
- Para lavar qualquer meio de gradiente de densidade residual, adicione 1x PBS a cada tubo de 15 mL até a marca de 15 mL.
- Centrifugar a 400 × g durante 5 min a RT com o travão ligado. Se as células não formarem um sedimento firme e permanecerem suspensas, repita esta etapa de lavagem, indicando a presença de meio de gradiente de densidade restante.
- Contagem de células e aplicações downstream
- Conte as células em cada fração e prossiga com aplicações a jusante, como experimentos metabólicos, coloração por citometria de fluxo, extração de RNA ou lise de proteínas, conforme necessário.
NOTA: Depois de revestir as células, recomenda-se girar a placa a 210 × g por 1 min (freio desligado).
- Conte as células em cada fração e prossiga com aplicações a jusante, como experimentos metabólicos, coloração por citometria de fluxo, extração de RNA ou lise de proteínas, conforme necessário.
4. Fenotipagem de LDN e NDN isolados
- Isole ~ 0,5-1 × 106 LDNs e NDNs. Faça um mastermix de anticorpos concentrado 2x usando CD14, CD86, CD15, CD16, CD10, bloqueio Fc e corante de viabilidade.
- Corar as populações isoladas de LDN e NDN com um volume equivalente do mastermix de anticorpos de modo que a diluição final dos anticorpos que colorem as células seja de 1:100 (CD14, CD86, CD15, CD16, CD10, bloco Fc) e 1:50 (coloração de viabilidade), respectivamente.
- Incube as células por 10 min no escuro em RT.
NOTA: Certifique-se de que as células estejam completamente misturadas com o mastermix de anticorpos e o bloco Fc. - Lave as células uma vez com PBS e centrifugue a 400 × g por 5 min. Descarte o sobrenadante.
- Fixe as células em paraformaldeído a 1% (PFA) por 15 min em RT no escuro.
- Lave novamente as células com PBS, centrifugue a 400 × g por 5 min e descarte o sobrenadante.
- Ressuspenda as células em 200 μL de PBS ou conforme necessário e adquira as células em um citômetro de fluxo o mais rápido possível.
NOTA: As células coradas e fixas podem ser armazenadas a curto prazo a 4 ◦C no escuro para evitar o fotobranqueamento dos fluoróforos. No entanto, idealmente, o procedimento de fenotipagem deve ser realizado imediatamente após a coloração e fixação para garantir a viabilidade celular ideal e resultados precisos.
Resultados
A estratificação bem-sucedida de neutrófilos totais sobre o meio gradiente de densidade pode ser observada na Figura 1B. Duas bandas distintas devem ser obtidas. Se ocorrer mistura dos gradientes, ou o número de neutrófilos totais em camadas por tubo for alto (maior que aproximadamente 5-6 × 106), as bandas parecerão difusas (Figura 1C) e o risco de mistura dos dois subtipos de neutrófilos aumenta significativamente. Para evitar o último, recomendamos camadas de até 5-6 × 106 neutrófilos totais por tubo de gradiente de densidade. Apesar dos relatos de LDNs estarem em números muito baixos em indivíduos saudáveis, o que os torna inatingíveis para estudos a jusante, este método mostra bom rendimento de LDNs (média de 3,28 × 106 células/mL) e NDNs (média de 10,64 × 106 células/mL) e pureza de participantes saudáveis (Figura 2).
A pureza média de isolamento para LDNs foi de 93,80% (± 5,80), e para NDNs, foi de 96,30% (± 3,30; Figura 2A) após o procedimento de isolamento, com contaminação mínima de outros tipos de células (Figura 2B). A coloração DAPI dos núcleos confirmou a presença de LDN/NDN através da morfologia dos núcleos e mostrou núcleos multilobados distintos em NDNs após o isolamento (Figura 2C). As contagens absolutas após o isolamento mostraram uma tendência comum de mais NDNs presentes do que LDNs, com rendimentos médios de 10,64 × 106 células/mL e 3,28 × 106 células/mL, respectivamente (Figura 2D). Usando citometria de fluxo, tanto os LDNs quanto os NDNs foram definidos como CD14lo CD86- CD15+ SSChi cells13 (Figura 2E). O CD14 é um marcador mieloide comum, o CD15 é um marcador de identificação de neutrófilos e o CD10 e o CD16 são marcadores de maturidade e ativação de neutrófilos comumente descritos13. Controles de fluorescência menos um (FMOs) foram usados para distinguir populações positivas para CD16 e CD10 de populações negativas. Uma população amplamente singular de LDNs maduros, bem como NDNs (CD16hiCD10+) foi observada em indivíduos saudáveis, o que é consistente com os relatos da literatura13, pois indivíduos saudáveis provavelmente não têm uma alta porcentagem de neutrófilos imaturos (CD16lo/intCD10+) em circulação (Figura 2F, G). Em média, a frequência de LDNs CD16hiCD10+ foi de 93,33% (± 5,29), NDNs CD16hiCD10+ foi de 98,03% (± 1,40), CD16lo/intCD10+ foi de 0,49% (± 0,38) e CD16lo/intCD10+ foi de 0,17% (± 0,06; Figura 2F, G). Quando as populações CD16 + CD10 + foram sobrepostas umas às outras, o grau de sobreposição não indicou diferenças perceptíveis na expressão desses marcadores em LDNs em comparação com NDNs (Figura 2H). As células foram adquiridas por meio de citômetro de fluxo e toda a análise dos dados foi realizada por meio do software apropriado para citometria de fluxo.
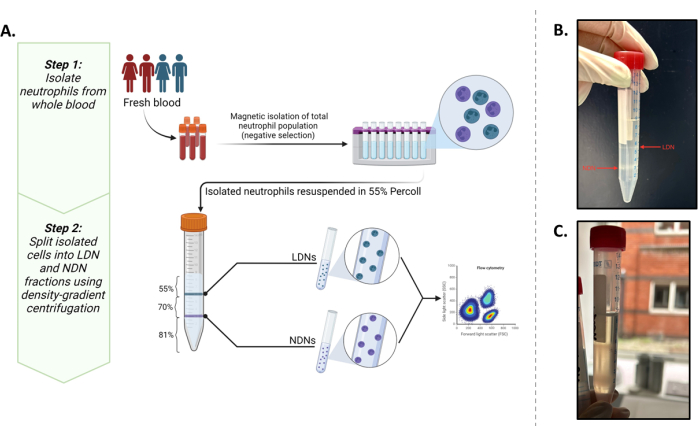
Figura 1: Visão geral do protocolo. (A) Um protocolo de isolamento em duas etapas de LDNs e NDNs de sangue total. A primeira etapa consiste em neutrófilos totais isolados de sangue total usando seleção negativa. A segunda etapa envolve ressuspender o total de neutrófilos em solução de trabalho isotônica a 55% e colocá-la em camadas sobre um gradiente de 81% e 70%. Após as centrifugações, os LDNs estarão na interface das camadas de 55% e 70% e os NDNs na interface das camadas de 81% e 70%. (B) Representação visual de LDNs e NDNs idealmente separados após centrifugação em meio gradiente. (C) Separação subótima de LDNs e NDNs, conforme visto pela natureza difusa das bandas. Há uma grande probabilidade neste caso de que os NDNs contaminem a fração LDN ou vice-versa. Gráfico criado em BioRender. Yennemadi, A. (2025) https://BioRender.com/t03m122. Clique aqui para ver uma versão maior desta figura.
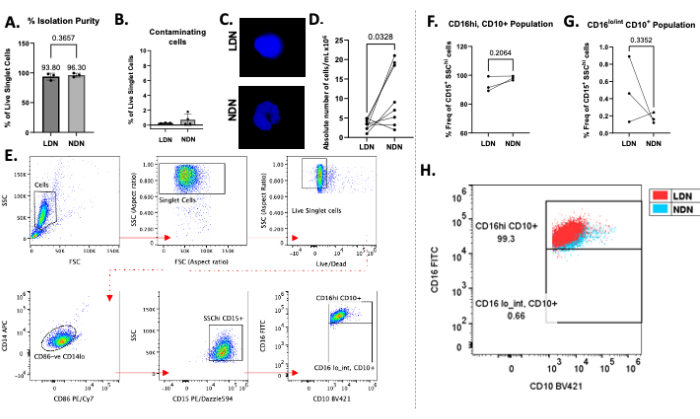
Figura 2: Resultados representativos do protocolo. (A) Porcentagem de pureza de isolamento de LDNs e NDNs do sangue total. (B) Porcentagem de células contaminantes (células B, células T e monócitos) após o isolamento. (C) Coloração DAPI de LDNs e NDNs após isolamento mostrando núcleos multilobados em NDNs e núcleos de lóbulo único em LDNs. (D) Número absoluto de LDNs e NDNs correspondentes isolados de sangue total. (E) Estratégia de gating usada para definir LDNs e NDNs, determinar sua pureza e calcular sua frequência. Detritos, gibões e células mortas foram eliminados da análise (linha superior), e as células CD86- CD14lo, CD15+ SSChi foram fechadas para definir neutrófilos. (F, G) A expressão de CD16 e CD10 foi usada para definir subpopulações em conjunto com o uso de controles de fluorescência menos um. Frequência de subpopulações LDN e NDN maduras isoladas (CD16hiCD10+) e imaturas (CD16lo/intCD10+), relatadas como a porcentagem do total de LDNs e NDNs (definidas como células CD15+SSChi ). (H) Gráfico de pontos mostrando LDNs CD16 + CD10 + sobrepostos a NDNs CD16 + CD10 + em indivíduos saudáveis. Média ± DP, teste t pareado, n = 3-8. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos um método otimizado de divisão da população total de neutrófilos em neutrófilos de baixa densidade e densidade normal, juntamente com a caracterização fenotípica de cada tipo de célula usando citometria de fluxo adaptada de métodos anteriores5.
Este protocolo é baseado no isolamento de LDNs e NDNs do sangue total. Um passo crucial é que os neutrófilos totais são isolados por meio de métodos de seleção negativa. Os métodos de seleção positiva envolvem o uso de anticorpos que se ligam a marcadores de superfície, potencialmente ativando os neutrófilos e desencadeando a degranulação5. Essa ativação pode interferir nos experimentos a jusante, alterando o estado funcional e metabólico dos neutrófilos, levando a resultados imprecisos e distorcendo a interpretação dos resultados experimentais. Portanto, a seleção negativa garante o isolamento dos neutrófilos sem induzir ativação ou alterações funcionais. Além disso, o uso de isolamento magnético baseado em separação negativa elimina a necessidade de lise de glóbulos vermelhos (RBC). Isso não apenas reduz as etapas extras de lavagem e a morte celular, preservando assim o rendimento, mas também aumenta a pureza dos neutrófilos isolados, minimizando a contaminação das hemácias. Em comparação com o protocolo original, um tampão de separação de células foi usado durante todo o processo, incluindo lavagem e ressuspensão, no lugar do PBS. Isso contém aditivos que reduzem a aglomeração de células e minimizam a ligação não específica durante o isolamento magnético. Ao usar o tampão de separação celular de forma consistente, obtivemos maior eficiência de separação celular, maior pureza e maior rendimento de neutrófilos viáveis e intocados em comparação com o uso de PBS. Isso resultou em maior precisão para análises a jusante. Além disso, o gradiente de densidade foi realizado em vários tubos, em vez de em um único tubo, para melhorar a resolução entre os dois tipos de células.
A separação bem-sucedida dos dois subtipos de neutrófilos é, sem surpresa, altamente dependente da formulação precisa e da estratificação precisa de cada gradiente15. Igualmente importante é a estratificação dos 70% sobre os 81%, bem como a suspensão de neutrófilos (em 55%) sobre a camada de 70%. É altamente recomendável praticar este método. É melhor usar uma pipeta de transferência ao estratificação e posicionar o tubo de 15 mL quase paralelo ao fundo do gabinete de biossegurança. A mistura dos gradientes, mesmo que ligeiramente, causará bandas indistintas e difusas, que podem tornar as populações indistintas. Deve-se tomar cuidado para remover lentamente apenas as bandas de neutrófilos usando uma pipeta Pasteur, pois as camadas acima e abaixo não devem ser aspiradas, se possível, devido à sua toxicidade. É importante minimizar a contaminação da fração neutrófila com a solução de trabalho isotônica para evitar efeitos adversos nas células15. Finalmente, números de células mais altos podem resultar em uma densidade geral mais alta das bandas LDN e NDN, resultando em pior resolução das populações de células. Portanto, recomendamos realizar uma contagem total de neutrófilos antes da ressuspensão na solução a 55%. Isso é particularmente significativo se estiver usando >12 mL de sangue total para isolamento de neutrófilos ou se a contagem total de neutrófilos exceder 5-6 × 106.
As alternativas a esse método consistem na combinação dextrana/Percoll, que não depende de separação magnética e é essencialmente um protocolo de etapa única16. O uso de sedimentação de dextrana para remover eritrócitos pode não ser tão eficiente ou consistente quanto outros métodos, como lise direta de hemácias ou gradientes de densidade. A sedimentação de dextrana pode deixar hemácias residuais no sobrenadante, o que pode afetar a pureza da população de neutrófilos. Sem uma etapa de seleção negativa, existe o risco de que os neutrófilos possam ser ativados por anticorpos residuais ou outros estímulos, o que pode afetar seu comportamento em ensaios a jusante. A remoção manual de PBMC e camadas de neutrófilos do meio de gradiente de densidade pode resultar em contaminação entre as populações de células, principalmente se a separação não for limpa.
Este estudo apresenta um painel de citometria de fluxo relativamente simplista para determinar a pureza dos LDNs e NDNs isolados e realizar uma caracterização mínima dessas células. Os marcadores usados aqui são amplamente relatados na literatura como parte de painéis de citometria de fluxo múltiplos e mais complexos envolvendo pesquisa de neutrófilos. Optamos por condensar o painel para determinar a pureza do isolamento, a frequência percentual de células vivas e mortas e examinar o status de maturação dos neutrófilos (com base na expressão de CD10 e CD16). No entanto, ele pode ser expandido para atender às necessidades de vários estudos de usuários finais. Este protocolo foi projetado especificamente para separar LDNs e NDNs para avaliação individual, pois distinguir essas subpopulações em um painel de citometria de fluxo provou ser um desafio devido à sua relativa indistinção (Figura 2H). Consistente com relatos anteriores5, verificou-se que LDNs e NDNs de indivíduos saudáveis não podem ser diferenciados de forma confiável quando analisados simultaneamente. Portanto, isolá-los previamente permite uma caracterização mais precisa e detalhada de cada subpopulação.
Sugerimos que, durante a fase de otimização deste protocolo, os usuários finais possam optar por incluir marcadores básicos de linfócitos, como CD3 e CD19, em seu painel de citometria de fluxo. Isso pode ajudar na solução de problemas, pois o isolamento magnético abaixo do ideal pode resultar na inclusão de linfócitos no isolado total de neutrófilos, o que poderia ser transferido para a fração LDN devido a densidades celulares semelhantes. Para fins de otimização, os usuários podem optar por adicionar CD45 para solucionar melhor os contaminantes em suas frações isoladas, ou seja, CD45-ve podem ser RBCs e CD45 + ve pode indicar contaminação por PBMC. As subpopulações de neutrófilos foram definidas com base na expressão de marcadores de superfície, que é uma propriedade dinâmica e pode apresentar um alto nível de variabilidade entre os doadores. Assim, de acordo com as boas práticas de citometria de fluxo, o uso de controles de FMO também é sugerido, pois isso pode ajudar a reduzir a variabilidade entre doadores e definir subpopulações mais claras.
Reconhecemos também que este protocolo foi otimizado apenas para sangue total fresco, de acordo com as diretrizes do kit de isolamento magnético, que afirma que apenas sangue total não processado deve ser usado com este kit e que a recuperação das células isoladas desejadas diminui com amostras com >24 h de idade. Isso elimina as opções para o material de partida a partir do qual os neutrófilos podem ser isolados, como lavado broncoalveolar (BALF), líquido pleural, ascite, etc. Connelly et al. mostraram que atrasos no processamento de neutrófilos17, mesmo de sangue total recém-coletado, podem alterar seu fenótipo e expressão de superfície. De acordo com isso, recomendamos o início do processamento com o menor atraso possível a partir do momento da coleta de sangue. Portanto, embora este protocolo seja ideal para sangue total fresco, em comparação com protocolos de etapa única como o dextrano/Percoll, pode ser um método relativamente longo e demorado que não oferece um ponto de parada intermediário. Isso apresenta uma limitação nos casos de estudos clínicos em que as amostras podem ser recebidas em horários posteriores do dia. Além disso, este método não permite a classificação de subconjuntos LDN e NDN, pois os métodos de classificação de subconjuntos (por citometria de fluxo ou de outra forma) correm o risco de ativar neutrófilos involuntariamente.
As subpopulações de neutrófilos têm recebido atenção significativa em condições como lúpus eritematoso sistêmico (LES)18,19, câncer20 e COVID-1921. O crescente interesse nesses tipos de células, particularmente no contexto de doenças inflamatórias e autoimunes, ressalta a necessidade de métodos confiáveis para avaliar com precisão cada população e entender melhor suas contribuições individuais para a patogênese.
Divulgações
Os autores não têm divulgações.
Agradecimentos
Este trabalho foi financiado pelo Health Research Board EIA-2024-002 e pelo Royal City of Dublin Hospital Trust. Gostaríamos de agradecer à Dra. Lorraine Thong e ao Dr. Kevin Brown por sua assistência na coleta de amostras de doadores saudáveis para este manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 14 mL Polypropylene Round-Bottom Tube (17 x 100 mm) | Corning Science | 352059 | |
| APC anti-human CD14 (63D3) | BioLegend | 367118 | |
| Brilliant Violet 421 anti-human CD10 (25 tests) | BioLegend | 312217 | |
| Dulbecco's Phosphate-Buffered Saline | Sigma | D8537-1L | |
| EasyEights EasySep Magnet | StemCell Technologies | #18103 | |
| EasySep Buffer (cell separation buffer) | StemCell Technologies | #20144 | |
| EasySep Direct Human Neutrophil Isolation Kit | StemCell Technologies | #19666 | |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| FITC anti-human CD16 (3G8) | BioLegend | 302005 | |
| OneComp eBeads Compensation Beads | eBioscience Inc. | 01-1111-42 | |
| PE/Cy7 anti-human CD86 (BU63) | BioLegend | 374209 | |
| PE/Dazzle 594 anti-human CD15 (SSEA-1) | BioLegend | 323037 | |
| Phosphate-Buffered Saline Tablets | Gibco | 18912-014 | |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 |
Referências
- Tracchi, I., et al. Increased neutrophil lifespan in patients with congestive heart failure. Eur J Heart Fail. 11 (4), 378-385 (2009).
- Ballesteros, I., et al. Co-option of neutrophil fates by tissue environments. Cell. 183 (5), 1282-1297.e18 (2020).
- Mckenna, E., et al. Neutrophils: Need for standardized nomenclature. Front Immunol. 12, 602963(2021).
- Hacbarth, E., Kajdacsy-Balla, A. Low density neutrophils in patients with systemic lupus erythematosus, rheumatoid arthritis, and acute rheumatic fever. Arthritis Rheumatol. 29 (11), 1334-1342 (1986).
- Hardisty, G. R., et al. High purity isolation of low density neutrophils casts doubt on their exceptionality in health and disease. Front Immunol. 12, 625922(2021).
- Scapini, P., Marini, O., Tecchio, C., Cassatella, M. A. Human neutrophils in the saga of cellular heterogeneity: Insights and open questions. Immunol Rev. 273 (1), 48-60 (2016).
- Ssemaganda, A., et al. Characterization of neutrophil subsets in healthy human pregnancies. PLoS One. 9 (2), e85696(2014).
- Tay, S. H., Celhar, T., Fairhurst, A. M. Low-density neutrophils in systemic lupus erythematosus. Arthritis Rheumatol. 72 (10), 1587-1595 (2020).
- Hassani, M., et al. On the origin of low-density neutrophils. J Leukoc Biol. 107 (5), 809-818 (2020).
- Cowland, J. B., Borregaard, N. Isolation of neutrophil precursors from bone marrow for biochemical and transcriptional analysis. J Immunol Methods. 232 (1-2), 191-200 (1999).
- Blanco-Camarillo, C., Aleman, O. R., Rosales, C. Low-density neutrophils in healthy individuals display a mature primed phenotype. Front Immunol. 12, 672520(2021).
- Park, J., et al. Low-density granulocytes display immature cells with enhanced NET formation in people living with HIV. Sci Rep. 13 (1), 13282(2023).
- Denny, M. F., et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs. J Immunol. 184 (6), 3284-3297 (2010).
- Ui Mhaonaigh, A., et al. Low density granulocytes in anca vasculitis are heterogenous and hypo-responsive to anti-myeloperoxidase antibodies. Front Immunol. 10, 2603(2019).
- Mosca, T., Forte, W. C. Comparative efficiency and impact on the activity of blood neutrophils isolated by Percoll, Ficoll and spontaneous sedimentation methods. Immunol Invest. 45 (1), 29-37 (2016).
- Ren, Y., et al. Increased apoptotic neutrophils and macrophages and impaired macrophage phagocytic clearance of apoptotic neutrophils in systemic lupus erythematosus. Arthritis Rheum. 48 (10), 2888-2897 (2003).
- Connelly, A. N., et al. Optimization of methods for the accurate characterization of whole blood neutrophils. Sci Rep. 12 (1), 3667(2022).
- Carmona-Rivera, C., Kaplan, M. J. Low-density granulocytes in systemic autoimmunity and autoinflammation. Immunol Rev. 314 (1), 313-325 (2023).
- Yennemadi, A. S., Keane, J., Leisching, G. Mitochondrial bioenergetic changes in systemic lupus erythematosus immune cell subsets: Contributions to pathogenesis and clinical applications. Lupus. 32 (5), 603-611 (2023).
- Futoh, Y., et al. Peripheral low-density granulocytes after colorectal cancer surgery in predicting recurrence. BJS Open. 7 (1), zrac154(2023).
- Dwivedi, A., et al. Emergence of dysfunctional neutrophils with a defect in arginase-1 release in severe COVID-19. JCI Insight. 9 (17), e171659(2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados