Method Article
İnsan Periferik Kan Lenfositlerinden Mikronükleusların Ekstraksiyonu ve Tanımlanması
Bu Makalede
Özet
Bu protokol, sükroz yoğunluk gradyan santrifüjlemesi kullanılarak insan lenfositlerinden mikronükleusların çıkarılması ve saflaştırılması için bir yöntemi ana hatlarıyla belirtir. Mikronükleusların bileşimini ve işlevini araştırmak için deneysel bir temel sağlar.
Özet
Mikronükleus (MN), çözülmemiş DNA hasarı veya mitotik hatalar nedeniyle radyasyon gibi dış hasara maruz kaldığında hücrelerde, özellikle kemik iliği veya kan hücrelerinde oluşan anormal bir nükleer yapıdır. Bir kez oluştuktan sonra, MN'ler, enflamatuar sinyalizasyon ve kromozomal genetik yeniden düzenlemeler dahil olmak üzere çeşitli kanserojen süreçlere aktif olarak katkıda bulunabilir. MN'ler, işlevleriyle yakından ilişkili olan nükleer DNA, histonlar, nükleoprotein fragmanları ve diğer aktif proteinleri içerir. MN'lerin oluşumunu ve bileşenlerini incelemek, kanserojen süreçleri yönlendirmedeki rollerini anlamak için çok önemlidir. MN'lerin ekstraksiyonu ve saflaştırılması, bu araştırma hedeflerine ulaşmak için esastır. Bununla birlikte, MN nükleer zarının kararsızlığı ve yırtılmaya yatkınlığı, bu süreçleri teknik olarak zorlaştırmaktadır. Şu anda, sadece birkaç çalışma, MN ayrımı için yoğunluk gradyan santrifüjünün kullanıldığını bildirmiştir. Bu çalışma, MN ayırma ve saflaştırma süreçlerini özetlemekte ve basitleştirmektedir. Radyasyona maruz kalan insan periferik kan lenfositleri izole edildi ve MN'ler, iki aşamalı bir işlemde farklı konsantrasyonlarda sükroz tamponları kullanılarak ayrıldı ve saflaştırıldı. MN'lerin bütünlüğü ve saflığı doğrulandı ve MN'lerin nedenlerini ve işlevlerini araştıran araştırmacılar için deneysel prosedürün açık ve pratik bir gösterimi sağlandı.
Giriş
Mikronükleus (MN), sitoplazmada nükleer DNA, histonlar ve nükleoprotein fragmanları içeren, zar yapıları 1,2 ile çevrili bir hücre altı yapıdır. MN, ana çekirdekten tamamen ayrıdır ve tipik olarak, ana çekirdeğin çapının 1/16 ila 1/3'ü arasında değişen bir boyutta, oval veya dairesel bir şekilde onun yanında görünür. MN'lerin oluşumu esas olarak asentrik kromozom fragmanları, kromozomal yanlış ayrışma, disentrik kromozom kırılması, kromozom kararsızlığı ve çift dakikaların (DB'ler) toplanması ile ilişkilidir3. MN'ler nadiren sağlıklı hücrelerde görülür ve ağırlıklı olarak DNA hasarına veya mitotik hatalara yol açan eksojen genotoksinlere maruz kalmaktan kaynaklanır 4,5. Radyasyon hasarı, MN oluşumuna önemli bir katkıda bulunur ve insanların iyonlaştırıcı radyasyona (IR) maruz kalması, klinik ve teknolojik uygulamalardaki gelişmelerle artmıştır 6,7. IR maruziyeti, hücresel DNA'da tek iplikli kopmalara (SSB'ler) ve çift iplikçik kopmalarına (DSB'ler) neden olur, bu da hücre ölümü veya apoptozile sonuçlanabilir 8,9,10. MN'ler, onarılmamış veya uyumsuz DSB onarımı nedeniyle üretilen kromozomların, tüm kromozomların veya kromatitlerin parçalarıdır. IR 7,11,12'nin neden olduğu hasar derecesinin kritik göstergeleri olarak hizmet ederler. Radyasyon tedavisinin yan etkilerini hafifletmek ve halkın istenmeyen radyasyona maruz kalmasını en aza indirmek için MN'lerdeki bileşenlerin kapsamlı bir şekilde anlaşılması esastır 6,13. Bununla birlikte, MN'lerde bulunan proteinler ve nükleik asitler bugüne kadar tam olarak karakterize edilmemiştir.
MN'lerin çeşitli DNA hasarının indüksiyonundan kaynaklandığına inanılmaktadır. Replikasyon mekanizmaları ve DNA onarım yetenekleri bozulur ve kısa bir süre içinde geniş DNA hasarına yol açar 3,14,15. MN'ler ayrıca, kanser öncesi hücrelerdesürekli olarak bulunan kromozomal instabilitenin önemli göstergeleridir 3,14,16,17,18,19. MN'ler uzun süredir genotoksisite, tümör riski ve tümör derecesi 3,20,21 için biyobelirteç olarak kullanılmaktadır. Bir kez oluştuktan sonra, MN'ler, inflamatuar sinyalizasyon22,23 ve kromozomal genetik yeniden düzenleme 24,25,26 dahil olmak üzere çok sayıda kanserojen süreci aktif olarak sürdürebilir. Örneğin, MN'ler, sitoplazma 4,22,23,27'den viral patern tanıma reseptörü (PRR) siklik GMP-AMP sentazı (cGAS) alarak inflamatuar bir kaskad başlatır. MN'lerde bulunabilecek diğer proteinler arasında eksonükleazlar28, transkripsiyonel mekanizmalar4 ve translasyon kofaktörleri bulunur. MN'lerin sitoplazmik protein kütüphanesinden benzersiz, önyargılı bir protein profili oluşturup oluşturmadığı veya oluşumları sırasında çekirdek ve sitoplazmadan pasif olarak yüksek miktarda protein elde edip etmediği belirsizliğini korumaktadır. cGAS gibi bireysel proteinlerin ötesinde, belirli ortamların genel MN bileşimini ne ölçüde etkilediği henüz belirlenmemiştir. Tüm mikronükleus manzarasının anlaşılması sınırlıdır ve keşif için halka açık veri kümeleri yoktur. Bu nedenle, bileşenlerinin derinlemesine ve kapsamlı analizleri için tam ve saflaştırılmış MN'lerin çıkarılmasına acilen ihtiyaç duyulmaktadır.
MN'lerde gecikmiş DNA replikasyonunun bir nedeni, DNA sentezi ve onarımı için gerekli enzim ve kofaktör eksikliğinden kaynaklanan replikasyon stresi olabilir. Bu eksiklik, MN nükleer zarfının hatalı montajından kaynaklanabilir ve bu da bir nükleer gözenek kompleksinin20 olmamasına yol açabilir. Sonuç olarak, MN'ler nükleer membran bütünlüğünü ve genom stabilitesini korumak için gerekli olan anahtar proteinleri içe aktaramazlar 2,29,30,31. Tamamlanmamış MN nükleer zarı yırtılmaya eğilimlidir ve bu da MN ekstraksiyonunu oldukça zor hale getirir.
Şu anda, MN'ler esas olarak sükroz yoğunluk gradyan santrifüjlemesi 27,32,33 kullanılarak ekstrakte edilmekte ve akış sitometrisi34 ile saflaştırılmaktadır. Bu çalışmada, MN'lerin ayırma ve saflaştırma işlemi özetlenerek basitleştirilmiştir. Radyasyona maruz kalan insanlardan periferik kan lenfositleri izole edildi ve MN'ler farklı konsantrasyonlarda sükroz tamponları kullanılarak iki kez saflaştırıldı. MN'lerin bütünlüğü ve saflığı doğrulandı ve araştırmacılara MN'lerin nedenlerini ve işlevlerini incelemek için pratik ve sezgisel bir deneysel gösteri sağlandı.
Protokol
İnsan periferik kan örneklerini içeren tüm deneyler, ilgili yönergelere ve düzenlemelere uygun olarak yürütülmüştür. Bu çalışma, Çin Nükleer Endüstri 416 Hastanesi Etik Komitesi (2020 İncelemesi [No. 48]) tarafından onaylandı ve tüm katılımcılardan bilgilendirilmiş onam alındı. Dışlama kriterleri, tümörler, gut veya kan bozuklukları gibi önemli kronik hastalıkları olan bireylerin yanı sıra mesleklerinde radyoaktif veya genotoksik maddelere maruz kalanları içeriyordu. Bu çalışma için, 28 yaşında sağlıklı bir erkekten antikoagülan olarak heparin sodyum içeren bir kan alma tüpüne 10 mL periferik kan toplandı. Numune, gama hava kinetik enerjili terapötik düzeyde standart bir cihaz kullanılarak 37 ° C'de 60Co γ ışını ile in vitro olarak ışınlandı. Işınlama dozu, 0.6350 Gy / dk'lık bir doz oranı ile 4.0 Gy'ye ayarlandı. Işınlamayı takiben, numune 37 ° C'de 2 saat inkübe edildi, RPMI-1640 ortamına aşılandı ve 60 saat boyunca 37 ° C'de kültürlendi. Bu çalışmada kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda verilmiştir.
1. Mikronükleus ve çekirdeğin hazırlanması
- 10 μg / mL'lik bir nihai konsantrasyon elde etmek için periferik kan hücresi ortamına Cytochalasin B ekleyin. Karışımı 37 °C'de 45 dakika inkübe edin.
NOT: Sitokalasin B, hücre lizizinden önce mikronükleusun çekirdekten verimli bir şekilde ayrılmasını kolaylaştıran bir aktin polimerizasyon inhibitörüdür35. - Kan hücrelerini 200 × g'da 4 ° C'de 5 dakika santrifüj edin.
- Kan hücrelerini, 4 ° C'de önceden soğutulmuş 10 mL 0.01 M PBS'de yeniden süspanse edin.
2. Lenfositlerin izolasyonu
- 50 mL'lik konik bir tüpe 15 mL insan lenfosit ayırma solüsyonu ekleyin. Askıya alınmış periferik kan hücrelerini, ayırma çözeltisinin üzerine dikkatlice yerleştirin.
- Tüpü 400 × g'da 4 ° C'de 30 dakika santrifüjleyin.
NOT: Santrifüjlemeden sonra, tüpteki kan hücreleri yukarıdan aşağıya doğru dört ayrı katmana ayrılacaktır: ilk katman plazma katmanıdır (trombositler), ikinci katman halka süt beyazı lenfosit tabakasıdır, üçüncü katman şeffaf ayırma sıvısı tabakasıdır ve dördüncü katman kırmızı kan hücresi tabakasıdır. - İkinci tabakayı (lenfositler) dikkatlice ayrı bir santrifüj tüpüne aktarın. Aktarılan hücrelerin hacminin üç katı kadar PBS (0.01 M) ekleyin, iyice karıştırın ve 200 × g'da 4 ° C'de 10 dakika santrifüjleyin. Süpernatanı bir pipet kullanarak atın.
3. Lenfositlerin parçalanması
- Konik tüpte toplanan hücre peletini buz üzerine yerleştirin.
- 6 mL soğuk lizis tamponu ekleyin (Tablo 1, Ek Dosya 1) ve hücre peletini lizis tamponunda yeniden süspanse edin.
NOT: Lizis tamponu, kullanımdan hemen önce Tablo 2, Ek Dosya 1'de listelenen bileşenlerle desteklenmelidir. - Hücre lizatını bir cam homojenizatöre aktarın.
- Homojenizatörü 10 kez yukarı ve aşağı hareket ettirerek numuneyi manuel olarak homojenize etmek için nazikçe gevşek bir öğütme kullanın.
- Homojenize hücre lizatını 50 mL'lik konik tüpe geri aktarın.
NOT: Tüm adımları nazikçe gerçekleştirin ve numuneyi buz üzerinde tutun.
4. MN'lerin bir sükroz yoğunluk gradyanı ile ilk izolasyonu
- 1: 1 oranında lizat / sakaroz tamponu elde etmek için 5 mL hücre lizatını eşit hacimde 1.8 M sükroz tamponu (Tablo 3, Ek Dosya 1) ile karıştırın.
NOT: 1.8 M sükroz tamponu, kullanımdan hemen önce Tablo 4, Ek Dosya 1'de listelenen bileşenlerle desteklenmelidir. - Sükroz yoğunluk gradyanını hazırlayın: 50 mL'lik konik bir tüpün dibine 15 mL 1.6 M sükroz tamponu (Tablo 5, Ek Dosya 1) ekleyin. 1.6 M sükroz tamponunun üzerine yavaşça 20 mL 1.8 M sükroz tamponu (Tablo 3, Ek Dosya 1) ekleyin.
NOT: Hem 1.6 M sükroz tamponu hem de 1.8 M sükroz tamponu, kullanımdan hemen önce sırasıyla Tablo 4, Ek Dosya 1'deki bileşenlerle desteklenmelidir. Sükroz tamponlarını eklemek için, pipetin ucunu konik tüpün üst iç tarafına yerleştirin ve çözeltiyi yavaşça pipetleyin. - İki katmanlı sükroz yoğunluk gradyanının üzerine 10 mL [Lizat 1: 1 1.8 M sükroz tamponu] karışımını yavaşça pipetleyin.
NOT: Orta 1,8 M tampon tabakasının alt 1,6 M tampon tabakası ile karışmamasını ve üst 1:1 parçalanmış hücre ve 1,8 M sükroz tampon karışımının 1,8 M tampon tabakası ile karışmamasını sağlamak için katmanları yavaşça ekleyin. - Tüpü yatay rotorlu bir santrifüjde 1000 × g'da 4 ° C'de 20 dakika santrifüjleyin.
NOT: Santrifüjlemeden sonra, sıvı üç katmana ayrılacaktır: üst katman yaklaşık 3 mL hücre kalıntısı içerir, orta katman yaklaşık 3 mL mikroçekirdek (MN) içerir, alt katman yaklaşık 39 mL çekirdek içerir. - Yüzeye yakın üst 3 mL sıvıyı çıkarın ve ikinci sükroz yoğunluk gradyanı için orta katmandan 3 mL saflaştırılmamış mikronükleusu toplayın.
5. MN'lerin bir sükroz yoğunluk gradyanı ile ikincil saflaştırılması
- Sükroz yoğunluk gradyanını hazırlayın:
- 15 mL'lik konik bir tüpün dibine 3 mL 1.8 M sükroz tamponu (Tablo 3, Ek Dosya 1) ekleyin.
- 1.8 M sükroz tamponunun üzerine 3 mL 1.5 M sükroz tamponu (Tablo 6, Ek Dosya 1) ekleyin.
- Son olarak, 1,5 M sükroz tamponunun üzerine 3 mL 1,4 M sükroz tamponu (Tablo 7, Ek Dosya 1) ekleyin.
NOT: Pipetin ucunu konik tüpün üst iç tarafına yerleştirin ve çözeltiyi yavaşça pipetleyin.
- İkinci sükroz yoğunluk gradyanından orta tabakanın 3 mL'sini üç katmanlı sükroz yoğunluk gradyanının üstüne yavaşça pipetleyin.
NOT: Karıştırmayı önlemek için katmanları yavaşça ekleyin. - Tüpü 500 × g'da yatay rotorlu bir santrifüjde 4 ° C'de 20 dakika boyunca santrifüjleyin.
NOT: Santrifüjlemeden sonra, üst katman 1-4 mL saflaştırılmış mikroçekirdek (MN) içerecek ve alt katman esas olarak 8 mL çekirdek içerecektir. - Üst 1-4 mL saflaştırılmış mikronükleusu daha sonra kullanmak üzere ayırın.
6. MN'lerin Tanımlanması
- Saflaştırılmamış mikronükleus solüsyonunu (4. adımda elde edilir) ve saflaştırılmış mikronükleus solüsyonunu (5. adımda elde edilir) alın ve slayt üzerinde hücre yaymalarını hazırlayın.
- Numuneyi oda sıcaklığında (RT) 15 dakika sabitlemek için% 4 paraformaldehit çözeltisi ekleyin.
- Slaytları PBS (0,01 M) ile yıkama başına 3 dakika olmak üzere iki kez yıkayın.
- RT'deki hücrelere 5 dakika boyunca nüfuz etmek için% 0.1 Triton X-100 ekleyin.
- Hücreleri 30 dakika boyunca RT'de% 5 BSA'da bloke edin.
- Anti-γ-H2AX'e karşı birincil antikoru ekleyin (% 5 BSA, 1:200 içinde seyreltilmiş) ve RT'de 1 saat inkübe edin.
- Slaytları PBS (0,01 M) ile yıkama başına 5 dakika olmak üzere iki kez yıkayın.
- İkincil antikoru ekleyin (% 5 BSA, 1:500 oranında seyreltilmiş) ve karanlıkta 1 saat boyunca RT'de inkübe edin.
- DAPI boya çözeltisi ekleyin ve RT'de 15 dakika inkübe edin.
- Slaytları PBS (0,01 M) ile yıkama başına 3 dakika olmak üzere iki kez yıkayın.
- Sızdırmaz hale getirmek için slayta bir sızdırmazlık solüsyonu uygulayın.
- Floresan mikroskobu altında floresansı gözlemleyin (büyütme: ×400, otomatik odaklama ve otomatik pozlama) ve bir hücre sayma plakası kullanarak mikronükleusları sayın.
NOT: %4 paraformaldehit, %0.1 Triton X-100 ve %5 BSA, PBS (0.01 M) ile seyreltilir. γ-H2AX (Gamma H2AX), DNA hasarına yanıt olarak oluşan Histon H2AX proteininin fosforile edilmiş bir formudur. Çekirdekte, Histon H2AX'in fosforilasyonu belirli bölgelerde yoğunlaşmıştır, bu nedenle anti-γ-H2AX floresan sivilceli görünebilir. Histon H2AX'in fosforilasyonu mikronükleusta konsantre edilir, bu da farklı noktalar36 ile genel olarak daha parlak floresan ile sonuçlanır. DAPI, DNA'ya güçlü bir şekilde bağlanan ve genellikle floresan mikroskobunda kullanılan bir floresan boyadır. Mikronükleuslar kırık DNA ve histon fragmanları içerdiğinden, anti-γ-H2AX floresan antikorları ve DAPI ile boyanabilirler. Floresan, mikronükleusların sayısını, boyutunu ve eksiksizliğini gösterecek, onları çekirdeklerden ayırt etmeye ve saflaştırma etkinliğini değerlendirmeye yardımcı olacaktır32.
Sonuçlar
Radyasyona maruz kaldıktan sonra, insan periferik kanı 60 saat boyunca RPMI-1640 ile inkübe edildi ve daha sonra mikronükleus (MN) hazırlığı için Cytochalasin B eklendi. Lenfositler, bir lenfosit ayırma solüsyonu kullanılarak izole edildi, ardından özel olarak yapılandırılmış bir hücre lizatı ile lizis ve bir cam homojenizatörde nazik homojenizasyon yapıldı. Homojenat, 1.8 M sükroz tamponu ile 1:1 oranında karıştırıldı. Birinci sükroz yoğunluk gradyanlı santrifüjlemeden sonra saflaştırılmamış mikronükleuslar elde edildi ve ikinci sükroz yoğunluk gradyanlı santrifüjlemeden sonra saflaştırılmış mikronükleuslar elde edildi (Şekil 1).
İlk sükroz yoğunluk gradyan santrifüjünden sonra, saflaştırılmamış mikronükleuslar hücre yaymalarına hazırlandı ve anti-γ-H2AX ve DAPI floresan boyamaya tabi tutuldu. Sonuçlar, saflaştırılmamış mikronükleusların boyutlarında geniş bir varyasyon olduğunu ve bazı büyük mikronükleusların görülebildiğini ortaya çıkardı (Şekil 2A). İkinci sükroz yoğunluk gradyan santrifüjünden sonra, saflaştırılmış mikronükleuslar hücre yaymalarına hazırlandı ve anti-γ-H2AX ve DAPI floresan boyamaya tabi tutuldu. Sonuçlar, saflaştırılmış mikronükleusların daha küçük olduğunu ve mikronükleuslar arasındaki boyut farkının daha az belirgin olduğunu ve büyük çekirdeklerin gözlenmediğini gösterdi (Şekil 2B). 10 mL periferik kana dayanarak, 100.000 ila 200.000 mikroçekirdek elde edilebilir.
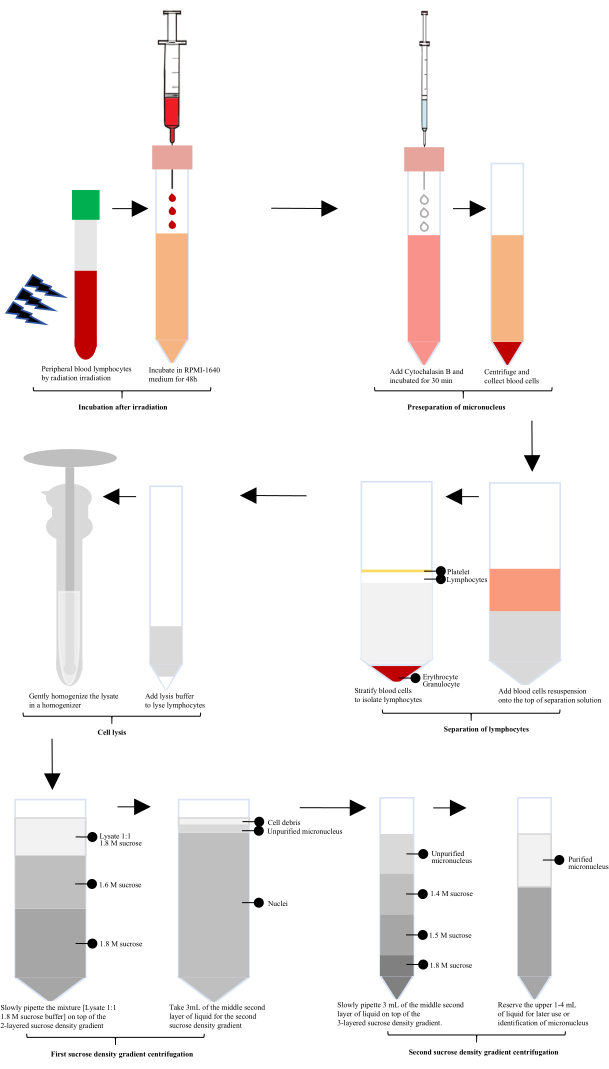
Şekil 1: Işınlamadan sonra lenfosit mikronükleuslarının ekstraksiyonu ve saflaştırılmasının şematik diyagramı. Işınlamayı takiben, işlem inkübasyon, mikronükleus ön ayrılması, lenfosit izolasyonu, hücre lizizi ve iki tur sükroz yoğunluk gradyan santrifüjlemesini içerir. Saflaştırılmış mikronükleuslar daha sonra bu adımlarla elde edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İmmünofloresan yoluyla mikronükleusların tanımlanması. (A) İlk sükroz yoğunluk gradyan santrifüjünden sonra, saflaştırılmamış mikronükleuslar hücre yaymaları olarak hazırlandı ve anti-γ-H2AX (yeşil) ve DAPI (mavi) floresan boyamaya tabi tutuldu. Oklar çekirdeği gösterir. (B) İkinci sükroz yoğunluk gradyan santrifüjünden sonra, saflaştırılmış mikronükleuslar hücre yaymaları olarak hazırlandı ve anti-γ-H2AX ve DAPI floresan boyamaya tabi tutuldu. Ölçek çubukları: 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Bu protokolde kullanılan reaktifler ve tamponlar. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntemde, mikronükleusların (MN'ler) izolasyonu ve saflaştırılması için ışınlanmış insan periferik kan lenfositleri kullanıldı. Önceki birçok çalışma, hücre lizisi veMNs 4,32,33,34'ün birincil ayrılması için ayrıntılı adımları bildirmiştir. Hücre lizis çözeltisi tipik olarak, nükleer zar üzerinde minimum etkiye sahipken hücre zarını bozmak için% 0.1 NP-40 içerir, böylece hem çekirdeğin hem de MN'lerin bütünlüğünü korur. Özellikle, lizatın diğer bileşenleri de bir tamponlama rolüoynar 4,32,33,34. Eksik montaj nedeniyle, MN membranı 2,29,30,31 yırtılmasına eğilimlidir, bu da ayırma ve saflaştırma işlemini zorlaştırır. Tipik olarak, 1.6 M ve 1.8 M sükroz tamponları, MN'lerin ilk ayrılması için yoğunluk gradyan santrifüjlemesinde kullanılır. Sükroz tamponları, MN'lerin korunmasına ve tamponlanmasına yardımcı olur, mikronükleer zarın bütünlüğünü sağlarken yoğunluk gradyanı 4,32,33,34 yoluyla ayrılmalarını kolaylaştırır. Bu yöntemde, lenfosit lizisi ve MN'lerin birincil ayrılması için bu anahtar adımlar dikkatle takip edildi.
Önceki mikronükleus (MN) ayırma yöntemlerinden farklı olarak, bu yöntem saflaştırma sürecini iyileştirir. MN'lerin akış sitometrisi ile saflaştırılması daha önce bildirilmiştir33,34. Bununla birlikte, ayırma işlemi sırasında sıvı kesme kuvvetleri nedeniyle MN'ler yırtılabilir ve bu da MN bileşenlerinin daha fazla algılanmasını engelleyebilir. Ek olarak, akış sitometrelerinin sınırlı mevcudiyeti, MN sıralaması için akış sitometrisinin yaygın olarak uygulanmasını kısıtlar. Diğer çalışmalar, MN'leri saflaştırmak için ikincil sükroz yoğunluk gradyan santrifüjlemesi kullanmıştır, ancak ikincil santrifüjleme4'ten önce ultra yüksek hızlı santrifüjleme kullanılmıştır. Bu yüksek hızlı santrifüjleme, bazı MN'lerin yırtılmasına yol açabilir ve bu da sonraki MN bileşen analizi için zararlıdır. Buna karşılık, bu protokolde, MN'lerin izolasyonu ve saflaştırılması kritik bir adımdır. İkincil sükroz yoğunluk gradyan santrifüjü, MN'leri saflaştırmak için kullanılır ve birinci sükroz yoğunluk gradyan santrifüjünden elde edilen MN içeren tabaka doğrudan ikinci santrifüjlemeye tabi tutulur. Bu yaklaşım, ultra yüksek hızlı santrifüjlemenin neden olduğu MN'lere verilen hasarı önler.
Bu yöntem yalnızca MN'lerin insan periferik kan lenfositlerinden izolasyonu ve saflaştırılmasına odaklanır ve tümör hücreleri gibi diğer hücre tiplerini içermez. Gelecekteki çalışmalar, yöntemin evrenselliğini arttırmak için MN'lerin çeşitli hücre tiplerinden saflaştırılmasını göstermeyi amaçlayacaktır. Ek olarak, saflaştırılmış MN karışımının hacmi nispeten büyük kalır. Gelecekteki çabalar, MN'lerin bileşimi ve işlevi hakkında daha fazla araştırma yapılmasını kolaylaştıracak yüksek konsantrasyonlu MN çözeltileri elde etmek için sakaroz yoğunluk gradyanını optimize etmeye odaklanacaktır.
MN'lerin görünümü, kromozom ve DNA hasarının derecesini yansıtır ve radyasyon hasarı onarımında ve kanser hücresi oluşumunda önemli bir rol oynar 7,11,12,13,14,16,17,18,19. Bu süreçler, MN'ler içindeki proteinlerin, nükleik asitlerin ve diğer bileşenlerin rolleri ve işlevleri ile yakından ilişkilidir. Bu nedenle, MN'lerin saflaştırılması, kromozom ve DNA hasarı ile ilgili hastalıklardaki rollerini incelemek için kritik öneme sahiptir. Bu yöntem, MN saflaştırma işleminde ikincil sükroz yoğunluk gradyan santrifüjleme adımını geliştirir ve insan periferik kan lenfositlerinde MN oluşumunu gösterir. Aynı zamanda hücre lizizini, birinci sükroz yoğunluk gradyanını kullanarak birincil ayırmayı ve ikinci sükroz yoğunluk gradyanı ile saflaştırmayı içerir. Bu yaklaşım, MN'lerin nedenlerini ve işlevlerini araştıran araştırmacılar için açık ve deneysel bir çerçeve sağlar.
Açıklamalar
Hiç kimse.
Teşekkürler
Tüm figürler yazarlar tarafından WPS ofisi aracılığıyla oluşturulmuştur. Bu çalışma, Chengdu Tıp Fakültesi Doğa Bilimleri Vakfı (CYZ19-38) ve Sichuan Eyaleti Bilim ve Teknoloji Destek Programı (2024NSFSC0592) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
Referanslar
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır