Method Article
Extração e Identificação de Micronúcleos de Linfócitos do Sangue Periférico Humano
Neste Artigo
Resumo
Este protocolo descreve um método para extrair e purificar micronúcleos de linfócitos humanos usando centrifugação por gradiente de densidade de sacarose. Ele fornece uma base experimental para investigar a composição e função dos micronúcleos.
Resumo
Um micronúcleo (MN) é uma estrutura nuclear anormal que se forma nas células, particularmente na medula óssea ou nas células sanguíneas, quando expostas a danos externos, como radiação, devido a danos não resolvidos no DNA ou erros mitóticos. Uma vez formados, os MNs podem contribuir ativamente para vários processos cancerígenos, incluindo sinalização inflamatória e rearranjos genéticos cromossômicos. Os MNs contêm DNA nuclear, histonas, fragmentos de nucleoproteínas e outras proteínas ativas, que estão intimamente associadas às suas funções. Estudar a formação e os componentes dos MNs é crucial para entender seu papel na condução de processos cancerígenos. A extração e purificação de MNs são essenciais para atingir esses objetivos de pesquisa. No entanto, a instabilidade da membrana nuclear do NM e sua suscetibilidade à ruptura tornam esses processos tecnicamente desafiadores. Atualmente, poucos estudos relataram o uso da centrifugação com gradiente de densidade para separação de MN. Este estudo resume e simplifica os processos de separação e purificação de MN. Os linfócitos do sangue periférico humano expostos à radiação foram isolados e os MNs foram separados e purificados usando tampões de sacarose de diferentes concentrações em um processo de duas etapas. A integridade e pureza dos NMs foram verificadas, fornecendo uma demonstração clara e prática do procedimento experimental para pesquisadores que investigam as causas e funções dos NMs.
Introdução
O micronúcleo (MN) é uma estrutura subcelular no citoplasma que contém fragmentos de DNA nuclear, histonas e nucleoproteínas, circundados por estruturas de membrana 1,2. O MN é completamente separado do núcleo principal e normalmente aparece próximo a ele em forma oval ou circular, com um tamanho variando de 1/16 a 1/3 do diâmetro do núcleo principal. A formação de MNs está associada principalmente a fragmentos cromossômicos acêntricos, má segregação cromossômica, quebra cromossômica dicêntrica, instabilidade cromossômica e agregação de minutos duplos (DBs)3. As NMs raramente ocorrem em células saudáveis e são predominantemente causadas pela exposição a genotoxinas exógenas, que levam a danos no DNA ou erros mitóticos 4,5. Os danos causados pela radiação contribuem significativamente para a formação de MN, e a exposição humana à radiação ionizante (IR) aumentou com os avanços nas aplicações clínicas e tecnológicas 6,7. A exposição ao IR induz quebras de fita simples (SSBs) e quebras de fita dupla (DSBs) no DNA celular, o que pode resultar em morte celular ou apoptose 8,9,10. MNs são fragmentos de cromossomos, cromossomos inteiros ou cromátides produzidos devido ao reparo de DSB não reparado ou incompatível. Eles servem como indicadores críticos do grau de dano causado pela RI 7,11,12. Uma compreensão abrangente dos componentes dentro dos NMs é essencial para mitigar os efeitos colaterais da radioterapia e minimizar a exposição pública à radiação indesejada 6,13. No entanto, as proteínas e ácidos nucléicos contidos nos MNs permanecem incompletamente caracterizados até o momento.
Acredita-se que os MNs resultem da indução de vários tipos de danos ao DNA. Seus mecanismos de replicação e habilidades de reparo do DNA são prejudicados, levando a extensos danos ao DNA em um curto período 3,14,15. Os MNs também são importantes indicadores de instabilidade cromossômica, que está consistentemente presente em células pré-cancerosas 3,14,16,17,18,19. Os MNs têm sido usados há muito tempo como biomarcadores para genotoxicidade, risco tumoral e grautumoral 3,20,21. Uma vez formados, os MNs podem conduzir ativamente vários processos cancerígenos, incluindo sinalização inflamatória22,23 e rearranjo genético cromossômico 24,25,26. Por exemplo, os MNs iniciam uma cascata inflamatória recrutando a GMP-AMP-AMP sintase cíclica do receptor de reconhecimento de padrão viral (PRR) (cGAS) do citoplasma 4,22,23,27. Outras proteínas que podem estar presentes nas NMs incluem exonucleases28, mecanismos transcricionais4 e cofatores de tradução. Ainda não está claro se os MNs montam um perfil proteico único e tendencioso da biblioteca de proteínas citoplasmáticas ou adquirem passivamente proteínas de alta abundância do núcleo e do citoplasma durante sua formação. Além de proteínas individuais, como cGAS, a extensão em que ambientes específicos influenciam a composição geral do MN ainda não foi determinada. A compreensão de todo o cenário de micronúcleos é limitada, sem conjuntos de dados disponíveis publicamente para exploração. Portanto, a extração de MNs completos e purificados é urgentemente necessária para análises aprofundadas e abrangentes de seus componentes.
Uma razão para a replicação atrasada do DNA em MNs pode ser o estresse de replicação causado pela falta de enzimas e cofatores necessários para a síntese e reparo do DNA. Essa deficiência pode resultar da montagem defeituosa do envelope nuclear do NM, levando à ausência de um complexo de poros nucleares20. Consequentemente, os MNs são incapazes de importar proteínas-chave essenciais para manter a integridade da membrana nuclear e a estabilidade do genoma 2,29,30,31. A membrana nuclear MN incompleta é propensa a ruptura, tornando a extração MN altamente desafiadora.
Atualmente, os MNs são extraídos principalmente por centrifugação com gradiente de densidade de sacarose 27,32,33 e purificados por citometria de fluxo34. Neste estudo, o processo de separação e purificação de MNs foi resumido e simplificado. Os linfócitos do sangue periférico de humanos expostos à radiação foram isolados e os NMs foram purificados duas vezes usando tampões de sacarose de diferentes concentrações. A integridade e pureza dos NMs foram verificadas, proporcionando aos pesquisadores uma demonstração experimental prática e intuitiva para o estudo das causas e funções dos NMs.
Protocolo
Todos os experimentos envolvendo amostras de sangue periférico humano foram conduzidos de acordo com as diretrizes e regulamentos relevantes. Este estudo foi aprovado pelo Comitê de Ética do Hospital 416 da Indústria Nuclear, China (Revisão de 2020 [No. 48]), e o consentimento informado foi obtido de todos os participantes. Os critérios de exclusão incluíram indivíduos com doenças crônicas importantes, como tumores, gota ou doenças do sangue, bem como aqueles expostos a substâncias radioativas ou genotóxicas em sua ocupação. Para este estudo, 10 mL de sangue periférico foram coletados de um homem saudável de 28 anos em um tubo de coleta de sangue contendo heparina sódica como anticoagulante. A amostra foi irradiada in vitro com 60raios γ Co a 37 °C usando um dispositivo padrão de nível terapêutico de energia cinética do ar gama. A dose de irradiação foi ajustada para 4,0 Gy, com uma taxa de dose de 0,6350 Gy/min. Após a irradiação, a amostra foi incubada a 37 °C por 2 h, inoculada em meio RPMI-1640 e cultivada a 37 °C por 60 h. Detalhes dos reagentes e equipamentos usados neste estudo são fornecidos na Tabela de Materiais.
1. Preparação de micronúcleo e núcleo
- Adicione citocalasina B ao meio celular do sangue periférico para atingir uma concentração final de 10 μg / mL. Incubar a mistura durante 45 min a 37 °C.
NOTA: A citocalasina B é um inibidor da polimerização da actina que facilita a separação eficiente dos micronúcleos do núcleo antes da lise celular35. - Centrifugue as células sanguíneas a 200 × g durante 5 min a 4 °C.
- Ressuspenda as células sanguíneas em 10 mL de PBS 0,01 M pré-resfriado a 4 ° C.
2. Isolamento de linfócitos
- Adicione 15 mL de solução de separação de linfócitos humanos em um tubo cônico de 50 mL. Coloque cuidadosamente as células sanguíneas periféricas suspensas em cima da solução de separação.
- Centrifugar o tubo a 400 × g durante 30 min a 4 °C.
NOTA: Após a centrifugação, as células sanguíneas no tubo se separarão em quatro camadas distintas de cima para baixo: a primeira camada é a camada de plasma (plaquetas), a segunda camada é a camada de linfócitos brancos leitosos em anel, a terceira camada é a camada líquida de separação transparente e a quarta camada é a camada de glóbulos vermelhos. - Transfira cuidadosamente a segunda camada (linfócitos) para um tubo de centrífuga separado. Adicione PBS (0,01 M) a três vezes o volume das células transferidas, misture bem e centrifugue a 200 × g por 10 min a 4 ° C. Descarte o sobrenadante usando uma pipeta.
3. Lise de linfócitos
- Coloque o pellet celular coletado no tubo cônico no gelo.
- Adicione 6 mL de tampão de lise a frio (Tabela 1, Arquivo Suplementar 1) e ressuspenda o pellet celular no tampão de lise.
NOTA: O tampão de lise deve ser complementado com os ingredientes listados na Tabela 2, Arquivo Suplementar 1, imediatamente antes do uso. - Transferir o lisado celular para um homogeneizador de vidro.
- Use suavemente uma moagem solta para homogeneizar manualmente a amostra, movendo o homogeneizador para cima e para baixo 10 vezes.
- Transferir o lisado de células homogeneizadas de volta para o tubo cónico de 50 ml.
NOTA: Execute todas as etapas com cuidado e mantenha a amostra no gelo.
4. Isolamento inicial de MNs por meio de um gradiente de densidade de sacarose
- Misture 5 mL do lisado celular com um volume igual de tampão de sacarose 1,8 M (Tabela 3, Arquivo Suplementar 1) para obter uma proporção de 1:1 de lisado para tampão de sacarose.
NOTA: O tampão de sacarose 1.8 M deve ser complementado com os ingredientes listados na Tabela 4, Arquivo Suplementar 1, imediatamente antes do uso. - Prepare o gradiente de densidade de sacarose: Adicione 15 mL de tampão de sacarose 1,6 M (Tabela 5, Arquivo Suplementar 1) ao fundo de um tubo cônico de 50 mL. Adicione lentamente 20 mL de tampão de sacarose 1,8 M (Tabela 3, Arquivo Suplementar 1) em cima do tampão de sacarose 1,6 M.
NOTA: Tanto o tampão de sacarose 1.6 M quanto o tampão de sacarose 1.8 M devem ser complementados com os ingredientes da Tabela 4, Arquivo Suplementar 1, respectivamente, imediatamente antes do uso. Para adicionar os tampões de sacarose, coloque a ponta da pipeta contra o lado interno superior do tubo cônico e pipete lentamente a solução. - Pipetar lentamente 10 mL da mistura [Tampão de sacarose Lysate 1:1 1,8 M] sobre o gradiente de densidade de sacarose de duas camadas.
NOTA: Adicione as camadas lentamente para garantir que a camada tampão intermediária de 1,8 M não se misture com a camada tampão inferior de 1,6 M e a mistura superior 1:1 de células lisadas e tampão de sacarose de 1,8 M não se misture com a camada tampão de 1,8 M. - Centrifugar o tubo numa centrífuga de rotor horizontal a 1000 × g durante 20 min a 4 °C.
NOTA: Após a centrifugação, o líquido se separará em três camadas: a camada superior contém aproximadamente 3 mL de detritos celulares, a camada intermediária contém aproximadamente 3 mL de micronúcleos (MNs), a camada inferior contém aproximadamente 39 mL de núcleos. - Remova os 3 mL superiores de líquido perto da superfície e colete os 3 mL de micronúcleos não purificados da camada intermediária para o segundo gradiente de densidade de sacarose.
5. Purificação secundária de MNs por meio de um gradiente de densidade de sacarose
- Prepare o gradiente de densidade de sacarose:
- Adicione 3 mL de tampão de sacarose 1,8 M (Tabela 3, Arquivo Suplementar 1) ao fundo de um tubo cônico de 15 mL.
- Adicione 3 mL de tampão de sacarose 1,5 M (Tabela 6, Arquivo Suplementar 1) em cima do tampão de sacarose 1,8 M.
- Finalmente, adicione 3 mL de tampão de sacarose 1,4 M (Tabela 7, Arquivo Suplementar 1) em cima do tampão de sacarose 1,5 M.
NOTA: Posicione a ponta da pipeta contra o lado interno superior do tubo cônico e pipete lentamente a solução.
- Pipete lentamente 3 mL da camada intermediária do segundo gradiente de densidade de sacarose para o topo do gradiente de densidade de sacarose de três camadas.
NOTA: Adicione as camadas lentamente para evitar misturar. - Centrifugar o tubo numa centrifugadora de rotor horizontal a 500 × g durante 20 min a 4 °C.
NOTA: Após a centrifugação, a camada superior conterá 1-4 mL de micronúcleos purificados (MN) e a camada inferior conterá principalmente 8 mL de núcleos. - Reserve os 1-4 mL superiores de micronúcleos purificados para uso posterior.
6. Identificação de MNs
- Pegue a solução de micronúcleo não purificada (obtida na etapa 4) e a solução de micronúcleo purificada (obtida na etapa 5) e prepare esfregaços de células na lâmina.
- Adicione solução de paraformaldeído a 4% para fixar a amostra à temperatura ambiente (RT) por 15 min.
- Lave as lâminas com PBS (0,01 M) duas vezes, 3 min por lavagem.
- Adicione 0,1% de Triton X-100 para permeabilizar as células em RT por 5 min.
- Bloqueie as células em BSA a 5% em RT por 30 min.
- Adicione o anticorpo primário contra anti-γ-H2AX (diluído em 5% BSA, 1:200) e incube em RT por 1 h.
- Lave as lâminas com PBS (0,01 M) duas vezes, 5 min por lavagem.
- Adicione o anticorpo secundário (diluído em 5% BSA, 1:500) e incube em RT por 1 h no escuro.
- Adicione a solução de corante DAPI e incube em RT por 15 min.
- Lave as lâminas com PBS (0,01 M) duas vezes, 3 min por lavagem.
- Aplique uma solução de vedação na lâmina para selá-la.
- Observe a fluorescência sob um microscópio de fluorescência (ampliação: 400×, foco automático e exposição automática) e conte os micronúcleos usando uma placa de contagem de células.
NOTA: 4% de paraformaldeído, 0,1% de Triton X-100 e 5% de BSA são diluídos com PBS (0,01 M). γ-H2AX (Gamma H2AX) é uma forma fosforilada da proteína histona H2AX, formada em resposta a danos no DNA. No núcleo, a fosforilação da histona H2AX está concentrada em certas regiões, de modo que a fluorescência anti-γ-H2AX pode parecer irregular. A fosforilação da histona H2AX está concentrada no micronúcleo, resultando em uma fluorescência geral mais brilhante com pontos distintos36. DAPI é um corante fluorescente que se liga fortemente ao DNA e é frequentemente usado em microscopia de fluorescência. Como os micronúcleos contêm fragmentos de DNA e histonas quebrados, eles podem ser corados por anticorpos fluorescentes anti-γ-H2AX e DAPI. A fluorescência indicará o número, tamanho e completude dos micronúcleos, ajudando a distingui-los dos núcleos e avaliar a eficácia da purificação32.
Resultados
Após a exposição à radiação, o sangue periférico humano foi incubado com RPMI-1640 por 60 h e, em seguida, a citocalasina B foi adicionada para a preparação do micronúcleo (MN). Os linfócitos foram isolados usando uma solução de separação de linfócitos, seguida de lise com um lisado celular especialmente configurado e homogeneização suave em um homogeneizador de vidro. O homogeneizado foi misturado 1:1 com tampão sacarose 1,8 M. Os micronúcleos não purificados foram obtidos após a primeira centrifugação do gradiente de densidade de sacarose, e os micronúcleos purificados foram obtidos após a segunda centrifugação do gradiente de densidade de sacarose (Figura 1).
Após a primeira centrifugação do gradiente de densidade de sacarose, os micronúcleos não purificados foram preparados em esfregaços celulares e submetidos à coloração de fluorescência anti-γ-H2AX e DAPI. Os resultados revelaram uma grande variação nos tamanhos dos micronúcleos não purificados, com alguns micronúcleos maiores visíveis (Figura 2A). Após a segunda centrifugação do gradiente de densidade de sacarose, os micronúcleos purificados foram preparados em esfregaços celulares e submetidos à coloração de fluorescência anti-γ-H2AX e DAPI. Os resultados mostraram que os micronúcleos purificados eram menores e que a diferença de tamanho entre os micronúcleos era menos pronunciada, não sendo observados núcleos grandes (Figura 2B). Com base em 10 mL de sangue periférico, 100.000 a 200.000 micronúcleos podem ser obtidos.
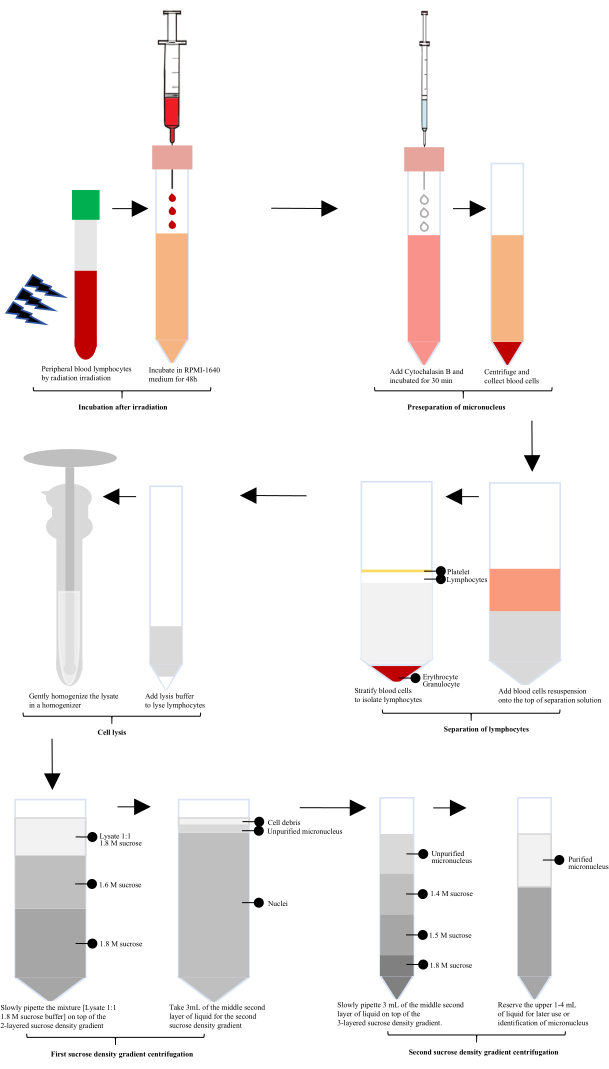
Figura 1: Diagrama esquemático da extração e purificação dos micronúcleos de linfócitos após a irradiação. Após a irradiação, o processo envolve incubação, pré-separação de micronúcleos, isolamento de linfócitos, lise celular e duas rodadas de centrifugação com gradiente de densidade de sacarose. Os micronúcleos purificados são então obtidos por meio dessas etapas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Identificação de micronúcleos via imunofluorescência. (A) Após a primeira centrifugação do gradiente de densidade de sacarose, os micronúcleos não purificados foram preparados como esfregaços celulares e submetidos à coloração de fluorescência anti-γ-H2AX (verde) e DAPI (azul). As setas indicam os núcleos. (B) Após a segunda centrifugação do gradiente de densidade de sacarose, os micronúcleos purificados foram preparados como esfregaços celulares e submetidos à coloração de fluorescência anti-γ-H2AX e DAPI. Barras de escala: 10 μm. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Reagentes e tampões usados neste protocolo. Clique aqui para baixar este arquivo.
Discussão
Nesse método, linfócitos do sangue periférico humano irradiados foram utilizados para o isolamento e purificação de micronúcleos (MNs). Muitos estudos anteriores relataram as etapas detalhadas para lise celular e separação primária de MNs 4,32,33,34. A solução de lise celular normalmente inclui 0,1% de NP-40 para romper a membrana celular enquanto tem efeito mínimo na membrana nuclear, preservando assim a integridade do núcleo e dos MNs. Notavelmente, outros componentes do lisado também desempenham um papel tampão 4,32,33,34. Devido à montagem incompleta, a membrana MN é propensa a ruptura 2,29,30,31, o que complica o processo de separação e purificação. Normalmente, os tampões de sacarose de 1,6 M e 1,8 M são usados na centrifugação com gradiente de densidade para a separação inicial de MNs. Os tampões de sacarose ajudam a proteger e tamponar os MNs, garantindo a integridade da membrana micronuclear e facilitando sua separação através do gradiente de densidade 4,32,33,34. Neste método, essas etapas principais para a lise de linfócitos e a separação primária de MNs foram cuidadosamente seguidas.
Ao contrário dos métodos anteriores de separação de micronúcleos (MN), este método melhora o processo de purificação. A purificação de NMs por citometria de fluxo foi relatada anteriormente33,34. No entanto, os MNs podem se romper devido às forças de cisalhamento do fluido durante o processo de classificação, o que pode dificultar a detecção adicional dos componentes do MN. Além disso, a disponibilidade limitada de citômetros de fluxo restringe a aplicação generalizada da citometria de fluxo para classificação de MN. Outros estudos empregaram centrifugação secundária com gradiente de densidade de sacarose para purificar NMs, mas a centrifugação de velocidade ultra-alta foi usada antes da centrifugação secundária4. Essa centrifugação de alta velocidade pode levar à ruptura de alguns MNs, o que é prejudicial para a análise subsequente do componente do MN. Em contraste, neste protocolo, o isolamento e purificação de MNs é uma etapa crítica. A centrifugação secundária com gradiente de densidade de sacarose é empregada para purificar MNs, com a camada contendo MN obtida a partir da primeira centrifugação com gradiente de densidade de sacarose diretamente submetida à segunda centrifugação. Essa abordagem evita os danos aos MNs causados pela centrifugação de velocidade ultra-alta.
Este método se concentra exclusivamente no isolamento e purificação de MNs de linfócitos do sangue periférico humano e não inclui outros tipos de células, como células tumorais. Estudos futuros terão como objetivo demonstrar a purificação de MNs de vários tipos de células para aumentar a universalidade do método. Além disso, o volume da mistura purificada de MN permanece relativamente grande. Esforços futuros se concentrarão na otimização do gradiente de densidade de sacarose para obter soluções de MN altamente concentradas, o que facilitaria uma investigação mais aprofundada sobre a composição e função dos MNs.
O aparecimento de MNs reflete a extensão dos danos cromossômicos e do DNA e desempenha um papel significativo no reparo de danos por radiação e na formação de células cancerígenas 7,11,12,13,14,16,17,18,19. Esses processos estão intimamente associados aos papéis e funções de proteínas, ácidos nucléicos e outros componentes dentro dos MNs. Portanto, a purificação de MNs é fundamental para estudar seu papel em doenças relacionadas a danos cromossômicos e no DNA. Este método aprimora a etapa de centrifugação do gradiente de densidade de sacarose secundário no processo de purificação do MN e demonstra a formação de MNs em linfócitos do sangue periférico humano. Também inclui lise celular, separação primária usando o primeiro gradiente de densidade de sacarose e purificação com o segundo gradiente de densidade de sacarose. Essa abordagem fornece uma estrutura experimental clara para pesquisadores que investigam as causas e funções dos MNs.
Divulgações
Nenhum.
Agradecimentos
Todas as figuras foram criadas pelos autores por meio do escritório da WPS. Este trabalho foi apoiado pela Fundação de Ciências Naturais da Faculdade de Medicina de Chengdu (CYZ19-38) e pelo Programa de Apoio à Ciência e Tecnologia da Província de Sichuan (2024NSFSC0592).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
Referências
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados