Method Article
Extracción e identificación de micronúcleos de linfocitos de sangre periférica humana
En este artículo
Resumen
Este protocolo describe un método para extraer y purificar micronúcleos de linfocitos humanos mediante centrifugación en gradiente de densidad de sacarosa. Proporciona una base experimental para investigar la composición y función de los micronúcleos.
Resumen
Un micronúcleo (MN) es una estructura nuclear anormal que se forma en las células, particularmente en la médula ósea o las células sanguíneas, cuando se expone a daños externos, como la radiación, debido a daños no resueltos en el ADN o errores mitóticos. Una vez formadas, las MN pueden contribuir activamente a varios procesos cancerígenos, incluida la señalización inflamatoria y los reordenamientos genéticos cromosómicos. Las MN contienen ADN nuclear, histonas, fragmentos de nucleoproteínas y otras proteínas activas, que están estrechamente asociadas con sus funciones. El estudio de la formación y los componentes de las MN es crucial para comprender su papel en la conducción de procesos cancerígenos. La extracción y purificación de MNs son esenciales para lograr estos objetivos de investigación. Sin embargo, la inestabilidad de la membrana nuclear MN y su susceptibilidad a la ruptura hacen que estos procesos sean técnicamente desafiantes. Actualmente, solo unos pocos estudios han informado sobre el uso de la centrifugación en gradiente de densidad para la separación de MN. Este estudio resume y simplifica los procesos de separación y purificación de MN. Se aislaron los linfocitos de sangre periférica humana expuestos a la radiación, y los MN se separaron y purificaron utilizando tampones de sacarosa de diferentes concentraciones en un proceso de dos etapas. Se verificó la integridad y pureza de las MN, proporcionando una demostración clara y práctica del procedimiento experimental para los investigadores que investigan las causas y funciones de las MN.
Introducción
El micronúcleo (MN) es una estructura subcelular en el citoplasma que contiene ADN nuclear, histonas y fragmentos de nucleoproteínas, rodeada de estructuras de membrana 1,2. El MN está completamente separado del núcleo principal y generalmente aparece cerca de él en forma ovalada o circular, con un tamaño que varía de 1/16 a 1/3 del diámetro del núcleo principal. La formación de MNs se asocia principalmente con fragmentos cromosómicos acéntricos, segregación cromosómica errónea, rotura cromosómica discéntrica, inestabilidad cromosómica y la agregación de minutos dobles (DBs)3. Las MN rara vez ocurren en células sanas y son causadas predominantemente por la exposición a genotoxinas exógenas, que conducen a daños en el ADN o errores mitóticos 4,5. El daño por radiación es un contribuyente significativo a la formación de MN, y la exposición humana a la radiación ionizante (IR) ha aumentado con los avances en aplicaciones clínicas y tecnológicas 6,7. La exposición a los infrarrojos induce roturas de una sola cadena (SSB) y roturas de doble cadena (DSB) en el ADN celular, lo que puede provocar la muerte celular o la apoptosis 8,9,10. Los MN son fragmentos de cromosomas, cromosomas completos o cromátidas producidos debido a una reparación DSB no reparada o no coincidente. Sirven como indicadores críticos del grado de daño causado por IR 7,11,12. Una comprensión integral de los componentes dentro de los MN es esencial para mitigar los efectos secundarios de la radioterapia y minimizar la exposición del público a la radiación no deseada 6,13. Sin embargo, las proteínas y los ácidos nucleicos contenidos en los MN permanecen incompletamente caracterizados hasta la fecha.
Se cree que las MN son el resultado de la inducción de varios tipos de daño en el ADN. Sus mecanismos de replicación y su capacidad de reparación del ADN se ven afectados, lo que provoca un daño extenso en el ADN en un corto períodode tiempo 3,14,15. Las MN también son indicadores importantes de inestabilidad cromosómica, que está presente de manera constante en las células precancerosas 3,14,16,17,18,19. Los MN se han utilizado durante mucho tiempo como biomarcadores de genotoxicidad, riesgo tumoral y grado tumoral 3,20,21. Una vez formadas, las MN pueden impulsar activamente numerosos procesos cancerígenos, incluida la señalización inflamatoria22,23 y el reordenamiento genético cromosómico 24,25,26. Por ejemplo, las MN inician una cascada inflamatoria reclutando la GMP-AMP sintasa cíclica (cGAS) del receptor de reconocimiento de patrones virales (PRR) del citoplasma 4,22,23,27. Otras proteínas que pueden estar presentes en las MN son las exonucleasas28, los mecanismos transcripcionales4 y los cofactores de traducción. No está claro si las MN ensamblan un perfil de proteínas único y sesgado a partir de la biblioteca de proteínas citoplasmáticas o adquieren pasivamente proteínas de alta abundancia del núcleo y el citoplasma durante su formación. Más allá de las proteínas individuales, como el cGAS, aún no se ha determinado hasta qué punto los entornos específicos influyen en la composición general de la MN. La comprensión de todo el panorama de los micronúcleos es limitada, ya que no hay conjuntos de datos disponibles públicamente para la exploración. Por lo tanto, se necesita urgentemente la extracción de MN completos y purificados para realizar análisis profundos y exhaustivos de sus componentes.
Una de las razones del retraso en la replicación del ADN en las MN puede ser el estrés de replicación causado por la falta de enzimas y cofactores necesarios para la síntesis y reparación del ADN. Esta deficiencia puede ser el resultado de un ensamblaje defectuoso de la envoltura nuclear MN, lo que lleva a la ausencia de un complejo de poros nucleares20. En consecuencia, los MN no pueden importar proteínas clave esenciales para mantener la integridad de la membrana nuclear y la estabilidad del genoma 2,29,30,31. La membrana nuclear incompleta de MN es propensa a romperse, lo que hace que la extracción de MN sea un gran desafío.
En la actualidad, los MN se extraen principalmente mediante centrifugación en gradiente de densidad de sacarosa 27,32,33 y se purifican mediante citometría de flujo34. En este estudio se resumió y simplificó el proceso de separación y purificación de los MN. Se aislaron los linfocitos de sangre periférica de seres humanos expuestos a la radiación y se purificaron dos veces los MN utilizando tampones de sacarosa de diferentes concentraciones. Se verificó la integridad y pureza de las MN, proporcionando a los investigadores una demostración experimental práctica e intuitiva para estudiar las causas y funciones de las MN.
Protocolo
Todos los experimentos con muestras de sangre periférica humana se llevaron a cabo de acuerdo con las directrices y reglamentos pertinentes. Este estudio fue aprobado por el Comité de Ética del Hospital 416 de la Industria Nuclear, China (Revisión de 2020 [n.º 48]), y se obtuvo el consentimiento informado de todos los participantes. Los criterios de exclusión incluyeron individuos con enfermedades crónicas importantes, como tumores, gota o trastornos sanguíneos, así como aquellos expuestos a sustancias radiactivas o genotóxicas en su ocupación. Para este estudio, se recolectaron 10 mL de sangre periférica de un hombre sano de 28 años en un tubo de extracción de sangre que contenía heparina sódica como anticoagulante. La muestra se irradió in vitro con rayos γ 60Co a 37 °C utilizando un dispositivo estándar de nivel terapéutico de energía cinética de aire gamma. La dosis de irradiación se fijó en 4,0 Gy, con una tasa de dosis de 0,6350 Gy/min. Después de la irradiación, la muestra se incubó a 37 °C durante 2 h, se inoculó en medio RPMI-1640 y se cultivó a 37 °C durante 60 h. Los detalles de los reactivos y equipos utilizados en este estudio se proporcionan en la Tabla de Materiales.
1. Preparación del micronúcleo y núcleo
- Agregue citocalasina B al medio de células de sangre periférica para lograr una concentración final de 10 μg/mL. Incubar la mezcla durante 45 min a 37 °C.
NOTA: La citocalasina B es un inhibidor de la polimerización de actina que facilita la separación eficiente de los micronúcleos del núcleo antes de la lisis celular35. - Centrifugar las células sanguíneas a 200 × g durante 5 min a 4 °C.
- Resuspender las células sanguíneas en 10 mL de PBS de 0,01 M preenfriadas a 4 °C.
2. Aislamiento de linfocitos
- Agregue 15 mL de solución de separación de linfocitos humanos en un tubo cónico de 50 mL. Coloque cuidadosamente las células de sangre periférica suspendidas sobre la solución de separación.
- Centrifugar el tubo a 400 × g durante 30 min a 4 °C.
NOTA: Después de la centrifugación, las células sanguíneas en el tubo se separarán en cuatro capas distintas de arriba a abajo: la primera capa es la capa de plasma (plaquetas), la segunda capa es la capa de linfocitos blancos lechosos del anillo, la tercera capa es la capa líquida de separación transparente y la cuarta capa es la capa de glóbulos rojos. - Transfiera con cuidado la segunda capa (linfocitos) a un tubo de centrífuga separado. Añadir PBS (0,01 M) a tres veces el volumen de las células transferidas, mezclar bien y centrifugar a 200 × g durante 10 min a 4 °C. Deseche el sobrenadante con una pipeta.
3. Lisis de linfocitos
- Coloque el pellet de celda recogido en el tubo cónico sobre hielo.
- Agregue 6 mL de tampón de lisis en frío (Tabla 1, Archivo Suplementario 1) y vuelva a suspender el pellet celular en el tampón de lisis.
NOTA: El tampón de lisis debe complementarse con los ingredientes enumerados en la Tabla 2, Archivo Suplementario 1, inmediatamente antes de su uso. - Transfiera el lisado celular a un homogeneizador de vidrio.
- Utilice suavemente una molienda suelta para homogeneizar manualmente la muestra moviendo el homogeneizador hacia arriba y hacia abajo 10 veces.
- Transfiera el lisado celular homogeneizado al tubo cónico de 50 mL.
NOTA: Realice todos los pasos con cuidado y mantenga la muestra en hielo.
4. Aislamiento inicial de MNs a través de un gradiente de densidad de sacarosa
- Mezcle 5 mL del lisado celular con un volumen igual de tampón de sacarosa de 1,8 M (Tabla 3, Archivo Suplementario 1) para lograr una proporción de 1:1 de lisado a tampón de sacarosa.
NOTA: El tampón de sacarosa de 1,8 M debe complementarse con los ingredientes enumerados en la Tabla 4, Archivo Suplementario 1, inmediatamente antes de su uso. - Prepare el gradiente de densidad de sacarosa: Agregue 15 mL de tampón de sacarosa de 1.6 M (Tabla 5, Archivo Suplementario 1) al fondo de un tubo cónico de 50 mL. Agregue lentamente 20 mL de tampón de sacarosa de 1.8 M (Tabla 3, Archivo Suplementario 1) encima del tampón de sacarosa de 1.6 M.
NOTA: Tanto el tampón de sacarosa de 1,6 M como el tampón de sacarosa de 1,8 M deben complementarse con los ingredientes de la Tabla 4, Archivo Suplementario 1, respectivamente, inmediatamente antes de su uso. Para añadir los tampones de sacarosa, coloque la punta de la pipeta contra la parte superior interior del tubo cónico y pipetee lentamente la solución. - Pipetear lentamente 10 mL de la mezcla [Lysate 1:1 1,8 M sacarosa tampón] sobre el gradiente de densidad de sacarosa de dos capas.
NOTA: Agregue las capas lentamente para asegurarse de que la capa tampón central de 1,8 M no se mezcle con la capa tampón inferior de 1,6 M, y que la mezcla superior 1:1 de células lisadas y tampón de sacarosa de 1,8 M no se mezcle con la capa tampón de 1,8 M. - Centrifugar el tubo en una centrífuga de rotor horizontal a 1000 × g durante 20 min a 4 °C.
NOTA: Después de la centrifugación, el líquido se separará en tres capas: la capa superior contiene aproximadamente 3 mL de restos celulares, la capa intermedia contiene aproximadamente 3 mL de micronúcleos (MN), la capa inferior contiene aproximadamente 39 mL de núcleos. - Retire los 3 mL superiores de líquido cerca de la superficie y recoja los 3 mL de micronúcleos no purificados de la capa intermedia para el segundo gradiente de densidad de sacarosa.
5. Purificación secundaria de MNs a través de un gradiente de densidad de sacarosa
- Prepare el gradiente de densidad de sacarosa:
- Agregue 3 mL de tampón de sacarosa de 1.8 M (Tabla 3, Archivo Suplementario 1) al fondo de un tubo cónico de 15 mL.
- Agregue 3 mL de tampón de sacarosa de 1.5 M (Tabla 6, Archivo Suplementario 1) encima del tampón de sacarosa de 1.8 M.
- Finalmente, agregue 3 mL de tampón de sacarosa de 1.4 M (Tabla 7, Archivo Suplementario 1) encima del tampón de sacarosa de 1.5 M.
NOTA: Coloque la punta de la pipeta contra la parte superior interna del tubo cónico y pipetee lentamente la solución.
- Pipetear lentamente 3 mL de la capa intermedia del segundo gradiente de densidad de sacarosa en la parte superior del gradiente de densidad de sacarosa de tres capas.
NOTA: Agregue las capas lentamente para evitar que se mezclen. - Centrifugar el tubo en una centrífuga de rotor horizontal a 500 × g durante 20 min a 4 °C.
NOTA: Después de la centrifugación, la capa superior contendrá de 1 a 4 ml de micronúcleos purificados (MN), y la capa inferior contendrá principalmente 8 ml de núcleos. - Reserve los 1-4 mL superiores de micronúcleos purificados para su uso posterior.
6. Identificación de las MN
- Tome la solución de micronúcleo no purificada (obtenida en el paso 4) y la solución de micronúcleo purificada (obtenida en el paso 5) y prepare frotis celulares en el portaobjetos.
- Agregue una solución de paraformaldehído al 4% para fijar la muestra a temperatura ambiente (RT) durante 15 min.
- Lave los portaobjetos con PBS (0,01 M) dos veces, 3 min por lavado.
- Añadir 0,1% de Triton X-100 para permeabilizar las células en RT durante 5 min.
- Bloquee las células en BSA al 5% en RT durante 30 min.
- Añadir el anticuerpo primario contra anti-γ-H2AX (diluido en BSA al 5%, 1:200) e incubar a RT durante 1 h.
- Lave los portaobjetos con PBS (0,01 M) dos veces, 5 min por lavado.
- Añadir el anticuerpo secundario (diluido en BSA al 5%, 1:500) e incubar a RT durante 1 h en la oscuridad.
- Agregue la solución de tinte DAPI e incube en RT durante 15 min.
- Lave los portaobjetos con PBS (0,01 M) dos veces, 3 min por lavado.
- Aplique una solución de sellado al portaobjetos para sellarlo.
- Observe la fluorescencia bajo un microscopio de fluorescencia (aumento: 400×, enfoque automático y exposición automática) y cuente los micronúcleos con una placa de recuento de células.
NOTA: El 4% de paraformaldehído, el 0,1% de Triton X-100 y el 5% de BSA se diluyen con PBS (0,01 M). γ-H2AX (Gamma H2AX) es una forma fosforilada de la proteína histona H2AX, formada en respuesta al daño del ADN. En el núcleo, la fosforilación de la histona H2AX se concentra en ciertas regiones, por lo que la fluorescencia anti-γ-H2AX puede parecer irregular. La fosforilación de la histona H2AX se concentra en el micronúcleo, lo que da como resultado una fluorescencia general más brillante con puntos distintos36. El DAPI es un tinte fluorescente que se une fuertemente al ADN y se utiliza a menudo en la microscopía de fluorescencia. Dado que los micronúcleos contienen fragmentos de ADN e histonas rotos, pueden teñirse con anticuerpos fluorescentes anti-γ-H2AX y DAPI. La fluorescencia indicará el número, el tamaño y la integridad de los micronúcleos, lo que ayudará a distinguirlos de los núcleos y a evaluar la eficacia de la purificación32.
Resultados
Después de la exposición a la radiación, se incubó sangre periférica humana con RPMI-1640 durante 60 h, y luego se agregó citocalasina B para la preparación de micronúcleos (MN). Los linfocitos se aislaron utilizando una solución de separación de linfocitos, seguida de lisis con un lisado celular especialmente configurado y homogeneización suave en un homogeneizador de vidrio. El homogeneizado se mezcló 1:1 con tampón sacarosa 1.8 M. Los micronúcleos no purificados se obtuvieron después de la primera centrifugación en gradiente de densidad de sacarosa, y los micronúcleos purificados se obtuvieron después de la segunda centrifugación en gradiente de densidad de sacarosa (Figura 1).
Después de la primera centrifugación en gradiente de densidad de sacarosa, los micronúcleos no purificados se prepararon en frotis celulares y se sometieron a tinción de fluorescencia anti-γ-H2AX y DAPI. Los resultados revelaron una amplia variación en el tamaño de los micronúcleos no purificados, con algunos micronúcleos más grandes visibles (Figura 2A). Después de la segunda centrifugación en gradiente de densidad de sacarosa, los micronúcleos purificados se prepararon en frotis celulares y se sometieron a tinción de fluorescencia anti-γ-H2AX y DAPI. Los resultados mostraron que los micronúcleos purificados eran más pequeños y que la diferencia de tamaño entre los micronúcleos era menos pronunciada, sin que se observaran núcleos grandes (Figura 2B). A partir de 10 mL de sangre periférica, se pueden obtener de 100.000 a 200.000 micronúcleos.
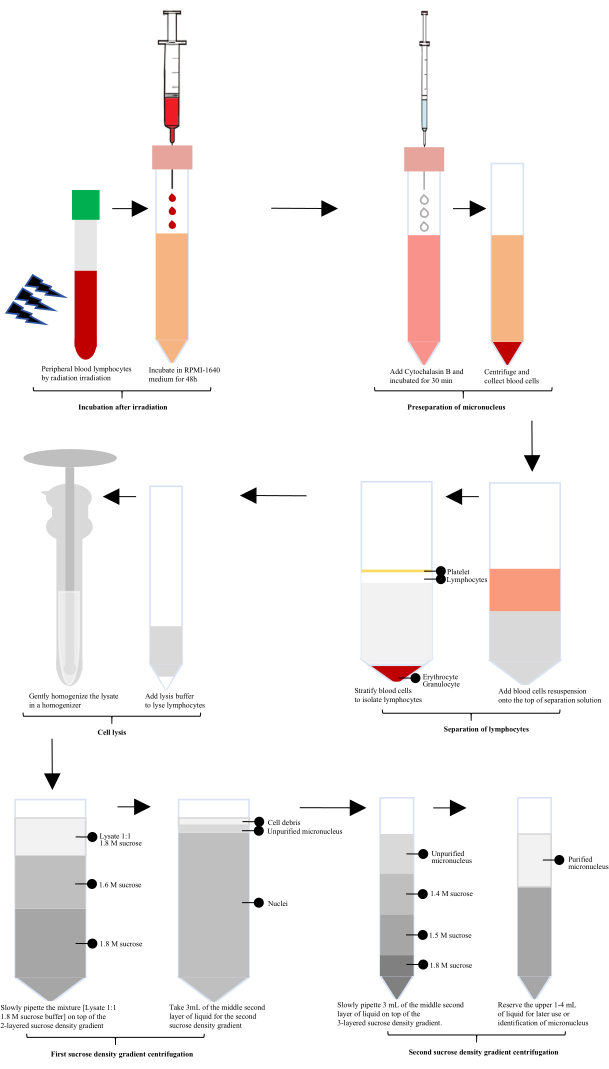
Figura 1: Diagrama esquemático de la extracción y purificación de los micronúcleos linfocitarios tras la irradiación. Después de la irradiación, el proceso implica la incubación, la preseparación de micronúcleos, el aislamiento de linfocitos, la lisis celular y dos rondas de centrifugación en gradiente de densidad de sacarosa. A continuación, se obtienen micronúcleos purificados a través de estos pasos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Identificación de micronúcleos mediante inmunofluorescencia. (A) Después de la primera centrifugación en gradiente de densidad de sacarosa, los micronúcleos no purificados se prepararon como frotis celulares y se sometieron a tinción de fluorescencia anti-γ-H2AX (verde) y DAPI (azul). Las flechas indican los núcleos. (B) Después de la segunda centrifugación en gradiente de densidad de sacarosa, los micronúcleos purificados se prepararon como frotis celulares y se sometieron a tinción de fluorescencia anti-γ-H2AX y DAPI. Barras de escala: 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Fichero complementario 1: Reactivos y tampones utilizados en este protocolo. Haga clic aquí para descargar este archivo.
Discusión
En este método, se utilizaron linfocitos de sangre periférica humana irradiados para el aislamiento y purificación de micronúcleos (MN). Muchos estudios previos han reportado los pasos detallados para la lisis celular y la separación primaria de MNs 4,32,33,34. La solución de lisis celular generalmente incluye 0.1% de NP-40 para alterar la membrana celular mientras tiene un efecto mínimo en la membrana nuclear, preservando así la integridad tanto del núcleo como de los MNs. En particular, otros componentes del lisado también cumplen un papel amortiguador 4,32,33,34. Debido a un ensamblaje incompleto, la membrana MN es propensa a romperse 2,29,30,31, lo que complica el proceso de separación y purificación. Normalmente, se utilizan tampones de sacarosa de 1,6 M y 1,8 M en la centrifugación en gradiente de densidad para la separación inicial de MN. Los tampones de sacarosa ayudan a proteger y amortiguar los MN, asegurando la integridad de la membrana micronuclear y facilitando su separación a través del gradiente de densidad 4,32,33,34. En este método, se siguieron cuidadosamente estos pasos clave para la lisis de linfocitos y la separación primaria de MN.
A diferencia de los métodos anteriores de separación de micronúcleos (MN), este método mejora el proceso de purificación. La purificación de MNs por citometría de flujo ha sido reportada previamente33,34. Sin embargo, los MN pueden romperse debido a las fuerzas de cizallamiento del fluido durante el proceso de clasificación, lo que puede dificultar la detección posterior de los componentes del MN. Además, la disponibilidad limitada de citómetros de flujo restringe la aplicación generalizada de la citometría de flujo para la clasificación de MN. Otros estudios han empleado la centrifugación secundaria en gradiente de densidad de sacarosa para purificar los MN, pero se utilizó la centrifugación de ultra alta velocidad antes de la centrifugación secundaria4. Esta centrifugación a alta velocidad puede provocar la ruptura de algunos MN, lo que es perjudicial para el análisis posterior de los componentes de MN. Por el contrario, en este protocolo, el aislamiento y la purificación de los MN es un paso crítico. La centrifugación secundaria en gradiente de densidad de sacarosa se emplea para purificar MN, y la capa que contiene MN se obtiene de la primera centrifugación en gradiente de densidad de sacarosa se somete directamente a la segunda centrifugación. Este enfoque evita el daño a los MN causado por la centrifugación a ultra alta velocidad.
Este método se centra únicamente en el aislamiento y la purificación de MN de linfocitos de sangre periférica humana y no incluye otros tipos de células, como las células tumorales. Los estudios futuros tendrán como objetivo demostrar la purificación de MN de varios tipos de células para mejorar la universalidad del método. Además, el volumen de la mezcla de MN purificada sigue siendo relativamente grande. Los esfuerzos futuros se centrarán en optimizar el gradiente de densidad de sacarosa para lograr soluciones de MN altamente concentradas, lo que facilitaría una mayor investigación sobre la composición y función de los MN.
La aparición de MN refleja la extensión del daño cromosómico y del ADN y desempeña un papel importante en la reparación del daño por radiación y la formación de células cancerosas 7,11,12,13,14,16,17,18,19. Estos procesos están estrechamente asociados con los roles y funciones de las proteínas, los ácidos nucleicos y otros componentes dentro de los MN. Por lo tanto, la purificación de las MN es fundamental para estudiar su papel en enfermedades relacionadas con el daño cromosómico y del ADN. Este método mejora el paso secundario de centrifugación en gradiente de densidad de sacarosa en el proceso de purificación de MN y demuestra la formación de MN en los linfocitos de sangre periférica humana. También incluye la lisis celular, la separación primaria mediante el primer gradiente de densidad de sacarosa y la purificación con el segundo gradiente de densidad de sacarosa. Este enfoque proporciona un marco claro y experimental para los investigadores que investigan las causas y funciones de las MN.
Divulgaciones
Ninguno.
Agradecimientos
Todas las figuras fueron creadas por los autores a través de la oficina de WPS. Este trabajo contó con el apoyo de la Fundación de Ciencias Naturales de la Facultad de Medicina de Chengdu (CYZ19-38) y el Programa de Apoyo a la Ciencia y la Tecnología de la Provincia de Sichuan (2024NSFSC0592).
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
Referencias
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados