Method Article
ヒト末梢血リンパ球からの小核の抽出と同定
要約
このプロトコールは、スクロース密度勾配遠心分離を使用してヒトリンパ球から小核を抽出し精製する方法を概説しています。これは、小核の組成と機能を調べるための実験的基礎を提供します。
要約
小核(MN)は、未解決のDNA損傷や有糸分裂エラーにより放射線などの外部損傷にさらされると、細胞、特に骨髄や血液細胞に形成される異常な核構造です。MNが形成されると、炎症性シグナル伝達や染色体遺伝子再構成など、さまざまな発がん性プロセスに積極的に関与することができます。MNには、核DNA、ヒストン、核タンパク質断片、およびその他の活性タンパク質が含まれており、これらはそれらの機能と密接に関連しています。MNの形成と成分を研究することは、発がん性プロセスの推進におけるMNの役割を理解するために重要です。これらの研究目標を達成するためには、MNの抽出と精製が不可欠です。しかし、MN核膜は不安定で破裂しやすいため、これらのプロセスは技術的に困難です。現在、MN分離に密度勾配遠心分離法を使用したことを報告している研究はごくわずかです。この研究は、MNの分離と精製のプロセスをまとめ、簡素化するものです。放射線に被曝したヒト末梢血リンパ球を単離し、MNを異なる濃度のショ糖緩衝液を用いて2段階のプロセスで分離精製した。MNの完全性と純度が検証され、MNsの原因と機能を調査する研究者に実験手順の明確で実用的なデモンストレーションを提供しました。
概要
小核(MN)は、細胞質内の細胞内構造であり、核DNA、ヒストン、および核タンパク質断片を含み、膜構造1,2に囲まれています。MNは主核から完全に分離しており、通常、主核の直径の1/16から1/3の範囲のサイズで、主核の近くに楕円形または円形に現れます。MNの形成は、主に非中心染色体断片、染色体ミスグレッション、二心性染色体切断、染色体不安定性、およびダブルミニッツ(DB)の凝集に関連しています3。MNは健康な細胞ではめったに発生せず、主に外因性遺伝子毒素への曝露によって引き起こされ、DNA損傷または有糸分裂エラーにつながります4,5。放射線損傷はMN形成に大きく寄与しており、臨床および技術応用の進歩に伴い、電離放射線(IR)へのヒトの被ばくは増加している6,7。IR曝露は、細胞DNAに一本鎖切断(SSB)および二本鎖切断(DSB)を誘導し、細胞死またはアポトーシスを引き起こす可能性がある8,9,10。MNは、染色体、全染色体、または未修復または不一致のDSB修復によって生成される染色分体の断片です。これらは、IR 7,11,12によって引き起こされた損傷の程度の重要な指標として機能します。MN内の成分を包括的に理解することは、放射線療法の副作用を軽減し、望ましくない放射線への公衆被ばくを最小限に抑えるために不可欠である6,13。しかし、MNに含まれるタンパク質や核酸は、これまでのところ完全には特徴付けられていません。
MNは、さまざまな種類のDNA損傷の誘導から生じると考えられています。それらの複製メカニズムとDNA修復能力が損なわれ、短期間で広範なDNA損傷を引き起こします3,14,15。MNは染色体不安定性の重要な指標でもあり、これは前がん細胞3,14,16,17,18,19に一貫して存在します。MNは、遺伝毒性、腫瘍リスク、および腫瘍グレード3,20,21のバイオマーカーとして長い間使用されてきました。MNが形成されると、炎症性シグナル伝達22,23や染色体遺伝子再構成24,25,26など、多数の発がん性プロセスを能動的に推進することができます。例えば、MNは、細胞質4,22,23,27からウイルスパターン認識受容体(PRR)の環状GMP-AMP合成酵素(cGAS)を動員することにより、炎症カスケードを開始する。MNに存在する可能性のある他のタンパク質には、エキソヌクレアーゼ28、転写メカニズム4、および翻訳補因子が含まれます。MNが細胞質タンパク質ライブラリーからユニークで偏ったタンパク質プロファイルを組み立てるのか、それとも形成中に核や細胞質から高存在量のタンパク質を受動的に獲得するのかは不明です。cGASのような個々のタンパク質に限らず、特定の環境が全体のMN組成にどの程度影響するかはまだわかっていません。小核全体のランドスケープの理解は限られており、探索のための公開データセットはありません。したがって、完全で精製されたMNを抽出することは、その成分を詳細かつ包括的に分析するために緊急に必要とされています。
MNにおけるDNA複製の遅延の原因の一つは、DNAの合成と修復に必要な酵素と補因子の不足によって引き起こされる複製ストレスである可能性があります。この欠損は、MN核膜の組み立て不良に起因する可能性があり、核孔複合体20の不在につながる。その結果、MNは核膜の完全性とゲノムの安定性を維持するために不可欠な主要なタンパク質を輸入することができません2,29,30,31。不完全なMN核膜は破裂しやすく、MNの抽出は非常に困難です。
現在、MNは主にショ糖密度勾配遠心分離27,32,33を用いて抽出され、フローサイトメトリー34によって精製されている。本研究では、MNsの分離・精製プロセスをまとめ、簡略化しました。放射線に被曝したヒトの末梢血リンパ球を単離し、MNを異なる濃度のショ糖緩衝液を用いて2回精製した。MNの完全性と純度が検証され、研究者はMNsの原因と機能を研究するための実用的で直感的な実験的デモンストレーションを得ることができました。
プロトコル
ヒトの末梢血サンプルを含むすべての実験は、関連するガイドラインと規制に従って実施されました。本研究は、中国原子力産業416病院倫理委員会(2020 Review [No. 48])で承認され、参加者全員からインフォームドコンセントが得られました。除外基準には、腫瘍、痛風、血液疾患などの主要な慢性疾患を持つ個人、および職業で放射性物質または遺伝毒性物質に曝露した人が含まれていました。この研究では、健康な28歳の男性から10mLの末梢血を、抗凝固剤としてヘパリンナトリウムを含む採血チューブに採取しました。サンプルは、ガンマ線運動エネルギー治療レベルの標準デバイスを使用して、37°Cで60のCo γ線をin vitroで照射しました。照射量は4.0Gy、線量率は0.6350Gy/minとした。照射後、サンプルを37°Cで2時間インキュベートし、RPMI-1640培地に接種し、37°Cで60時間培養しました。この研究で使用した試薬と機器の詳細は、材料表に記載されています。
1.小核と核の準備
- サイトカラシンBを末梢血細胞培地に添加して、最終濃度10 μg/mLにします。混合物を37°Cで45分間インキュベートします。
注:サイトカラシンBは、細胞溶解35に先立って小核を核から効率的に分離するアクチン重合阻害剤である。 - 血球を200 × g で4°Cで5分間遠心分離します。
- 4°Cで予冷した0.01 M PBS10 mLに血球を再懸濁します。
2. リンパ球の単離
- 15 mLのヒトリンパ球分離溶液を50 mLのコニカルチューブに加えます。懸濁した末梢血細胞を分離溶液の上に慎重に重ねます。
- チューブを400 × g で4°Cで30分間遠心分離します。
注:遠心分離後、チューブ内の血球は上から下に4つの異なる層に分離します:最初の層は血漿層(血小板)、2番目の層はリング乳白色リンパ球層、3番目の層は透明な分離液層、4番目の層は赤血球層です。 - 2番目の層(リンパ球)を別の遠心分離チューブに慎重に移します。転写した細胞の3倍の容量でPBS(0.01 M)を添加し、よく混合し、200 × g で4°Cで10分間遠心分離します。 ピペットを使用して上清を捨てます。
3. リンパ球の溶解
- 円錐形のチューブに集めた細胞ペレットを氷の上に置きます。
- 6 mLの冷溶解バッファー(表1、 補足ファイル1)を加え、細胞ペレットを溶解バッファーに再懸濁します。
注:溶解バッファーには、使用直前に 表2、 補足ファイル1に記載されている成分を補充する必要があります。 - 細胞溶解物をガラスホモジナイザーに移します。
- ルーズグラインドを静かに使用して、ホモジナイザーを上下に10回動かしてサンプルを手動で均質化します。
- ホモジナイズした細胞ライセートを50 mLのコニカルチューブに戻します。
注:すべての手順を穏やかに実行し、サンプルを氷の上に保ちます。
4. ショ糖密度勾配 による MNの初期単離
- 5 mLの細胞ライセートを等量の1.8 Mショ糖緩衝液(表3、 補足ファイル1)と混合して、ライセートとショ糖緩衝液の比率が1:1になるようにします。
注:1.8 Mショ糖緩衝液には、使用直前に 表4、 補足ファイル1に記載されている成分を補充する必要があります。 - スクロース密度勾配を調製する:1.6 Mショ糖緩衝液15 mL(表5、 補足ファイル1)を50 mLコニカルチューブの底に加えます。1.6 Mショ糖緩衝液の上に20 mLの1.8 Mショ糖緩衝液(表3、 補足ファイル1)をゆっくりと加えます。
注:1.6 Mショ糖緩衝液と1.8 Mショ糖緩衝液の両方に、それぞれ 表4、 補足ファイル1の成分を添加する必要があります。ショ糖緩衝液を追加するには、ピペットの先端を円錐管の上部内側に当て、溶液をゆっくりとピペットで挟みます。 - [Lysate 1:1 1.8 M sucrose buffer]混合物10 mLを2層のショ糖密度勾配の上にゆっくりとピペットで移します。
注:中間の1.8 Mバッファー層が下部の1.6 Mバッファー層と混合しないように、また、溶解細胞と1.8 Mショ糖バッファーの上部1:1の混合物が1.8 Mバッファー層と混合しないように、層をゆっくりと追加します。 - 水平ローター遠心分離機でチューブを1000 × g で4°Cで20分間遠心分離します。
注:遠心分離後、液体は3つの層に分離します:上層には約3 mLの細胞破片が含まれ、中間層には約3 mLの小核(MNs)が含まれ、下層には約39 mLの核が含まれます。 - 表面付近の上部3 mLの液体を取り出し、2番目のスクロース密度勾配のために中間層から未精製の小核3 mLを回収します。
5. ショ糖密度勾配 による MNの二次精製
- ショ糖密度勾配を準備します。
- 1.8 Mショ糖緩衝液(表3、 補足ファイル1)3 mLを15 mLコニカルチューブの底に加えます。
- 1.8 Mショ糖緩衝液の上に3 mLの1.5 Mショ糖緩衝液(表6、 補足ファイル1)を加えます。
- 最後に、1.5 Mショ糖緩衝液の上に3 mLの1.4 Mショ糖緩衝液(表7、 補足ファイル1)を加えます。
注意: ピペットの先端をコニカルチューブの上部内側に当て、溶液をゆっくりとピペットで掴みます。
- 第2のショ糖密度勾配から3層のショ糖密度勾配の上部に、中間層の3 mLをゆっくりとピペットで移します。
注意: 混合を避けるために、レイヤーをゆっくりと追加します。 - 水平ローター遠心分離機でチューブを500 × g で4°Cで20分間遠心分離します。
注:遠心分離後、上層には1〜4 mLの精製小核(MN)が含まれ、下層には主に8 mLの核が含まれます。 - 精製した小核の上部1〜4 mLを後で使用するために取っておきます。
6. MNの同定
- 未精製の小核溶液(ステップ4で得られたもの)と精製された小核溶液(ステップ5で得られたもの)を取り、スライド上に細胞塗抹標本を調製します。
- 4%パラホルムアルデヒド溶液を添加して、サンプルを室温(RT)で15分間固定します。
- スライドをPBS(0.01 M)で2回、1回の洗浄につき3分間洗浄します。
- 0.1% Triton X-100を添加し、室温で細胞を5分間透過処理します。
- 細胞を5% BSA中で室温で30分間ブロックします。
- 抗γ-H2AX(5%BSAで希釈、1:200)に対する一次抗体を添加し、室温で1時間インキュベートします。
- スライドをPBS(0.01 M)で2回、1回の洗浄につき5分間洗浄します。
- 二次抗体(5% BSA、1:500で希釈)を添加し、室温で暗所で1時間インキュベートします。
- DAPI色素溶液を加え、室温で15分間インキュベートします。
- スライドをPBS(0.01 M)で2回、1回の洗浄につき3分間洗浄します。
- スライドにシール液を塗布してシールします。
- 蛍光顕微鏡(倍率400×、オートフォーカス、オート露光)で蛍光を観察し、セルカウンティングプレートで小核をカウントします。
注:4%パラホルムアルデヒド、0.1%Triton X-100、および5%BSAをPBS(0.01 M)で希釈します。γ-H2AX(Gamma H2AX)は、DNA損傷に応答して形成されるヒストンH2AXタンパク質のリン酸化型です。核内では、ヒストンH2AXのリン酸化が特定の領域に集中しているため、抗γ-H2AX蛍光がむらとして現れることがあります。ヒストンH2AXのリン酸化は小核に集中しており、その結果、全体的に明るい蛍光が明瞭なスポットを有する36。DAPIはDNAに強く結合する蛍光色素で、蛍光顕微鏡でよく用いられます。小核には壊れたDNAやヒストン片が含まれているため、抗γ-H2AX蛍光抗体やDAPIで染色することができます。蛍光は、小核の数、サイズ、および完全性を示し、それらを核と区別し、精製効果を評価するのに役立つ32。
結果
放射線被ばく後、ヒト末梢血をRPMI-1640と60時間インキュベートし、次いでサイトカラシンBを小核(MN)調製のために添加した。リンパ球をリンパ球分離溶液を用いて単離した後、特別に構成された細胞溶解物を用いて溶解し、ガラスホモジナイザーで穏やかに均質化しました。ホモジネートを1.8 Mショ糖緩衝液と1:1で混合しました。未精製の小核は、最初のショ糖密度勾配遠心分離後に得られ、精製された小核は、2回目のショ糖密度勾配遠心分離後に得られました(図1)。
最初のショ糖密度勾配遠心分離後、未精製の小核を細胞塗抹標本に調製し、抗γ-H2AXおよびDAPI蛍光染色を行いました。その結果、未精製の小核のサイズには大きなばらつきがあり、より大きな小核がいくつか見えることが明らかになりました(図2A)。2回目のショ糖密度勾配遠心分離後、精製した小核を細胞塗抹標本に調製し、抗γ-H2AXおよびDAPI蛍光染色を行いました。その結果、精製された小核はより小さく、小核間のサイズ差はそれほど顕著ではなく、大きな核は観察されないことが示されました(図2B)。10mLの末梢血を基に、100,000〜200,000個の小核を得ることができます。
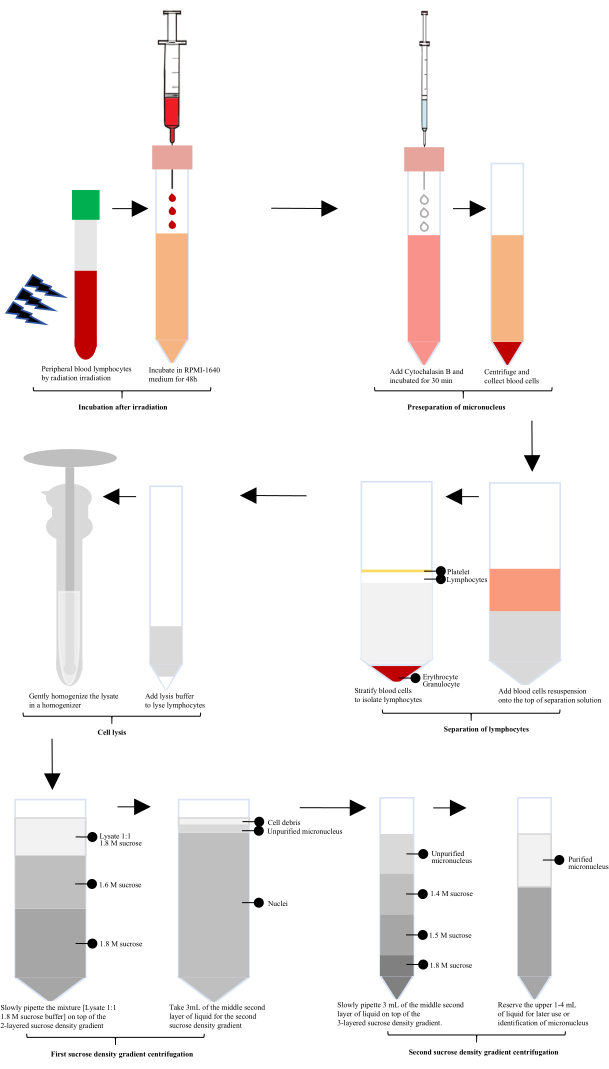
図1:照射後のリンパ球小核の抽出と精製の模式図。 照射後のプロセスには、インキュベーション、小核の事前分離、リンパ球の単離、細胞溶解、および2ラウンドのショ糖密度勾配遠心分離が含まれます。次に、精製された小核をこれらのステップを通じて取得します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:免疫蛍光法による小核の同定。(A)最初のショ糖密度勾配遠心分離後、未精製の小核を細胞塗抹標本として調製し、抗γ-H2AX(緑)およびDAPI(青)蛍光染色を行った。矢印は原子核を示しています。(B)2回目のショ糖密度勾配遠心分離後、精製した小核を細胞塗抹標本として調製し、抗γ-H2AXおよびDAPI蛍光染色を行った。スケールバー:10μmこの図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:このプロトコルで使用される試薬とバッファー。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この方法では、照射されたヒト末梢血リンパ球を用いて、小核(MN)の単離と精製を行いました。多くの先行研究で、MNの細胞溶解と一次分離の詳細なステップが報告されています4,32,33,34。細胞溶解溶液は、典型的には、0.1%NP−40を含んでおり、細胞膜を破壊しつつ、核膜への影響を最小限にとどめ、それにより核およびMNsの両方の完全性を維持する。組み立てが不完全なため、MN膜は2,29,30,31を破裂させやすく、分離および精製プロセスを複雑にします。通常、1.6 Mおよび1.8 Mのショ糖バッファーは、MNの初期分離のための密度勾配遠心分離で使用されます。スクロース緩衝液は、MNの保護と緩衝に役立ち、密度勾配4,32,33,34を介して微小核膜の分離を促進しながら、微小核膜の完全性を確保します。この方法では、リンパ球の溶解とMNの一次分離のためのこれらの重要なステップを慎重に追跡しました。
従来の小核(MN)分離法とは異なり、この方法は精製プロセスを改善します。フローサイトメトリーによるMNの精製は、以前に報告されています33,34。しかし、MNは選別プロセス中の流体のせん断力によって破裂する可能性があり、MN成分のさらなる検出を妨げる可能性があります。さらに、フローサイトメーターの利用が限られているため、MNソーティングのためのフローサイトメトリーの広範な適用が制限されています。他の研究では、MNの精製に二次ショ糖密度勾配遠心分離が採用されていますが、二次遠心分離に先立って超高速遠心分離が使用されていました4。この高速遠心分離は、一部のMNの破裂につながる可能性があり、これはその後のMN成分分析に悪影響を及ぼします。対照的に、このプロトコルでは、MNの単離と精製が重要なステップです。二次ショ糖密度勾配遠心分離は、MNの精製に使用され、第1のショ糖密度勾配遠心分離から得られたMN含有層を第2の遠心分離に直接さらします。このアプローチにより、超高速遠心分離によるMNsへのダメージを回避できます。
この方法は、ヒト末梢血リンパ球からのMNの単離と精製のみに焦点を当てており、腫瘍細胞などの他の細胞タイプは含まれていません。今後の研究では、さまざまな細胞タイプからのMNの精製を実証し、この手法の普遍性を高めることを目指しています。さらに、精製されたMN混合物の体積は比較的大きいままです。今後の取り組みでは、ショ糖密度勾配を最適化して高濃度のMN溶液を実現することに焦点を当て、MNの組成と機能のさらなる研究を促進します。
MNの出現は、染色体とDNAの損傷の程度を反映しており、放射線損傷の修復とがん細胞の形成に重要な役割を果たしています7,11,12,13,14,16,17,18,19。これらのプロセスは、MN内のタンパク質、核酸、およびその他のコンポーネントの役割と機能と密接に関連しています。したがって、MNの精製は、染色体およびDNA損傷に関連する疾患におけるMNの役割を研究するために重要です。この方法は、MN精製プロセスにおける二次ショ糖密度勾配遠心分離ステップを強化し、ヒト末梢血リンパ球におけるMNの形成を実証します。また、細胞溶解、第1のショ糖密度勾配を用いた一次分離、第2のショ糖密度勾配を用いた精製も含まれます。このアプローチは、MNの原因と機能を調査する研究者に明確な実験的枠組みを提供します。
開示事項
何一つ。
謝辞
すべての図は、WPSオフィス を通じて 著者によって作成されました。この研究は、成都医科大学自然科学財団(CYZ19-38)と四川省科学技術支援プログラム(2024NSFSC0592)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
参考文献
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved