Method Article
Estrazione e identificazione di micronuclei da linfociti del sangue periferico umano
In questo articolo
Riepilogo
Questo protocollo delinea un metodo per estrarre e purificare i micronuclei dai linfociti umani utilizzando la centrifugazione in gradiente di densità del saccarosio. Fornisce una base sperimentale per studiare la composizione e la funzione dei micronuclei.
Abstract
Un micronucleo (MN) è una struttura nucleare anomala che si forma nelle cellule, in particolare nel midollo osseo o nelle cellule del sangue, quando esposte a danni esterni, come le radiazioni, a causa di danni al DNA irrisolti o errori mitotici. Una volta formati, i MN possono contribuire attivamente a vari processi cancerogeni, tra cui la segnalazione infiammatoria e i riarrangiamenti genetici cromosomici. I MN contengono DNA nucleare, istoni, frammenti di nucleoproteine e altre proteine attive, che sono strettamente associate alle loro funzioni. Studiare la formazione e i componenti dei MN è fondamentale per comprendere il loro ruolo nel guidare i processi cancerogeni. L'estrazione e la purificazione dei MN sono essenziali per raggiungere questi obiettivi di ricerca. Tuttavia, l'instabilità della membrana nucleare MN e la sua suscettibilità alla rottura rendono questi processi tecnicamente impegnativi. Attualmente, solo pochi studi hanno riportato l'uso della centrifugazione in gradiente di densità per la separazione del MN. Questo studio riassume e semplifica i processi di separazione e purificazione del MN. I linfociti del sangue periferico umano esposti alle radiazioni sono stati isolati e gli MN sono stati separati e purificati utilizzando tamponi di saccarosio di diverse concentrazioni in un processo in due fasi. L'integrità e la purezza dei MN sono state verificate, fornendo una dimostrazione chiara e pratica della procedura sperimentale per i ricercatori che indagano le cause e le funzioni dei MN.
Introduzione
Il micronucleo (MN) è una struttura subcellulare nel citoplasma che contiene DNA nucleare, istoni e frammenti di nucleoproteine, circondata da strutture di membrana 1,2. Il MN è completamente separato dal nucleo principale e appare tipicamente vicino ad esso in una forma ovale o circolare, con una dimensione che varia da 1/16 a 1/3 del diametro del nucleo principale. La formazione di MN è principalmente associata a frammenti cromosomici acentrici, missegregazione cromosomica, rottura cromosomica dicentrica, instabilità cromosomica e aggregazione di doppi minuti (DB)3. Le MN si verificano raramente nelle cellule sane e sono prevalentemente causate dall'esposizione a genotossine esogene, che portano a danni al DNA o errori mitotici 4,5. Il danno da radiazioni contribuisce in modo significativo alla formazione di MN e l'esposizione umana alle radiazioni ionizzanti (IR) è aumentata con i progressi nelle applicazioni cliniche e tecnologiche 6,7. L'esposizione a infrarossi induce rotture a filamento singolo (SSB) e rotture a doppio filamento (DSB) nel DNA cellulare, che possono provocare la morte cellulare o l'apoptosi 8,9,10. Gli MN sono frammenti di cromosomi, cromosomi interi o cromatidi prodotti a causa di una riparazione non riparata o non corrispondente. Servono come indicatori critici del grado di danno causato da IR 7,11,12. Una comprensione completa dei componenti all'interno dei MN è essenziale per mitigare gli effetti collaterali della radioterapia e ridurre al minimo l'esposizione pubblica alle radiazioni indesiderate 6,13. Tuttavia, le proteine e gli acidi nucleici contenuti all'interno dei MN rimangono fino ad oggi caratterizzati in modo incompleto.
Si ritiene che le MN derivino dall'induzione di vari tipi di danni al DNA. I loro meccanismi di replicazione e le capacità di riparazione del DNA sono compromessi, portando a un esteso danno al DNA in un breve periodo 3,14,15. Le MN sono anche importanti indicatori di instabilità cromosomica, che è costantemente presente nelle cellule precancerose 3,14,16,17,18,19. I MN sono stati a lungo utilizzati come biomarcatori per la genotossicità, il rischio tumorale e il grado tumorale 3,20,21. Una volta formati, i MN possono guidare attivamente numerosi processi cancerogeni, tra cui la segnalazione infiammatoria22,23 e il riarrangiamento genetico cromosomico 24,25,26. Ad esempio, i MN avviano una cascata infiammatoria reclutando il recettore di riconoscimento del pattern virale (PRR) ciclico GMP-AMP sintasi (cGAS) dal citoplasma 4,22,23,27. Altre proteine che possono essere presenti nelle MN includono le esonucleasi28, i meccanismi trascrizionali4 e i cofattori di traduzione. Non è chiaro se le MN assemblino un profilo proteico unico e distorto dalla libreria proteica citoplasmatica o acquisiscano passivamente proteine ad alta abbondanza dal nucleo e dal citoplasma durante la loro formazione. Al di là delle singole proteine come il cGAS, la misura in cui ambienti specifici influenzano la composizione complessiva del MN non è ancora determinata. La comprensione dell'intero panorama dei micronuclei è limitata, senza set di dati pubblicamente disponibili per l'esplorazione. Pertanto, l'estrazione di MN completi e purificati è urgentemente necessaria per analisi approfondite e complete dei loro componenti.
Uno dei motivi del ritardo nella replicazione del DNA nei MN può essere lo stress di replicazione causato dalla mancanza di enzimi e cofattori necessari per la sintesi e la riparazione del DNA. Questa carenza può derivare da un assemblaggio difettoso dell'involucro nucleare MN, che porta all'assenza di un complesso di pori nucleari20. Di conseguenza, i MN non sono in grado di importare proteine chiave essenziali per mantenere l'integrità della membrana nucleare e la stabilità del genoma 2,29,30,31. La membrana nucleare MN incompleta è soggetta a rotture, rendendo l'estrazione del MN molto impegnativa.
Attualmente, i MN vengono estratti principalmente utilizzando la centrifugazione in gradiente di densità di saccarosio 27,32,33 e purificati mediante citometria a flusso34. In questo studio, il processo di separazione e purificazione dei MN è stato riassunto e semplificato. I linfociti del sangue periferico provenienti da esseri umani esposti alle radiazioni sono stati isolati e le MN sono state purificate due volte utilizzando tamponi di saccarosio di diverse concentrazioni. L'integrità e la purezza dei MN sono state verificate, fornendo ai ricercatori una dimostrazione sperimentale pratica e intuitiva per lo studio delle cause e delle funzioni dei MN.
Protocollo
Tutti gli esperimenti che hanno coinvolto campioni di sangue periferico umano sono stati condotti in conformità con le linee guida e le normative pertinenti. Questo studio è stato approvato dal Comitato etico dell'industria nucleare 416 Hospital, Cina (2020 Review [n. 48]) e ha ottenuto il consenso informato di tutti i partecipanti. I criteri di esclusione includevano individui con gravi malattie croniche, come tumori, gotta o disturbi del sangue, nonché coloro che erano esposti a sostanze radioattive o genotossiche nella loro professione. Per questo studio, 10 ml di sangue periferico sono stati raccolti da un maschio sano di 28 anni in una provetta per la raccolta del sangue contenente eparina sodica come anticoagulante. Il campione è stato irradiato in vitro con 60raggi Co γ a 37 °C utilizzando un dispositivo standard a livello terapeutico di energia cinetica gamma aria. La dose di irradiazione è stata impostata a 4,0 Gy, con un'intensità di dose di 0,6350 Gy/min. Dopo l'irradiazione, il campione è stato incubato a 37 °C per 2 ore, inoculato in terreno RPMI-1640 e coltivato a 37 °C per 60 ore. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono forniti nella Tabella dei materiali.
1. Preparazione del micronucleo e del nucleo
- Aggiungere la citocalasina B al terreno cellulare del sangue periferico per ottenere una concentrazione finale di 10 μg/mL. Incubare la miscela per 45 minuti a 37 °C.
NOTA: La citocalasina B è un inibitore della polimerizzazione dell'actina che facilita l'efficiente separazione dei micronuclei dal nucleo prima della lisi cellulare35. - Centrifugare le cellule del sangue a 200 × g per 5 minuti a 4 °C.
- Risospendere le cellule del sangue in 10 mL di 0,01 M PBS pre-raffreddato a 4 °C.
2. Isolamento dei linfociti
- Aggiungere 15 mL di soluzione per la separazione dei linfociti umani in una provetta conica da 50 mL. Sovrapporre accuratamente le cellule del sangue periferico sospese sopra la soluzione di separazione.
- Centrifugare la provetta a 400 × g per 30 minuti a 4 °C.
NOTA: Dopo la centrifugazione, le cellule del sangue nella provetta si separeranno in quattro strati distinti dall'alto verso il basso: il primo strato è lo strato di plasma (piastrine), il secondo strato è lo strato di linfociti bianchi lattigi, il terzo strato è lo strato liquido di separazione trasparente e il quarto strato è lo strato dei globuli rossi. - Trasferire con cautela il secondo strato (linfociti) in una provetta da centrifuga separata. Aggiungere PBS (0,01 M) a tre volte il volume delle celle trasferite, mescolare bene e centrifugare a 200 × g per 10 minuti a 4 °C. Eliminare il surnatante utilizzando una pipetta.
3. Lisi dei linfociti
- Posizionare il pellet di cella raccolto nel tubo conico sul ghiaccio.
- Aggiungere 6 mL di tampone di lisi a freddo (Tabella 1, File supplementare 1) e risospendere il pellet cellulare nel tampone di lisi.
NOTA: Il tampone di lisi deve essere integrato con gli ingredienti elencati nella Tabella 2, File supplementare 1, immediatamente prima dell'uso. - Trasferire il lisato cellulare in un omogeneizzatore di vetro.
- Utilizzare delicatamente una macinatura sciolta per omogeneizzare manualmente il campione muovendo l'omogeneizzatore su e giù 10 volte.
- Trasferire nuovamente il lisato cellulare omogeneizzato nella provetta conica da 50 mL.
NOTA: Eseguire tutti i passaggi delicatamente e mantenere il campione sul ghiaccio.
4. Isolamento iniziale di MN tramite un gradiente di densità di saccarosio
- Miscelare 5 mL di lisato cellulare con un volume uguale di tampone di saccarosio 1,8 M (Tabella 3, File supplementare 1) per ottenere un rapporto 1:1 tra lisato e tampone di saccarosio.
NOTA: Il tampone di saccarosio 1,8 M deve essere integrato con gli ingredienti elencati nella Tabella 4, File supplementare 1, immediatamente prima dell'uso. - Preparare il gradiente di densità del saccarosio: aggiungere 15 mL di tampone di saccarosio 1,6 M (Tabella 5, File supplementare 1) sul fondo di una provetta conica da 50 mL. Aggiungere lentamente 20 mL di tampone saccarosio 1,8 M (Tabella 3, File supplementare 1) sopra il tampone saccarosio 1,6 M.
NOTA: Sia il tampone saccarosio 1,6 M che il tampone saccarosio 1,8 M devono essere integrati con gli ingredienti nella Tabella 4, File supplementare 1, rispettivamente, immediatamente prima dell'uso. Per aggiungere i tamponi di saccarosio, posizionare la punta della pipetta contro il lato interno superiore del tubo conico e pipettare lentamente la soluzione. - Pipettare lentamente 10 mL della miscela [Lysate 1:1 1.8 M sucrosio buffer] sopra il gradiente di densità del saccarosio a due strati.
NOTA: Aggiungere gli strati lentamente per assicurarsi che lo strato tampone centrale da 1,8 M non si mescoli con lo strato tampone inferiore da 1,6 M e che la miscela superiore 1:1 di celle lisate e tampone saccarosio da 1,8 M non si mescoli con lo strato tampone da 1,8 M. - Centrifugare la provetta in una centrifuga a rotore orizzontale a 1000 × g per 20 minuti a 4 °C.
NOTA: Dopo la centrifugazione, il liquido si separerà in tre strati: lo strato superiore contiene circa 3 mL di detriti cellulari, lo strato intermedio contiene circa 3 mL di micronuclei (MN), lo strato inferiore contiene circa 39 mL di nuclei. - Rimuovere i 3 mL superiori di liquido vicino alla superficie e raccogliere i 3 mL di micronuclei non purificati dallo strato intermedio per il secondo gradiente di densità del saccarosio.
5. Purificazione secondaria dei MN tramite un gradiente di densità del saccarosio
- Preparare il gradiente di densità del saccarosio:
- Aggiungere 3 mL di tampone di saccarosio 1,8 M (Tabella 3, File supplementare 1) sul fondo di una provetta conica da 15 mL.
- Aggiungere 3 mL di tampone di saccarosio 1,5 M (Tabella 6, File supplementare 1) sopra il tampone di saccarosio 1,8 M.
- Infine, aggiungere 3 mL di tampone di saccarosio 1,4 M (Tabella 7, File supplementare 1) sopra il tampone di saccarosio 1,5 M.
NOTA: Posizionare la punta della pipetta contro il lato interno superiore del tubo conico e pipettare lentamente la soluzione.
- Pipettare lentamente 3 mL dello strato intermedio dal secondo gradiente di densità del saccarosio sulla parte superiore del gradiente di densità del saccarosio a tre strati.
NOTA: Aggiungere gli strati lentamente per evitare che si mescolino. - Centrifugare la provetta in una centrifuga a rotore orizzontale a 500 × g per 20 minuti a 4 °C.
NOTA: Dopo la centrifugazione, lo strato superiore conterrà 1-4 mL di micronuclei purificati (MN) e lo strato inferiore conterrà principalmente 8 mL di nuclei. - Conservare 1-4 ml superiori di micronuclei purificati per un uso successivo.
6. Identificazione dei MN
- Prelevare la soluzione di micronucleo non purificato (ottenuta nella fase 4) e la soluzione di micronucleo purificato (ottenuta nella fase 5) e preparare gli strisci cellulari sul vetrino.
- Aggiungere una soluzione di paraformaldeide al 4% per fissare il campione a temperatura ambiente (RT) per 15 minuti.
- Lavare i vetrini con PBS (0,01 M) due volte, 3 minuti per lavaggio.
- Aggiungere lo 0,1% di Triton X-100 per permeabilizzare le cellule a RT per 5 minuti.
- Bloccare le celle in BSA al 5% a RT per 30 min.
- Aggiungere l'anticorpo primario contro l'anti-γ-H2AX (diluito in BSA al 5%, 1:200) e incubare a RT per 1 ora.
- Lavare i vetrini con PBS (0,01 M) due volte, 5 minuti per lavaggio.
- Aggiungere l'anticorpo secondario (diluito in BSA al 5%, 1:500) e incubare a RT per 1 ora al buio.
- Aggiungere la soluzione colorante DAPI e incubare a RT per 15 minuti.
- Lavare i vetrini con PBS (0,01 M) due volte, 3 minuti per lavaggio.
- Applicare una soluzione sigillante sul vetrino per sigillarlo.
- Osservare la fluorescenza al microscopio a fluorescenza (ingrandimento: 400×, messa a fuoco automatica ed esposizione automatica) e contare i micronuclei utilizzando una piastra per il conteggio delle cellule.
NOTA: Il 4% di paraformaldeide, lo 0,1% di Triton X-100 e il 5% di BSA sono diluiti con PBS (0,01 M). γ-H2AX (Gamma H2AX) è una forma fosforilata della proteina H2AX dell'isto, formatasi in risposta a un danno al DNA. Nel nucleo, la fosforilazione dell'istone H2AX è concentrata in alcune regioni, quindi la fluorescenza anti-γ-H2AX può apparire a macchia di leopardo. La fosforilazione dell'istone H2AX è concentrata nel micronucleo, risultando in una fluorescenza complessivamente più luminosa con macchie distinte36. DAPI è un colorante fluorescente che si lega fortemente al DNA ed è spesso utilizzato nella microscopia a fluorescenza. Poiché i micronuclei contengono frammenti di DNA e istoni rotti, possono essere colorati con anticorpi fluorescenti anti-γ-H2AX e DAPI. La fluorescenza indicherà il numero, le dimensioni e la completezza dei micronuclei, aiutando a distinguerli dai nuclei e a valutare l'efficacia della purificazione32.
Risultati
Dopo l'esposizione alle radiazioni, il sangue periferico umano è stato incubato con RPMI-1640 per 60 ore, quindi è stata aggiunta la citocalasina B per la preparazione del micronucleo (MN). I linfociti sono stati isolati utilizzando una soluzione di separazione dei linfociti, seguita da lisi con un lisato cellulare appositamente configurato e da una delicata omogeneizzazione in un omogeneizzatore di vetro. L'omogenato è stato miscelato 1:1 con tampone di saccarosio 1,8 M. I micronuclei non purificati sono stati ottenuti dopo la prima centrifugazione in gradiente di densità di saccarosio e i micronuclei purificati sono stati ottenuti dopo la seconda centrifugazione in gradiente di densità di saccarosio (Figura 1).
Dopo la prima centrifugazione in gradiente di densità del saccarosio, i micronuclei non purificati sono stati preparati in strisci cellulari e sottoposti a colorazione a fluorescenza anti-γ-H2AX e DAPI. I risultati hanno rivelato un'ampia variazione nelle dimensioni dei micronuclei non purificati, con alcuni micronuclei più grandi visibili (Figura 2A). Dopo la seconda centrifugazione in gradiente di densità di saccarosio, i micronuclei purificati sono stati preparati in strisci cellulari e sottoposti a colorazione a fluorescenza anti-γ-H2AX e DAPI. I risultati hanno mostrato che i micronuclei purificati erano più piccoli e che la differenza di dimensioni tra i micronuclei era meno pronunciata, senza nuclei grandi osservati (Figura 2B). Sulla base di 10 ml di sangue periferico, si possono ottenere da 100.000 a 200.000 micronuclei.
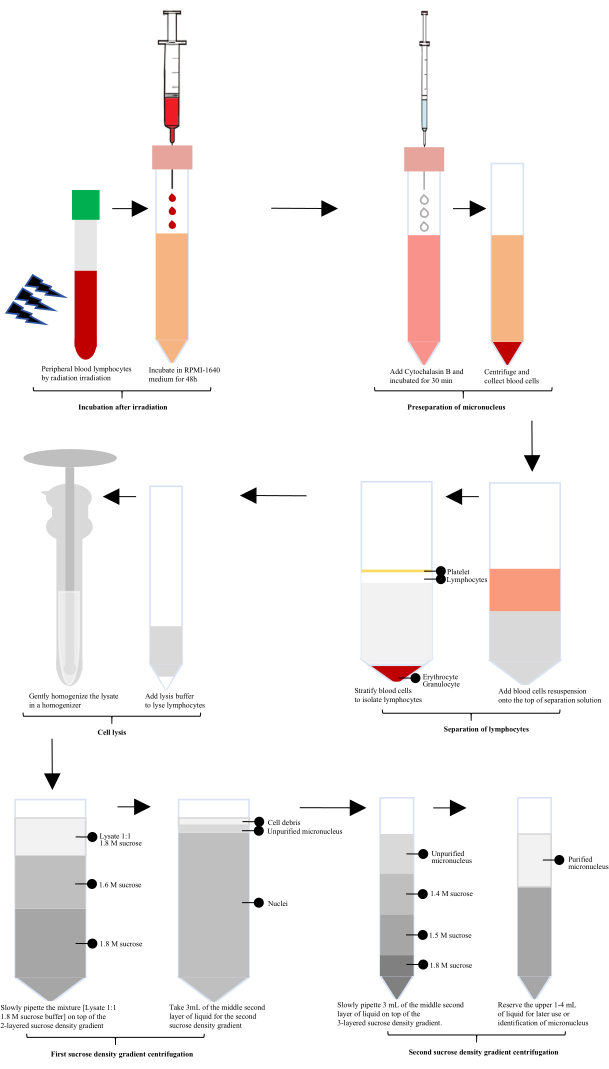
Figura 1: Diagramma schematico dell'estrazione e della purificazione dei micronuclei linfocitari dopo irradiazione. Dopo l'irradiazione, il processo prevede l'incubazione, la preseparazione del micronucleo, l'isolamento dei linfociti, la lisi cellulare e due cicli di centrifugazione in gradiente di densità di saccarosio. Attraverso questi passaggi si ottengono quindi micronuclei purificati. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Identificazione di micronuclei tramite immunofluorescenza. (A) Dopo la prima centrifugazione in gradiente di densità di saccarosio, i micronuclei non purificati sono stati preparati come strisci cellulari e sottoposti a colorazione a fluorescenza anti-γ-H2AX (verde) e DAPI (blu). Le frecce indicano i nuclei. (B) Dopo la seconda centrifugazione in gradiente di densità di saccarosio, i micronuclei purificati sono stati preparati come strisci cellulari e sottoposti a colorazione a fluorescenza anti-γ-H2AX e DAPI. Barre di scala: 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Reagenti e tamponi utilizzati in questo protocollo. Clicca qui per scaricare questo file.
Discussione
In questo metodo, sono stati utilizzati linfociti del sangue periferico umano irradiati per l'isolamento e la purificazione dei micronuclei (MN). Molti studi precedenti hanno riportato le fasi dettagliate per la lisi cellulare e la separazione primaria dei MN 4,32,33,34. La soluzione di lisi cellulare include tipicamente lo 0,1% di NP-40 per distruggere la membrana cellulare mentre ha un effetto minimo sulla membrana nucleare, preservando così l'integrità sia del nucleo che dei MN. In particolare, anche altri componenti del lisato svolgono un ruolo tampone 4,32,33,34. A causa dell'assemblaggio incompleto, la membrana MN è soggetta a rottura 2,29,30,31, il che complica il processo di separazione e purificazione. Tipicamente, i tamponi saccarosio da 1,6 M e 1,8 M vengono utilizzati nella centrifugazione in gradiente di densità per la separazione iniziale dei MN. I tamponi di saccarosio aiutano a proteggere e tamponare gli MN, garantendo l'integrità della membrana micronucleare e facilitando la loro separazione attraverso il gradiente di densità 4,32,33,34. In questo metodo, questi passaggi chiave per la lisi dei linfociti e la separazione primaria dei MN sono stati seguiti attentamente.
A differenza dei precedenti metodi di separazione dei micronuclei (MN), questo metodo migliora il processo di purificazione. La purificazione dei MN mediante citometria a flusso è stata riportata in precedenza33,34. Tuttavia, gli MN possono rompersi a causa delle forze di taglio del fluido durante il processo di selezione, il che può ostacolare l'ulteriore rilevamento dei componenti MN. Inoltre, la disponibilità limitata di citometri a flusso limita l'applicazione diffusa della citometria a flusso per lo smistamento MN. Altri studi hanno impiegato la centrifugazione secondaria in gradiente di densità di saccarosio per purificare i MN, ma la centrifugazione ad altissima velocità è stata utilizzata prima della centrifugazione secondaria4. Questa centrifugazione ad alta velocità può portare alla rottura di alcuni MN, il che è dannoso per la successiva analisi dei componenti MN. Al contrario, in questo protocollo, l'isolamento e la purificazione dei MN è un passaggio critico. La centrifugazione secondaria in gradiente di densità di saccarosio viene impiegata per purificare gli MN, con lo strato contenente MN ottenuto dalla prima centrifugazione in gradiente di densità di saccarosio direttamente sottoposto alla seconda centrifugazione. Questo approccio evita i danni ai MN causati dalla centrifugazione ad altissima velocità.
Questo metodo si concentra esclusivamente sull'isolamento e la purificazione dei MN dai linfociti del sangue periferico umano e non include altri tipi di cellule, come le cellule tumorali. Gli studi futuri mireranno a dimostrare la purificazione dei MN da vari tipi di cellule per migliorare l'universalità del metodo. Inoltre, il volume della miscela di MN purificata rimane relativamente grande. Gli sforzi futuri si concentreranno sull'ottimizzazione del gradiente di densità del saccarosio per ottenere soluzioni MN altamente concentrate, che faciliterebbero ulteriori indagini sulla composizione e la funzione dei MN.
La comparsa di MN riflette l'entità del danno cromosomico e del DNA e svolge un ruolo significativo nella riparazione del danno da radiazioni e nella formazione delle cellule tumorali 7,11,12,13,14,16,17,18,19. Questi processi sono strettamente associati ai ruoli e alle funzioni delle proteine, degli acidi nucleici e di altri componenti all'interno dei MN. Pertanto, la purificazione dei MN è fondamentale per studiare il loro ruolo nelle malattie legate al danno cromosomico e al DNA. Questo metodo migliora la fase di centrifugazione secondaria con gradiente di densità di saccarosio nel processo di purificazione del MN e dimostra la formazione di MN nei linfociti del sangue periferico umano. Include anche la lisi cellulare, la separazione primaria utilizzando il primo gradiente di densità del saccarosio e la purificazione con il secondo gradiente di densità del saccarosio. Questo approccio fornisce un quadro sperimentale chiaro per i ricercatori che studiano le cause e le funzioni dei MN.
Divulgazioni
Nessuno.
Riconoscimenti
Tutte le figure sono state create dagli autori tramite l'ufficio WPS. Questo lavoro è stato sostenuto dalla Natural Science Foundation of Chengdu Medical College (CYZ19-38) e dal Programma di supporto scientifico e tecnologico della provincia del Sichuan (2024NSFSC0592).
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
Riferimenti
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon