Method Article
Extraction et identification de micronoyaux à partir de lymphocytes du sang périphérique humain
Dans cet article
Résumé
Ce protocole décrit une méthode d’extraction et de purification des micronoyaux de lymphocytes humains à l’aide de la centrifugation par gradient de densité de saccharose. Il fournit une base expérimentale pour l’étude de la composition et de la fonction des micronoyaux.
Résumé
Un micronoyau (MN) est une structure nucléaire anormale qui se forme dans les cellules, en particulier la moelle osseuse ou les cellules sanguines, lorsqu’elle est exposée à des dommages externes, tels que des radiations, en raison de dommages non résolus à l’ADN ou d’erreurs mitotiques. Une fois formés, les MN peuvent contribuer activement à divers processus cancérigènes, notamment la signalisation inflammatoire et les réarrangements génétiques chromosomiques. Les MN contiennent de l’ADN nucléaire, des histones, des fragments de nucléoprotéines et d’autres protéines actives, qui sont étroitement associées à leurs fonctions. L’étude de la formation et des composants des MN est cruciale pour comprendre leur rôle dans les processus cancérigènes. L’extraction et la purification des MN sont essentielles à l’atteinte de ces objectifs de recherche. Cependant, l’instabilité de la membrane nucléaire MN et sa susceptibilité à la rupture rendent ces processus techniquement difficiles. À l’heure actuelle, seules quelques études ont rapporté l’utilisation de la centrifugation à gradient de densité pour la séparation des MN. Cette étude résume et simplifie les processus de séparation et de purification des MN. Les lymphocytes du sang périphérique humain exposés aux radiations ont été isolés, et les MN ont été séparés et purifiés à l’aide de tampons de saccharose de différentes concentrations dans un processus en deux étapes. L’intégrité et la pureté des MN ont été vérifiées, fournissant une démonstration claire et pratique de la procédure expérimentale pour les chercheurs qui étudient les causes et les fonctions des MN.
Introduction
Le micronoyau (MN) est une structure subcellulaire du cytoplasme qui contient de l’ADN nucléaire, des histones et des fragments de nucléoprotéines, entourés de structures membranaires 1,2. Le MN est complètement séparé du noyau principal et apparaît généralement près de lui sous une forme ovale ou circulaire, avec une taille allant de 1/16 à 1/3 du diamètre du noyau principal. La formation de MN est principalement associée à des fragments de chromosomes acentriques, à une déségrégation chromosomique, à une rupture chromosomique dicentrique, à une instabilité chromosomique et à l’agrégation de minutes doubles (DB)3. Les MN sont rarement présents dans les cellules saines et sont principalement causés par l’exposition à des génotoxines exogènes, qui entraînent des dommages à l’ADN ou des erreurs mitotiques 4,5. Les dommages causés par les rayonnements contribuent de manière significative à la formation de MN, et l’exposition humaine aux rayonnements ionisants (IR) a augmenté avec les progrès des applications cliniques et technologiques 6,7. L’exposition aux IR induit des cassures simple brin (SSB) et des cassures double brin (DSB) dans l’ADN cellulaire, ce qui peut entraîner la mort cellulaire ou l’apoptose 8,9,10. Les MN sont des fragments de chromosomes, des chromosomes entiers ou des chromatides produits en raison d’une réparation DSB non réparée ou incompatible. Ils servent d’indicateurs critiques de l’ampleur des dommages causés par l’IR 7,11,12. Une compréhension complète des composants des MN est essentielle pour atténuer les effets secondaires de la radiothérapie et minimiser l’exposition du public aux rayonnements indésirables 6,13. Cependant, les protéines et les acides nucléiques contenus dans les MN restent incomplètement caractérisés à ce jour.
On pense que les MN résultent de l’induction de divers types de dommages à l’ADN. Leurs mécanismes de réplication et leurs capacités de réparation de l’ADN sont altérés, entraînant des dommages importants à l’ADN dans un court laps de temps 3,14,15. Les MN sont également des indicateurs importants de l’instabilité chromosomique, qui est constamment présente dans les cellules précancéreuses 3,14,16,17,18,19. Les MN sont utilisés depuis longtemps comme biomarqueurs de la génotoxicité, du risque de tumeur et du gradetumoral 3,20,21. Une fois formés, les MN peuvent activement piloter de nombreux processus cancérigènes, y compris la signalisation inflammatoire22,23 et le réarrangement génétique chromosomique 24,25,26. Par exemple, les MN déclenchent une cascade inflammatoire en recrutant le récepteur de reconnaissance de motifs viraux (PRR) GMP-AMP synthase cyclique (cGAS) à partir du cytoplasme 4,22,23,27. D’autres protéines qui peuvent être présentes dans les MN comprennent les exonucléases28, les mécanismes transcriptionnels4 et les cofacteurs de traduction. Il n’est pas clair si les MN assemblent un profil protéique unique et biaisé à partir de la bibliothèque de protéines cytoplasmiques ou s’ils acquièrent passivement des protéines à haute abondance du noyau et du cytoplasme au cours de leur formation. Au-delà des protéines individuelles telles que le cGAS, la mesure dans laquelle des environnements spécifiques influencent la composition globale des MN n’est pas encore déterminée. La compréhension de l’ensemble du paysage des micronoyaux est limitée, et il n’existe aucun ensemble de données accessibles au public pour l’exploration. Par conséquent, il est urgent d’extraire des MN complets et purifiés pour des analyses approfondies et complètes de leurs composants.
L’une des raisons du retard de la réplication de l’ADN dans les MN peut être le stress de réplication causé par un manque d’enzymes et de cofacteurs nécessaires à la synthèse et à la réparation de l’ADN. Cette déficience peut résulter d’un assemblage défectueux de l’enveloppe nucléaire MN, conduisant à l’absence d’un complexe de pores nucléaires20. Par conséquent, les MN sont incapables d’importer des protéines clés essentielles au maintien de l’intégrité de la membrane nucléaire et de la stabilité du génome 2,29,30,31. La membrane nucléaire MN incomplète est sujette à la rupture, ce qui rend l’extraction MN très difficile.
Actuellement, les MN sont principalement extraits à l’aide de la centrifugation à gradient de densité de saccharose 27,32,33 et purifiés par cytométrie en flux34. Dans cette étude, le processus de séparation et de purification des MN a été résumé et simplifié. Des lymphocytes du sang périphérique provenant d’humains exposés à des radiations ont été isolés et les MN ont été purifiés deux fois à l’aide de tampons de saccharose de concentrations différentes. L’intégrité et la pureté des MN ont été vérifiées, fournissant aux chercheurs une démonstration expérimentale pratique et intuitive pour étudier les causes et les fonctions des MN.
Protocole
Toutes les expériences impliquant des échantillons de sang périphérique humain ont été menées conformément aux directives et réglementations en vigueur. Cette étude a été approuvée par le Comité d’éthique de l’hôpital 416 de l’industrie nucléaire, en Chine (2020 Review [n° 48]), et le consentement éclairé a été obtenu de tous les participants. Les critères d’exclusion comprenaient les personnes atteintes de maladies chroniques graves, telles que les tumeurs, la goutte ou les troubles sanguins, ainsi que celles exposées à des substances radioactives ou génotoxiques dans leur profession. Dans le cadre de cette étude, 10 mL de sang périphérique ont été prélevés sur un homme en bonne santé de 28 ans dans un tube de prélèvement sanguin contenant de l’héparine sodique comme anticoagulant. L’échantillon a été irradié in vitro avec des rayons γ de 60Co à 37 °C à l’aide d’un dispositif étalon de niveau thérapeutique à énergie cinétique gamma air. La dose d’irradiation a été fixée à 4,0 Gy, avec un débit de dose de 0,6350 Gy/min. Après l’irradiation, l’échantillon a été incubé à 37 °C pendant 2 h, inoculé dans un milieu RPMI-1640 et cultivé à 37 °C pendant 60 h. Des détails sur les réactifs et l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Préparation du micronoyau et du noyau
- Ajouter la cytochalasine B dans le milieu des cellules sanguines périphériques pour obtenir une concentration finale de 10 μg/mL. Incuber le mélange pendant 45 min à 37 °C.
REMARQUE : La cytochalasine B est un inhibiteur de la polymérisation de l’actine qui facilite la séparation efficace des micronoyaux du noyau avant la lyse cellulaire35. - Centrifuger les cellules sanguines à 200 × g pendant 5 min à 4 °C.
- Remettre les cellules sanguines en suspension dans 10 mL de PBS 0,01 M pré-refroidi à 4 °C.
2. Isolement des lymphocytes
- Ajouter 15 ml de solution de séparation des lymphocytes humains dans un tube conique de 50 ml. Superposez soigneusement les cellules sanguines périphériques en suspension sur la solution de séparation.
- Centrifuger le tube à 400 × g pendant 30 min à 4 °C.
REMARQUE : Après la centrifugation, les cellules sanguines du tube se sépareront en quatre couches distinctes de haut en bas : la première couche est la couche de plasma (plaquettes), la deuxième couche est la couche de lymphocytes blanc laiteux annulaire, la troisième couche est la couche liquide de séparation transparente et la quatrième couche est la couche de globules rouges. - Transférez avec précaution la deuxième couche (lymphocytes) dans un tube à centrifuger séparé. Ajouter du PBS (0,01 M) à trois fois le volume des cellules transférées, bien mélanger et centrifuger à 200 × g pendant 10 min à 4 °C. Jetez le surnageant à l’aide d’une pipette.
3. Lyse des lymphocytes
- Placez la pastille de cellule recueillie dans le tube conique sur de la glace.
- Ajouter 6 mL de tampon de lyse à froid (Tableau 1, Fichier supplémentaire 1) et remettre en suspension la pastille de cellule dans le tampon de lyse.
REMARQUE : Le tampon de lyse doit être complété par les ingrédients énumérés au tableau 2, fichier supplémentaire 1, immédiatement avant l’utilisation. - Transférez le lysat cellulaire dans un homogénéisateur en verre.
- Utilisez doucement un broyeur lâche pour homogénéiser manuellement l’échantillon en déplaçant l’homogénéisateur de haut en bas 10 fois.
- Transférez le lysat cellulaire homogénéisé dans le tube conique de 50 ml.
REMARQUE : Effectuez toutes les étapes doucement et gardez l’échantillon sur de la glace.
4. Isolement initial des MN via un gradient de densité de saccharose
- Mélanger 5 mL de lysat cellulaire avec un volume égal de tampon de saccharose de 1,8 M (tableau 3, fichier supplémentaire 1) pour obtenir un rapport de 1:1 entre le lysat et le tampon de saccharose.
REMARQUE : Le tampon de saccharose de 1,8 M doit être complété par les ingrédients énumérés au tableau 4, fichier supplémentaire 1, immédiatement avant l’utilisation. - Ajouter 15 mL de tampon de saccharose de 1,6 M (tableau 5, fichier supplémentaire 1) au fond d’un tube conique de 50 mL. Ajouter lentement 20 mL de tampon de saccharose de 1,8 M (tableau 3, fichier supplémentaire 1) sur le tampon de saccharose de 1,6 M.
REMARQUE : Le tampon de saccharose de 1,6 M et le tampon de saccharose de 1,8 M doivent être complétés par les ingrédients du tableau 4, fichier supplémentaire 1, respectivement, immédiatement avant l’utilisation. Pour ajouter les tampons de saccharose, placez la pointe de la pipette contre la face intérieure supérieure du tube conique et pipetez lentement la solution. - Pipetez lentement 10 ml du mélange [Lysat 1:1 1,8 M tampon de saccharose] sur le gradient de densité du saccharose à deux couches.
REMARQUE : Ajoutez les couches lentement pour vous assurer que la couche tampon centrale de 1,8 M ne se mélange pas avec la couche tampon inférieure de 1,6 M, et que le mélange supérieur 1:1 de cellules lysées et de tampon de saccharose de 1,8 M ne se mélange pas avec la couche tampon de 1,8 M. - Centrifuger le tube dans une centrifugeuse à rotor horizontal à 1000 × g pendant 20 min à 4 °C.
REMARQUE : Après centrifugation, le liquide se sépare en trois couches : la couche supérieure contient environ 3 ml de débris cellulaires, la couche intermédiaire contient environ 3 ml de micronoyaux (MN), la couche inférieure contient environ 39 ml de noyaux. - Retirer les 3 mL supérieurs de liquide près de la surface et recueillir les 3 mL de micronoyaux non purifiés de la couche intermédiaire pour le deuxième gradient de densité du saccharose.
5. Purification secondaire des MN via un gradient de densité de saccharose
- Préparez le gradient de densité du saccharose :
- Ajouter 3 mL de tampon saccharose de 1,8 M (tableau 3, fichier supplémentaire 1) au fond d’un tube conique de 15 mL.
- Ajouter 3 mL de tampon de saccharose de 1,5 M (tableau 6, fichier supplémentaire 1) sur le tampon de saccharose de 1,8 M.
- Enfin, ajoutez 3 mL de tampon de saccharose de 1,4 M (tableau 7, fichier supplémentaire 1) par-dessus le tampon de saccharose de 1,5 M.
REMARQUE : Placez la pointe de la pipette contre la face intérieure supérieure du tube conique et pipetez lentement la solution.
- Pipetez lentement 3 ml de la couche intermédiaire du deuxième gradient de densité de saccharose sur le dessus du gradient de densité de saccharose à trois couches.
REMARQUE : Ajoutez les couches lentement pour éviter de mélanger. - Centrifuger le tube dans une centrifugeuse à rotor horizontal à 500 × g pendant 20 min à 4 °C.
REMARQUE : Après centrifugation, la couche supérieure contiendra 1 à 4 mL de micronoyaux purifiés (MN), et la couche inférieure contiendra principalement 8 mL de noyaux. - Réservez les 1 à 4 ml supérieurs de micronoyaux purifiés pour une utilisation ultérieure.
6. Identification des MN
- Prenez la solution de micronoyau non purifiée (obtenue à l’étape 4) et la solution de micronoyau purifié (obtenue à l’étape 5) et préparez des frottis cellulaires sur la lame.
- Ajouter une solution de paraformaldéhyde à 4 % pour fixer l’échantillon à température ambiante (RT) pendant 15 min.
- Lavez les lames avec du PBS (0,01 M) deux fois, 3 min par lavage.
- Ajouter 0,1 % de Triton X-100 pour perméabiliser les cellules à la RT pendant 5 min.
- Bloquez les cellules dans 5 % de BSA à RT pendant 30 min.
- Ajouter l’anticorps primaire contre l’anti-γ-H2AX (dilué dans 5 % BSA, 1:200) et incuber à RT pendant 1 h.
- Lavez les lames avec du PBS (0,01 M) deux fois, 5 min par lavage.
- Ajouter l’anticorps secondaire (dilué dans 5 % BSA, 1:500) et incuber à RT pendant 1 h dans l’obscurité.
- Ajouter la solution de colorant DAPI et incuber à RT pendant 15 min.
- Lavez les lames avec du PBS (0,01 M) deux fois, 3 min par lavage.
- Appliquez une solution d’étanchéité sur la lame pour l’étanchéité.
- Observez la fluorescence au microscope à fluorescence (grossissement : 400×, mise au point automatique et exposition automatique) et comptez les micronoyaux à l’aide d’une plaque de comptage cellulaire.
REMARQUE : 4 % de paraformaldéhyde, 0,1 % de Triton X-100 et 5 % de BSA sont dilués avec du PBS (0,01 M). γ-H2AX (Gamma H2AX) est une forme phosphorylée de la protéine Histone H2AX, formée en réponse à des dommages à l’ADN. Dans le noyau, la phosphorylation de l’histone H2AX est concentrée dans certaines régions, de sorte que la fluorescence anti-γ-H2AX peut apparaître inégale. La phosphorylation de l’histone H2AX est concentrée dans le micronoyau, ce qui entraîne une fluorescence globale plus brillante avec des taches distinctes36. Le DAPI est un colorant fluorescent qui se lie fortement à l’ADN et est souvent utilisé en microscopie à fluorescence. Étant donné que les micronoyaux contiennent des fragments d’ADN et d’histones brisés, ils peuvent être colorés par des anticorps fluorescents anti-γ-H2AX et du DAPI. La fluorescence indiquera le nombre, la taille et l’exhaustivité des micronoyaux, ce qui aidera à les distinguer des noyaux et à évaluer l’efficacité de la purification32.
Résultats
Après l’exposition aux rayonnements, du sang périphérique humain a été incubé avec le RPMI-1640 pendant 60 h, puis la cytochalasine B a été ajoutée pour la préparation du micronoyau (MN). Les lymphocytes ont été isolés à l’aide d’une solution de séparation des lymphocytes, suivis d’une lyse avec un lysat cellulaire spécialement configuré et d’une homogénéisation douce dans un homogénéisateur en verre. L’homogénat a été mélangé 1:1 avec un tampon de saccharose de 1,8 M. Des micronoyaux non purifiés ont été obtenus après la première centrifugation par gradient de densité de saccharose, et des micronoyaux purifiés ont été obtenus après la deuxième centrifugation par gradient de densité de saccharose (Figure 1).
Après la première centrifugation par gradient de densité de saccharose, des micronoyaux non purifiés ont été préparés en frottis cellulaires et soumis à une coloration par fluorescence anti-γ-H2AX et DAPI. Les résultats ont révélé une grande variation dans la taille des micronoyaux non purifiés, avec quelques micronoyaux plus gros visibles (Figure 2A). Après la deuxième centrifugation par gradient de densité de saccharose, des micronoyaux purifiés ont été préparés en frottis cellulaires et soumis à une coloration par fluorescence anti-γ-H2AX et DAPI. Les résultats ont montré que les micronoyaux purifiés étaient plus petits et que la différence de taille entre les micronoyaux était moins prononcée, sans qu’aucun gros noyau n’ait été observé (Figure 2B). Sur la base de 10 ml de sang périphérique, on peut obtenir 100 000 à 200 000 micronoyaux.
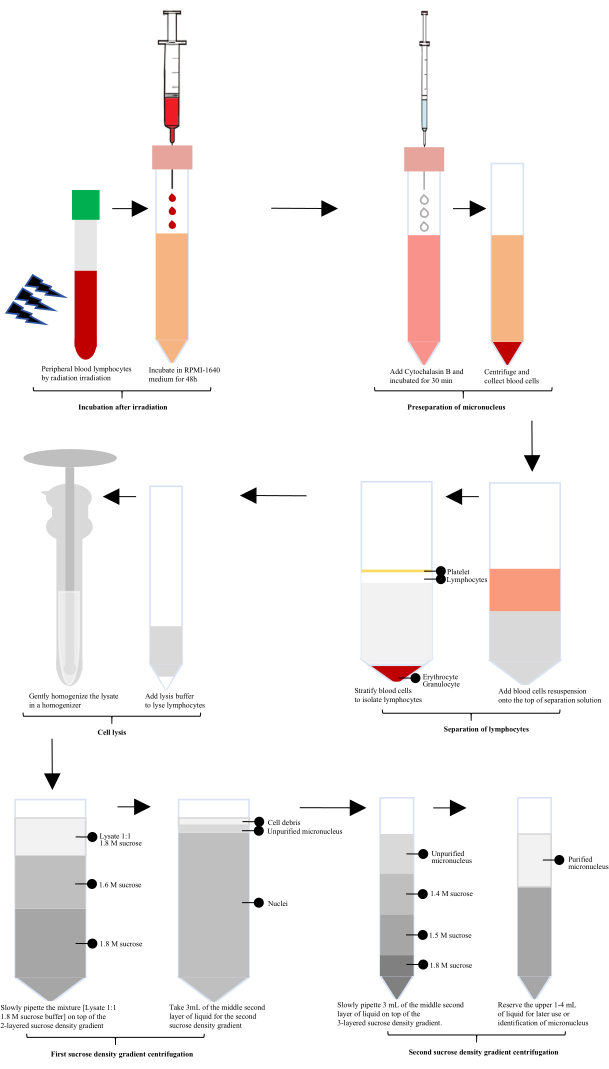
Figure 1 : Schéma de principe de l’extraction et de la purification des micronoyaux lymphocytaires après irradiation. Après l’irradiation, le processus implique l’incubation, la préséparation des micronoyaux, l’isolement des lymphocytes, la lyse cellulaire et deux cycles de centrifugation par gradient de densité de saccharose. Des micronoyaux purifiés sont ensuite obtenus par ces étapes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Identification de micronoyaux par immunofluorescence. (A) Après la première centrifugation par gradient de densité de saccharose, des micronoyaux non purifiés ont été préparés sous forme de frottis cellulaires et soumis à une coloration par fluorescence anti-γ-H2AX (vert) et DAPI (bleu). Les flèches indiquent les noyaux. (B) Après la deuxième centrifugation par gradient de densité de saccharose, des micronoyaux purifiés ont été préparés sous forme de frottis cellulaires et soumis à une coloration par fluorescence anti-γ-H2AX et DAPI. Barres d’échelle : 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Réactifs et tampons utilisés dans ce protocole. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cette méthode, des lymphocytes du sang périphérique humain irradiés ont été utilisés pour l’isolement et la purification des micronoyaux (MN). De nombreuses études antérieures ont rapporté les étapes détaillées de la lyse cellulaire et de la séparation primaire des MN 4,32,33,34. La solution de lyse cellulaire comprend généralement 0,1 % de NP-40 pour perturber la membrane cellulaire tout en ayant un effet minimal sur la membrane nucléaire, préservant ainsi l’intégrité du noyau et des MN. Notamment, d’autres composants du lysat jouent également un rôle tampon 4,32,33,34. En raison d’un assemblage incomplet, la membrane MN est sujette à la rupture 2,29,30,31, ce qui complique le processus de séparation et de purification. En règle générale, les tampons de saccharose de 1,6 M et 1,8 M sont utilisés dans la centrifugation par gradient de densité pour la séparation initiale des MN. Les tampons de saccharose aident à protéger et à tamponner les MN, assurant l’intégrité de la membrane micronucléaire tout en facilitant leur séparation via le gradient de densité 4,32,33,34. Dans cette méthode, ces étapes clés pour la lyse des lymphocytes et la séparation primaire des MN ont été soigneusement suivies.
Contrairement aux méthodes précédentes de séparation des micronoyaux (MN), cette méthode améliore le processus de purification. La purification des MN par cytométrie en flux a déjà été signalée 33,34. Cependant, les MN peuvent se rompre en raison des forces de cisaillement du fluide pendant le processus de tri, ce qui peut entraver la détection ultérieure des composants MN. De plus, la disponibilité limitée des cytomètres en flux limite l’application généralisée de la cytométrie en flux pour le tri des MN. D’autres études ont utilisé la centrifugation secondaire à gradient de densité de saccharose pour purifier les MN, mais la centrifugation à ultra-haute vitesse a été utilisée avant la centrifugation secondaire4. Cette centrifugation à grande vitesse peut entraîner la rupture de certains MN, ce qui est préjudiciable à l’analyse ultérieure des composants MN. En revanche, dans ce protocole, l’isolement et la purification des MN sont une étape critique. La centrifugation secondaire par gradient de densité de saccharose est utilisée pour purifier les MN, la couche contenant des MN obtenue à partir de la première centrifugation par gradient de densité de saccharose étant directement soumise à la seconde centrifugation. Cette approche permet d’éviter les dommages causés aux MN par la centrifugation à ultra-grande vitesse.
Cette méthode se concentre uniquement sur l’isolement et la purification des MN à partir des lymphocytes du sang périphérique humain et n’inclut pas d’autres types de cellules, telles que les cellules tumorales. Les études futures viseront à démontrer la purification des MN de divers types de cellules afin d’améliorer l’universalité de la méthode. De plus, le volume du mélange de MN purifié reste relativement important. Les efforts futurs se concentreront sur l’optimisation du gradient de densité du saccharose pour obtenir des solutions de MN hautement concentrées, ce qui faciliterait une étude plus approfondie de la composition et de la fonction des MN.
L’apparition des MN reflète l’étendue des dommages aux chromosomes et à l’ADN et joue un rôle important dans la réparation des dommages causés par les radiations et la formation des cellules cancéreuses 7,11,12,13,14,16,17,18,19. Ces processus sont étroitement associés aux rôles et aux fonctions des protéines, des acides nucléiques et d’autres composants des MN. Par conséquent, la purification des MN est essentielle pour étudier leur rôle dans les maladies liées aux dommages aux chromosomes et à l’ADN. Cette méthode améliore l’étape secondaire de centrifugation par gradient de densité du saccharose dans le processus de purification des MN et démontre la formation de MN dans les lymphocytes du sang périphérique humain. Il comprend également la lyse cellulaire, la séparation primaire à l’aide du premier gradient de densité de saccharose et la purification à l’aide du second gradient de densité de saccharose. Cette approche fournit un cadre clair et expérimental aux chercheurs qui étudient les causes et les fonctions des MN.
Déclarations de divulgation
Aucun.
Remerciements
Toutes les figures ont été créées par les auteurs via le bureau WPS. Ce travail a été soutenu par la Fondation des sciences naturelles de la faculté de médecine de Chengdu (CYZ19-38) et le programme de soutien à la science et à la technologie de la province du Sichuan (2024NSFSC0592).
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
Références
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon