Method Article
Extraction and Identification of Micronuclei from Human Peripheral Blood Lymphocytes
요약
이 프로토콜은 자당 밀도 구배 원심분리를 사용하여 인간 림프구에서 소핵을 추출하고 정제하는 방법을 설명합니다. 소핵의 구성과 기능을 조사하기 위한 실험적 기초를 제공합니다.
초록
소핵(MN)은 해결되지 않은 DNA 손상 또는 유사분열 오류로 인해 방사선과 같은 외부 손상에 노출될 때 세포, 특히 골수 또는 혈액 세포에서 형성되는 비정상적인 핵 구조입니다. 일단 형성되면 MN은 염증 신호 전달 및 염색체 유전자 재배열을 포함한 다양한 발암 과정에 적극적으로 기여할 수 있습니다. MN은 핵 DNA, 히스톤, 핵단백질 단편 및 기타 활성 단백질을 포함하고 있으며, 이는 그 기능과 밀접한 관련이 있습니다. MN의 형성과 구성 요소를 연구하는 것은 발암 과정을 주도하는 MN의 역할을 이해하는 데 중요합니다. MN의 추출 및 정제는 이러한 연구 목표를 달성하는 데 필수적입니다. 그러나 MN 핵막의 불안정성과 파열에 대한 민감성으로 인해 이러한 과정은 기술적으로 어렵습니다. 현재 MN 분리를 위한 밀도 구배 원심분리의 사용을 보고한 연구는 소수에 불과합니다. 이 연구는 MN 분리 및 정제 과정을 요약하고 단순화합니다. 방사선에 노출된 인간 말초 혈액 림프구를 분리하고, MN을 분리하여 2단계 공정에서 서로 다른 농도의 자당 완충액을 사용하여 정제했습니다. MN의 무결성과 순도가 검증되어 MN의 원인과 기능을 조사하는 연구자에게 실험 절차에 대한 명확하고 실용적인 시연을 제공했습니다.
서문
소핵(MN)은 핵 DNA, 히스톤 및 핵단백질 조각을 포함하는 세포질의 세포 내 구조로, 막 구조 1,2로 둘러싸여 있습니다. MN은 주핵과 완전히 분리되어 있으며 일반적으로 주핵 직경의 1/16에서 1/3 사이의 크기를 가진 타원형 또는 원형 모양으로 그 근처에 나타납니다. MN의 형성은 주로 비심성 염색체 단편, 염색체 불일치, 이심성 염색체 파손, 염색체 불안정성 및 이중 분(DB)3의 응집과 관련이 있습니다. MN은 건강한 세포에서 드물게 발생하며 주로 외인성 제노톡신에 노출되어 발생하며, 이는 DNA 손상 또는 유사분열 오류를 유발합니다 4,5. 방사선 손상은 MN 형성에 중요한 기여를 하며, 임상 및 기술 응용 분야의 발전으로 전리 방사선(IR)에 대한 인체 노출이 증가했습니다 6,7. IR 노출은 세포 DNA에서 단일 가닥 절단(SSB) 및 이중 가닥 절단(DSB)을 유발하여 세포 사멸 또는 세포사멸을 초래할 수 있습니다 8,9,10. MN은 복구되지 않았거나 일치하지 않는 DSB 복구로 인해 생성된 염색체, 전체 염색체 또는 염색체의 조각입니다. IR 7,11,12로 인한 손상 정도를 나타내는 중요한 지표 역할을 합니다. 방사선 요법의 부작용을 완화하고 원치 않는 방사선에 대한 대중의 노출을 최소화하기 위해서는 MN의 구성 요소에 대한 포괄적인 이해가 필수적입니다 6,13. 그러나 MN에 포함된 단백질과 핵산은 현재까지 불완전하게 특성화된 상태로 남아 있습니다.
MN은 다양한 유형의 DNA 손상의 유도로 인해 발생하는 것으로 여겨집니다. 그들의 복제 메커니즘과 DNA 복구 능력이 손상되어 단기간 내에 광범위한 DNA 손상이 발생합니다 3,14,15. MN은 또한 전암성 세포에 일관되게 존재하는 염색체 불안정성의 중요한 지표입니다 3,14,16,17,18,19. MN은 유전독성, 종양 위험 및 종양 등급 3,20,21에 대한 바이오마커로 오랫동안 사용되어 왔습니다. MN은 일단 형성되면 염증 신호전달 22,23 및 염색체 유전자 재배열 24,25,26을 포함한 수많은 발암 과정을 적극적으로 주도할 수 있습니다. 예를 들어, MN은 세포질에서 바이러스 패턴 인식 수용체(PRR) 고리형 GMP-AMP 합성효소(cGAS)를 모집하여 염증 연쇄 반응을 시작합니다 4,22,23,27. MN에 존재할 수 있는 다른 단백질로는 엑소뉴클레아제28, 전사 메커니즘4 및 번역 보조인자 등이 있습니다. MN이 세포질 단백질 라이브러리에서 독특하고 편향된 단백질 프로파일을 조립하는지 아니면 형성 중에 핵과 세포질에서 고농도 단백질을 수동적으로 획득하는지는 불분명합니다. cGAS와 같은 개별 단백질을 넘어 특정 환경이 전체 MN 구성에 영향을 미치는 정도는 아직 결정되지 않았습니다. 전체 소핵 환경에 대한 이해는 제한적이며, 탐사를 위해 공개적으로 사용할 수 있는 데이터 세트가 없습니다. 따라서 성분에 대한 심층적이고 포괄적인 분석을 위해 완전하고 정제된 MN을 추출하는 것이 시급히 필요합니다.
MN에서 DNA 복제가 지연되는 한 가지 이유는 DNA 합성 및 복구에 필요한 효소와 보조 인자의 부족으로 인한 복제 스트레스일 수 있습니다. 이러한 결함은 MN 핵막의 결함 조립으로 인해 발생할 수 있으며, 이는 핵 공극 복합체(20)의 부재로 이어질 수 있습니다. 결과적으로, MN은 핵막 무결성과 게놈 안정성을 유지하는 데 필수적인 핵심 단백질을 가져올 수 없습니다 2,29,30,31. 불완전한 MN 핵막은 파열되기 쉬워 MN 추출이 매우 어렵습니다.
현재 MN은 주로 자당 밀도 구배 원심분리 27,32,33을 사용하여 추출되고 유세포 분석34로 정제됩니다. 본 연구에서는 MN의 분리 및 정제 과정을 요약하고 단순화하였다. 방사선에 노출된 인간의 말초 혈액 림프구를 분리하고, MN을 상이한 농도의 자당 완충액을 사용하여 2회 정제하였다. MN의 무결성과 순도가 검증되어 연구자들에게 MN의 원인과 기능을 연구하기 위한 실용적이고 직관적인 실험적 시연을 제공했습니다.
프로토콜
인간 말초 혈액 샘플과 관련된 모든 실험은 관련 지침 및 규정에 따라 수행되었습니다. 본 연구는 중국 원자력 산업 416병원 윤리위원회(2020 Review [No. 48])의 승인을 받았으며, 모든 참가자로부터 사전 동의를 얻었다. 제외 기준에는 종양, 통풍 또는 혈액 질환과 같은 주요 만성 질환이 있는 개인과 직업에서 방사성 또는 유전 독성 물질에 노출된 개인이 포함되었습니다. 이 연구를 위해 건강한 28세 남성의 말초 혈액 10mL를 항응고제로 헤파린 나트륨이 들어 있는 채혈 튜브에 채취했습니다. 샘플은 감마 공기 운동 에너지 치료 수준 표준 장치를 사용하여 37°C에서 60Co γ선을 시험관 내에서 조사했습니다. 방사선 조사량은 4.0 Gy로 설정되었으며 선량률은 0.6350 Gy/min입니다. 방사선 조사 후, 샘플을 37°C에서 2시간 동안 배양하고, RPMI-1640 배지에 접종하고, 37°C에서 60시간 동안 배양했습니다. 이 연구에 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나와 있습니다.
1. 소핵 및 핵의 제조
- 사이토칼라신 B를 말초 혈액 세포 배지에 첨가하여 10μg/mL의 최종 농도를 달성합니다. 혼합물을 37 ° C에서 45 분 동안 배양합니다.
참고: Cytochalasin B는 세포 용해 전에 핵에서 소핵의 효율적인 분리를 촉진하는 액틴 중합 억제제입니다35. - 혈액 세포를 200 × g 에서 4 °C에서 5 분 동안 원심 분리하십시오.
- 4°C에서 예냉각된 0.01M PBS 10mL에 혈액 세포를 재현탁합니다.
2. 림프구의 분리
- 15mL의 인간 림프구 분리 용액을 50mL 원뿔형 튜브에 추가합니다. 부유 말초 혈액 세포를 분리 용액 위에 조심스럽게 겹쳐 놓습니다.
- 튜브를 400 × g 에서 4 °C에서 30 분 동안 원심 분리하십시오.
참고: 원심분리 후 튜브의 혈액 세포는 위에서 아래로 4개의 별개의 층으로 분리됩니다: 첫 번째 층은 플라즈마 층(혈소판), 두 번째 층은 고리 유백색 림프구 층, 세 번째 층은 투명 분리 액체 층, 네 번째 층은 적혈구 층입니다. - 두 번째 층(림프구)을 별도의 원심분리기 튜브로 조심스럽게 옮깁니다. 옮겨진 세포 부피의 3배에 PBS(0.01M)를 첨가하고 잘 혼합한 후 4°C에서 10분 동안 200× g 으로 원심분리한다. 피펫을 사용하여 상등액을 폐기합니다.
3. 림프구의 용해
- 원뿔형 튜브에 모인 세포 펠릿을 얼음 위에 놓습니다.
- 6mL의 저온 용해 완충액(표 1, 보충 파일 1)을 추가하고 용해 완충액에 세포 펠렛을 재현탁합니다.
참고: 용해 완충액은 사용 직전에 표 2, 보충 파일 1에 나열된 성분으로 보충해야 합니다. - 세포 용해물을 유리 균질기로 옮깁니다.
- 느슨한 분쇄기를 부드럽게 사용하여 균질화기를 위아래로 10회 움직여 샘플을 수동으로 균질화합니다.
- 균질화된 세포 용해물을 50mL 코니컬 튜브로 다시 옮깁니다.
알림: 모든 단계를 부드럽게 수행하고 샘플을 얼음 위에 보관하십시오.
4. 자당 밀도 구배를 통한 MN의 초기 분리
- 5mL의 세포 용해물을 동일한 부피의 1.8M 자당 완충액(표 3, 보충 파일 1)과 혼합하여 용해물 대 자당 완충액의 1:1 비율을 달성합니다.
참고: 1.8M 자당 완충액은 사용 직전에 표 4, 보충 파일 1에 나열된 성분을 보충해야 합니다. - 슈크로스 밀도 구배 준비: 1.6M 슈크로스 완충액 15mL(표 5, 보충 파일 1)를 50mL 코니컬 튜브의 바닥에 추가합니다. 1.6M 슈크로스 완충액 위에 1.8M 슈크로스 완충액 20mL(표 3, 보충 파일 1)를 천천히 첨가합니다.
참고: 1.6M 슈크로스 완충액 및 1.8M 슈크로스 완충액은 모두 사용 직전에 각각 표 4, 보충 파일 1의 성분을 보충해야 합니다. 자당 완충액을 추가하려면 피펫 끝을 원뿔형 튜브의 상단 안쪽에 대고 용액을 천천히 피펫으로 만듭니다. - 2층 자당 밀도 구배 위에 [Lysate 1:1 1.8 M 자당 완충액] 혼합물 10mL를 천천히 피펫으로 만듭니다.
참고: 중간 1.8M 버퍼 층이 하단 1.6M 버퍼 층과 혼합되지 않고 용해된 세포와 1.8M 자당 버퍼의 상단 1:1 혼합물이 1.8M 버퍼 레이어와 혼합되지 않도록 레이어를 천천히 추가합니다. - 수평 로터 원심분리기로 튜브를 1000 × g 에서 4°C에서 20분 동안 원심분리합니다.
참고: 원심분리 후 액체는 3개의 층으로 분리됩니다: 상층에는 약 3mL의 세포 파편이 포함되고, 중간층에는 약 3mL의 소핵(MN)이 포함되며, 하층에는 약 39mL의 핵이 포함됩니다. - 표면 근처에서 상부 3mL의 액체를 제거하고 두 번째 자당 밀도 구배를 위해 중간층에서 3mL의 정제되지 않은 소핵을 수집합니다.
5. 자당 밀도 구배를 통한 MN의 2차 정제
- 자당 밀도 구배를 준비합니다.
- 1.8M 슈크로스 완충액 3mL(표 3, 보충 파일 1)를 15mL 원추형 튜브의 바닥에 추가합니다.
- 1.8M 슈크로스 완충액 위에 3mL의 1.5M 슈크로스 완충액(표 6, 보충 파일 1)을 추가합니다.
- 마지막으로, 1.5M 슈크로스 완충액 위에 1.4M 슈크로스 완충액 3mL(표 7, 보충 파일 1)를 첨가합니다.
알림: 피펫 끝을 원뿔형 튜브의 상단 안쪽에 대고 용액을 천천히 피펫팅합니다.
- 두 번째 자당 밀도 구배에서 중간 층의 3mL를 3층 자당 밀도 구배의 상단으로 천천히 피펫합니다.
참고: 섞이지 않도록 레이어를 천천히 추가하십시오. - 500 × g 의 수평 로터 원심분리기에서 튜브를 4°C에서 20분 동안 원심분리합니다.
참고: 원심분리 후 상층에는 1-4mL의 정제된 소핵(MN)이 포함되고 하층에는 주로 8mL의 핵이 포함됩니다. - 나중에 사용할 수 있도록 상부 1-4mL의 정제된 소핵을 예약합니다.
6. MN의 식별
- 정제되지 않은 소핵 용액(단계 4에서 얻음)과 정제된 소핵 용액(단계 5에서 얻음)을 취하여 슬라이드에 세포 도말 제조를 합니다.
- 4% 파라포름알데히드 용액을 첨가하여 샘플을 실온(RT)에서 15분 동안 고정합니다.
- PBS(0.01M)로 슬라이드를 세탁당 3분씩 두 번 세탁합니다.
- 0.1% Triton X-100을 첨가하여 5분 동안 RT에서 세포를 투과시킵니다.
- 30분 동안 RT에서 5% BSA의 세포를 차단합니다.
- 항γ-H2AX에 대한 1차 항체(5% BSA, 1:200으로 희석)를 추가하고 RT에서 1시간 동안 배양합니다.
- PBS(0.01M)로 슬라이드를 두 번 세탁하고 세탁당 5분씩 세탁합니다.
- 2차 항체(5% BSA, 1:500으로 희석)를 추가하고 어둠 속에서 1시간 동안 RT에서 배양합니다.
- DAPI 염료 용액을 넣고 RT에서 15분 동안 배양합니다.
- PBS(0.01M)로 슬라이드를 세탁당 3분씩 두 번 세탁합니다.
- 슬라이드에 밀봉 용액을 도포하여 밀봉합니다.
- 형광 현미경(배율: 400×, 자동 초점 및 자동 노출)으로 형광을 관찰하고 세포 계수판을 사용하여 소핵을 계수합니다.
참고 : 4 % 파라 포름 알데히드, 0.1 % 트리톤 X-100 및 5 % BSA는 PBS (0.01 M)로 희석됩니다. γ-H2AX(감마 H2AX)는 DNA 손상에 반응하여 형성된 히스톤 H2AX 단백질의 인산화 형태입니다. 핵에서 히스톤 H2AX의 인산화는 특정 영역에 집중되어 있으므로 항γ-H2AX 형광이 드문드문 나타날 수 있습니다. 히스톤 H2AX의 인산화는 소핵에 집중되어 뚜렷한 반점으로 전체적으로 더 밝은 형광을 나타냅니다36. DAPI는 DNA에 강하게 결합하는 형광 염료로 형광 현미경 검사에 자주 사용됩니다. 소핵에는 깨진 DNA와 히스톤 단편이 포함되어 있기 때문에 항γ-H2AX 형광 항체 및 DAPI에 의해 염색될 수 있습니다. 형광은 소핵의 수, 크기 및 완전성을 표시하여 소핵과 구별하고 정제 효과를 평가하는 데 도움이 됩니다32.
결과
방사선에 노출된 후 인간 말초 혈액을 RPMI-1640으로 60시간 동안 배양한 다음 소핵(MN) 준비를 위해 사이토칼라신 B를 첨가했습니다. 림프구는 림프구 분리 용액을 사용하여 분리한 후 특별히 구성된 세포 용해물로 용해하고 유리 균질화기에서 부드러운 균질화를 수행했습니다. 균질산염을 1.8M 자당 완충액과 1:1로 혼합하였다. 정제되지 않은 소핵은 첫 번째 슈크로스 밀도 구배 원심분리 후에 수득하고, 정제된 소핵은 두 번째 슈크로스 밀도 구배 원심분리 후에 수득했습니다(그림 1).
첫 번째 자당 밀도 구배 원심분리 후, 정제되지 않은 소핵을 세포 도말로 준비하고 항γ-H2AX 및 DAPI 형광 염색을 실시했습니다. 그 결과 정제되지 않은 소핵의 크기가 크게 변했으며 일부 더 큰 소핵이 보였다(그림 2A). 두 번째 자당 밀도 구배 원심분리 후, 정제된 소핵을 세포 도말로 준비하고 항γ-H2AX 및 DAPI 형광 염색을 실시했습니다. 그 결과, 정제된 소핵이 더 작고, 소핵 간의 크기 차이가 덜 뚜렷하며, 큰 핵은 관찰되지 않는 것으로 나타났습니다(그림 2B). 10mL의 말초 혈액을 기준으로 100,000 - 200,000개의 소핵을 얻을 수 있습니다.
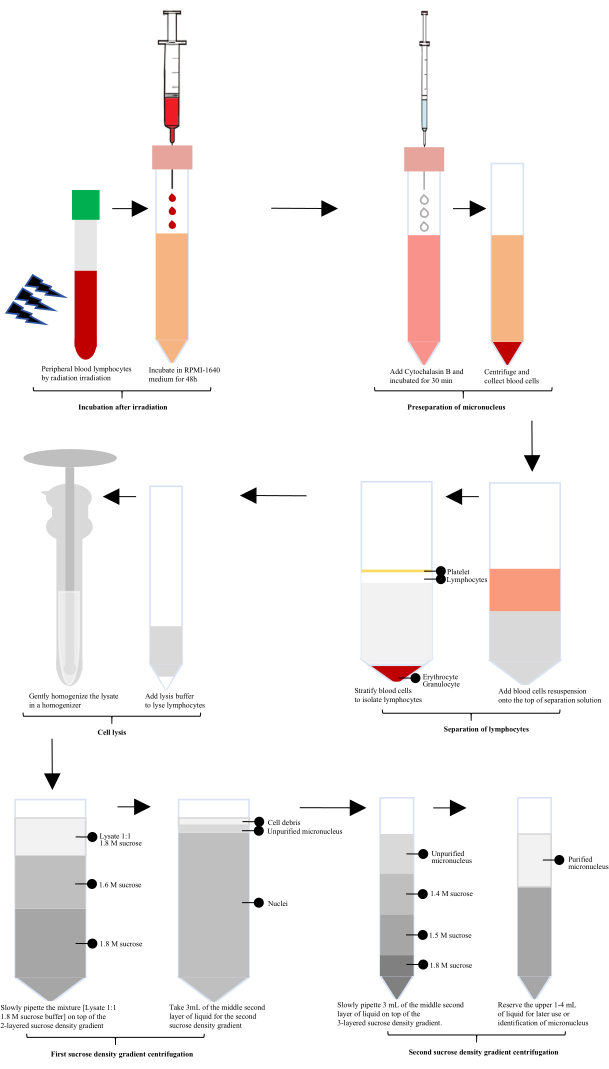
그림 1: 방사선 조사 후 림프구 소핵의 추출 및 정제에 대한 개략도. 방사선 조사 후 이 프로세스에는 배양, 소핵 전치, 림프구 분리, 세포 용해 및 2회에 걸친 자당 밀도 구배 원심분리가 포함됩니다. 그런 다음 이러한 단계를 통해 정제된 소핵을 얻습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 면역형광을 통한 소핵 식별. (A) 첫 번째 자당 밀도 구배 원심분리 후, 정제되지 않은 소핵을 세포 도말로 준비하고 항γ-H2AX(녹색) 및 DAPI(파란색) 형광 염색을 실시했습니다. 화살표는 핵을 나타냅니다. (B) 두 번째 자당 밀도 구배 원심분리 후, 정제된 소핵을 세포 도말로 준비하고 항γ-H2AX 및 DAPI 형광 염색을 실시했습니다. 스케일 바: 10μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 이 프로토콜에 사용되는 시약 및 버퍼. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 방법에서는 방사선 조사된 인간 말초 혈액 림프구를 사용하여 소핵(MN)을 분리하고 정제했습니다. 이전의 많은 연구에서 MN 4,32,33,34의 세포 용해 및 1차 분리에 대한 자세한 단계를 보고했습니다. 세포 용해 용액은 일반적으로 0.1% NP-40을 포함하여 핵막에 미치는 영향을 최소화하면서 세포막을 파괴하여 핵과 MN의 무결성을 보존합니다.특히, 용해물의 다른 성분도 완충 역할을 합니다 4,32,33,34. 불완전한 조립으로 인해 MN 멤브레인은 2,29,30,31이 파열되기 쉬워 분리 및 정제 과정을 복잡하게 만듭니다. 일반적으로 1.6 M 및 1.8 M 자당 완충액은 MN의 초기 분리를 위한 밀도 구배 원심분리에 사용됩니다. 자당 완충액은 MN을 보호하고 완충하는 데 도움이 되어 미세핵막의 무결성을 보장하는 동시에 밀도 구배 4,32,33,34를 통해 분리를 용이하게 합니다. 이 방법에서는 림프구 용해와 MN의 1차 분리를 위한 이러한 주요 단계를 주의 깊게 따랐습니다.
이전의 소핵(MN) 분리 방법과 달리 이 방법은 정제 과정을 개선합니다. 유세포 분석에 의한 MN의 정제는 이전에 보고된 바 있습니다33,34. 그러나 MN은 분류 과정에서 유체 전단력으로 인해 파열될 수 있으며, 이는 MN 구성 요소의 추가 감지를 방해할 수 있습니다. 또한 유세포 분석기의 가용성이 제한되어 MN 분류를 위한 유세포 분석의 광범위한 적용이 제한됩니다. 다른 연구에서는 MN을 정제하기 위해 2차 자당 밀도 구배 원심분리를 사용했지만, 2차 원심분리보다 먼저 초고속 원심분리가 사용되었습니다4. 이러한 고속 원심분리는 일부 MN의 파열로 이어질 수 있으며, 이는 후속 MN 성분 분석에 해롭습니다. 대조적으로, 이 프로토콜에서는 MN의 격리 및 정제가 중요한 단계입니다. 2차 슈크로스 밀도 구배 원심분리는 MN을 정제하기 위해 사용되며, 첫 번째 자당 밀도 구배 원심분리에서 얻은 MN 함유층은 두 번째 원심분리에 직접 적용됩니다. 이 접근 방식은 초고속 원심분리로 인한 MN 손상을 방지합니다.
이 방법은 인간 말초 혈액 림프구에서 MN을 분리하고 정제하는 데만 중점을 두며 종양 세포와 같은 다른 세포 유형은 포함하지 않습니다. 향후 연구는 이 방법의 보편성을 향상시키기 위해 다양한 세포 유형에서 MN을 정제하는 방법을 입증하는 것을 목표로 합니다. 또한, 정제된 MN 혼합물의 부피는 상대적으로 크게 유지된다. 향후 노력은 고농축 MN 용액을 달성하기 위해 자당 밀도 구배를 최적화하는 데 중점을 둘 것이며, 이는 MN의 조성 및 기능에 대한 추가 조사를 용이하게 할 것입니다.
MN의 출현은 염색체와 DNA 손상의 정도를 반영하며 방사선 손상 복구 및 암세포 형성에 중요한 역할을 합니다 7,11,12,13,14,16,17,18,19. 이러한 과정은 MN 내의 단백질, 핵산 및 기타 구성 요소의 역할 및 기능과 밀접하게 관련되어 있습니다. 따라서 MN의 정제는 염색체 및 DNA 손상과 관련된 질병에서 MN의 역할을 연구하는 데 중요합니다. 이 방법은 MN 정제 공정에서 2차 자당 밀도 구배 원심분리 단계를 향상시키고 인간 말초 혈액 림프구에서 MN의 형성을 입증합니다. 또한 세포 용해, 첫 번째 자당 밀도 구배를 사용한 1차 분리 및 두 번째 자당 밀도 구배를 사용한 정제도 포함됩니다. 이 접근 방식은 MN의 원인과 기능을 조사하는 연구자에게 명확하고 실험적인 프레임워크를 제공합니다.
공개
없음.
감사의 말
모든 피규어는 WPS 사무실을 통해 저자가 제작했습니다. 이 연구는 청두 의과대학 자연과학재단(CYZ19-38)과 쓰촨성 과학기술지원프로그램(2024NSFSC0592)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL conical tube | Thermo | 339650 | |
| 4% paraformaldehyde solution | Beyotime | P0099 | |
| 50 mL conical tube | Thermo | 339652 | |
| Anti-γ-H2AX antibody | Bioss | bsm-52163R | |
| Bovine serum albumin | Beyotime | ST023 | |
| Calcium chloride | Biosharp | BS249 | |
| Cytochalasin B | Macklin | 14930-96-2 | |
| DAPI dyeing solution | Bioss | S0001 | |
| Dithiothreitol (DTT) | Coolaber | CD4941 | |
| EDTA | Biosharp | BS107 | Ethylene Diamine Tetraacetic Acid |
| Fluorescence microscope | Nikon | Ti2-U | |
| Homogenizer | Ybscience | YB101103-1(20 mL) | |
| Horizontal controlled temperature centrifuge | Thermo | Sorvall ST1R plus | Brake speed is set to "5" |
| Human lymphocyte separation solution | Beyotime | C0025 | |
| Magnesium acetate | Macklin | M833330 | |
| NP-40 | Coolaber | SL9320 | 10% solution |
| Phosphate buffer solution(PBS) | HyClone | SH30256.01B | |
| Protease inhibitors | Coolaber | SL1086 | Cocktail (100×) |
| Secondary antibody | Bioss | Bs-0295G | Goat Anti-Rabbit IgG H&L/FITC |
| Spermidine | Coolaber | CS10431 | |
| Spermine | Coolaber | CS10441 | |
| Sucrose | Coolaber | CS10581 | |
| Tris-HCl | Biosharp | BS157 | |
| Triton X-100 | Beyotime | P0096 |
참고문헌
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Liu, S., Kwon, M., Mannino, N. Nuclear envelope assembly defects link mitotic errors to chromothripsis. Nature. 561, 551-555 (2018).
- Sommer, S., Buraczewska, I., Kruszewski, M. Micronucleus assay: The state of art, and future directions. Int J Mol Sci. 21 (4), 1534 (2020).
- MacDonald, K. M., et al. Antecedent chromatin organization determines cGAS recruitment to ruptured micronuclei. Nat. Commun. 14, 556 (2023).
- Abdisalaam, S., Mukherjee, S., Bhattacharya, S. NBS1-CtIP–mediated DNA end resection suppresses cGAS binding to micronuclei. Nucleic Acids Res. 50, 2681-2699 (2022).
- Li, L., Kim, H. S., Kwon, S. W. Inhibitory effects of saeu-jeot extract on NLRP3 inflammasome activation and radiation-induced micronucleus formation. Food Sci Nutr. 10 (6), 1921-1927 (2022).
- Qian, Q. Z., Cao, X., Ke, F. H., Shen, Effects of ionising radiation on micronucleus formation and chromosomal aberrations in Chinese radiation workers. Radiat Prot Dosimetry. 168 (2), 197-203 (2016).
- Rzeszowska-Wolny, J., Przybyszewski, W. M., Widel, M. Ionizing radiation-induced bystander effects, potential targets for modulation of radiotherapy. Eur J Pharmacol. 625 (1-3), 156-164 (2009).
- Zuo, Y. H., Dang, X. H., Zhang, H. F. Genomic instability induced by ionizing radiation in human hepatocytes. J Toxicol Environ Health A. 75 (12), 700-706 (2012).
- Eken, A., Aydin, A., Erdem, O. Cytogenetic analysis of peripheral blood lymphocytes of hospital staff occupationally exposed to low doses of ionizing radiation. Toxicol Ind Health. 26 (5), 273-280 (2010).
- Gutierrez-Enriquez, S., Ramon, Y. C. T., Alonso, C. Ionizing radiation or mitomycin-induced micronuclei in lymphocytes of BRCA1 or BRCA2 mutation carriers. Breast Cancer Res Treat. 127 (3), 611-622 (2011).
- Brzozowska, K., et al. Effect of temperature during irradiation on the level of micronuclei in human peripheral blood lymphocytes exposed to X-rays and neutrons. Int J Radiat Biol. 85 (10), 891-899 (2009).
- Yamini, K., Gopal, V. Natural radioprotective agents against ionizing radiation-an overview. Int J PharmTech Res. 2 (2), 1421-1426 (2010).
- Terradas, M., Martín, M., Genescà, A. Impaired nuclear functions in micronuclei results in genome instability and chromothripsis. Arch Toxicol. 90, 2657-2667 (2016).
- Crasta, K., Ganem, N. J., Dagher, R. DNA breaks and chromosome pulverization from errors in mitosis. Nature. 482, 53-58 (2012).
- Fenech, M., Morley, A. Measurement of micronuclei in lymphocytes. Mutat Res. 147, 29-36 (1985).
- Kirsch-Volders, M., Bonassi, S., Knasmueller, S. Commentary: Critical questions, misconceptions and a road map for improving the use of the lymphocyte cytokinesis-block micronucleus assay for in vivo biomonitoring of human exposure to genotoxic chemicals-a HUMN project perspective. Mutat Res Rev Mutat Res. 759, 49-58 (2014).
- Fenech, M., et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 26, 125-132 (2011).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nat Protoc. 2, 1084-1104 (2007).
- Fenech, M. Cytokinesis-block micronucleus cytome assay evolution into a more comprehensive method to measure chromosomal instability. Genes (Basel). 11 (10), 1203 (2020).
- Kwon, M., Leibowitz, M. L., Lee, J. H. Small but mighty: The causes and consequences of micronucleus rupture. Exp Mol Med. 52 (11), 1777-1786 (2020).
- Harding, S. M., et al. Mitotic progression following DNA damage enables pattern recognition within micronuclei. Nature. 548, 466-470 (2017).
- Mackenzie, K. J., et al. cGAS surveillance of micronuclei links genome instability to innate immunity. Nature. 548, 461-465 (2017).
- Tang, S., Stokasimov, E., Cui, Y. Breakage of cytoplasmic chromosomes by pathological DNA base excision repair. Nature. 606, 930-936 (2022).
- Zhang, C. Z., et al. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184 (2015).
- Umbreit, N. T., Zhang, C. Z. Z., Lynch, L. D. Mechanisms generating cancer genome complexity from a single cell division error. Science. 368, eaba0712 (2020).
- Li, Q. J., Wu, P., Du, Q. J. cGAS-STING, an important signaling pathway in diseases and their therapy. Med Comm. 5 (4), e511 (2024).
- Mohr, L., Toufektchan, E., von Morgen, P. ER-directed TREX1 limits cGAS activation at micronuclei. Mol Cell. 81, 724-738.e9 (2021).
- Okamoto, A., Utani, K., Shimizu, N. DNA replication occurs in all lamina positive micronuclei, but never in lamina negative micronuclei. Mutagenesis. 27, 323-327 (2012).
- Hatch, E. M., Fischer, A. H., Deerinck, T. J. Catastrophic nuclear envelope collapse in cancer cell micronuclei. Cell. 154, 47-60 (2013).
- Guo, X., Dai, X., Wu, X. Understanding the birth of rupture-prone and irreparable micronuclei. Chromosoma. 129 (3-4), 181-200 (2020).
- MacDonald, K. M., et al. The proteomic landscape of genotoxic stress-induced micronuclei. Molecular Cell. 84 (7), 1377-1391.e6 (2024).
- Agustinus, A. S., Al-Rawi, D., Dameracharla, B. Epigenetic dysregulation from chromosomal transit in micronuclei. Nature. 619 (7968), 176-183 (2023).
- Toufektchan, E., Maciejowski, J. Purification of micronuclei from cultured cells by flow cytometry. STAR Protoc. 2 (1), 100378 (2021).
- Shimizu, N., Kanda, T., Wahl, G. M. Selective capture of acentric fragments by micronuclei provides a rapid method for purifying extrachromosomally amplified DNA. Nat Genet. 12, 65 (1996).
- Samur, B. M., et al. Assessment of extracorporeal photopheresis related cell damage. Transfus Apher Sci. 61 (6), 103472 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유