Method Article
5xFAD Farelerin Beyinlerinde Demir Birikiminin Perls/DAB Boyama ile Değerlendirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, dokularda, özellikle beyinde demir birikiminin dağılımını ve miktarını değerlendirmek için yöntemler sunar. Protokol, numune hazırlama, Perls/DAB boyama, görüntü yakalama ve veri analizi prosedürlerini detaylandırır.
Özet
Yaygın bir nörodejeneratif hastalık olan Alzheimer hastalığı (AD), yaşlılarda demansın önde gelen nedenidir. Demir birikimi AH patogenezi ile yakından ilişkilidir. AD beyninde, yüksek demir seviyeleri, β-amiloid plakları, tau nörofibriler yumaklar ve apoptoz dahil olmak üzere karakteristik AD patolojileri ile güçlü bir şekilde ilişkilidir. Artan kanıtlar, düzensiz demir metabolizmasına bağlı oksidatif stresin AH patofizyolojisinde önemli bir rol oynadığını göstermektedir. Bu nedenle, AH patolojisinde demir birikiminin rolünü anlamak, AH tedavisinde kritik öneme sahiptir. Beyindeki demir ekspresyonunu ve dağılımını tespit etmek için kapsamlı bir demir boyama protokolü gereklidir. Bu protokol, beyindeki demir birikiminin miktarını ve dağılımını değerlendirmek için bir yöntemi tanımlamayı amaçlamaktadır. Reaktif hazırlama, fare tedavisi ve beyin bölümlerinin hazırlanması ile ilgili süreçleri açıklıyoruz. Ek olarak, boyama sonuçlarının kapsamlı bir şekilde yorumlanmasını sağlamak için hem kantitatif değerlendirmeyi hem de morfolojik değerlendirmeyi entegre eden sistematik bir analitik çerçeve ile birlikte, serebral doku kesitlerinde histokimyasal demir tespiti için ayrıntılı bir adım adım protokol sunuyoruz. Bu deneysel protokol, araştırmacıların beyindeki demir birikimlerini anlamalarına ve AD araştırmalarını desteklemelerine yardımcı olacaktır.
Giriş
Alzheimer hastalığı (AH) en sık görülen nörodejeneratif hastalıktır ve toplum için ciddi bir sorun haline gelmiştir. AD prevalansı 1,2,3,4 yaşla birlikte dramatik bir şekilde artmaktadır. Alzheimer hastalığının (AD) birincil patolojik özellikleri, tau proteinlerinin anormal fosforilasyonuna bağlı olarak β-amiloid (Aβ) plaklarının ve nörofibriler yumakların (NFT'ler) birikmesini içerir. Aβ, amiloid öncü proteininin (APP) β-sekretaz ve γ-sekretaz enzimleri tarafından sıralı bölünmesi yoluyla üretilir. Aβ üretimindeki veya klerensindeki düzensizlik, beyinde birikmesine yol açar ve AD'nin en erken patolojik belirteçlerinden biri olarak kabul edilen amiloid plaklarını oluşturur. Bu plaklar sadece doğrudan nöronal hasara neden olmakla kalmaz, aynı zamanda nöroinflamasyon, oksidatif stres ve sinaptik disfonksiyon dahil olmak üzere bir dizi zararlı etki başlatır. Toplu olarak, bu süreçler nöronal ölüme ve MS5'te gözlenen ilerleyici bilişsel gerilemeye katkıda bulunur. Amiloid β plak birikimi ve hiperfosforile tau proteini agregasyonu dahil olmak üzere ağırlıklı olarak Alzheimer hastalığının (AD) patolojik özelliklerini hedef alan onlarca yıllık araştırmalara rağmen, klinik olarak anlamlı terapötik atılımlar belirsizliğini korumaktadır ve mevcut müdahaleler hastalığın ilerlemesini değiştirmede sınırlı etkinlik göstermektedir6.
Demir, beyin fonksiyonunu sürdürmek için önemli bir metaldir ve oksijen taşınması, DNA sentezi, mitokondriyal solunum, miyelin sentezi, nörotransmitter sentezi ve metabolizmada rol oynar. Bununla birlikte, konsantrasyonlar hücresel sekestrasyon kapasitesiniaştığında demir zararlı hale gelir 6,7,8. AD9,10 olan hastalarda beynin hem kortikal hem de hipokampal bölgelerinde genellikle Aβ plakları ile birlikte lokalize olan artmış demir birikimi gözlenmiştir. Fenton reaksiyonu11 sayesinde, hücre içi serbest demir, reaktif oksijen türlerinin yanı sıra hidroksil radikalleri (•OH) üretebilir. Bu zararlı maddeler sadece glial hücreleri aktive ederek nöroinflamasyonu indüklemekle kalmaz, aynı zamanda oksidatif stres yoluyla hücrenin biyomoleküllerine saldırır, normal hücresel fonksiyonu bozar ve sinaptik disfonksiyona yol açar 8,12. Ayrıca, artan demir, AD'nin patolojik belirtilerinin gelişiminde doğrudan rol oynar: demir, Aβ üretimine12 katkıda bulunur ve ayrıca tau proteini disfonksiyonunu artırarak nörofibriler yumaklara(13) yol açar.
Beyindeki demir içeriğini değerlendirmek için manyetik rezonans görüntüleme (MRI) ile kimyasal ve histokimyasal yöntemler de dahil olmak üzere çeşitli teknikler geliştirilmiştir14. MRG kullanılarak intraserebral demir seviyelerinin in vivo olarak ölçülmesi, yaşlanma ve nörodejenerasyon hastaları için klinik olarak önemlidir15. MRG, non-invaziv ve son derece hassas olma avantajına sahiptir: hastalığın erken evrelerinde demir birikimini tespit edebilir. Özellikle, alana bağlı R2 artışı (FDRI) tekniği, ferritin demir ve heme-demir16 gibi farklı demir formlarını ayırt edebilir. Bununla birlikte, MRG hücresel düzeyde demir birikimini tespit edemez ve pahalıdır, bu nedenle esas olarak klinik araştırmalarda kullanılır17.
Kolorimetrik ölçüm, çözelti içindeki maddenin bir kromojenik ajan18 ile reaksiyonu sonucu üretilen rengin yoğunluğunu ölçerek bir maddenin (demir gibi) konsantrasyonunu belirleyen kimyasal bir yöntemdir. Bu yöntemin gerçekleştirilmesi kolaydır ve düşük maliyetli reaktifler ve enstrümantasyon kullanır, bu da onu sınırlı bütçeli laboratuvarlar için uygun hale getirir18. Bununla birlikte, bu yöntemin doğruluğu ve hassasiyeti çok sınırlıdır, çünkü sonuçlar çevresel faktörler, renk geliştirme süresi ve operatörün öznel yargısı tarafından etkilenmektedir. Alev atomik absorpsiyon spektrometresi (FAAS), demir seviyelerini19 değerlendirmek için kullanılabilecek başka bir yöntemdir. Bu yöntemde, ilgilenilen dokunun yüksek sıcaklıktaki bir fırında yakılmasıyla berraklaştırılmış bir numune çözeltisi elde edilir. Numune daha sonra hidroklorik asit kullanılarak çözülür ve çözeltideki demir konsantrasyonu atomik absorpsiyon spektrometrisi ile belirlenir. Bu yöntem son derece hassastır ve her türlü biyolojik numune için uygundur19. Bununla birlikte, süreç zaman alıcıdır ve pahalı ekipman gerektirir, bu nedenle kullanımı sınırlıdır.
Hem olmayan ferrik demiri tespit etmek için Perls/DAB boyama, diğer histokimyasal yöntemlerle karşılaştırıldığında yüksek özgüllüğü ve uygulama kolaylığı nedeniyle en yaygın kullanılan demir tespit yöntemidir14. Kolorimetrik analizden farklı olarak, Perls'in boyaması, mavi bir çökelti oluşturmak için demir iyonları ve potasyum ferrosiyanür arasındaki reaksiyona dayanan kalitatif bir histokimyasal boyama yöntemidir. Dokulardaki demirin varlığını ve dağılımını mikroskobik olarak görselleştirmek için kullanılır. Ayrıca, bu yöntem, farklı hücre tiplerinde demir birikimini ayırt etmemize ve demir birikiminin hücre altı dağılımını gözlemlememize olanak tanıyarak AD20'nin incelenmesi için bir yöntem sağlar. Perls'in boyası öncelikle hem olmayan ferrik demiri tespit eder ve Prusya mavisi kompleksinin oluşumuna bağlıdır:

(Prusya mavisi)
Bununla birlikte, geleneksel Perls boyası, düşük demir seviyelerinde demir lokalizasyonunu tespit etmek için etkisizdir. Diaminobenzidin (DAB) eklendiğinde, kahverengi bir bileşik oluşturmak için ferrik hekzasiyanoferrat ile reaksiyona girerek testinözgüllüğünü arttırır 21.
Bu protokolün amacı, bir AD fare modelinin beyinlerindeki demir birikiminin miktarının ve dağılımının nasıl değerlendirileceğini açıklamaktır. Bu protokolde, 8 aylık 5×FAD (C57BL / 6J) transgenik fareler AD fare modeli olarak kullanıldı ve aynı yaştaki vahşi tip farelerle karşılaştırıldı. Kimyasal reaktifin hazırlanması, beynin kesitlendirilmesi, Perls/DAB boyasının gerçekleştirilmesi ve boyamadan sonra alınan görüntülerin analiz edilmesi ile ilgili prosedürlerin ayrıntıları burada sunulmaktadır.
Protokol
Tüm prosedürler, Xuzhou Tıp Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin yönergelerine ve Çin hükümetinin Laboratuvar Hayvanlarının Bakımı ve Kullanımı düzenlemelerine uygun olarak gerçekleştirildi.
1. Hayvanların perfüzyonu
- Fiksatifi hazırlayın:% 4 paraformaldehiti (PFA) 1× fosfat tamponlu salin (PBS) içinde çözün (bkz. Tablo 1).
- Fareyi ketamin (100 mg / kg) ve ksilazin (15 mg / kg) ile intraperitoneal enjeksiyon ile uyuşturun. Fare uyuşturulduktan sonra, uzuvları sabitlemek için dört pimli perfüzyon cerrahisi tepsisine sabitleyin.
DİKKAT: Uygun anesteziyi sağlamak için, ayak parmağını sıkıştırmaya yanıt kaybını, uzuv kaslarının gevşemesini ve derin, yavaş ve sabit nefesi kontrol edin. - Kalbi ortaya çıkarmak için göğsü makasla kesin ve sağ atriyumu kesin. Kanı yıkamak için bir şırınga ile sol ventriküle 20 mL 1× PBS enjekte edin. Ardından, fiksasyon için 20 mL% 4 PFA enjekte edin.
NOT: İnterventriküler septumun delinmesini önlemek için iğnenin derinliğini ve yönünü kontrol edin. Optimal bir perfüzyonun, ilk titremeden sonra soluk bir karaciğer ve sert uzuvlar içerdiğini unutmayın. - Perfüze farenin kafasını kesin, kafatasının etrafındaki kemiği bir çift ince makasla kesin, künt forseps kullanarak kafatasını dikkatlice kaldırın ve beyni çıkarın. Ardından, beyni gece boyunca 4 ° C'de% 4 PFA'ya batırın.
DİKKAT: Güçlü bir solunum yolu tahriş edici olan %4 PFA'ya dikkat edin. Uygun bir maske takın ve bu adımı çeker ocakta gerçekleştirin.
NOT: Ötenazi yöntemi, Xuzhou Tıp Üniversitesi Hayvan Bakımı ve Kullanımı Programı Ötenazi Yönergeleri: Fareler / Sıçanlar'ın IACUC tarafından onaylanmıştır.
2. Beyin kriyoseksiyonu
- Beyni, her adım için 24 saat boyunca 4 ° C'de kademeli sükroz çözeltileri (% 15 ve% 30) ile kurutun. Beyin sonunda sükroz çözeltisinin dibine batmalıdır.
- Beyni bir neşter ile interhemisferik fissür boyunca kesin. OCT ile beyin arasındaki teması arttırmak için sol yarısını 1 mL% 30 sükroz çözeltisi ve eşit hacimde optimal kesme sıcaklığı (OCT) bileşiği ile doldurulmuş 5 mL'lik bir mikrosantrifüj tüpüne koyun.
- Sol hemisferden yabancı dokuyu bir tıraş bıçağıyla kesin ve OCT platformuna taşıyın.
- Alüminyum folyodan yapılmış dairesel bir duvarın desteğiyle dokuyu OCT'ye gömün.
- Dokuyu bir kriyostat mikrotomunda -22 °C'de en az 1 saat dondurun ve kesme kafası sıcaklığını -19 °C'ye ayarlayın.
NOT: Numune ile birlikte kriyostattaki rulo önleyici camı ve fırçaları önceden soğutmayı unutmayın. - Donmuş doku bloğunu monte edin. İlgilenilen alana bağlı olarak doku bloğunu tekrar uygun bir konuma getirin ve ardından beyni 20 μm kalınlığında sagital bölümlere ayırmaya başlayın.
NOT: Bölümler katlanırsa, bölümleri açmak için yumuşak fırçalar kullanın. - Jelatin kaplı slaytlardaki her bölümü toplayın ve üzerine 1× PBS'lik bir damla sürün. İnce bir fırça kullanarak beyin bölümünü ters çevirin ve ardından bölümü hızlı bir şekilde slayta monte edin.
- Toplanan kısımları gece boyunca oda sıcaklığında kurutun ve -20 °C'de saklayın.
NOT: Protokol burada 2 haftaya kadar duraklatılabilir. Daha uzun saklama süresi doku kalitesini etkileyebilir ve bu nedenle deneyin sonucunu etkileyebilir.
3. Perls/DAB boyama
- Aşağıdaki çözeltileri hazırlayın:% 2 potasyum ferrosiyanür (K4 [Fe (CN) 6] · 3H2O,% 2 hidroklorik asit (HCI) ve× 20 DAB çözeltisi (bkz. Tablo 1).
- 1× PBS ile doldurulmuş bir boyama kavanozuna bölümler içeren bir slayt koyun ve OCT'yi dokudan yıkamak için kavanozu 5 dakika boyunca bir orbital çalkalayıcı üzerine yerleştirin.
NOT: Yüksek hızlarda kızaktan doku düşmesini önlemek için orbital çalkalayıcının hızını dikkatli bir şekilde ayarlayın (önerilen hız: 20 rpm). - 50 mL'lik bir santrifüj tüpünde 20 mL %2 potasyum ferrosiyanür çözeltisi ve eşit hacimde %2 hidroklorik asidi karıştırın.
- Slaytı 50 mL'lik tüpe aktarmak için plastik forseps kullanın ve ardından tüpü 30 dakika boyunca 60 ° C'de bir su banyosunda ısıtın.
- Slaytı 1× PBS ile durulayın ve fazla solüsyonu kağıt mendille kurulayın.
- Her beyin bölümüne 50 μL DAB çözeltisi eklemek için bir pipet kullanın ve oda sıcaklığında 10 dakika inkübe edin.
- Fazla DAB solüsyonunu bir pipetle aspire edin ve ardından slaytı PBS'de 3 kez yıkayın.
- Bölümleri dereceli alkol solüsyonları (%50, %70, %95, %100) ve ksilen (%100, %100) ile kurutun. Slaytları her biri 3 dakika kuluçkaya yatırın.
- Bölümleri nötr sakız22 ile kapatın ve ardından lameli yerleştirin.
- Slaytları bir mikroskop slayt kutusunda saklamadan önce 24 saat çeker ocakta kurutun.
4. Görüntüleme
- Mikroskobu açın, ışık kaynağının parlaklığını ayarlayın ve 4 × büyütme hedefi altında beyin bölümüne odaklanın.
- Görüntüyü kamera kontrol yazılımıyla yakalayın ve aşırı pozlamayı önlemek için parametre ayarlarını yapın. Özel ayarlar (10×, 40× objektif) Şekil 1'de gösterilmiştir.
NOT: Her görüntü için aynı pozlama süresini sağlamak için otomatik beyaz dengesini kullanmaktan kaçının. - 10× büyütme objektifine geçin, mikroskop tablasını yüksek Perls/DAB boyama sinyalleri olan alanlara, özellikle hipokampus ve serebral kortekse odaklanmak için hareket ettirin ve görüntüleri yakalayın (Şekil 1A).
- Net boyama sinyallerine sahip görüntüler yakalamak için 40x büyütme hedefine geçin.
- Her görüntüyü 8 bit TIFF olarak kaydedin ve daha fazla analiz için görüntüleri dışa aktarın.
5. Görüntü analizi
- ImageJ/Fiji'de, menüde Eklentiler > birleştirme > Izgara/Koleksiyon birleştirme'yi seçin, ardından dikilmesi amaçlanan görüntüleri seçmek için Bilinmeyen konum'u seçin (Şekil 2A).
- Bitmiş görüntüyü TIFF olarak kaydetmek için Dosya > Farklı Kaydet > Tiff'i seçin (Şekil 2B).
- Bir görüntüyü açmak ve görüntü formatının RGB Renkli olduğundan emin olmak için ImageJ/Fiji'yi kullanın (Şekil 2C).
- Menüde IHC Profiler Image > Eklentiler'i seçin, ardından Sitoplazmik Lekeli Görüntü > Mod'u ve Renk Evrişimi Giderme varsayılan H DAB'yi seçin (Şekil 2D). Ardından görüntü formatını 8 bit Gri tonlamaya dönüştürün.
- Analiz Et > Kalibre Et > Kalibre Edilmemiş OD'yi seçerek görüntünün gri değerlerini OD değerlerine dönüştürün (Şekil 2E).
- Pozitif Perls'/DAB boyama alanını seçmek için Eşik işlevini kullanın, ardından tüm kahverengi sinyal noktaları kırmızıyla kaplanana kadar yatay kaydırma çubuklarını ayarlayın (Şekil 2F).
- Analiz Et > Ölçümleri Ayarla'ya tıklayın, ardından arka plan gürültüsünü dışlamak için Alan, Ortalama gri değer, Entegre yoğunluk ve en önemlisi Eşik sınırla seçeneklerini belirleyin (Şekil 2G).
- Sonuç tablosunu elde etmek için Analiz Et > Ölç'ü seçin (Şekil 2H).
- Sonuçları gruplandırın ve istatistiksel analiz yapmak için istatistiksel yazılım kullanın. Bizim olgumuzda, 5xFAD transgenik farelerin hipokampus ve korteksindeki demir birikimini negatif kontroldeki (vahşi tip fareler) ile karşılaştırdık. Üç gruplu karşılaştırmalarda, Gauss dağılımından elde edilen veriler için aynı standart sapmaya sahip tek yönlü varyans analizi (ANOVA) kullanılmıştır.
Sonuçlar
AD'nin bir fare modelinde demir dağılımını ve birikimini araştırmak için, 8 aylık 5xFAD farelerin sagital dilimlerinde Perls / DAB boyaması gerçekleştirdik. Şekil 3'te gösterildiği gibi, 8 aylık 5xFAD ve vahşi tip farelerde ve 2 aylık vahşi tip farelerde Perls/DAB boyama sinyalleri gözlenmiştir. 5xFAD farelerinde, hipokampus ve kortekste, özellikle hipokampusun subikulumunda yüksek Perls' / DAB boyama sinyalleri gözlendi. Yabani tip fareler, doğrulanmış negatif kontroller olarak görev yaptı; hem 2 hem de 8 aylık kohortlar, tespit edilebilir ancak anlamlı olmayan yaş ilerleyici birikim eğilimleri ile önemli ölçüde zayıflamış demir biriktirme sinyalleri sergiledi (Şekil 3A). 40 × büyütme altında, 5xFAD farelerdeki sinyaller, önceki çalışmalarlatutarlı olarak Aβ plak benzeri yapılarda gözlendi 9,10 (Şekil 3B). 4 × büyütme görüntüleri, 5xFAD farelerinin beyinlerindeki demir lekelenmesinin dağılımını incelemek için birleştirildi. Perls/DAB boyama sinyalleri korteks, hipokampus ve beyincikte diğer bölgelere göre belirgin şekilde daha güçlüydü. (Şekil 3C). Serebral korteksin üç bölümü ve her koşul ve yaş grubundaki üç farenin her birinden üç hipokampus, nicelik ölçümü için seçildi. 8 aylık 5xFAD farelerde demir birikimi, aynı yaştaki vahşi tip kontrollere göre önemli ölçüde daha yüksekti. 2 aylık ve 8 aylık vahşi tip farelerde sinyalin yoğunluğunu karşılaştırırken, bu iki yaş arasında demir birikiminde önemli bir fark bulamadık (Şekil 3D). Bu sonuçlar, demir tespiti için histokimyasal bir teknik olarak Perls/DAB boyamanın etkinliğini göstermektedir. Şekil 4, başarısız boyamanın iki örneğini göstermektedir. Beyin bölümleri DAB solüsyonunda çok uzun süre bırakılırsa aşırı arka plan renklendirmesi meydana gelecektir (Şekil 4A). Uygun olmayan dehidrasyon, katlanmış bölümlere neden olacaktır (Şekil 4B).
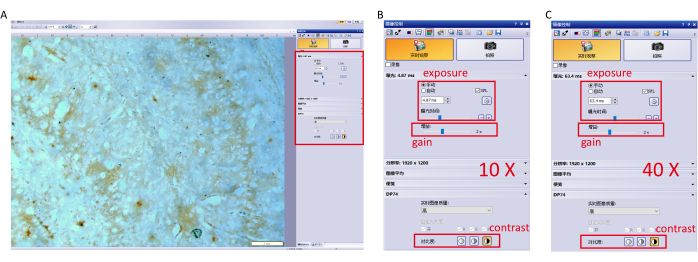
Şekil 1: Görüntüleme yazılımı için parametre ayarları. (A) Yazılımın parametre ayarlarını (pozlama, kazanç ve kontrast.) 10× objektifte ayarlayın ve hipokampusa odaklanın. (B) 10 × bir hedef için ayrıntılı parametre ayarları. (C) 40 × bir hedef için ayrıntılı parametre ayarları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Perls/DAB boyama sonuçlarının veri işlemesi. (A) ImageJ/Fiji'de, menüde Birleştirme > Eklentiler'i > Grid/Collection birleştirme'yi seçin, ardından birleştirilmesi amaçlanan görüntüleri seçmek için Bilinmeyen konum'u seçin. (B) Dosya > Farklı Kaydet'i seçin> Bitmiş görüntüyü TIFF olarak kaydetmek için. (C) Bir görüntüyü açmak için ImageJ/Fiji'yi kullanın ve görüntü formatının RGB Renkli olduğundan emin olun. (D) IHC Profiler Görüntüsü > Eklentiler'i seçin, ardından Sitoplazmik Lekeli Görüntü > Modu ve Renk Evrişimi Giderme varsayılan H DAB'yi seçin. (E) Analiz Et > Kalibre Edilmemiş OD'yi seçerek görüntünün gri değerlerini OD değerlerine > dönüştürün. (F) Perls'in pozitif alanını seçmek için Eşik fonksiyonunu kullanın, ardından tüm sinyal noktaları kaplanana kadar yatay kaydırma çubuklarını ayarlayın. (G) Analiz Et > Ölçümleri Ayarla'ya tıklayın, arka plan gürültüsünü dışlamak için Alan, Ortalama gri değer, Entegre yoğunluk ve Eşik sınırla seçeneklerini belirleyin. (entegre yoğunluk = alan × ortalama). (H) Sonuç tablosunu elde etmek için Analiz Et > Ölç'ü seçin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
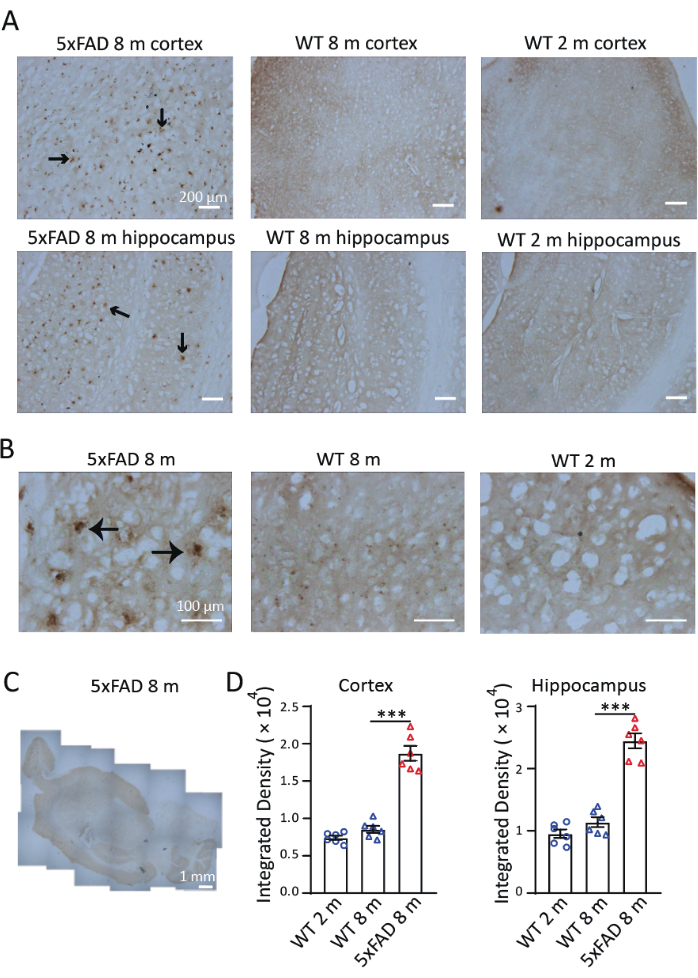
Şekil 3: 5xFAD farelerin ve vahşi tip (WT) farelerin beyinlerinde temsili Perls/DAB boyama . (A) 2 aylık ve 8 aylık vahşi tip farelerde boyama ile karşılaştırıldığında, 8 aylık 5xFAD farelerden hipokampus ve korteksin uzunlamasına bölümlerinde güçlü Perls/DAB sinyalleri. (B) Perls'/DAB sinyalleri, özellikle hipokampusta, Aβ plakları etrafında kümelenmiştir. (C) 5xFAD fare beyninde Perls/DAB sinyallerinin dağılımını gösteren dikişli uzunlamasına bir görüntü. (D) 2 aylık WT, 8 aylık WT ve 8 aylık 5xFAD farelerin korteks veya hipokampusundaki Perls / DAB sinyalinin istatistiksel analizi. Tek yönlü ANOVA, ***, P < 0.001. Ölçek çubukları görüntülerde görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: İki başarısız Perls/DAB boyama örneği. (A) Aşırı DAB yoğunlaşmasına bağlı aşırı renkli Perls/DAB lekesi. (B) Uygun olmayan dehidrasyon nedeniyle beyin bölümünün kenarı kıvrılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Demir birikimi Alzheimer hastalığı ile yakından ilişkilidir. Bir yandan, amiloid öncü proteininin artan ekspresyonu {NOTE:20}23 ve ayrıca hızlandırılmış Aβ üretimine yol açabilen gelişmiş γ-sekretaz aktivitesi dahil olmak üzere çoklu mekanizmalar yoluyla Aβ üretimine yol açabilir24; Öte yandan, artan demirin neden olduğu lipid peroksidasyonu, tau polimerizasyonunu teşvik edebilir, bu da nöronlarda25 tau proteininin anormal fosforilasyonunun artmasına yol açabilir. Perls'in Prusya mavisi boyaması, biyolojik örneklerdeki ferrik demir (Fe3 +) birikintilerinin seçici görselleştirilmesi için iyi bilinen bir histokimyasal tekniktir. Ferrik demir, mavi ferrik ferrosiyanür (Prusya mavisi) üretmek için ferrosiyanür ile reaksiyona girer14. Perls/DAB boyama, geleneksel Perls boyamanın bir modifikasyonudur. Reaksiyona giren numuneler, DAB (diamino benzamin) içeren bir çözeltiye aktarılır, bunun üzerine Prusya mavisi kahverengi renkli bir bileşik oluşturur. Bu yöntemi kullanarak, 5xFAD farelerinin beyinlerindeki demir birikiminin mekansal dağılımını gözlemledik ve AD model farelerde ve vahşi tip farelerde demir birikimini kantitatif olarak karşılaştırdık.
Bu protokolde, patolojik demir birikimini değerlendirmek için Perls/DAB boyamanın uygulanabilir ve etkili olduğunu gösterdik. İdeal sonuçlar için birkaç ipucuna dikkat edilmelidir. İlk olarak, arka plan lekelenmesini azaltmak için demir içermeyen reaktifler ve aletler, özellikle demir içermeyen hidroklorik asit kullanılmalıdır. Potasyum ferrosiyanür ve hidroklorik asit taze olarak hazırlanmalıdır. Slayt üzerinde kalan ekstra çözelti çıkarılmalı ve tam dehidrasyonu sağlamak için saf alkol ve ksilen kullanılmalıdır. Görüntüleme sırasında, otomatik beyaz dengesinin kullanılması hatalı analizlere yol açacaktır. Görüntünün gri değerlerini, histokimyasal sinyallerin yoğunluğuna karşılık gelen OD değerlerine dönüştürmeyi unutmayın.
Burada tarif edilen yöntem, boyamanın özgüllüğünü arttırır ve özellikle düşük demir seviyelerine sahip dokularda faydalıdır. DAB boyası, mikroskopi ve görüntü analizi için önemli olan yüksek kontrastlı bir sinyal üretir. Özetle, Perls/DAB boyama, geleneksel Perls boyamadan daha güçlü bir sinyal ve daha iyi arka plan kontrastı sağlayarak demir algılamanın hassasiyetini ve doğruluğunu artırır. Ek olarak, Perls'in boyanması, ferrik demiri yalnızca gevşek bağlı protein komplekslerinde (hemosiderinde olduğu gibi) tespit eder21. Hemoglobinde olduğu gibi güçlü bir şekilde bağlı olan demir reaksiyona girmez. Bu, kırmızı kan hücrelerinde ve hemoglobinde demirin neden olduğu istenmeyen sinyalleri büyük ölçüde azaltır.
Bununla birlikte, Perls/DAB boyamanın bazı sınırlamaları vardır. Örneğin, DAB boyama, pozitif sonuçların gözlemlenmesini engelleyebilecek bazı spesifik olmayan arka plan boyamalarına neden olur. Ek olarak, boyama işlemi hem zamanın hem de konsantrasyonun hassas bir şekilde kontrol edilmesini gerektirir; Aksi takdirde, lekelenme düzensiz olabilir veya yetersiz sinyal yoğunluğuna sahip olabilir. Boyama yanıtının ağırlıklı olarak nöronlardan ziyade oligodendrositlerde olduğu da bildirilmiştir26.
Perls/DAB boyama, orta özgüllük ve duyarlılık gerektiren patoloji çalışmaları için uygundur. Bu yöntem, araştırmacılara demir birikimini görselleştirmek ve ölçmek için MRI veya FAAS'tan daha az zaman alıcı ve daha az maliyetli bir yol sağlar. Farklı hücre tiplerinde ve hücre altı yapılarda demir birikiminin dağılımını daha fazla araştırmak için, nöronlar ve glial hücreler için belirteçlerle birlikte boyamaya ihtiyaç vardır. Genel olarak, Perls/DAB boyaması AD patolojisinin araştırılmasını hızlandıracak ve demir metabolizması ile ilgili terapötiklere yönelik araştırmaları kolaylaştıracaktır.
Açıklamalar
Bu araştırma, Çin Doğa Bilimleri Vakfı'nın genel bir projesi tarafından desteklenmiştir (hibe numarası: 32271010).
Teşekkürler
Bu çalışmanın hazırlanması sırasında yazarlar, dili ve okunabilirliği geliştirmek için DeepSeek'i kullandılar. Bu aracı/hizmeti kullandıktan sonra, yazarlar içeriği gerektiği gibi gözden geçirip düzenlediler ve yayının içeriği için tüm sorumluluğu üstlendiler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
Referanslar
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır