Method Article
Perls/DAB Stainingによる5xFADマウスの脳内における鉄沈着の評価
* これらの著者は同等に貢献しました
要約
このプロトコルは、組織、特に脳における鉄沈着の分布と量を評価するための方法を提示します。このプロトコールには、サンプル調製、Perls/DAB染色、画像キャプチャ、およびデータ解析の手順が詳述されています。
要約
アルツハイマー病(AD)は、一般的な神経変性疾患であり、高齢者の認知症の主な原因です。鉄の沈着は、ADの病因と密接に関連しています。AD脳では、鉄レベルの上昇は、βアミロイド斑、タウ神経原線維変化、アポトーシスなどの特徴的なADの病状と強く相関しています。鉄代謝の調節不全による酸化ストレスがADの病態生理学において重要な役割を果たしていることを示唆する証拠が増えています。したがって、ADの病理における鉄蓄積の役割を理解することは、ADの治療にとって重要です。包括的な鉄染色プロトコルは、脳内の鉄の発現と分布を検出するために不可欠です。このプロトコルは、脳内の鉄沈着の量と分布を評価する方法を説明することを目的としています。試薬の調製、マウスの治療、脳切片の調製に関与するプロセスについて説明します。さらに、脳組織切片における組織化学的鉄検出の詳細なステップバイステップのプロトコルを提示し、定量的評価と形態学的評価の両方を統合した体系的な分析フレームワークを伴って、染色結果の包括的な解釈を確保します。この実験プロトコルは、研究者が脳内の鉄沈着を理解するのに役立ち、AD研究をサポートします。
概要
アルツハイマー病(AD)は、最も一般的な神経変性疾患であり、社会にとって深刻な問題となっています。ADの有病率は、1,2,3,4歳とともに劇的に増加します。アルツハイマー病(AD)の主な病理学的特徴には、タウタンパク質の異常なリン酸化によるβ-アミロイド(Aβ)プラークと神経原線維変化(NFT)の沈着が含まれます。Aβは、β-セクレターゼおよびγ-セクレターゼ酵素によるアミロイド前駆体タンパク質(APP)の連続的な切断によって生成されます。Aβの産生やクリアランスの調節不全は、脳内に蓄積し、アミロイド斑を形成することで、アミロイド斑が形成されます。これは、アミロイドの最も初期の病理学的マーカーの1つとして認識されています。これらのプラークは、直接的なニューロンの損傷を引き起こすだけでなく、神経炎症、酸化ストレス、シナプス機能障害などの有害な影響の連鎖を引き起こします。全体として、これらのプロセスは、ニューロンの死とAD5で観察される進行性の認知機能低下に寄与しています。アミロイドβプラーク沈着や過剰リン酸化タウタンパク質凝集など、主にアルツハイマー病(AD)の病理学的特徴を標的とした数十年にわたる研究にもかかわらず、臨床的に意味のある治療上のブレークスルーは依然としてとらえどころがなく、既存の介入では疾患の進行を修飾する効果が限定的であることが示されています6。
鉄は脳の機能を維持するための重要な金属であり、酸素輸送、DNA合成、ミトコンドリア呼吸、ミエリン合成、神経伝達物質合成、代謝に関与しています。しかし、鉄は、濃度が細胞隔離の能力を超えると有害になる6,7,8。鉄沈着の増加は、通常はAβプラークと共局在し、AD9,10の患者の脳の皮質領域と海馬領域の両方で観察されています。フェントン反応11を通じて、細胞内の遊離鉄は、活性酸素種だけでなく、ヒドロキシルラジカル(•OH)を生成することができます。これらの有害物質は、グリア細胞を活性化して神経炎症を誘発するだけでなく、酸化ストレスを通じて細胞の生体分子を攻撃し、正常な細胞機能を混乱させ、シナプス機能障害を引き起こします8,12。さらに、鉄の増加はADの病理学的徴候の発症に直接関与しており、鉄はAβ産生に寄与し12、またタウタンパク質の機能障害を増加させ、神経原線維変化13を引き起こす。
脳内の鉄含有量を評価するために、磁気共鳴画像法(MRI)、化学的および組織化学的方法など、いくつかの技術が開発されてきた14。MRIを用いた脳内鉄濃度の in vivo 定量化は、老化および神経変性患者にとって臨床的に重要である15。MRIは、非侵襲的で高感度であるという利点があり、病気の初期段階で鉄の沈着を検出できます。特に、磁場依存性R2増加(FDRI)技術は、フェリチン鉄とヘム鉄16のような鉄の異なる形態を区別することができる。しかし、MRIは細胞レベルで鉄の蓄積を検出することができず、高価なため、主に臨床研究で使用されています17。
比色測定は、物質(鉄など)の濃度を、溶液中の物質と発色剤18との反応によって生成される色の強度を測定することによって決定する化学的方法である。この方法は簡単に実行でき、低コストの試薬と機器を使用するため、予算が限られているラボに適しています18。しかし、この方法の精度と感度は、環境要因、発色時間、およびオペレーターの主観的な判断によって結果が影響を受けるため、非常に限られています。フレーム原子吸光分析(FAAS)は、鉄のレベル19を評価するために使用できる別の方法です。この方法では、目的の組織を高温炉で燃焼させることにより、清澄化されたサンプル溶液が得られます。次に、サンプルを塩酸を使用して溶解し、溶液中の鉄の濃度を原子吸光分析 法で 測定します。この方法は感度が高く、すべてのタイプの生物学的サンプルに適しています19。しかし、このプロセスには時間がかかり、高価な機器が必要なため、その使用は限られています。
非ヘム第二鉄を検出するためのPerls'/DAB染色は、他の組織化学的方法と比較して高い特異性と実装の容易さから、最も一般的に使用される鉄検出法です14。比色分析とは異なり、Perls染色は、鉄イオンとフェロシアン化カリウムとの反応に依存して青色の沈殿物を生成する定性的な組織化学的染色法です。これは、組織内の鉄の存在と分布を顕微鏡で視覚化するために使用されます。さらに、この方法により、異なる細胞タイプでの鉄沈着を区別し、鉄沈着の細胞内分布を観察することができ、AD20の研究方法を提供します。パールズ染色は主に非ヘム第二鉄を検出し、プルシアンブルー錯体の形成に依存します。

(プルシアンブルー)
しかし、従来のPerls染色は、低鉄レベルでの鉄局在を検出するのに効果がありません。ジアミノベンジジン(DAB)を添加すると、ヘキサシアノ鉄と反応して褐色の化合物を形成し、アッセイの特異性を高めます21。
このプロトコルの目標は、ADマウスモデルの脳内の鉄沈着量と分布を評価する方法を説明することです。このプロトコルでは、生後8か月の5×FAD(C57BL/6J)トランスジェニックマウスをADマウスモデルとして使用し、同齢の野生型マウスと比較しました。ここでは、化学試薬の調製、脳の切片化、Perls/DAB染色の実施、染色後に撮影した画像の解析の手順について詳しく説明します。
プロトコル
すべての手続きは、徐州医科大学の動物施設管理・使用委員会のガイドラインおよび中国政府の実験動物の管理・使用に関する規則に従って行われました。
1.動物の灌流
- 固定液を調製する:4%パラホルムアルデヒド(PFA)を1×リン酸緩衝生理食塩水(PBS)に溶解します( 表1を参照)。
- ケタミン(100 mg / kg)とキシラジン(15 mg / kg)による腹腔内注射によりマウスに麻酔をかけます。マウスに麻酔をかけたら、4本のピンで灌流手術トレイに固定し、手足を固定します。
注意: 適切な麻酔を確保するために、つま先をつまむこと、手足の筋肉の弛緩、深くゆっくりと安定した呼吸に対する反応の喪失を確認してください。 - 胸部をハサミで切り開いて心臓を露出させ、右心房をカットします。1×PBSの20mLを注射器で左心室に注入し、血液を洗い流します。その後、4% PFA を 20 mL 注入して固定します。
注意: 心室中隔に穴を開けないように、針の深さと方向を制御します。最適な灌流は、最初の振戦後の肝臓が青白く、手足が硬くなるのが特徴です。 - 灌流したネズミの首を切り落とし、細いハサミで頭蓋骨の周りの骨を切り、鈍い鉗子を使って慎重に頭蓋骨を持ち上げ、脳を摘出します。その後、脳を4°Cの4%PFAに一晩浸します。
注意:呼吸器を強く刺激する4%PFAに注意してください。適切なマスクを着用し、この手順をドラフトで実行します。
注:安楽死の方法は、徐州医科大学のIACUCによって承認されました 動物ケアおよび使用プログラム安楽死ガイドライン:マウス/ラット。
2.脳の凍結切片
- 段階的なショ糖溶液(15%および30%)で脳を4°Cで24時間、各ステップで脱水します。脳はついにショ糖溶液の底に沈むはずです。
- 半球間裂に沿って脳をメスで半球切除します。左半分を、1 mLの30%ショ糖溶液と等量の最適切断温度(OCT)化合物を充填した5 mLの微量遠心チューブに入れ、OCTと脳との接触を強化します。
- カミソリの刃で左半球から無関係な組織をトリミングし、OCTプラットフォームに移動します。
- アルミホイル製の円形の壁で支えて、ティッシュをOCTに埋め込みます。
- クライオスタットミクロトーム内の組織を-22°Cで少なくとも1時間凍結し、カッティングヘッドの温度を-19°Cに設定します。
注:サンプルと一緒にクライオスタット内のアンチロールガラスとブラシを予冷することを忘れないでください。 - 凍結ティッシュブロックを取り付けます。組織ブロックを関心のある領域に応じて適切な位置に再度トリミングし、脳を厚さ20μmの矢状切片に切片化し始めます。
注意: セクションが折りたたまれている場合は、柔らかいブラシを使用してセクションを展開します。 - ゼラチンでコーティングされたスライドの各セクションを収集し、1×PBSを一滴塗ります。細いブラシを使用して脳のセクションを裏返し、セクションをスライドにすばやく取り付けます。
- 採取した切片を室温で一晩乾燥させ、-20°Cで保存します。
注:プロトコルは、ここで最大2週間一時停止できます。保存時間が長くなると、組織の品質が妨げられ、実験の結果に影響を与える可能性があります。
3. Perls'/DAB染色
- 2%フェロシアン化カリウム(K4[Fe(CN)6]・3H2O)、2%塩酸(HCI)、および20×DAB溶液( 表1を参照)を調製します。
- 切片を含むスライドを1×PBSで満たされた染色ジャーに入れ、ジャーをオービタルシェーカーに5分間置いて、OCTを組織から洗い流します。
注意: オービタルシェーカーの速度を慎重に調整します(推奨速度:20 rpm)ため、高速で組織がスライドから落ちるのを防ぎます。 - 20 mLの2%フェロシアン化カリウム溶液と等量の2%塩酸を50 mLの遠心分離チューブで混合します。
- プラスチック製の鉗子を使用してスライドを50 mLチューブに移し、60°Cのウォーターバスでチューブを30分間加熱します。
- スライドを1×PBSですすぎ、余分な溶液をティッシュペーパーで拭き取ります。
- ピペットを使用して、各脳切片に50 μLのDAB溶液を加え、室温で10分間インキュベートします。
- 余分なDAB溶液をピペットで吸引し、スライドをPBSで3回洗浄します。
- 切片を等級付けされたアルコール溶液(50%、70%、95%、100%)とキシレン(100%、100%)で脱水します。スライドをそれぞれ3分間インキュベートします。
- セクションをニュートラルガム22 で密封してから、カバースリップを置きます。
- スライドをヒュームフードで24時間乾燥させてから、顕微鏡スライドボックスに保管します。
4. イメージング
- 顕微鏡の電源を入れ、光源の明るさを調整し、4×倍率の対物レンズの下で脳部分に焦点を合わせます。
- カメラ制御ソフトウェアで画像をキャプチャし、パラメータ設定を調整して露出オーバーを防ぎます。特定の設定(10×、40×の目的)を 図1に示します。
注:各画像の露光時間を同じにするために、自動ホワイトバランスの使用は避けてください。 - 倍率10×の対物レンズに切り替え、顕微鏡ステージを動かしてPerls/DAB染色シグナルが高い領域、特に海馬と大脳皮質に焦点を合わせ、画像をキャプチャします(図1A)。
- 倍率40倍の対物レンズに切り替えると、鮮明な染色信号で画像を撮影できます。
- 各画像を8ビットTIFFとして保存し、画像をエクスポートしてさらに分析します。
5. 画像解析
- ImageJ/Fijiで、メニューで 「Plugins > stitching」>「Grid/Collection stitching 」を選択し、「 Unknown position 」を選択してスティッチする画像を選択します(図2A)。
- [ ファイル] > [名前を付けて保存] > [Tiff ] を選択して、完成したイメージを TIFF として保存します (図 2B)。
- ImageJ/Fijiを使用して画像を開き、画像形式がRGBカラーであることを確認します(図2C)。
- メニューで 「Plugins」>「IHC Profiler Image 」を選択し、「Mode」 >「Cytoplasmic Stained Image 」を選択し、「Color Deconvolution」のデフォルトの H DAB (図2D)を選択します。次に、画像形式を8ビットグレースケールに変換します。
- 画像のグレー値をOD値に変換するには 、[Analyze]>[Calibrate]>[Uncalibrated OD ]を選択します(図2E)。
- スレッショルド機能を使用して、Perls/DAB染色の陽性領域を選択し、すべての茶色のシグナルスポットが赤で覆われるまで水平スクロールバーを調整します(図2F)。
- 「Analyze」>「Set Measurements」をクリックし、「Area」、「Mean gray value」、「Integrated density」のオプション、そして最も重要な「Limit to threshold」を選択してバックグラウンドノイズを除外します(図2G)。
- 「Analyze > Measure」を選択して、結果テーブルを取得します(図2H)。
- 結果をグループ化し、統計ソフトウェアを使用して統計分析を実行します。私たちの場合、5xFADトランスジェニックマウスの海馬と皮質の鉄蓄積をネガティブコントロール(野生型マウス)の鉄蓄積と比較しました。3群比較では、同じ標準偏差を持つガウス分布のデータに対して一元配置分散分析(ANOVA)を使用しました。
結果
ADモデルマウスにおける鉄の分布と蓄積を調べるために、生後8ヶ月齢の5xFADマウスの矢状切片にPerls/DAB染色を行いました。図3に示すように、Perls/DAB染色シグナルは、生後8ヶ月の5xFADマウスと野生型マウス、および生後2ヶ月の野生型マウスで観察されました。5xFADマウスでは、海馬と皮質、特に海馬の亜細胞で高いPerls'/DAB染色シグナルが観察されました。野生型マウスは、検証されたネガティブコントロールとして機能しました。生後2か月と8か月のコホートの両方で、鉄沈着シグナルが有意に減衰し(図3A)、検出可能ではあるが有意ではない年齢進行性の蓄積傾向が示されました。40×倍率で、5xFADマウスのシグナルはAβプラーク様構造で観察され、これは以前の研究9,10(図3B)と一致した。4×倍率の画像をつなぎ合わせて、5xFADマウスの脳内の鉄染色の分布を調べました。Perls/DAB染色シグナルは、皮質、海馬、小脳で他の領域よりも明らかに強かった。(図3C)。大脳皮質の3つの切片と、各病態および年齢群の3匹のマウスのそれぞれから3つの海馬を定量化のために選択した。8ヶ月齢の5xFADマウスにおける鉄沈着は、同齢の野生型対照群よりも有意に高かった。生後2か月齢と8か月齢の野生型マウスで信号の密度を比較したところ、これら2つの年齢間で鉄の蓄積に有意差は見られませんでした(図3D)。これらの結果は、鉄検出の組織化学的手法としてのPerls/DAB染色の有効性を示しています。図4は、染色不良の2つの例を示しています。脳の部分をDAB溶液に長時間放置すると、過度の背景色が発生します(図4A)。不適切な脱水状態になると、セクションが折りたたまれます(図4B)。
図1:イメージングソフトウェアのパラメータ設定 (A)ソフトウェアのパラメータ設定(露光、ゲイン、コントラスト)を10×対物レンズで調整し、海馬に焦点を合わせます。(B)10×対物レンズの詳細なパラメータ設定。(C)40×対物レンズの詳細なパラメータ設定。 この図の拡大版を表示するには、ここをクリックしてください。

図2:Perls/DAB染色結果のデータ処理 (A) ImageJ/Fijiで、メニューの 「Plugins > stitching」>「Grid/Collection stitching 」を選択し、「 Unknown position 」を選択してステッチする画像を選択します。(B)選択 フィレット > 名前を付けて保存> TIFF 完成した画像をTIFFとして保存します。(C)ImageJ / Fijiを使用して画像を開き、画像形式がRGBカラーであることを確認します。(D) 「Plugins」>「IHC Profiler Image」を選択し、「 Mode」>「Cytoplasmic Stained Image 」を選択し、デフォルトの「Color Deconvolution」に「 H DAB」を選択します。(E)「 分析」>「キャリブレーション」>「未キャリブレーションOD」を選択して、画像のグレー値をOD値に変換します。(F) しきい値 機能を使用してPerlsの正の領域を選択し、すべての信号スポットがカバーされるまで水平スクロールバーを調整します。(G) 「分析」をクリックして「測定を設定」>、「 面積」、「 平均グレー値」、「 積分密度」、および「 しきい値に制限」 のオプションを選択して、バックグラウンドノイズを除外します。(積分密度 = 面積 × 平均)。(H) 「Analyze > Measure 」を選択して、結果テーブルを取得します。 この図の拡大版を表示するには、ここをクリックしてください。
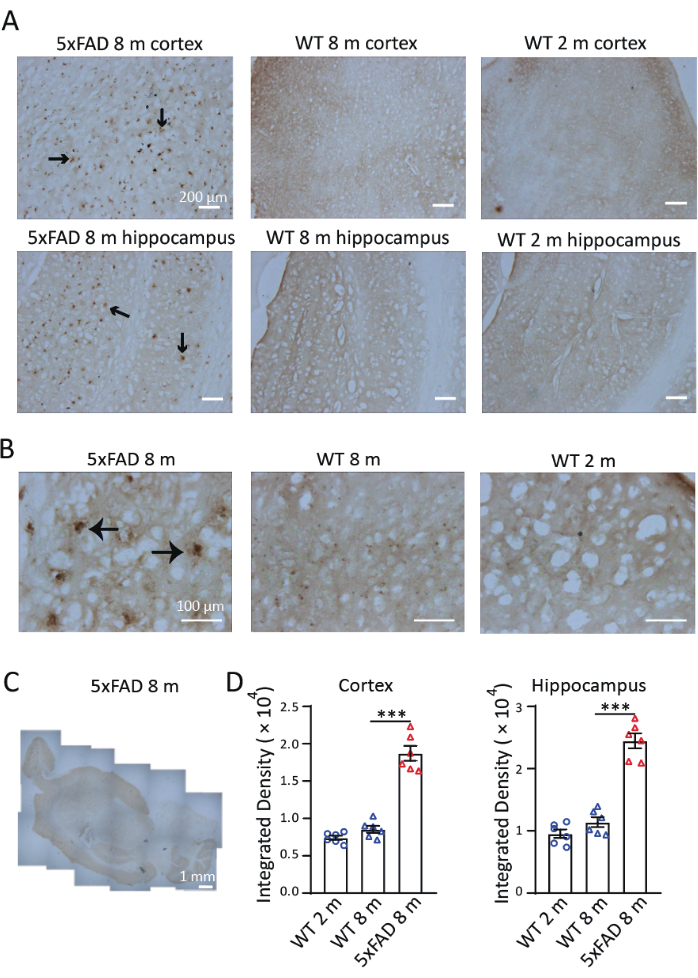
図3:5xFADマウスおよび野生型(WT)マウスの脳における代表的なPerls'/DAB染色 (A) 8ヶ月齢の5xFADマウスの海馬および皮質の縦断面における強いPerls/DABシグナルと、生後2ヶ月および8ヶ月齢の野生型マウスの染色と比較。(B)Perls/DABシグナルは、特に海馬においてAβプラークの周囲に集まっていた。(C)5xFADマウス脳におけるPerls/DAB信号の分布を示すステッチされた縦断的画像。(D)2ヶ月齢のWT、8ヶ月齢のWT、および8ヶ月齢の5xFADマウスの皮質または海馬におけるPerls/DABシグナルの統計解析。一元配置分散分析、***、P < 0.001。画像にはスケールバーが表示されます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:Perls'/DAB染色の失敗例2例 (A)過度のDAB強化による過度なカラーリングのPerls'/DAB染色。(B)不適切な脱水症状により、脳部分の端が丸まっています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
鉄の沈着はアルツハイマー病と密接に関連しています。一方では、アミロイド前駆体タンパク質の発現増加を含む複数のメカニズムを通じてAβ産生につながる可能性があります{NOTE:20}23、またγ-セクレターゼ活性の増強により、Aβ産生の加速につながる可能性があります24。一方、鉄の増加によって誘導される脂質過酸化は、タウ重合を促進することができ、これもまたニューロンにおけるタウタンパク質の異常なリン酸化の増加をもたらす可能性がある25。Perlsのプルシアンブルー染色は、生体試料中の第二鉄(Fe3+)沈着物を選択的に可視化するための確立された組織化学的手法です。第二鉄はフェロシアン化物と反応して青色のフェロシアン化第二鉄(プルシアンブルー)を生成します14。Perls/DAB染色は、従来のPerls染色の修正版です。反応したサンプルをDAB(ジアミノベンゼンアミン)を含む溶液に移すと、プルシアンブルーが茶色の化合物を形成します。この手法を用いて、5xFADマウスの脳における鉄蓄積の空間分布を観察し、ADモデルマウスと野生型マウスの鉄蓄積量を定量的に比較しました。
このプロトコルでは、Perls/DAB染色が病理学的鉄沈着の評価に実行可能かつ効果的であることを示しています。理想的な結果を得るには、いくつかのヒントに注意する必要があります。まず、バックグラウンド染色を減らすために、鉄を含まない試薬とツール、特に鉄を含まない塩酸を使用する必要があります。フェロシアン化カリウムと塩酸は新たに調製する必要があります。スライドに残った余分な溶液を取り除き、純粋なアルコールとキシレンを使用して徹底的な脱水を確実にする必要があります。イメージング中に自動ホワイトバランスを使用すると、分析が不正確になります。画像のグレー値を、組織化学信号の密度に対応するOD値に変換することを忘れないでください。
ここで説明する方法は、染色の特異性を高め、鉄分が少ない組織に特に有用です。DAB染色は、顕微鏡や画像解析に重要な高コントラストのシグナルを生成します。要約すると、Perls/DAB染色は、従来のPerls染色よりも強いシグナルと優れた背景コントラストを提供し、鉄検出の感度と精度を向上させます。さらに、Perlsの染色は、疎結合したタンパク質複合体(ヘモシデリンなど)でのみ第二鉄を検出します21。ヘモグロビンのように強く結合している鉄は反応しません。これにより、赤血球やヘモグロビン中の鉄分による不要なシグナルが大幅に減少します。
ただし、Perls/DAB染色にはいくつかの制限があります。例えば、DAB染色は、陽性結果の観察を妨げる可能性のある非特異的なバックグラウンド染色をもたらします。さらに、染色プロセスでは、時間と濃度の両方を正確に制御する必要があります。そうしないと、染色が不均一になったり、シグナル強度が不十分になったりする可能性があります。また、染色応答はニューロンではなく主にオリゴデンドロサイトにあることも報告されている26。
Perls/DAB染色は、中程度の特異性と感度を必要とする病理学の研究に適しています。この方法により、MRIやFAASよりも時間とコストのかからない鉄蓄積の可視化と定量化が可能になります。さまざまな細胞タイプや細胞内構造における鉄蓄積の分布をさらに調べるには、ニューロンやグリア細胞のマーカーとの共染色が必要です。全体として、Perls/DAB染色はAD病理の探索を加速し、鉄代謝に関連する治療法の研究を促進します。
開示事項
本研究は、中国自然科学基金会(助成番号:32271010)の一般プロジェクトによって支援されました。
謝辞
この作品の準備中に、著者は言語と読みやすさを向上させるためにDeepSeekを使用しました。このツール/サービスを使用した後、著者は必要に応じてコンテンツをレビューおよび編集し、出版物の内容について全責任を負います。
資料
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
参考文献
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved