Method Article
Valutazione della deposizione di ferro nel cervello di topi 5xFAD mediante colorazione Perls/DAB
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo presenta metodi per valutare la distribuzione e la quantità di deposizione di ferro nei tessuti, in particolare nel cervello. Il protocollo descrive in dettaglio le procedure per la preparazione del campione, la colorazione Perls/DAB, l'acquisizione delle immagini e l'analisi dei dati.
Abstract
Il morbo di Alzheimer (AD), una comune malattia neurodegenerativa, è la principale causa di demenza negli anziani. La deposizione di ferro è strettamente legata alla patogenesi dell'AD. Nel cervello di AD, livelli elevati di ferro sono fortemente correlati con patologie caratteristiche dell'AD, tra cui placche di β-amiloide, grovigli neurofibrillari tau e apoptosi. Prove crescenti suggeriscono che lo stress ossidativo, dovuto al metabolismo del ferro disregolato, svolge un ruolo importante nella fisiopatologia dell'AD. Comprendere il ruolo dell'accumulo di ferro nella patologia dell'AD è, quindi, fondamentale per il trattamento dell'AD. Un protocollo completo di colorazione del ferro è essenziale per rilevare l'espressione e la distribuzione del ferro nel cervello. Questo protocollo ha lo scopo di descrivere un metodo per valutare la quantità e la distribuzione della deposizione di ferro nel cervello. Descriviamo i processi coinvolti nella preparazione dei reagenti, nel trattamento dei topi e nella preparazione delle sezioni cerebrali. Inoltre, presentiamo un protocollo dettagliato passo dopo passo per la rilevazione istochimica del ferro in sezioni di tessuto cerebrale, accompagnato da un quadro analitico sistematico che integra sia la valutazione quantitativa che la valutazione morfologica per garantire un'interpretazione completa dei risultati della colorazione. Questo protocollo sperimentale aiuterà i ricercatori a comprendere le deposizioni di ferro nel cervello e a sostenere la ricerca sull'AD.
Introduzione
Il morbo di Alzheimer (AD) è la malattia neurodegenerativa più comune ed è diventato un problema serio per la società. La prevalenza dell'AD aumenta notevolmente con l'età di 1,2,3,4 anni. I principali segni patologici della malattia di Alzheimer (AD) includono la deposizione di placche di β-amiloide (Aβ) e grovigli neurofibrillari (NFT) dovuti alla fosforilazione aberrante delle proteine tau. L'Aβ è generato attraverso la scissione sequenziale della proteina precursore dell'amiloide (APP) da parte degli enzimi β-secretasi e γ-secretasi. La disregolazione nella produzione o nella clearance di Aβ porta al suo accumulo nel cervello, formando placche amiloidi, che sono riconosciute come uno dei primi marcatori patologici dell'AD. Queste placche non solo causano danni neuronali diretti, ma avviano anche una cascata di effetti dannosi, tra cui neuroinfiammazione, stress ossidativo e disfunzione sinaptica. Collettivamente, questi processi contribuiscono alla morte neuronale e al progressivo declino cognitivo osservato nell'AD5. Nonostante decenni di ricerca mirati principalmente ai segni patologici della malattia di Alzheimer (AD), tra cui la deposizione di placche amiloide-β e l'aggregazione iperfosforilata della proteina tau, le scoperte terapeutiche clinicamente significative rimangono sfuggenti, con gli interventi esistenti che dimostrano un'efficacia limitata nel modificare la progressione della malattia6.
Il ferro è un metallo importante per il mantenimento della funzione cerebrale ed è coinvolto nel trasporto dell'ossigeno, nella sintesi del DNA, nella respirazione mitocondriale, nella sintesi della mielina, nella sintesi dei neurotrasmettitori e nel metabolismo. Tuttavia, il ferro diventa dannoso quando le concentrazioni superano la capacità di sequestro cellulare 6,7,8. Un aumento della deposizione di ferro, solitamente co-localizzato con placche di Aβ, è stato osservato sia nelle regioni corticali che in quelle ippocampali del cervello in pazienti con AD 9,10. Attraverso la reazione di Fenton11, il ferro libero intracellulare può generare radicali ossidrilici (•OH) e specie reattive dell'ossigeno. Queste sostanze nocive non solo inducono la neuroinfiammazione attivando le cellule gliali, ma attaccano anche le biomolecole della cellula attraverso lo stress ossidativo, interrompendo la normale funzione cellulare e portando alla disfunzione sinaptica 8,12. Inoltre, l'aumento del ferro è direttamente coinvolto nello sviluppo dei segni patologici dell'AD: il ferro contribuisce alla produzione di Aβ12 e aumenta anche la disfunzione della proteina tau, portando a grovigli neurofibrillari13.
Sono state sviluppate diverse tecniche per valutare il contenuto di ferro nel cervello, tra cui la risonanza magnetica per immagini (MRI), nonché metodi chimici e istochimici14. La quantificazione in vivo dei livelli di ferro intracerebrale mediante risonanza magnetica è clinicamente importante per i pazienti con invecchiamento e neurodegenerazione15. La risonanza magnetica ha il vantaggio di essere non invasiva e altamente sensibile: può rilevare la deposizione di ferro nelle prime fasi della malattia. In particolare, la tecnica dell'aumento dell'R2 campo-dipendente (FDRI) è in grado di distinguere tra diverse forme di ferro, come il ferro ferritina e il ferro eme16. Tuttavia, la risonanza magnetica non è in grado di rilevare l'accumulo di ferro a livello cellulare ed è costosa, quindi viene utilizzata principalmente nelle indagini cliniche17.
La misurazione colorimetrica è un metodo chimico che determina la concentrazione di una sostanza (come il ferro) misurando l'intensità del colore prodotto dalla reazione della sostanza in soluzione con un agente cromogenico18. Questo metodo è facile da eseguire e utilizza reagenti e strumentazione a basso costo, il che lo rende adatto a laboratori con budget limitati18. Tuttavia, l'accuratezza e la sensibilità di questo metodo sono molto limitate, poiché i risultati sono soggetti all'influenza di fattori ambientali, del tempo di sviluppo del colore e del giudizio soggettivo dell'operatore. La spettrometria di assorbimento atomico a fiamma (FAAS) è un altro metodo che può essere utilizzato per valutare i livelli di ferro19. In questo metodo, una soluzione campione chiarificata si ottiene bruciando il tessuto di interesse in un forno ad alta temperatura. Il campione viene quindi disciolto utilizzando acido cloridrico e la concentrazione di ferro nella soluzione viene determinata mediante spettrometria di assorbimento atomico. Questo metodo è altamente sensibile e adatto a tutti i tipi di campioni biologici19. Tuttavia, il processo richiede molto tempo e attrezzature costose, quindi il suo utilizzo è limitato.
La colorazione Perls/DAB per rilevare il ferro ferrico non eme è il metodo di rilevazione del ferro più comunemente usato a causa della sua elevata specificità e facilità di implementazione rispetto ad altri metodi istochimici14. A differenza dell'analisi colorimetrica, la colorazione di Perls è un metodo di colorazione istochimica qualitativa che si basa sulla reazione tra ioni ferro e ferrocianuro di potassio per generare un precipitato blu. Viene utilizzato per visualizzare al microscopio la presenza e la distribuzione del ferro nei tessuti. Inoltre, questo metodo ci permette di distinguere la deposizione di ferro in diversi tipi cellulari e di osservare la distribuzione subcellulare della deposizione di ferro, fornendo un metodo per lo studio del20 d.C. La colorazione di Perls rileva principalmente il ferro ferrico non eme e dipende dalla formazione del complesso blu di Prussia:

(Blu di Prussia)
Tuttavia, la tradizionale colorazione di Perls è inefficace per rilevare la localizzazione del ferro a bassi livelli di ferro. Quando viene aggiunta la diaminobenzidina (DAB), reagisce con l'esacianoferrato ferrico per formare un composto marrone, aumentando la specificità del test21.
L'obiettivo di questo protocollo è quello di descrivere come valutare la quantità e la distribuzione della deposizione di ferro nel cervello di un modello murino di AD. In questo protocollo, topi transgenici 5×FAD (C57BL/6J) di 8 mesi sono stati utilizzati come modello murino di AD e sono stati confrontati con topi wild-type della stessa età. I dettagli delle procedure per la preparazione del reagente chimico, il sezionamento del cervello, l'esecuzione della colorazione Perls/DAB e l'analisi delle immagini scattate dopo la colorazione sono presentati qui.
Protocollo
Tutte le procedure sono state eseguite in conformità con le linee guida del Comitato istituzionale per la cura e l'uso degli animali dell'Università di Medicina di Xuzhou e con le normative governative cinesi per la cura e l'uso degli animali da laboratorio.
1. Perfusione di animali
- Preparare il fissativo: Sciogliere il 4% di paraformaldeide (PFA) in soluzione salina tamponata con fosfato all'1× (PBS) (vedi Tabella 1).
- Anestetizzare il topo mediante iniezione intraperitoneale con ketamina (100 mg/kg) e xilazina (15 mg/kg). Una volta che il topo è stato anestetizzato, fissarlo al vassoio per la chirurgia di perfusione con quattro perni per fissare gli arti.
ATTENZIONE: Per garantire un'anestesia adeguata, verificare la perdita di risposte al pizzicamento delle dita dei piedi, al rilassamento dei muscoli degli arti e al respiro profondo, lento e costante. - Taglia il petto con le forbici per esporre il cuore e taglia l'atrio destro. Iniettare 20 ml di PBS 1× nel ventricolo sinistro con una siringa per lavare il sangue. Quindi, iniettare 20 ml di PFA al 4% per il fissaggio.
NOTA: Controllare la profondità e la direzione dell'ago per evitare di perforare il setto interventricolare. Ricorda che una perfusione ottimale è caratterizzata da un fegato pallido e arti rigidi dopo il tremore iniziale. - Decapitare il topo perfuso, tagliare l'osso attorno al cranio con un paio di forbici sottili, sollevare con cura il cranio usando una pinza smussata ed estrarre il cervello. Quindi, immergere il cervello in PFA al 4% a 4 °C per una notte.
ATTENZIONE: Fai attenzione al 4% di PFA, che è un forte irritante per le vie respiratorie. Indossare una maschera appropriata ed eseguire questo passaggio in una cappa aspirante.
NOTA: Il metodo di eutanasia è stato approvato dall'IACUC del programma di cura e utilizzo degli animali della Xuzhou Medical University Linee guida per l'eutanasia: topi / ratti.
2. Criosezione cerebrale
- Disidratare il cervello con soluzioni graduate di saccarosio (15% e 30%) a 4 °C per 24 ore per ogni fase. Il cervello dovrebbe finalmente sprofondare sul fondo della soluzione di saccarosio.
- Emisectare il cervello lungo la fessura interemisferica con un bisturi. Mettere la metà sinistra in una provetta da microcentrifuga da 5 mL riempita con 1 mL di soluzione di saccarosio al 30% e un volume uguale di composto per la temperatura di taglio ottimale (OCT) per migliorare il contatto tra l'OCT e il cervello.
- Tagliare il tessuto estraneo dall'emisfero sinistro con una lama di rasoio e spostarlo sulla piattaforma OCT.
- Incorporare il tessuto nell'OCT con il supporto di una parete circolare in foglio di alluminio.
- Congelare il tessuto in un microtomo criostato a -22 °C per almeno 1 ora e impostare la temperatura della testa di taglio a -19 °C.
NOTA: Ricordarsi di preraffreddare il vetro antirollio e le spazzole nel criostato insieme al campione. - Montare il blocco di tessuto congelato. Taglia nuovamente il blocco di tessuto in una posizione appropriata a seconda dell'area di interesse e poi inizia a sezionare il cervello in sezioni sagittali spesse 20 μm.
NOTA: Se le sezioni si piegano, utilizzare spazzole morbide per aprire le sezioni. - Raccogli ogni sezione sui vetrini rivestiti di gelatina e spalma su di essa una goccia di 1× PBS. Capovolgere la sezione del cervello con un pennello sottile e poi montare rapidamente la sezione sul vetrino.
- Asciugare le parti raccolte a temperatura ambiente per una notte e conservarle a −20 °C.
NOTA: Il protocollo può essere messo in pausa per un massimo di 2 settimane. Un tempo di conservazione più lungo può interferire con la qualità del tessuto e quindi influenzare l'esito dell'esperimento.
3. Colorazione Perls'/DAB
- Preparare le seguenti soluzioni: ferrocianuro di potassio al 2% (K4[Fe(CN)6]·3H2O), acido cloridrico (HCI) al 2% e soluzione DAB al 20× (vedere Tabella 1).
- Mettere un vetrino contenente sezioni in un barattolo colorante riempito con 1× PBS e posizionare il barattolo su uno shaker orbitale per 5 minuti per lavare via l'OCT dal fazzoletto.
NOTA: Regolare attentamente la velocità dell'agitatore orbitale (velocità consigliata: 20 giri/min) per evitare che il tessuto cada dal vetrino ad alta velocità. - Mescolare 20 mL di soluzione di ferrocianuro di potassio al 2% e un volume uguale di acido cloridrico al 2% in una provetta da centrifuga da 50 mL.
- Utilizzare una pinza di plastica per trasferire il vetrino nella provetta da 50 mL e quindi riscaldare la provetta a bagnomaria a 60 °C per 30 minuti.
- Sciacquare il vetrino con 1× PBS e tamponare la soluzione in eccesso con carta velina.
- Utilizzare una pipetta per aggiungere 50 μl di soluzione DAB a ciascuna sezione del cervello e incubare per 10 minuti a temperatura ambiente.
- Aspirare la soluzione DAB in eccesso con una pipetta e quindi lavare il vetrino 3 volte in PBS.
- Disidratare le sezioni con soluzioni alcoliche graduate (50%, 70%, 95%, 100%) e xilene (100%, 100%). Incubare i vetrini per 3 minuti ciascuno.
- Sigillare le sezioni con gomma neutra22 e quindi posizionare il vetrino coprioggetti.
- Asciugare i vetrini in una cappa aspirante per 24 ore prima di riporli in una scatola per vetrini da microscopio.
4. Imaging
- Accendi il microscopio, regola la luminosità della sorgente luminosa e metti a fuoco la sezione del cervello sotto un obiettivo con ingrandimento di 4×.
- Acquisisci l'immagine con il software di controllo della fotocamera e regola le impostazioni dei parametri per evitare la sovraesposizione. Le impostazioni specifiche (10×, 40× obiettivo) sono mostrate nella Figura 1.
NOTA: Evitare di utilizzare il bilanciamento del bianco automatico per garantire lo stesso tempo di esposizione per ogni immagine. - Passa a un obiettivo con ingrandimento di 10×, sposta il tavolino del microscopio per mettere a fuoco le aree con segnali di colorazione Perls/DAB elevati, in particolare l'ippocampo e la corteccia cerebrale, e acquisisci le immagini (Figura 1A).
- Passa a un obiettivo con ingrandimento 40x per acquisire immagini con chiari segnali di colorazione.
- Salva ogni immagine come TIFF a 8 bit ed esporta le immagini per ulteriori analisi.
5. Analisi delle immagini
- In ImageJ/Fiji, selezionare Plug-in > stitching > Stitching Griglia/Collezione nel menu, quindi selezionare Posizione sconosciuta per scegliere le immagini da unire (Figura 2A).
- Scegliere File > Salva come > Tiff per salvare l'immagine finita come TIFF (Figura 2B).
- Utilizzare ImageJ/Fiji per aprire un'immagine e assicurarsi che il formato dell'immagine sia RGB Color (Figura 2C).
- Selezionare Plug-in > IHC Profiler Image (Immagine profilo IHC Profiler ) nel menu, quindi scegliere Modalità > Immagine colorata citoplasmatica e l'impostazione predefinita di Deconvoluzione del colore H DAB (Figura 2D). Quindi converti il formato dell'immagine in scala di grigi a 8 bit.
- Convertire i valori di grigio dell'immagine in valori OD selezionando Analizza > Calibra > OD non calibrato (Figura 2E).
- Utilizzare la funzione Soglia per selezionare l'area di colorazione positiva Perls/DAB, quindi regolare le barre di scorrimento orizzontali fino a coprire tutti i punti marroni del segnale (Figura 2F).
- Fare clic su Analizza > Imposta misurazioni, quindi selezionare le opzioni Area, Valore medio di grigio, Densità integrata e, soprattutto, Limita alla soglia per escludere il rumore di fondo (Figura 2G).
- Selezionare Analizza > misura per ottenere la tabella dei risultati (Figura 2H).
- Raggruppa i risultati e utilizza un software statistico per eseguire analisi statistiche. Nel nostro caso, abbiamo confrontato l'accumulo di ferro nell'ippocampo e nella corteccia di topi transgenici 5xFAD con quello nel controllo negativo (topi wild-type). Per i confronti a tre gruppi, è stata utilizzata l'analisi unidirezionale della varianza (ANOVA) per i dati della distribuzione gaussiana con la stessa deviazione standard.
Risultati
Per studiare la distribuzione e l'accumulo di ferro in un modello murino di AD, abbiamo eseguito la colorazione Perls/DAB in fette sagittali di topi 5xFAD di 8 mesi. Come mostrato nella Figura 3, i segnali di colorazione di Perls/DAB sono stati osservati in topi 5xFAD e wild-type di 8 mesi e in topi wild-type di 2 mesi. Nei topi 5xFAD, sono stati osservati segnali di colorazione Perls/DAB elevati nell'ippocampo e nella corteccia, specialmente nel subiculum dell'ippocampo. I topi wild-type sono serviti come controlli negativi convalidati; entrambe le coorti di 2 e 8 mesi hanno mostrato segnali di deposizione di ferro significativamente attenuati (Figura 3A), con tendenze di accumulo progressive per età rilevabili ma non significative. Con un ingrandimento inferiore a 40×, i segnali nei topi 5xFAD sono stati osservati in strutture simili a placche Aβ, in linea con studi precedenti 9,10 (Figura 3B). Le immagini con ingrandimento di 4× sono state cucite per esaminare la distribuzione della colorazione del ferro nel cervello di topi 5xFAD. I segnali di colorazione Perls/DAB erano chiaramente più forti nella corteccia, nell'ippocampo e nel cervelletto rispetto ad altre regioni. (Figura 3C). Tre sezioni della corteccia cerebrale e tre ippocampi di ciascuno dei tre topi in ciascuna condizione e gruppo di età sono stati selezionati per la quantificazione. La deposizione di ferro nei topi 5xFAD di 8 mesi era significativamente più alta rispetto ai controlli wild-type della stessa età. Confrontando la densità del segnale in topi wild-type di 2 mesi e 8 mesi, non abbiamo trovato differenze significative nell'accumulo di ferro tra queste due età (Figura 3D). Questi risultati dimostrano l'efficacia della colorazione Perls/DAB come tecnica istochimica per la rilevazione del ferro. La Figura 4 mostra due casi di colorazione non riuscita. Se le sezioni cerebrali vengono lasciate troppo a lungo nella soluzione DAB, si verifica un'eccessiva colorazione dello sfondo (Figura 4A). Una disidratazione inappropriata si tradurrà in sezioni piegate (Figura 4B).
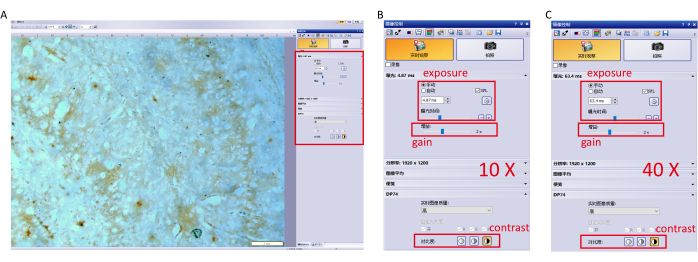
Figura 1: Impostazioni dei parametri per il software di imaging. (A) Regolare le impostazioni dei parametri del software (esposizione, guadagno e contrasto) al 10× obiettivo e mettere a fuoco l'ippocampo. (B) Impostazioni dettagliate dei parametri per un obiettivo 10×. (C) Impostazioni dettagliate dei parametri per un obiettivo del 40×. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Elaborazione dei dati dei risultati della colorazione Perls/DAB. (A) In ImageJ/Fiji, selezionare Plugins > stitching > Stitching Grid/Collection nel menu, quindi selezionare Posizione sconosciuta per scegliere le immagini da unire. (B) Scegliere File > Salva con nome> Tiff per salvare l'immagine finita come TIFF. (C) Utilizzare ImageJ/Fiji per aprire un'immagine e assicurarsi che il formato dell'immagine sia RGB Color. (D) Selezionare Plug-in > IHC Profiler Image, quindi scegliere Modalità > Immagine colorata citoplasmatica e il DECONVOLUZIONE del colore predefinito H DAB. (E) Convertire i valori di grigio dell'immagine in valori OD selezionando Analizza > Calibra > OD non calibrato. (F) Utilizzare la funzione Soglia per selezionare l'area positiva di Perls, quindi regolare le barre di scorrimento orizzontali fino a coprire tutti i punti del segnale. (G) Fare clic su Analizza > Imposta misurazioni, selezionare le opzioni per Area, Valore medio di grigio, Densità integrata e Limita alla soglia per escludere il rumore di fondo. (Densità integrata = Area × Media). (H) Selezionare Analizza > misura per ottenere la tabella dei risultati. Clicca qui per visualizzare una versione più grande di questa figura.
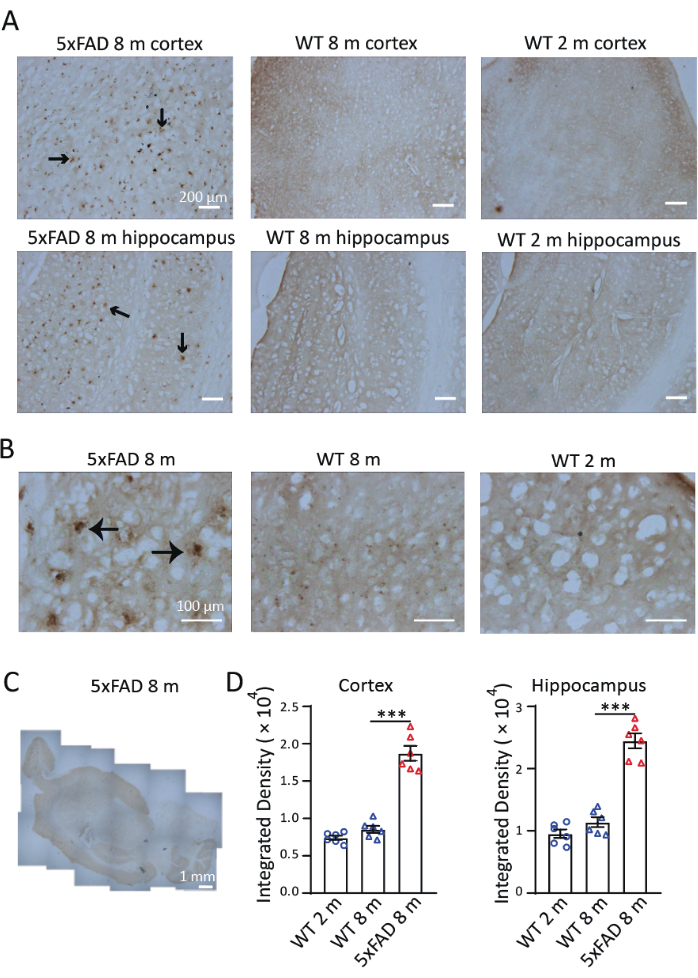
Figura 3: Colorazione rappresentativa di Perls/DAB nel cervello di topi 5xFAD e topi wild-type (WT). (A) Forti segnali Perls/DAB nelle sezioni longitudinali dell'ippocampo e della corteccia di topi 5xFAD di 8 mesi, rispetto alla colorazione in topi wild-type di 2 mesi e 8 mesi. (B) I segnali di Perls/DAB erano raggruppati attorno alle placche Aβ, specialmente nell'ippocampo. (C) Un'immagine longitudinale cucita che mostra la distribuzione dei segnali Perls/DAB in un cervello di topo 5xFAD. (D) Analisi statistica del segnale Perls/DAB nella corteccia o nell'ippocampo di topi WT di 2 mesi, WT di 8 mesi e topi 5xFAD di 8 mesi. Anova unidirezionale, ***, P < 0,001. Le barre di scala vengono visualizzate nelle immagini. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Due casi di colorazione Perls/DAB non riuscita. (A) Una colorazione Perls/DAB troppo colorata a causa di un'eccessiva intensificazione del DAB. (B) Il bordo della sezione cerebrale è arricciato a causa di una disidratazione inappropriata. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La deposizione di ferro è strettamente associata al morbo di Alzheimer. Da un lato, può portare alla produzione di Aβ attraverso molteplici meccanismi, tra cui l'aumento dell'espressione della proteina precursore dell'amiloide{NOTA:20}23, e anche l'aumento dell'attività della γ-secretasi, che può portare a un'accelerazione della produzione di Aβ24; D'altra parte, la perossidazione lipidica indotta dall'aumento del ferro può promuovere la polimerizzazione della tau, che può anche portare a un aumento della fosforilazione anomala della proteina tau nei neuroni25. La colorazione con blu di Prussia di Perls è una tecnica istochimica ben consolidata per la visualizzazione selettiva dei depositi di ferro ferrico (Fe3+) in campioni biologici. Il ferro ferrico reagisce con il ferrocianuro per produrre ferrocianuro ferrico blu (blu di Prussia)14. La colorazione Perls/DAB è una modifica della colorazione tradizionale Perls. I campioni reagenti vengono trasferiti in una soluzione contenente DAB (diamino benzenamina), dopodiché il blu di Prussia forma un composto di colore marrone. Utilizzando questo metodo, abbiamo osservato la distribuzione spaziale dell'accumulo di ferro nel cervello di topi 5xFAD e confrontato quantitativamente l'accumulo di ferro nei topi modello AD e nei topi wild-type.
In questo protocollo, dimostriamo che la colorazione Perls/DAB è fattibile ed efficace per valutare la deposizione patologica di ferro. Per ottenere risultati ideali, è necessario notare alcuni suggerimenti. Innanzitutto, è necessario utilizzare reagenti e strumenti privi di ferro, in particolare l'acido cloridrico privo di ferro, per ridurre la colorazione di fondo. Il ferrocianuro di potassio e l'acido cloridrico devono essere preparati al momento. La soluzione extra rimasta sul vetrino deve essere rimossa e devono essere utilizzati alcol puro e xilene per garantire una disidratazione completa. Durante l'imaging, l'uso del bilanciamento automatico del bianco porterà ad analisi imprecise. Ricordarsi di convertire i valori di grigio dell'immagine in valori OD, che corrispondono alla densità dei segnali istochimici.
Il metodo qui descritto migliora la specificità della colorazione ed è particolarmente utile nei tessuti con bassi livelli di ferro. La colorazione DAB produce un segnale ad alto contrasto, importante per la microscopia e l'analisi delle immagini. In sintesi, la colorazione Perls/DAB fornisce un segnale più forte e un migliore contrasto di fondo rispetto alla colorazione Perls convenzionale, aumentando la sensibilità e l'accuratezza del rilevamento del ferro. Inoltre, la colorazione di Perls rileva il ferro ferrico solo in complessi proteici debolmente legati (come nell'emosiderina)21. Il ferro che è fortemente legato, come nell'emoglobina, non reagisce. Ciò riduce notevolmente i segnali indesiderati causati dal ferro nei globuli rossi e nell'emoglobina.
Tuttavia, la colorazione Perls/DAB ha alcune limitazioni. Ad esempio, la colorazione DAB provoca una colorazione di fondo non specifica che può interferire con l'osservazione di risultati positivi. Inoltre, il processo di colorazione richiede un controllo preciso sia del tempo che della concentrazione; In caso contrario, la colorazione potrebbe essere irregolare o potrebbe avere un'intensità del segnale insufficiente. È stato anche riportato che la risposta di colorazione è prevalentemente negli oligodendrociti piuttosto che nei neuroni26.
La colorazione Perls/DAB è appropriata per studi di patologia che richiedono specificità e sensibilità media. Questo metodo fornisce ai ricercatori un modo meno dispendioso in termini di tempo e meno costoso per visualizzare e quantificare l'accumulo di ferro rispetto alla risonanza magnetica o alla FAAS. Per studiare ulteriormente la distribuzione dell'accumulo di ferro in diversi tipi di cellule e strutture subcellulari, è necessaria la co-colorazione con marcatori per neuroni e cellule gliali. Nel complesso, la colorazione di Perls/DAB accelererà l'esplorazione della patologia dell'AD e faciliterà la ricerca sulle terapie correlate al metabolismo del ferro.
Divulgazioni
Questa ricerca è stata supportata da un progetto generale della Natural Science Foundation of China (numero di sovvenzione: 32271010).
Riconoscimenti
Durante la preparazione di questo lavoro gli autori hanno utilizzato DeepSeek per migliorare il linguaggio e la leggibilità. Dopo aver utilizzato questo strumento/servizio, gli autori hanno rivisto e modificato il contenuto secondo necessità e si assumono la piena responsabilità del contenuto della pubblicazione.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
Riferimenti
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon